ПРОЧИЕ НАПРАВЛЕНИЯ ИСПОЛЬЗОВАНИЯ БЕНЗОЛА
 13 августа, 2013
13 августа, 2013  admin
admin Окислением бензола на V-Мо-катализаторе производится малеиновый ангидрид [551]. Конкурирующий процесс - окисление бутана - несмотря на меньшую стоимость сырья характеризуется более сложной очисткой малеинового ангидрида от примесей, что приводит к повышенным энергозатратам и капиталов вложениям. В связи с этим основное количество малеинового ангидрида (около 82 % ) в начале 80-х годов XX века в развитых капиталистических странах получали по бензольному варианту.
Малеиновый ангидрид получается также как побочный продукт с выходом 7-9 % при производстве фталевого ангидрида окислением нафталина или о-ксилола [552].
Одним из важнейших направлений применения малеинового ангидрида в последние годы стало развивающееся быстрыми темпами производство 1,4-бутандиола. Так, в 1997 г. мировые мощности по этому продукту, необходимому для получения тет- рагидрофурана, полибутилентерефталата, у-бутиролактона, полиуретанов, составляли 740 тыс. т, а к 2002 г. возрастут более* чем на 500 тыс. т. Компания «Sisas» планирует использовать новый процесс производства 1,4-бутандиона - прямую гидрогени-! зацию малеинового ангидрида, минуя промежуточную стадию получения эфира малеинового ангидрида; компания считает этот процесс самым рентабельным и эффективным. Однако фирмы «BP Chemicals» и «Lurgi» разработали каталитический процесс! переработки бутана в бутандиол и считают эту технологию, по которой будет построена установка в г. Лима, США, самой перспективной [553]. *
Конденсацией бензола с фталевым ангидридом в присутствий А1С13 и H2S04 может быть получен антрахинон [554]. Реакция протекает также в присутствии цеолитов через образование бен - зоилбензойной кислоты уже при 200 °С [555]. 4
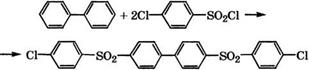
Методом термической дегидроконденсации бензола в промышленности производится бифенил. Ранее процесс проводился.
В пиролизной печи при 800 °С в присутствии водяного пара для снижения температуры и сероводородной коррозии пирозмеевика. При конверсии бензола 30-35 % на 1 т вырабатываемого бифенила получали около 500 кг смеси изомеров терфенила и полифенилов. ВНИИолефин усовершенствовал технологию производства бифенила: конверсия бензола была снижена до 11-17 %, при этом количество терфенильной фракции уменьшилось до 180 кг на 1 т дифенила. Благодаря использованию вместо каменноугольного нефтяного бензола, содержащего на порядок меньше серы, оказалось возможным исключить водяной пар, расход которого в процессе пиролиза составлял 40 % (мае.) на сырье, снизить себестоимость бифенила на 25 % [556].
Бифенил применяется как промежуточный продукт в производстве красителей, негорючих трансформаторных масел. Азео - тропная смесь, содержащая 26.5 % (мае.) бифенила и 73.5 % (мае.) дифенилоксида, широко используется в качестве высокотемпературного теплоносителя под названием даутерм. Смесь бифенила с изомерами терфенила применяется как охлаждающая жидкость в ядерных реакторах. Бифенил - слабый фунгицид, используемый для пропитки бумаги при упаковке цитрусовых. Гидроксибифенилы применяются как антисептики при выделке кож [557].
Селективным метилированием бифенила с использованием цеолита типа ультрастабильного фожазита получают 4-метил - и 4,4'-диметилбифенилы [558]. 4,4'-Диалкилбифенилы, например диэтильные и диизопропильные производные, получают алки - лированием на формоселективных цеолитах типа ZSM-5, ZSM - 12, морденит. 4,4'-Изомеры селективно сорбируются на тех же цеолитах, что позволяет отделять их от изомеров положения путем хроматографии [559]. Высокая селективность при алкили - ровании бифенила и нафталина на цеолите ZSM-12 отмечена также в работе [560].
Запатентовано использование в качестве катализатора при алкилировании бифенила пропиленом Mg-содержащего морде - нита с отношением Si/Al = 80 и Mg/Al = 0.35. При газофазном алкилировании при 250 °С, давлении 0.8 МПа и продолжительности процесса 3 ч конверсия бифенила составила 95.6 %, выход 3,4'- и 4,4'-диизопропилбифенилов - 12.1 и62.9 % соответственно, селективность образования 4,4'-изомера - 74 % [561].
Алкилирование бифенила пропиленом исследовано на различных цеолитах (фожазит, Y, Я, оффретит, морденит, ZSM-5 и ZSM-8) и алюмосиликате. Наиболее активным и селективным при образовании 4,4'-диизопропилбифенила оказался морденит [562]. Хорошие результаты при изопропилировании бифенила получены при проведении реакции в мезитилене на высококристаллических морденитах с низким содержанием Ыа и отношением 81/А1 около 70, модифицированных с помощью кислотной обработки и прокаливания [563].
4,4'-Диалкилбифенилы могут быть получены также трансал - килированием бифенила и 4-алкилбифенилов [564].
Низшие алкилбифенилы, в частности диизопропилбифени - лы, предложено использовать в качестве пластификаторов [565].
Окислением 4,4'-диизопропилбифенила может быть получен 4,4'-дигидроксибифенил, использующийся для получения жидкокристаллических полимеров или термостабильных смол. Необходимый для этого 99.9 % - й 4,4'-дигидроксибифенил получают из сырого продукта экстрактивной кристаллизацией из ацетона, содержащего 20 % (мае.) воды и фенола, с последующей промывкой кристаллов толуолом [566].
В современной индикаторной технике наиболее широко применяют жидкокристаллические нематические 4-алкокси-4'-циано- бифенилы. Их уникальные свойства (большая термо - и электрохимическая стабильность, высокое значение анизотропии диэлектрической проницаемости и др.) способствовали тому, что они вытеснили из массового производства индикаторов азомети - ны и азоксибензолы [567]. Очистка 4-алкокси-4'-цианобифени - лов от примесей основного характера может быть проведена муравьиной кислотой, а от ионных примесей - комплексом различных методов - электродиализом, экстракцией [568].
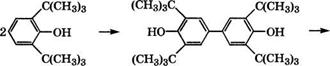
Запатентован также процесс получения 4,4'-дигидроксиби- фенила каталитическим дебутилированием 3,3',5,5'-тетра-трет - бутил-4,4'-дигидроксибифенила, синтезированного окислительной димеризацией 2,6-ди-трет-бутилфенола [569]:
|
|
|
|
Дебутилирование проводится при 130-180 °С в среде неполярных растворителей (аренов, хлорбензола) в присутствии воды или низших спиртов и катализаторов - сульфокатионитов, сульфокислот, Н2в04. Выход 4,4'-дигидроксидифенила 93.5-94 %, степень чистоты - 99.7 % .
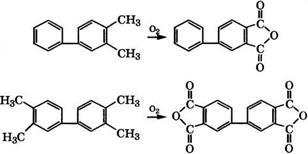
Окислением метилбифенилов получают бифенилкарбоновые кислоты. При жидкофазном окислении воздухом в уксусной кислоте их выход составляет 80-95 % при полной конверсии углеводородов. Однако недостаток жидкофазных процессов - экологические проблемы при утилизации отходов и сточных вод.
При парофазном окислении 3,4-ди - и 3,3',4,4'-тетраметилби - фенилов на У-Тькатализаторе с мольным соотношением оксидов
1 : 32 получены соответственно 3,4-бифенилдикарбоновый ангидрид с выходом 58 % при селективности 71 % и 3,3',4,4'- бифенилтетракарбоновый диангидрид с выходом 51 % при селективности 58 % [570]:
|
|
Полученные ангидриды используются для производства тер-і мопрочных полиимидных смол.
Прямым нитрованием 2,4- и 2,6-бифенилдикарбоновых кислот получают нитропроизводные, применяющиеся в синтезах термостойких полимеров, красителей, пигментов, сенсибилизаторов [571].
Алкилированием бифенила олигомерами пропилена состава Сі8-С30 с последующим сульфированием алкилпроизводных газообразным 803 и обработкой сульфокислот водной суспензией Са(ОН)2 получены сульфонатные присадки к моторным маслам [572].
Высшие алкилбифенилы могут быть получены жидкофазным алкилированием бифенила олефинами в присутствии цеолитов, например Цеокар-Зф, с добавлением 10-15 % (мае.) активного оксида алюминия [573].
|
193 |
![]() Бензилированием бифенила бензилхлоридом, бензиловым спиртом или бензальдегидом в присутствии активных глин при 80 °С с последующим трансбензилированием при 130 °С получают бензил бифенил, использующийся в качестве сенсибилизирующей добавки для термочувствительных бумаг [574].
Бензилированием бифенила бензилхлоридом, бензиловым спиртом или бензальдегидом в присутствии активных глин при 80 °С с последующим трансбензилированием при 130 °С получают бензил бифенил, использующийся в качестве сенсибилизирующей добавки для термочувствительных бумаг [574].
]3- 128-1
Кинетика реакции бензилирования бифенила бензилхлоридом исследована с использованием деалюминированного цеолита Н-У [575] и аморфного алюмосиликата с мольным отношением 8Ю/А1203 = 11.4 [576]. Реакцию проводили в циклогексане при 80 °С. Последний катализатор менее активен, имеет меньшую пара-селективность, однако более стабилен, чем цеолит Н-У. Полученная смесь изомерных бензилбифенилов используется в качестве высокотемпературного теплоносителя.
Хлорированием бифенила в промышленности производятся различные полихлорбифенилы, применяющиеся в качестве пластификаторов, средств для пропитки, в том числе средств, обеспечивающих электрическую изоляцию. Однако в связи с высокой токсичностью полихлорбифенилов обращение с ними требует особых правил предосторожности [577].
Взаимодействием бифенила с 12 или Ма1 в присутствии растворителя (1,1-дихлорэтана, нитрометана), а также Н202 и Н2804 при содержании в них воды не более 60 % (мае.) получают иодированные бифенилы с повышенной мара-селективностью, которые применяют для синтеза волокон с повышенной термической и химической стабильностью [578].
Гидрированием бифенила можно получать циклогексилбен - зол [579], производные которого являются перспективными мономерами для производства термостойких полимеров, жидкокристаллических композиций, биологически активных веществ [580].
Взаимодействием бифенила с 4-хлорбензолсульфонилхлори - дом при 150 °С в присутствии апротонных кислот (ГеС13) в нитробензоле получают с выходом 66.5 % 4,4'-бис(хлорбензолсульфо - нил)бифенил [581]:
Г
|
|
При проведении той же реакции в присутствии А1С13 в смешанном растворителе нитрометан - 1,2-дихлорэтан при 50-130 °С выход целевого дисульфона составляет 74 % [582]. Полученный дисульфон используется для получения термостабильных по- ли(арилэфиросульфонов) с температурой стеклования более 260 °С.
Конденсацией сульфоэфира 4-гидроксибифенила с алкил - или арилсульфохлоридами в присутствии кислот Льюиса (ВГ3, А1С13, ТЮ13, ГеС13 и др.) или сильных кислот получены сульфоны общей формулы RS020AAS02R, где А= 1,4-фенилен [583, 584]. Полученные сульфоны могут использоваться для получения смол с высокой термо - и ударостойкостью, красителей, ПАВ, агрохимикатов и лекарственных препаратов.
Конденсацией бензола с формальдегидом в присутствии H2S04 в промышленности производится дифенилметан [585, 586]. Недостатки процесса - невысокий выход продукта, большое количество отходов.
Конденсация бензола с формальдегидом с образованием ди - фенилметана протекает более эффективно при использовании цеолитов в качестве катализаторов [587].
Разработан метод производства дифенилметана на основе отходов производства бензилового спирта щелочным гидролизом бензилхлорида, получающихся в количестве около 280 кг на 1 т бензилового спирта. Отходы состоят из бензилирующих агентов, % (мае.): дибензилового эфира 70-80, бензилового спирта 15-20 и бензальдегида 3-7. Лучшим бензилирующим агентом является дибензиловый эфир, несколько уступает ему по активности бен - зилацетат, и наибольшее количество полимерных продуктов образуется при использовании бензилового спирта. Поэтому содержащийся в отходах бензиловый спирт переводили взаимодействием с уксусным ангидридом или уксусной кислотой в бензилацетат. Реакцию бензилирования проводили при 75-80 °С и мольном соотношении дибензиловый эфир : бензол = 1 : (8-10) в присутствии 85-95 % - й H2S04. Расходные показатели на 1 т дифенилметана, кг: бензол 700-750; отходы производства бензилового спирта 780-800; уксусная кислота 55-60; H2S04 450- 500. Полная конверсия бензилирующих агентов достигается при продолжительности процесса 0.5 ч, выход дифенилметана составляет 95-98 % [588].
В качестве бензилирующего агента при получении дифенилметана может использоваться также бензил хлорид. При нагревании бензилхлорида с избытком бензола (мольное соотношение
1 : (1-5)) в присутствии безводного FeCl3 при 150-300 °С степень конверсии бензилхлорида 70-90%, чистота полученного дифенилметана 99.5-99.9 % [589].
Дифенилметан применяется для промышленного производства бензофенона, а также в парфюмерной и лакокрасочной промышленности в качестве отдушки мыла и как растворитель [590].
Взаимодействием бензола с 1,2-дихлорэтаном по реакции Фриделя - Крафтса получают 1,2-дифенилэтан. При дегидрировании 1,2-дифенилэтана образуется стильбен, применяющийся в производстве оптических отбеливателей.
Взаимодействием бензола с 1,3-бутадиеном в присутствии в качестве катализатора морденита с мольным соотношением SiO/AlgOg = 114 получают смесь 1,3-, 1,2-, 2,3- и 1,1-дифенилбу - танов с выходом, %: 66.7, 26.8, 4.9 и 1.5 соответственно [591]. Дифенилбутаны используются в качестве растворителей в производстве термочувствительной регистрационной бумаги и как масляные теплоносители.
Взаимодействием бензола с хлороформом, тетрахлормета - ном, бензотрихлоридом или бензилиденхлоридом по реакции Фриделя - Крафтса в присутствии А1С13, FeCl2, ZnCl2 получают трифенилметан, например:
А1С13 (С2Н5)20
С6Н6 + СС14 --------- ► (С6Н5)3СС1 --------------- ► (С6Н5)3СН +
+ СН3СНО + С2Н5С1
Выход трифенилметана при использовании СС14 составляет 70-80 %. Трифенилметан применяется как стабилизатор полимеров и топлив, а его производные - при получении триарилме - тановых красителей.
При производстве этилбензола этилированием бензола в качестве побочного продукта образуется диэтилбензольная фракция, имеющая следующий типичный состав, % (мае.): о-, ж - и п-диэтилбензолы - 7.7, 49.3 и 18.2 соответственно, н-бутилбен - зол - 3.1, ж-этилизопропилбензол - 3.4, прочие примеси - 17.5. Из этой смеси возможно выделение ж-диэтилбензола ректификацией, однако из-за близких температур кипения изомеров выход его составляет всего 8-10 % на диэтилбензольную фракцию. Разработан метод синтеза ж-диэтилбензола с выходом 60 % взаимодействием бензола с этилбензолом при 55-60 °С в присутствии А1С13 в качестве катализатора [592].
Фирма «Mobil Oil Corp.» запатентовала в качестве катализатора диспропорционирования этилбензола, селективного по отношению к /г-диэтилбензолу, формоселективные цеолитные катализаторы, предварительно силилированные толуольными растворами силиконов, силиконовых полимеров, силанов или алкоксисиланов [593].
Дегидрированием диэтилбензолов получают дивинилбензолы и на их основе - сорбенты аналитического назначения; ионообменные смолы высокой степени прочности, каучуки, полупроводники, пластмассы.
Взаимодействием бензола с алленом и метилацетиленом в присутствии цеолита Са-У с силикатным модулем 3.4-6.0 и степенью катионного обмена ионов Са на водород 0.1-0.9, при атмосферном давлении, 140-220 °С, времени контакта 0.1-0.6 с, мольном соотношении бензол : (аллен + метил ацетилен) =1:4 можно получать а-метилстирол [594].
Окислительной дегидрополиконденсацией бензола при 80 °С в присутствии катализатора А1С13-СиС12 в США производится в небольших количествах тг-полифенилен (под торговым названием эймак-221). Установлено, что добавление фторированной сульфокислоты к этой каталитической системе, в которой СиС12 играет роль окислителя, приводит к увеличению степени поликонденсации на 40 %. Использование твердого сокатализатора А1С12[ОСН(СЕ3)2] приводит к образованию полифенилена [595].
Кроме метода окислительной катионной полимеризации бензола для получения п-полифенилена можно использовать электрохимическую полимеризацию бензола, синтезировать его из
1,4- дигалобензолов, поликонденсацией ароматических бис(пиро - нов) с 1,4-диэтинилбензолами по Дильсу - Альдеру. Однако общие недостатки этих методов - наличие в структуре полимера нелинейных дефектов или низкая молекулярная масса [596].
Для полифениленов характерны высокие тепло - и термостойкость (300-600 °С), очень высокая химическая стойкость, даже к кислотам и щелочам, высокая радиационная и абляционная стойкость, хорошие диэлектрические свойства, высокие коксовые числа [597].
Аллилирование бензола и других ароматических соединений аллилхлоридом с использованием каталитической системы гпС12/8Ю2 - К2С03/А1203 (в отличие от гпС12/8Ю2) приводит к образованию только моноаллилпроизводных с выходом 60-80 % [598].
Хлорированием бензола при 80-85 °С и атмосферном давлении в присутствии ЕеС13 производится в промышленности хлорбензол [599]. В качестве побочных продуктов образуется смесь полихлорбензолов, из которой могут быть выделены о - и п-дихлорбензол в отношении 1:2.
Хлорбензол применяется в производстве фенола, дихлорбен - золов, красителей, пестицидов. Дихлорбензолы получают жидкофазным хлорированием хлорбензола в присутствии Ее при 70 °С. Из полученной смеси изомеров п-дихлорбензол выделяют кристаллизацией, а о-дихлорбензол - ректификацией. Методы разделения дихлорбензолов рассмотрены в обзоре [600].
П-Дихлорбензол применяется в качестве инсектицида против моли, дубильного вещества для кожи, промежуточного продукта для производства 2,5-дихлорнитробензола, получаемого нитрованием п-дихлорбензола нитрующей смесью и применяющегося в синтезе красителей. о-Дихлорбензол применяется как высоко - кипящий растворитель (Ткип 179°С) и теплоноситель, например,
в производстве толуилендиизоцианатов, пестицида которана, красителей [599].
На основе о-дихлорбензола получают полиакрилатные и полиамидные пленки и линейные полимеры. Из п-дихлорбензола предложено синтезировать полифениленсульфиды и волокна.
Нитрованием хлорбензола обычно получают смесь 2- и 4-хлор - нитробензолов. Мононитрование хлорбензола в присутствии суль- фатированного оксида циркония [601, 602] или Ее3+-монтмориллонита [603] приводит к преимущественному образованию 4-хлор - нитробензола.
Аминирование арилхлоридов и арилбромидов проводится в присутствии комплексов меди. Еще более активным катализатором аминирования является система 0.25 % (мол.) Рс1 - трет - бутилфосфин [604].
Аминированием нитрохлорбензолов 40 % - м водным раствором ЫНд при 170-197 °С, давлении 5 МПа, продолжительности реакции 4-7 ч получают в промышленности 2- и 4-нитроанилины. Мононитроанилины являются диазосоставляющими при образовании на волокне нерастворимых азокрасителей: 2-, 3- и 4-нитроанилины носят названия азоаминов оранжевого О, оранжевого К и красного Ж. 4-Нитроанилин применяется также в производстве дисперсных и катионных красителей, пигментов, оптических отбеливателей. Восстановлением 4-нитроанилина железом производится п-фени лен диамин. Из 4-нитроанилина получают 2-хлор - и 2,6-дихлор-4-нитроанилины.
2-Нитроанилин применяется в производстве диазолей, дисперсных красителей, пигментов, о-фенилендиамина, 4,6-дихлор - 2-нитроанилина, в качестве антивуалирующего агента в фотографии [356, 467].
Метоксилированием 2- и 4-нитрохлорбензола 80-90 % - м водным раствором метанола при 95-110 °С в течение 4-8 ч в присутствии воздуха или кислорода и щелочи в промышленности получают 2- и 4-нитроанизолы, применяющиеся в производстве 2- и
4- анизидинов - полупродуктов при синтезе красителей и лекарственных средств.
![]()
![]() Этоксилированием 4-хлорнитробензола щелочным раствором этанола в присутствии СиО при 110°С, давлении 0.3 МПа получают 4-нитрофенетол и последующим восстановлением водным раствором ^НБ при 140 °С - п-фенетидин:
Этоксилированием 4-хлорнитробензола щелочным раствором этанола в присутствии СиО при 110°С, давлении 0.3 МПа получают 4-нитрофенетол и последующим восстановлением водным раствором ^НБ при 140 °С - п-фенетидин:
П-Фенетидин применяется в синтезе лекарственных средств - фенацетина, риванола; о и га-фенетидины используются также в производстве азотолов.
Гидрированием хлорнитробензолов получают хлоранилины. Известные каталитические способы получения замещенных ароматических аминов реализуются при средних и высоких давлениях, что связано с повышенными капитальными затратами, металло - и энергоемкостью, эксплуатационными трудностями [605, 606].
Разработана технология получения хлоранилинов и других производных анилина при нормальном давлении водорода в присутствии высокодисперсных катализаторов, содержащих или Рс1 [607]. Производительность предложенной конструкции реактора по аминопродуктам 800-1000 т/(м3- год). Задача отделения суспендированных частиц катализатора от продуктов реакции решена следующим образом: при внезапном расширении потока суспензии, движущейся со скоростью 2-5 м/с, и выводе потока осветленной жидкости из зоны расширения под углом 90-180 к направлению движения суспензии, твердые частицы из-за действия сил инерции сохраняют прежнее направление движения и не попадают в поток. С использованием этого принципа разработана конструкция реакторной системы для непрерывных процессов жидкофазного гидрирования [608]. По предложенной технологии отработаны процессы получения м - и /г-хлоранили- нов, 3,4-дихлоранилина, .м-толуидина, о - и гс-анизидинов, п-фе - нетидина, я-фенилендиамина, ж-трифторметиланилина, 2,4,4'-три-
| аминобензанилида, толуилендиаминов [607].
! Недостатки многих катализаторов гидрирования хлорнитро-
Аренов до хлоранилинов - высокая степень дегалогенирования и низкий выход целевых продуктов [609, 610], низкая удельная ; активность [611]. Предложено использовать в качестве катали
Заторов комплексы Рс12+ с 1-фенил-3-метил-4-фенилазопиразоло - ! ном-5 или 1-фенил-3-метилпиразолоном-5 на носителе А1203, ко-
) торые проявляют высокую активность и селективность при гид
Рировании в мягких условиях. Так, тг-хлоранилин при 25-50 °С получается с выходом 97-98 %. При гидрировании п-динитробензола в спиртовой среде возможно остановить реакцию на стадии восстановления одной нитрогруппы, так как далее скорость реакции снижается вдвое. Скорость поглощения водорода для м-замещенных нитробензолов зависит от природы заместителей, снижаясь в следующем ряду: СООН > С1 > Н > СН3 >
> ЫН2 [612].
Нитрованием хлорбензола или /г-нитрохлорбензола произво-1 дится 2,4-динитрохлорбензол, применяющийся в производстве
2.4- динитрофенола, 2,4-динитроанизола, 2,4-динитроанилина, производных дифениламина.
Так, взаимодействием 2,4-динитрохлорбензола с метанолом в щелочной среде при 50-60 °С получают 2,4-динитроанизол и последующим восстановлением полисульфидами Na - 2-амино-4- нитроанизол (азоамин алый К) [613].
При восстановлении 2,4-динитрохлорбензола ТіС13 (при соотношении 1 : 3) получается смесь З-нитро-4-хлоранилина и
5- нитро-2-хлоранилина в различных соотношениях в зависимости от растворителя - от 3.02 при проведении реакции в метаноле до 4.87 в пропаноле [614,615]. Образующиеся нитрохлорани - лины служат полупродуктами в производстве красителей.
Хлорированием 4-нитрохлорбензола в присутствии безводного FeCl3 в среде дихлорэтана при 85-90 °С в промышленности получают 3,4-дихлорнитробензол и последующим его восстановлением - 3,4-дихлоранилин, применяющийся для производства гербицидов - пропанида, диурона[599].
Нитрованием п-дихлорбензола нитрующей смесью получают
2.5- дихлорнитробензол, использующийся в синтезе красителей.
Хлорметилированием бензола по реакции Блана - действием
Формальдегида и НС1 в присутствии кислот Льюиса или протонных кислот (ZnCl2, А1С13, SnCl4, H2S04> Н3Р04 и др.) получают бензилхлорид [616]. Вместо формальдегида можно использовать триоксиметилен, параформ, ацетали формальдегида.
Бензилхлорид применяется для получения бензилового спирта, сложных эфиров бензойной кислоты, бензилцианида, бензил целлюлозы, используемых в фармацевтической и парфюмерной промышленности, а также в производстве красителей и пластмасс [617].
Омылением бензилхлорида водными растворами щелочей в промышленности производится бензиловый спирт.
Выход бензилового спирта в процессе гидролиза бензилхлорида увеличивается при использовании карбонатов и бикарбонатов вместо щелочи и может достигать 98 %:
2С6Н5СН2С1 + Na2C03 + Н20 — 2С6Н5СН2ОН + 2NaCl +С02
Побочная реакция при гидролизе бензилхлорида - образование дибензилового эфира:
+OH“, - н2о +С6Н5СН2С1
С6Н5СН2ОН «г С6Н5СН2СГ ----- —.... ............ (С6Н5СН2)20
Фирма «Bayer AG» запатентовала способ превращения дибензилового эфира в бензилхлорид и получение чистой соляной кислоты из содержащих НС1 сточных вод синтеза бензилового
Спирта [618]. Способ состоит в нагревании дибензилового эфира при 80-180 °С и давлении 0.05-3 МПа с 5-45 %-м водным раствором НС1 без катализатора.
Той же фирмой запатентован процесс получения бензилового спирта гидролизом бензилхлорида в 10-70-кратном избытке воды при 80-180 °С, без добавления щелочных реагентов и водорастворимых органических растворителей [619]. При этом не образуется №С1 в качестве побочного продукта. Степень конверсии бензилхлорида составляет 35-99 %. Процесс включает следующие стадии: гидролиз бензилхлорида водой; разделение реакционной смеси в сепараторе на водную и органическую фазу; ректификационную отгонку непрореагировавшего бензилхлорида с возвратом его в реактор; ректификационное удаление бензилового спирта из смеси с дибензиловым эфиром, остающимся в кубовом остатке; экстрагирование бензилового спирта из водной фазы; отгонка экстрагента в третьей ректификационной колонне с возвратом его в экстрактор, а кубовый остаток направляют в, первую колонну и далее во вторую для выделения бензилового к спирта; отделение разбавленной соляной кислоты, абсорбция НС1 [620].
Бензиловый спирт применяется в парфюмерии и в качестве растворителя при изготовлении лаков [617].
Взаимодействием бензилового спирта с уксусной кислотой или бензилхлорида с ацетатами щелочных металлов получают бензилацетат. Бензилбензоат производится из бензилхлорида и бензоата Ка в присутствии аминов или из метилбензоата и бензилового спирта в присутствии соды или М^О. Аналогичными методами получают бензилсалицилат и бензилциннамат - бензиловый эфир коричной кислоты С6Н50С(0)СН=СНСбН5.
Бензиловый спирт и его эфиры - душистые вещества в парфюмерии и производстве мыла, а также фиксаторы запаха и рас - творители в парфюмерии (бензилбензоат, бензилциннамат), компоненты пищевых эссенций (бензилацетат, бензилсалицилат) и спазмолитических средств (бензилбензоат). Бензилсалицилат входит в состав фотозащитных косметических препаратов, предохраняющих от солнечных ожогов. Бензиловый спирт и его эфиры служат также растворителями лаков и чернил.
Окислением бензилового спирта, например, трет-бутилгид- ропероксидом с использованием в качестве катализатора молекулярных сит типа МЕЬ (Сг-в-2 с отношением в1/Сг более 140) получен бензальдегид. Селективность образования бензальдеги - да 100 %, выход - 20 % [621]. Этот метод может применяться и для окисления производных бензилового спирта, содержащих, например, в пара-положении группы С1, ОН, ОСН3, ]М02, в соот-
201 ветствующие альдегиды, а также для окисления 1-тетралола в
1-тетралон.
Окислением бензилового спирта при использовании в качестве катализатора цеолита Cu-Na-ZSM-5 с атомным отношением Na/Cu = 5.4 и температуре реакции 400°С получен бензальдегид с выходом 71.1 % при конверсии бензилового спирта 84.4 % [622].
Аминированием бензилхлорида аммиаком в спиртовой среде получают бензиламин [617]:
+NH3 +NH3
С6Н5СН2С1 -------------- C6H5CH2NH2 • HCl _NH4C1» C6H5CH2NH2
В качестве побочных продуктов получаются ди - и трибензил- амины:
+СбН5СН2С1 +c6h5ch2nh2
C„hsch2nh2 -------------------------- ► (c6h5ch2)2nh ■ неї ,СбН5СНгКНг. НС1 -
+СбН5СН2С1 н-СбНйСНгЬШг
(CeHsCH2)2NH ----------------------------- ► (C6H5CH2)3N HCl-------------------------- -
(C6H5CH2)3N
Добавление к спирту воды приводит к снижению общего выхода аминов, но зато повышается селективность образования бензиламина [623]. Наилучшие результаты получены при взаимодействии бензилхлорида с аммиаком в смеси изопропилового спирта с водой и бензолом [624]: при 60 °С выход бензиламина равен 57.5 % при содержании его в реакционной смеси 65.2 % и минимальном содержании трибензиламина - 4.8 %.
Производные бензиламина могут быть получены взаимодействием соответствующего производного бензилхлорида с NH4OH в присутствии производных бензальдегида. Так, 2-хлорбензил - амин получен из 2-хлорбензилхлорида, 2-хлорбензальдегида и NH4OH с выходом 80 % [625]. Полученные бензиламины используются как полупродукты синтеза лекарств, красителей, сельскохозяйственных химикатов, пластических масс, ингибиторов кислотной коррозии [617].
Бензилхлорид применяется также для получения четвертичных аммониевых оснований. N-Бензилтриэтаноламмонийхлорид и в особенности продукт его этоксилирования являются превосходными ингибиторами коррозии для стальных трубопроводов при работе с сырой нефтью и нефтяным топливом [626].
Взаимодействием бензилхлорида с диметиламином при 100- 160 °С и давлении 0.5-3 МПа получают ІЧ^-диметилбензил-
амин, применяющийся в качестве отвердителя олигодиенуре - тандиэпоксидов, ингибитора коррозии, экстрагента Со2+ и №2+ из сульфатных растворов, а также для получения четвертичных аммониевых солей и оснований.
Взаимодействием бензилхлорида с ИаСЫ производится бен - зилцианид, применяющийся для получения транквилизаторов (диазепама, фенобарбитона) и других лекарственных препаратов, например Р-фенилэтиламина. Гидролизом бензилцианида получают фенилуксусную кислоту:
SHAPE \* MERGEFORMAT ![]()
|
Н20 |
![]()
|
CrHsCHj. CN |
![]() С«Н*СН9С00Н
С«Н*СН9С00Н
Фенилуксусная кислота применяется для производства пенициллина, транквилизаторов, антикоагулянтов крови и как душистое вещество в парфюмерии и пищевой промышленности [627].
Сплавлением фенилуксусной кислоты с о-фенилендиамином с последующим гидрохлорированием получают гидрохлорид
2 - бензи лбензимидазола:
|
N112 |
|
А |
|
НС1 |
|
+ СбН5СН2СООН |
|
МНг |
|
НС1 |
|
|] ^СН СН2С6Н5 N I Н |
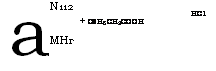 |
![]()
Полученный продукт под названием дибазол применяется как сосудорасширяющее, гипотензивное и спазмолитическое средство.
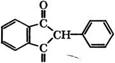
Взаимодействием фенилуксусной кислоты и ее производных с фталевым ангидридом с последующей изомеризацией образующихся бензилиденфталидов в присутствии СН3СЖа или С2Н5СЖа образуются 2-фенил-1,3-индандион (фенилин)
|
О |
И его производные - антикоагулянты крови [628].
Нитрованием фенилуксусной кислоты азотной кислотой в отсутствие Н2804 при -14 °С получается п-нитрофенилуксусная кислота [629]. л-Нитрофенилуксусная кислота используется для получения биологически активных соединений, в том чис
ле модифицированного пенициллина О, анальгетиков, диуретиков, антиаритмических препаратов, веществ с антибактерицид ной и фунгицидной активностью, гербицидов. На основе п-нитрофенилуксусной кислоты и п-нитробензилцианида получены красители и пигменты для синтетических материалов. д-Нитрофенилуксусная кислота используется для получения фотоматериалов, в том числе для записи голограмм, приготовления фоточувствительных полимерных композиций. Она применяется также для синтеза арилпиримидинов, на основе которых получены термостойкие высокомодульные полиимидные пленки и волокна.
Взаимодействием бензилхлорида с Р-нафтолом и карбонатом щелочного или щелочноземельного металла в инертном, смешивающемся с водой растворителе, при 60-150 °С получают Р-наф - тилбензиловый эфир, применяющийся для получения термобумаги для телефаксов [630].
Взаимодействием бензола с тетрахлорметаном в присутствии А1С13 получают дифенилдихлорметан, гидролизом которого в промышленности производится бензофенон.
Бензофенон может быть также получен взаимодействием бензола с бензоилхлоридом в мольном соотношении 5 : 1 в присутствии 1 % (мае.) РеС13 (по отношению к бензоилхлориду) при 190°С, давлении 0.14 МПа, продолжительности процесса 8 ч с выходом 83.2 % [631].
Бензофенон применяется как фиксатор запаха и душистое вещество в производстве мыла, ингибитор полимеризации, мягкий окислитель.
2-Гидрокси-4-алкил(С7-С9)гидроксибензофеноны и 2,2'-дигид- рокси-4-октилгидроксибензофенон применяются в качестве стабилизаторов пластмасс, особенно для прозрачных пленок. Так,
2- гидрокси-4-октилоксибензофенон может быть получен с выходом 90 % кипячением в бутанольном растворе в течение 15 ч смеси 2,4-дигидроксибензофенона и октилхлорида в присутствии К1, триэтиламина и безводного Ка2С03 [632].
![]()
|
+ А1С13 ■ НС1 |
![]() Формилированием бензола по реакции Гаттермана - Коха действием смеси СО и НС1 получают бензальдегид [633]:
Формилированием бензола по реакции Гаттермана - Коха действием смеси СО и НС1 получают бензальдегид [633]:
|
|
Карбонилирование бензола может проводиться с образованием бензальдегида и в присутствии цеолитных катализаторов, например типа H-Y [634].
По реакции Фриделя - Крафтса из бензола и ацетилхлорида или уксусного ангидрида в присутствии А1С13 или FeCl3 с выходом 85 % получается ацетофенон. Ацилирование аренов до соответствующих кетонов может проводиться также с использованием цеолитов в качестве катализаторов [635].
Ацетофенон и его замещенные (п-метил-, п-метокси-) применяются в парфюмерии как душистые вещества.
Ацетофенон получается также в качестве побочного продукта совместного производства стирола и пропиленоксида [636]. Применяемой технологией предусматривается стадия гидрирования ацетофенона в метилфенилкарбинол с последующим получением стирола дегидратацией при 280-300 °С. Однако более экономично каталитическое окисление ацетофенона в среде алифатических кислот в присутствии органических солей Мп или Со-Mn до бензойной кислоты [637]. Окисление ацетофенона может проводиться также без кислотного растворителя в присутствии резината Мп. При этом протекают следующие реакции:
С6Н5СОСН3 + 202 — С6Н5СООН + С02 + Н20 С6Н5СОСН3 + 1.502 — С6Н5СООН + НСООН
С6н5сосн3+о2 —► С6Н5СООН + сн2о
Определены оптимальные условия процесса: 140-150°С, содержание катализатора 0.07 % (мае.) на Мп, скорость воздуха 0.08 м/с. При этом селективность образования бензойной кислоты 90-94 % , конверсия ацетофенона 40 %.
Продолжается поиск более эффективных катализаторов гидрирования ацетофенона до метилфенилкарбинола. Так, ПО «Нижнекамскнефтехим» запатентовано использование Cu-Cr - Ва-катализатора и стабилизирующей добавки - диэтилгидрок - силамина в количестве 0.005-0.05 % (мае.) от ацетофенона
[638] . Японской фирмой «Sumitomo Chemical Со.» предложено проводить гидрирование ацетофенона в присутствии медных катализаторов, содержащих соединения щелочного металла
[639] .
При использовании Rh на силикагеле, промотированного тетрабутило ловом, метилфенилкарбинол при гидрировании ацетофенона образуется с селективностью 92-97 % [640].
•и В присутствии комплексов рутения, содержащих полиден - татные аминофосфиновые лиганды состава RuC12(P2N2H4), гидрирование ацетофенона происходит до 2-фенилэтанола с выходом 99 % [641].
Корпорация «Hoechst Celanese» запатентовала способ получения арилэтанолов RCH2CH2OH (R = С6Н5, 4-НОС6Н4, нафтил) окислением RCOCHg в кислой среде алкилнитритом в смеси с алифатическим спиртом R'OH, полученный продукт RCOCH(OR')2 гидролизуют до арилглиоксаля, который восстанавливают над Pd/C. Например, из 4-гидроксиацетофенона может быть получен арилэтанол (R = 4-НОС6Н4) с выходом 50 % [642].
4-Гидроксифенилметилкарбинол получают гидрированием 4-гидроксиацетофенона при 20-100°С на Pd, нанесенном на А1203, Si02, СаС03 или С, в полярном протонном растворителе (метанол, вода) в присутствии щелочных добавок [643, 644]. Синтезированный спирт применяется для получения 4-гидроксистирола, полимеры на основе которого используются как адгезивы, в фоторезистах, покрытиях.
Взаимодействием ацетофенона с метилбензоатом в присутствии метилата Na в ксилоле при 135—140 °С с непрерывной отгонкой метанола получен с выходом 95 % ароматический Я-дикетон [645]:
CHoONa
С6н5-сх + 'с-с6н5 --------- ►
СН3 СН30
—► с6н5—с—сн2—с—с6н5 + СН3ОН
Полученный дикетон может быть использован в качестве стабилизатора полимеров и как добавка, ускоряющая фотодеструкцию полиолефинов.
Конденсацией ацетофенона с этилацетатом в присутствии этилата Na при 85-100 °С с выходом 50% в промышленности получают бензоилацетон:
CoHЯONa
С6Н5С(0)СН3+СН3С00С2Н5 ---------------- ► С6Н5С(0)СН2С(0)СН3 + С2Н5ОН
Бензоилацетон - душистое вещество в парфюмерии, реагент в аналитической химии.
Взаимодействием бензола с избытком хлорсульфоновой кислоты при 30-35 °С в промышленности получают бензолсульфо- хлорид. Бензолсульфохлорид применяется для получения бен - золсульфамида и метилового эфира бензолсульфокислоты - полупродуктов в производстве красителей и лекарственных веществ.
Бензолсульфамид получают в промышленности взаимодействием бензолсульфохлорида с водным раствором МН3 или (1Ш4)2С03 при 70-90°С [599]:
С6Н5802С1 + 21Шз —► С6Н58021Ш2 + Ш14С1
Алкилзамещенные бензолсульфамиды синтезируют из бен - золсульфохлоридов и первичных или вторичных аминов в водной среде или инертном растворителе. Алкилбензолсульфамиды используются в качестве пластификаторов.
Хлорированием щелочного раствора бензолсульфамида производится хлорамин Б (тригидрат натриевой соли монохлор- амида бензолсульфокислоты) С6Н5802Ы(Ка)С1 • ЗН20. Водные растворы хлорамина Б применяются для лечения инфицированных ран, дезинфекции, дегазации некоторых отравляющих веществ, а также в качестве отбеливателя в текстильной промышленности.
Бензолсульфамиды, содержащие аминогруппы в бензольном кольце, являются промежуточными продуктами в производстве сульфамидных препаратов, азокрасителей и оптических отбеливателей.
Взаимодействием бензола с бензолсульфохлоридом при 80- 110°С в присутствии ЕеС13 получают дифенилсульфон. Дифенил - сульфон образуется также при пропускании паров бензола через колонну с 95 % - й Н2804, нагретую до 260 °С [362].
Дифенилсульфоны могут быть получены и по реакции Ульмана - конденсацией арилгалогенидов с арилсульфиновыми кислотами в присутствии Си при нагревании в инертном растворителе [646]:
АгНа1 +Аг'БОгН — Аг802Аг' + НС1
Взаимодействием хлорбензола с хлорсульфоновой кислотой получают 4,4'-дихлордифенилсульфон. Образующуюся в качестве примеси п-хлорбензолсульфокислоту переводят в аммонийную соль, которая взаимодействует с хлорсульфоновой кислотой в присутствии растворителя (СС14, дихлорэтана) с образованием п-хлорбензолсульфохлорида [647].
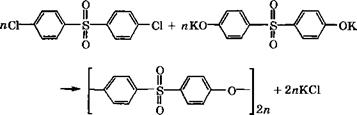
Поликонденсацией 4,4'-дигалогендифенилсульфона со щелочными солями бисфенола А в полярных растворителях (диме- тилсульфоксиде, Ы-метилпирролидоне, сульфолане) при 150- 200 °С получают полисульфоны [393]:
Поликонденсацией 4,4'-дихлордифенилсульфона с дикалие - вой солью дигидроксидифенилсульфона (бисфенола в) в растворе синтезируют полиэфирсульфоны [648]:
|
|
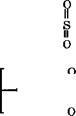
|
ПС—-------------------------------------------------- О-С! + пКО—°К |
![]()
|
+ 2пКС1 |
![]()
|
Полисульфоны отличаются высокой термо - и химической стойкостью, негорючестью, стойкостью к радиоактивному излучению. Температура начала термического разложения полису льфонов превышает 400 °С, т. е. на 40-60°С выше температуры переработки. Полисульфоны устойчивы в растворах щелочей и минеральных солей, слабых растворах минеральных кислот, алифатических углеводородах, моторных и дизельных топливах, нефтяных и растительных маслах. |
 Поликонденсацией 4,4'-дихлордифенилсульфона с дикалие - вой солью 4,4'-дигидроксидифенила в растворе получают поли - фениленсульфон:
Поликонденсацией 4,4'-дихлордифенилсульфона с дикалие - вой солью 4,4'-дигидроксидифенила в растворе получают поли - фениленсульфон:
Полисульфоны применяются в качестве конструкционных материалов для изготовления изделий, работающих длительное время в экстремальных условиях - при температуре от -100 до 200 °С, под нагрузкой, в агрессивных средах. Используются полисульфоны и в производстве электроизоляционных пленок, в том числе для печатных плат. Кроме того, полисульфоны применяются как связующие при изготовлении препрегов, армированных углеродными и другими высокопрочными волокнами.
Добавлением к полисульфонам политерефталатных эфиров, полиэфирэфиркетонов или полиимидов можно значительно улучшить скольжение и износостойкость. Фирма «Ticona», выпускающая полисульфоны, применяет их в машиностроении и промышленности полупроводников. Порошкообразную смесь по- лифениленсульфонов с металлами или керамикой можно перерабатывать плазменным распылением, получать износостойкие покрытия для турбин самолетов, турбонагнетателей или газовых турбин для повышения их мощности [649].
Эффективными добавками к полиариленсульфонам для производства стеклопластиков являются жидкокристаллические полиэфиры на основе оксибензойной кислоты и полиэти - лентерефталата. Эти добавки снижают вязкость расплавов полимеров, что важно при пропитке волокнистых материалов для получения препрегов. Сдвиговые характеристики стеклопластиков повышаются при содержании 2-8 % (мае.) жидкокристаллических полиэфиров в смесях с полисульфонами [650].
Потребление полисульфонов и полиэфирсульфонов в 1985 г. составляло, тыс. т: в США - 7, Западной Европе - 2, Японии - 0.7. К 1995 г. масштабы их потребления в Западной Европе должны были возрасти до 5.6 тыс. т [651].
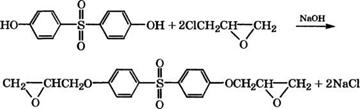
Технический дигидроксидифенилсульфон может быть очищен до содержания основного вещества 99.8 % (мае.) растворением при 90-110 °С в н-бутаноле с последующей обработкой апротонным растворителем (бензолом, трихлорэтиленом, тет - рахлорметаном). 4,4'-Дигидроксидифенилсульфон (бисфенол S) применяется также в синтезе искусственных дубителей кожи [652].
Конденсацией бисфенола S с эпихлоргидрином в водном растворе NaOH в присутствии катализатора - насыщенного водного раствора солянокислого триметиламина и дегидрохлорированием в изопропиловом спирте получен кристаллический диглици - диловый эфир 4,4'-дигидроксидифенилсульфона [653]:
|
|
Полученный диглицидиловый эфир используется в качестве основы для создания компаундов для герметизации изделий электронной техники.
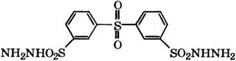
Аммонолизом 4,4/-дихлордифенилсульфона 15-24 %-м водным раствором МН3 получают 4,4'-диаминодифенилсульфон [654], применяющийся в качестве отвердителя эпоксидных смол, а также в производстве красителей и лекарственных веществ.
Дигидразид дифенилсульфон-3,3'-дисульфокислоты
|
|
Применяется как порообразователь [362].
Жидкофазным бромированием бензола на холоду в присутствии железных стружек в промышленности производится бром - бензол. При избытке Вг2 получаются дибромбензолы. Бромбен - зол используется как растворитель, а также для получения реактива Гриньяра и дифенила.
Взаимодействием бромбензола с ЬШ4Вг или бромидами щелочных металлов, а также с нитрующей смесью получен 1,2-дибром-3,5-динитробензол, использующийся как полупродукт в синтезе красителей, пестицидов и гербицидов [655].
Кипячением бензола с 4-фторфенолом в присутствии А1С13 получают 4-гидроксидифенил. Он может быть также получен щелочным плавлением дифенил-4-сульфокислоты. 4-Гидрокси - дифенил применяется как промежуточный продукт при синтезе неионогенных ПАВ.
Взаимодействием бензола с этиленоксидом в присутствии А1С13 или гидрированием стиролоксида в промышленности производится 2-фенилэтанол. 2-Фенилэтанол применяется для приготовления парфюмерных композиций, отдушек для мыла и косметических изделий, пищевых эссенций. Аналогичное применение находят и эфиры 2-фенилэтанола, в частности фенил -
Этилацетат, получаемый взаимодействием 2-фенилэтанола с уксусной кислотой в присутствии Н2804. Каталитическим окислением 2-фенилэтанола получают фенилацетальдегид, также использующийся в парфюмерии как душистое вещество с запахом гиацинта.
Конденсацией бензола с 3,3-фталоилдихлоридом в присутствии А1С13 получают 3,3-дифенилфталид, входящий как структурный фрагмент в состав красителей фталеинов, в частности фенолфталеина.
Прямым замещением трех СО-групп в молекуле гексакарбонила металла бензолом в присутствии инициатора (пиридина, ГШ4ВГ4) при 160-200 °С с выходом 70-95 % получены бензолме - таллтрикарбонилы [656]:
С6Н6 + М(СО)6 ^ С6Н6М(СО)3 + ЗСО М == Сг, Мо, \^
Бензолхромтрикарбонил - уникальный по селективности катализатор гидрирования диенов и полиенов до моноолефинов - проявляет высокую активность при полимеризации этилена. Бензолмолибдентрикарбонил катализирует реакцию эпоксиди - рования.

 Опубликовано в
Опубликовано в