ПРИМЕНЯЕМЫЕ ПРИ ЭЛЕКТРИЧЕСКОЙ СВАРКЕ ПЛАВЛЕНИЕМ
 20 февраля, 2016
20 февраля, 2016  xeil
xeil Аргон, так же как и гелий, является одноатомным инертным газом, он бесцветен, не имеет запаха, тяжелее воздуха, что обеспечивает хорошую защиту сварочной ванны.
В промышленности аргон добывается при получении кислорода и азота из воздуха, массовая доля в котором составляет 1,28 %.
Аргон, предназначенный для сварки, регламентируется ГОСТ 10157—79 и в зависимости от содержания и назначения делится на три сорта.
Аргон высшего сорта (не менее 99,99 % Аг) предназначен для сварки титановых сплавов, циркония, молибдена и других активных металлов и их сплавов, а также особо ответственных изделий из нержавеющих сталей.
Аргон первого сорта (не менее 99,98 % Аг) предназначен для сварки плавящимся и неплавящимся электродом алюминиевых и магниевых сплавов.
Аргон второго сорта (не менее 99,95 % Аг) предназначен для сварки изделий из чистого алюминия, коррозионно-стойких сталей и жаропрочных сплавов.
Смеси аргона с другими газами в определенных процентных отношениях поставляются по особым ТУ.
Гелий — инертный газ без цвета и запаха, значительно легче воздуха. Получают из природных газов методом фракционной конденсации, который заключается в следующем. Природный газ, содержащий гелий, подвергают неоднократному сжатию и охлаждению, при этом примеси, имеющие более высокую, чем гелий, температуру сжижения, превращаются в жидкость. Гелий, температура сжижения которого равна —269 °С, остается при этом в газообразном состоянии. После ряда сопутствующих химических очисток окончательная очистка гелия производится пропусканием его через активированный уголь, после чего он поступает в баллоны. ГОСТ 20461—75 предусматривает два сорта газообразного гелия: гелий высокой чистоты (99,98 Не) и гелий технический (99,8 % Не).
Углекислый газ в нормальных условиях представляет собой бесцветный газ с едва ощутимым запахом.
При повышенном давлении и низкой температуре углекислота переходит в жидкое или твердое состояние. Под давлением 528 кПа и при температуре —56 °С углекислота может находиться во всех трех состояниях (так называемая тройная точка).
Плотность жидкой углекислоты сильно изменяется с температурой. Так, масса 1 л жидкой углекислоты при температуре - f-20 °С равна 0,77 кг, а при температуре ниже 11 °С жидкая углекислота становится тяжелее воды. Поэтому она поставляется не по объему, а по массе. При испарении 1 кг жидкой углекислоты образуется 509 л углекислого газа.
В промышленном масштабе углекислоту можно получить следующими способами:
1) из известняка, в котором содержится до 40 % С02, кокса или антрацита путем их обжига в специальных печах;
2) на установках, работающих по сернокислому методу за счет реакций взаимодействия серной кислоты с эмульсией мела;
3) из газов брожения гидролизной, сахарной промышленности;
4) из выхлопных газов двигателей внутреннего сгорания.
Рассмотрим третий способ получения С02 применительно к гидролизному производству, как более распространенный.
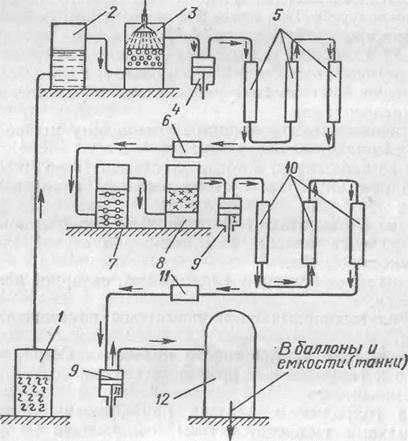
На гидролизных заводах при брожении дрожжей с опилками выделяются газы, содержащие 99 % С02 (рис. 46). Газ из бродильного чана 1 подается насосами, а при наличии достаточного давления поступает самостоятельно в газгольдер 2, где происходит отделение от него твердых частиц. Затем газ поступает в промывочную башню 3, заполненную коксом или керамическими кольцами, где он омывается встречным потоком воды и окончательно освоболздается от твердых частиц и растворимых в воде примесей. После промывки газ поступает в предварительный компрессор 4, где он сжимается до давления 400—550 кПа.
Так как при сжатии температура газа повышается до 90—100 °С, то после компрессора газ поступает в трубчатый холодильник 5, где охлаждается до 15 °С. Затем
ИЗ
газ направляется в маслоотделитель 6, где отделяется масло, попавшее в газ при сжатии. После этого газ подвергается очистке водными растворами окислителей (КМп04, К2Сг2Р7, гипохромитом) в башне 7, а затем осушке активированным углем или силикагелем в башне 8.
После очистки и осушки газ поступает в двухступенчатый компрессор 9. На ступени I происходит сжатие
|
Рис. 46. Схема получения углекислого газа на гидролизных заводах |
его до 1—1,2 МПа; затем он поступает в холодильник 10, где охлаждается со 100 до 15 °С, проходит маслоотделитель 11 и поступает на II ступень компрессора, где сжимается до б—7 МПа, превращается в жидкость и собирается в цистерну 12, из которой производится наполнение стандартных баллонов или других емкостей (танков).
Хранится жидкая углекислота в баллонах при давлении 5—6 МПа.
В стандартные баллоны емкостью 40 л летом заливается 25 л углекислоты, при испарении которой образуется
Азот — газ без цвета и запаха; при температуре —196 °С превращается в жидкость. Азот является нейтральным по отношению к меди, а при высоких температурах ряд металлов с азотом образует нитриды (титан, молибден и др.).
![]()
 Получают азот из атмосферного воздуха, путем его сжижения с последующей ректификацией. Газообразный азот применяется для сварки меди, аустенитных сталей и плазменной резки. Технический газообразный азот должен соответствовать требованиям ГОСТ 9293—74, регламентирующего три состава азота: 1) электровакуумный, не менее 99,9 % азота; 2) первый сорт — не менее 99,5 % азота; 3) второй сорт — не менее 99,0 % азота, остальное — допустимое содержание кислорода.
Получают азот из атмосферного воздуха, путем его сжижения с последующей ректификацией. Газообразный азот применяется для сварки меди, аустенитных сталей и плазменной резки. Технический газообразный азот должен соответствовать требованиям ГОСТ 9293—74, регламентирующего три состава азота: 1) электровакуумный, не менее 99,9 % азота; 2) первый сорт — не менее 99,5 % азота; 3) второй сорт — не менее 99,0 % азота, остальное — допустимое содержание кислорода.
Водород в чистом виде представляет собой газ в 14,5 раза легче воздуха, не имеющий цвета, запаха и вкуса.
Для промышленных нужд водород производится следующими способами:
1) электролизом дистиллированной воды, при котором получают водород, кислород и некоторые примеси;
2) железопаровым способом, основанном на пропускании через горячее восстановленное железо пара. В результате проходящей реакции образуется водород, окись железа и некоторые примеси;
3) электролизом раствора хлористых солей, при этом получается водород, хлор и некоторое количество примесей.
ГОСТ 3022—80 предусматривает четыре марки технического водорода: 1) А — 99,8 % Н; 2) Б — 98 % Н;
3) В первого сорта — 98,5 % Н, второго сорта — 97,5 % Н; 4) Г первого сорта — 97,5 % Н, второго сорта — 95 % I I.
Сравнительная стоимость 1 м3 газа при принятии за единицу стоимость 1 м3 азота:
Азот........................................................ 1
Кислород.............................................. 2
Водород. 3
Углекислый газ..................................... 3
Аргон.................................................... 20
Гелий.................................................. 110

 Опубликовано в
Опубликовано в