ОБЩИЕ ПРЕДСТАВЛЕНИЯ О ВОЗНИКНОВЕНИИ НОВОЙ ФАЗЫ
 4 января, 2013
4 января, 2013  admin
admin В результате взаимодействия воды с поверхностью реального твердого тела возникают процессы, ведущие к его полному или частичному растворению. Это явление зависит прежде всего от структуры растворимого вещества, природы (свойств) растворителя и температуры.
Минералы портландцемента имеют преимущественно ионную кристаллическую структуру, в связи с чем рассмотрим механизм растворения кристалла, в узлах ячеек которого находятся поочередно расположенные ионы соответствующих химических элементов. В кристаллах такого типа разноименно заряженные ионы связаны друг с другом силами электростатического притяжения, и работа, необходимая для нарушения этих связей, измеряется энергией кристаллической решетки. Последняя не одинакова для различных минералов и зависит от радиуса и заряда ионов, расстояния между ними, характера (геометрического строения) решетки и др.
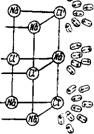
Для растворения минералов цемента необходимо преодолеть силы, действующие в кристаллической решетке, т. е. надо разрушить кристаллическую структуру, поэтому растворимость находится в обратной зависимости от энергии, аккумулированной в кристаллической решетке, т. е. от химического потенциала минерала. При диссоциации минералов портландцемента энергии решетки противостоит энергия гидратации, зависящая от сил, действующих между полярными молекулами воды и ионами минералов твердой фазы. При соприкосновении воды с поверхностью минерала, ионы, составляющие его кристаллическую решетку, притягиваются противоположно заряженными частицами молекул воды. При погружении в воду кристалла какой-либо соли, например NaCl, катион будет притягиваться отрицательно заряженной частью диполя молекулы воды (атомом кислорода), а ион (анион)—положительно заряженными атомами водорода (рис. 4.1).
Если при этом энергия гидратации будет достаточно велика по сравнению с энергией кристаллической ре
шетки, то ионы поверхностного слоя окажутся оторванными от нее и перейдут в раствор. Здесь ионы будут разобщены молекулами воды, которые их окружают, ориентируясь своими противоположными по заряду частями и образуя так называемую гидратную оболочку, которая очень устойчива. В процессе кристаллизации солей из пересыщенного ионного раствора часть ее сохраняется даже в твердом состоянии (кристаллизационная вода). Примером могут служить соединения: Na2S04 • ЮН20 • СаС12 • 6Н20; CaS04-2H20, а также кристаллогидраты портландцемента. Кристаллизационная вода испаряется только при высоких температурах: у гипса — CaS04-2H20 дегидратация наступает при 473 К, а у других минералов — при более высоких температурах (573— 773) К. В количественном отношении ослабление связи между ионами в растворе определяется законом Кулона.
Из-за большой диэлектрической постоянной воды, равной 81, и ослабленной в силу этого связи между поверхностными ионами минерала (растворяемого вещества) последние легко отрываются от кристалла. При взаимодействии ионного кристалла с водой происходят два процесса: переход ионов из твердого тела в раствор (растворение) и объединение ионов в растворе в кристаллы. Скорость первого процесса прямо пропорциональна величине поверхности кристалла, а скорость второго — определяется непосредственно концентрацией ионов в растворе. По мере его насыщения ионами, оторвавшимися от кристалла, определенное количество молекул воды расходуется на образование гидратных оболочек вокруг ионов, а поэтому растворение минерала, или диссоциация его на ионы, замедляется. Вместе о ростом концентрации раствора ускоряется обратный процесс, связанный с ассоциацией ионов в кристаллы. Когда оба процесса начинают протекать с одинаковой скоростью, наступает энергетическое равновесие, при котором минерал практически перестает растворяться.
|
Рис. 4.1. Разрушение - ионной решетки кристалла NaCi молекулами воды |
Если переходящие в раствор ионы не удаляются из его слоя (прилегающего к поверхнности кристалла), рас
творение сильно замедляется. Поскольку диполи в смежных слоях водьг могут притягивать перешедшие в раствор ионы, то они будут находиться в движении. Вследствие этого произойдет перераспределение ионов из мест с большей концентрацией в места с меньшей концентрацией, и растворение будет продолжаться. Диффузия происходит медленно; скорость растворения можно увеличить в случае периодической смены (обновления) растворителя или же при искусственном механическом перемешивании. Активизация растворения после достижения раствором состояния насыщения происходит при повышении температуры, так как в этом случае возрастает уровень колебательного движения атомов в кристаллической решетке, способствующего ослаблению в ней ионных связей. Это облегчает разрушение диполями воды кристаллической решетки и в результате ускоряется растворимость минерала (вещества).
Увеличение растворимости с повышением температуры наблюдается почти у всех твердых тел. Исключение составляет небольшое число веществ, растворимость которых в интервале температур между 313 и 373 К уменьшается. Например, это свойственно CaS04; NaS04-H20; Са(ОН)2, что объясняется разным содержанием кристаллизационной воды в образующихся осадках.
При температурах выще 373 К растворимость большинства солей, подобно гипсу, уменьшается. При медленном охлаждении насыщенного раствора из него может выпадать осадок в виде кристаллов, а в другом случае некоторые вещества образуются при охлаждении пересыщенного раствора с большим содержанием новообразований. Такой раствор неустойчив и из него при встряхивании или введении электролитов быстро выделяется избыток продуктов растворения.
В разведенных ионных растворах диссоциация протекает полностью. Однако с увеличением концентрации при сближении ионов некоторая часть их может вновь образовать молекулы; такие системы называются сильными электролитами. В растворе могут находиться также и неэлектролиты, которые из-за гидратной оболочки не диссоциируют на ионы. Если только часть молекул подвергается диссоциации, то полученный раствор будет слабым электролитом, степень диссоциации которого определяется отношением диссоциированных к общему числу растворенных молекул (в %). При уменьшении концентрации электролитов степень диссоциации, выраженная указанным отношением, возрастает.
Если среди пространственно ориентированных молекул воды находятся ионы, создающие силовые поля, кристаллическое строение воды будет нарушаться. Следовательно, процесс растворения выражается не только физическим актом разъединения частиц, составляющих кристаллическую решетку вещества. Образование раствора сопровождается также кардинальным изменением структуры воды, зависящим от химического состава вещества (его химического потенциала), температуры и внутренних силовых полей между ассоциированными ионными кристаллами.
Трансформация цементного геля в реальное твердое тело обусловливается образованием новых фаз (кри - сталлогидратных комплексов) в результате взаимодействия ионов и молекул растворимого вещества и растворителя. Этот сложный процесс состоит из нескольких стадий; он начинается с образования пересыщенных ионных растворов, в которых затем возникают кристаллические зародыши (центры кристаллизации).
Как известно, ненасыщенные и насыщенные растворы находятся в устойчивом состоянии; в отличие от них, пересыщенные растворы нестабильны. Однако в ряде случаев в них, так же как и при устойчивых формах, может в течение определенного времени, зависящего от степени отклонения концентрации раствора от равновесного состояния и природы составляющих его веществ (диссоциированных ионов минералов первичной твердой фазы), не происходить никаких изменений. Переход из неравновесного состояния в равновесное сопровождается кристаллизацией, непременное условие для которой — наличие пересыщенного раствора.
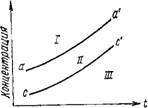
При концентрации вещества выше предельной растворы кристаллизуются мгновенно. Если же в пересыщенных растворах концентрация вещества ниже предельной, кристаллизации в них не происходит. Граница, разделяющая эти две области, называется границей местабильности. Первая область пересыщенных растворов именуется лабильной, а вторая — нестабильной. Область на диаграмме состояний растворов (рис. 4.2), расположенная выше кривой аасоответствует лабильному состоянию, между кривыми аа' и сс' находится область местабильных растворов, а ниже кривой сс— область
стабильных ненасыщенных растворов. Кривая аа' определяет границу местабиль - ности, а кривая ее' — растворимости.
Способность вещества образовывать пересыщенные растворы обусловливается силами электрического происхождения, однако представление о природе этих сил, определяющих пересыщение вообще и положение границы местабиль - ности, в частности, сформулировано лишь в общем виде.
Период кристаллизации, в течение которого концентрация ионного раствора не изменяется, называется индукционным (латентным или скрытным). Продолжительность этого периода зависит от степени пересыщения, природы кристаллизующегося вещества и растворителя, содержания в растворе различных примесей (твердых частиц), интенсивности физического воздействия и других факторов. Изучение периода индукции имеет важное значение для раскрытия механизма кристаллизации, природы отдельных ее стадий и определения некоторых физических величин, характеризующих свойства кристаллических образований. При исследовании индукционных периодов различных веществ ряд авторов высказал различные точки зрения. Одни придерживаются мнения, что на протяжении индукции превалирует процесс образования зародышей. Другие связывают этот период с агрегацией (коагуляцией) частиц до размеров, при которых происходит их седиментация. Предполагают, что в течение периода индукции идет образование мельчайших кристаллов, рост которых лимитируется диффузией.
|
С
Температура Рис. 4.2, Области состояния раствора при различном насыщении |
|
/ — область лабильных; II — места- бильных; /// — стабильных (ненасыщенных) растворов |
При одном и том же пересыщении продолжительность индукционного периода существенно зависит от присутствия в растворе растворимых и нерастворимых примесей. Вторые способствуют увеличению периода индукции. Растворимые же примеси могут сокращать или удлинять период индукции при изменении степени раство
римости кристаллизующейся соли из раствора, адсорбироваться на зародышах и маленьких кристалликах, а также входить в химическое взаимодействие с кристаллизующимся веществом, например при образовании комплексных соединений. Кроме того, большое влияние на индукционный период оказывает температура, с ростом которой его продолжительность уменьшается.
Длительность периода индукции можно изменить физическим воздействием на раствор, например путем механических (вибрационных) колебаний, интенсивного перемешивания, а также использования различных силовых полей и излучения. Ряд исследователей установил, что физические воздействия на ионные растворы способствуют возникновению центров кристаллизации, и в зависимости от степени насыщения интенсивность таких воздействий должна быть различной. В частности, было определено сильное действие лучей радия, электрического поля, магнитного поля и ультразвука на возникновение и развитие центров кристаллизации. Этот процесс существенно зависит также от концентрации раствора, наличия в нем примесей и др. [128].
Процессы, связанные с образованием центров кристаллизации, в указанных случаях не получили еще должного объяснения. Имеются попытки относить это за счет диффузии кристаллизующего вещества к месту образования зародыша, вывода его из зоны флуктуации, уменьшения флуктуации вообще и т. п. Зародышами обычно называют комплексы из минимального количества новообразований, способные самостоятельно существовать и служащие центрами кристаллизации новой фазы. Полагают, что зародышем может стать частица определенной минимальной (критической) величины, так как при меньшем размере она распадается на составные элементы. Одни исследователи считают зародыш мельчайшим кристаллом. Другие «утверждают, что зародыши может вовсе не иметь кристаллической структуры; им может быть устойчивый комплекс ионов или молекул, способных к дальнейшему росту. Зародышем также может быть не только мельчайшая частица кристаллизующегося вещества, но и любая другая твердая частица, обладающая свойством адсорбировать на своей поверхности ионы или молекулы кристаллизующейся соли.
Как известно, образование зародышей происходит в гомогенной и гетерогенной средах. При этом рост кристаллов может быть обусловлен либо увеличением размеров соответствующих зародышей, либо срастанием отдельных кристалликов, т. е. увеличением объема новообразований. В гетерогенных системах механизм образования зародышей может быть самым разнообразным. Возникновение их в присутствии различных твердых частиц с развитой поверхностью происходит легче, так как необходимая для этого величина изменения свободной энергии в гетерогенных растворах ниже, чем в гомогенных.
По поводу возникновения зародышей в работе [83] высказывается предположение, что «сначала в результате столкновения двух молекул возникают мельчайшие структурные образования, которые объединяются с третьей молекулой, и т. д. Сначала могут образовываться короткие цепи или плоские мономолекулярные слои, и в конце концов строится структура решетки». Имеет ли зародыш сразу кристаллическую структуру или ему предшествуют молекулярные ассоциаты, зависит от конкретных условий протекания процесса. Полагают [128], что при значительных перемещениях чаще образуются кристаллические зародыши, а при малых вначале возникают молекулярные комплексы. В пользу такого предположения свидетельствует всевозрастающая вероятность одновременного столкновения большего количества частиц с ростом пересыщения раствора.
Большинство современных теорий фазовых превращений основано на представлениях, согласно которым изолированная система находится в устойчивом равновесии, если при любом сколь угодно малом изменении ее состояния (при постоянстве энергии системы) энтропия остается постоянной или уменьшается. Если же при указанном изменении состояния системы энтропия увеличивается, тогда ее устойчивость является относительной, а состояние местабильным. Примером этого может служить пересыщенный ионный раствор, концентрация которого остается неизменной в течение некоторого времени. Переход же от нестабильного состояния к стабильному происходит при самопроизвольном уменьшении свободной энергии и затрате определенной работы на образование новой фазы. Такое кажущееся несоответствие термодинамическим закономерностям и представлениям о возникновении зародышей объясняется тем, что при этом изменение свободной энергии системы обусловлено как появлением самой фазы, так и образованием поверхности раздела фаз. Как следует из работы [98], с увеличением пересыщения раствора критический размер частиц и свободная энергия в процессе фазового превращения уменьшаются, в связи с чем облегчаются условия образования зародышей: чем выше пересыщение, тем все меньшие и меньшие зародыши оказываются способными к дальнейшему росту.
Анализ теорий кинетики возникновения зародышей и образования из них кристаллов показывает, что в целом они приводят к одним и тем же выводам. В теории, основанной на представлениях об элементарных процессах [98, 128], предполагается, что молекулы, атомы и ионы имеют кубическую форму и взаимодействие их обусловливается связями ближнего порядка. Соединяясь последовательно, частицы образуют сначала ряд, затем слой, и, наконец, куб. Составленный из множества частиц, куб постепенно увеличивается до размеров, соответствующих кристаллическому зародышу, который, продолжая расти, образует кристалл.
По теории флуктуации кристалл образуется в результате столкновения групп элементарных частиц. При этом условие возникновения центров кристаллизации определяется выражением
S = (4.1)
Если обозначить работу, затраченную на образование зародыша, через AFmax, то скорость его возникновения можно определить зависимостью
AFmax
»ос = Ске КТ. (4.2)
Согласно зависимости (4.2), скорость образования зародышей возрастает с увеличением температуры и уменьшением поверхностной энергии на границе раздела фаз.
При значительных пересыщениях из-за возрастающей вязкости раствора, препятствующей зарождению новой фазы, скорость ее образования в ряде случаев снижается. Для учета этого явления вводится еще один экспоненциальный член Еа, зависящий от вязкости раствора, и уравнение скорости образования зародышей записывают в виде
Ооз=Ске «т . (4.3)
Образование зародышей и их дальнейший рост следует рассматривать как взаимно связанные этапы одного и того же процесса формирования новой фазы. Если в пересыщенном растворе появились устойчивые зародыши, они начинают расти с определенной скоростью. В зависимости от условий кристаллизации скорость роста кристаллов может характеризоваться изменением во времени их линейных размеров, поверхности, объема и массы.

 Опубликовано в
Опубликовано в