КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА ТВЕРДЫХ МЕТАЛЛОВ
 11 марта, 2016
11 марта, 2016  Oleg Maloletnikov
Oleg Maloletnikov 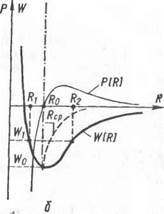 |
 |
Не касаясь пока природы межатомных сил связей, рассмотрим характер взаимодействия атомов в кристаллической решетке на упрощенной модели из двух атомов. Среднее расстояние
Рис. 1. Изменение силы взаимодействия атомов и величины потенциальной энергии В зависимости от межатомного расстояния в системе из двух атомов.
между атомами называется параметром кристаллической решетки. Величиной параметра и сил взаимодействия между атомами определяются многие физические свойства образовавшихся кристаллов. Если по оси абсцисс откладывать межатомные расстояния R, а по оси ординат — силы Р взаимодействия атомов и значения потенциальной энергии W, то можно получить зависимости, схематически изображенные на рис. 1, а, б.
При большом межатомном расстоянии атомы практически не взаимодействуют друг с другом, т. е. силы их взаимодействия близки к нулю. С уменьшением расстояния до некоторого значения RK силы притяжения P„p(R) возрастают быстрее сил отталкивания Рт (R). Последующее сокращение расстояния R связано с дальнейшим увеличением сил притяжения, но силы отталкивания также растут, и растут быстрее. В результате суммарная сила P(R) взаимодействия (притяжение) уменьшается и при некотором значении R — R0 становится равной нулю. Дальнейшее сближение атомов приведет к тому, что силы отталкивания будут значительно больше сил притяжения. Таким образом, система из двух атомов будет стремиться к устойчивому состоянию, при котором расстояние между ними равно R„. По мере сближения атомов потенциальная энергия системы W(R) снижается (рис. 1, б). Состояние равновесия между силами притяжения и отталкивания характеризуется минимальным значением потенциальной энергии системы. Поскольку всякая изолированная материальная система стремится к уменьшению потенциальной энергии, то положение атомов при межатомном расстоянии R0 наиболее устойчиво.
![]() До сих пор мы не учитывали тепловых колебаний атомов. В реальных же условиях полная энергия атомов Wt всегда больше, чем рассмотренная W„, так как в результате теплообмена происходит ее приращение соответственно температуре нагрева:
До сих пор мы не учитывали тепловых колебаний атомов. В реальных же условиях полная энергия атомов Wt всегда больше, чем рассмотренная W„, так как в результате теплообмена происходит ее приращение соответственно температуре нагрева:
W1 = W0 + &W.
Этому реальному уровню энергии Wx на кривой W (R) соответствуют два предельных значения межатомных расстояний Rt и R2. В пределах этих значений атомы совершают колебания с амплиту-
дой —- относительно среднего межатомного расстояния Rcр==
Ri + R>
— —=■» которое и принимается в качестве параметра кристаллической решетки.
С увеличением температуры (приростом энергии AW) растет амплитуда колебаний атомов, а также среднее межатомное расстояние RCp > R0 (рис. 1, б). Такая зависимость удовлетворительно объясняет целый ряд явлений, например увеличение объема твердых тел с повышением температуры.
Мы рассмотрели схему взаимодействия двух атомов в каком-то одном пространственном направлении. Естественно, что и по другим направлениям такое взаимодействие аналогично. Каждый атом приобретает себе «соседей» в таком количестве, в каком это'возможно.
Таким образом, возникает закономерное пространственное расположение атомов, определяющее структуру кристалла. Если на время отвлечься от практически неизбежных нарушений в этом, расположении, а также не принимать во внимание тепловые коле бания атомов, то условно изобразить кристаллическую структуру можно в виде пространственной решетки, состоящей из точек
Б1&ЛІОТЕКЛ
Черг '• "У
Київського ПОЛІ Г»йіі - ІН«Гв
Інституту
с одинаковым окружением. Каждая точка решетки изображает положение центра, вокруг которого атом совершает тепловые колебания. Пространственные, или кристаллические, решетки полезно рассматривать как эталоны для сравнения с ними реальных кристаллических структур. Установлено, что теоретически возможно существование 14-ти различных типов пространственных решеток. Рассмотрим некоторые из них.
Гексагональная плотноупакованная и кубическая гранецентрированная структуры. В процессе кристаллизации атомы обязательно занимают такое положение, при котором вся система имеет
|
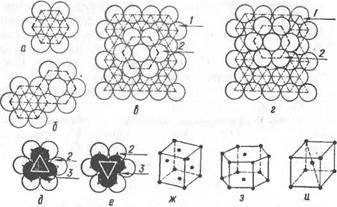
Рис. 2. Схема образования кубической гранецентрированной и гексагональной плотноупакованной кристаллической решеток; ячейка кубической объемноцентрированной решетки. |
минимальное значение свободной энергии. В простейшем представлении это соответствует максимально плотному расположению атомов по отношению друг к другу.
Форма атомов не сферическая, тем не менее для простоты рас - суждений и наглядности их часто изображают в виде шаров. Структуру металла в этом случае условно можно представить как совокупность одинаковых твердых шаров, находящихся в наиболее плотной упаковке.
Образование некоторых кристаллических структур, например гексагональной плотноупакованной и кубической гранецентрированной, можно объяснить на основе простейших рассуждений о возможных вариантах наиболее плотной упаковки твердых шаров.
Если на плоскости разместить 1-й слой шаров, то наибольшая плотность будет в том случае, когда вокруг одного из них, центрального, расположатся 6 шаров, касающихся друг друга (рис. 2, а). Центры шаров разместятся в вершинах правильного шестиугольника. Добавляя шары, этот шестиугольник можно повторять неограниченное число раз (рис. 2, б).
Шары 2-го слоя, наложенные поверх 1-го, попадут в углубления 1-го слоя. Здесь возможны два варианта:
1) шары лягут над центрами треугольников, соединяющих центры шаров 1-го слоя, с вершинами, направленными вниз (рис. 2, е);
2) шары расположатся над центрами треугольников с вершинами, направленными вверх (рис. 2, г).
Оба варианта, как видим, совершенно равноценны и отличаются лишь ориентацией на плоскости.
Примем расположение шаров 2-го слоя над центрами треугольников с вершинами, направленными вниз (рис. 2, е). При укладке 3-го слоя вновь возникают две возможности размещения шаров (рис. 2, д, е). Если 3-й слой расположен так же, как и 2-й, то конечная структура будет кубической гранецентрированной. Элементарная ячейка такой структуры показана на рис. 2, ж. Эту ячейку получим, приняв один из шаров 1-го слоя за угол куба. Если же шары 3-го слоя займут положение над треугольниками с вершинами вверх, то этот слой в точности повторит размещение шаров 1-го слоя и мы получим гексагональное плотноупакованное расположение шаров, которому соответствует элементарная ячейка, изображенная на рис. 2, з.
Многие металлы и их сплавы кристаллизуются по двум рассмотренным схемам: в гексагональной плотноупакованной — Zn, Mg, a-Ni, a-Ti и др., в гранецентрированной кубической — Си, Al, Pb, Ag, Аи, Pt, y-Fe, P-Ni и пр. В связи с различиями между гексагональной плотноупакованной и кубической гранецентрированной решетками существенно различаются и свойства металлов, кристаллизующихся в этих решетках.
Кубическая объемкоцентрированная структура. Приведенные рассуждения, казалось бы, дают основание утверждать, что при наличии металлической связи все вещества должны кристаллизоваться только двумя указанными способами, так как других вариантов плотной упаковки шаров не существует. Однако в природе имеется еще ряд решеток, в которых кристаллизуются металлы, что свидетельствует о большей сложности законов образования кристаллических структур.
Так, в реальных кристаллах часто встречается кубическая объемноцентрированная структура, которую невозможно получить на основе приведенных выше простейших рассуждений. В этой структуре кристаллизуются a-Fe, Mo, V, a-Cr, Na, К и многие другие металлы. Элементарная ячейка кубической объемноцентри - рованной решетки показана на рис. 2, и. Общим принципом, лежащим в основе образования реальных кристаллических решеток, является повышение устойчивости системы с уменьшением ее энергии.
Полиморфизм. Следует отметить, что в зависимости от энергетического состояния атомов, т. е. практически в зависимости от температуры и давления, некоторые вещества могут кристалл и- зеваться в различных структурах, причем при изменении температуры и давления возможна перестройка одной структуры в другую, более устойчивую для данных условий. Явление это называется полиморфизмом или аллотропией.
Процесс перехода вещества из одной модификации в другую можно пояснить так.
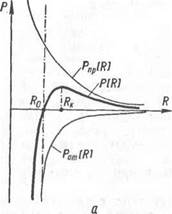
По мере повышения температуры вещества величина свободной энергии различных модификаций уменьшается с различной скоростью, и тем быстрее, чем выше удельная теплоемкость модификации. Поскольку при 0° К уровень свободной энергии модификаций различен, а убывание энергии происходит по разным законам, то
|
Рис. 3. Схема полиморфных превращений веществ в связи с изменением энергетического состояния в зависимости от температурь!. |
при некоторой температуре превращения Т,-р кривые изменения свободной энергии пересекутся (рис. 3, а). Устойчивой будет та модификация, которая в данных условиях имеет меньшую величину свободной энергии: в нашем случае — ^-модификация при низких и a-модификация при высоких температурах. Переход из Р* в а-мо - дификацию произойдет при определенной температуре — Тпр.
В ряде случаев процесс полиморфных превращений несколько усложнен. Так, железо, например, имеет две модификации: a-Fe и y-Fe. Кривые изменения свободной энергии а - и у-модификаций железа (рис. 3, б) пересекаются в двух точках в связи с возрастанием удельной теплоемкости a-Fe в интервале температур 910— 1400° С.
В области 0° К—910° С устойчива модификация a-Fe с кубической объемноцентрированной решеткой. При температуре — 910° С модификация a-Fe переходит в y-Fe с кубической гранецентрированной решеткой. Модификация y-Fe устойчива в интервале температур 910—1400° С, а при дальнейшем нагревании вновь
приобретает объемноцентрированную кубическую решетку, т. е. переходит в a-Fe[3].
Полиморфизм — явление довольно широко распространенное. Некоторые металлы имеют по три (Сг, Са, Li, Se) и даже по четыре модификации (Мп). Полиморфные превращения, как правило связанные с изменением параметров кристаллической решетки, удельного веса и многих других свойств металлов, играют важную роль в производстве и использовании последних


 Опубликовано в
Опубликовано в