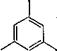
Алкилфенолы
 19 апреля, 2013
19 апреля, 2013  admin
admin Алкилфенолы образуются при разложении почти, всех органических соединений. Они обнаружены в продуктах переработки каменного и бурого углей, в фенольных сточных водах и продуктах крекинга нефти. Некоторые алкилфенолы (тимол, карвакрол) встречаются в природных эфирных маслах. В перечисленных веществах, которые являются основными источниками получения низших алкилфенолов, наряду с фенолом и крезолами присутствуют также ксиленолы, мезитол, этилбензолы и некоторые высшие алкилфенолы. В продуктах, получаемых при крекинге нефти, встречаются алщшфенолы (например, бутил фенолы), отсутствующие в фенольных фракциях переработки углей. Некоторые алкилфенолы можно получить также путем синтеза. В промышленности алкилфенолы применяются не в чистом виде, а в составе смесей. Среди изомерных моноалкилфенолов 0/?т0-замещенные характеризуются более высоким давлением паров, пара-замещенные — более высокой температурой плавления.
Алкилирование в присутствии кислого катализатора — это важнейший способ алкилирования с введением алкил-, цикло - алкил - и а рил алкильных остатков. Алкилирующими агентами могут быть спирты, алкил - и арилалкилгалогениды, ненасыщенные алкил - и арилалкильные соединения, В качестве катализаторов применяют серную кислоту, безводный АЮ3, трехфтористый бор, ГеС13, 2пС12, Н3Р04, хлорокись фосфора, смешанные катализаторы на основе А1203 и 8Ю2, активированные кислотой, и катионообменные смолы в Н-форме. Реакции проходят при температурах от 20 до 180 °С. В ходе реакций образуются смеси продуктов различной степени алкилирования, в которых преобладают пара - или орто - и /га/?а-замещенные соединения. Соотношение о - и п-алкилфенолов зависит от условий реакции. Так, при высоких температурах может образовываться до 70% о/?то-замещенных фенолов.
Реакции алкилирования нередко обратимы: диалкилфенолы, например, могут диспропорционировать с незамещенным фенолом, образуя моноалкильные соединения.
При алкилировании в присутствии фенолята алюминия [29] алкильные группы (в отличие от алкилирования в кислых средах) присоединяются в оба о/?то-положения по отношению к гидроксильным группам фенола; лишь изобутильные группы после того,, как они займут о/?то-положение, могут занять и пара - положение. Синтетические алкил - и арилфенолы, в которых заместители находятся в пара - и о/?то-положениях по отношению к гидроксильной групне, менее склонны к изменению цвета. Они применяются в производстве лаков, смол для слоистых пресс - материалов и для модификации эластомеров.
Олефины, особенно разветвленные — изобутилен, изоамилен, диизобутилен и другие, легко алкилируют фенол и его гомологи в присутствии Н2!304 или Н3Р04, А1С13 и активной глины.
Этот способ применяется для получения трет-бутилкрезолов при алкилировании изобутиленом.
Крезолы
Обычно применяют не индивидуальные изомеры крезолов, а их смеси. Исключение составляет о-крезол, служащий сырьем в производстве некоторых типов фенольных смол. Смеси, применяемые в промышленности, различаются содержанием ж-крезола. Крезолы представляют собой маслянистые жидкости бурого цвета с температурами кипения (в зависимости от изомерного состава) от 190 до 204 °С. Крезолы в ГДР классифицируют следующим образом:
Сырой крезол ДАВ4 (содержание ле-крезола не установлено) сырой крезол ДАВ4М (содержание ле-крезола не мёнее 30%) сырой крезол ДАВ4В (содержание ле-крезола пе менее 38%) сырой крезол ДАВ6 (содержание ле-крезола не менее 50%). Крезолы были обнаружены Вильямсоном и Фэйрли в 1854 г. в средней фракции масла каменноугольной смолы. Они были найдены также в других смолах и смолообразных. продуктах:
Древесном дегте, смоле бурого угля, смоле полукоксования, первичной смоле коксования углей, продуктах гидрогенизации углей^ сточных водах полукоксования, продуктах крекинга и т. д. Из каменноугольной смолы в 1860 г. Кольбе и Тиманн выделили п-крезол, в 1873 г. Саутворт выделил о-^резол, а Биндерманн и Пике — ж-крезол.
К резолы могут быть получены:
Из средней фракции масла продуктов коксования каменного угля, где их содержание колеблется от 0,3 до 1,1%;
Из надсмольной воды полукоксования бурого угля, в которой содержится от 8 до 15 г/л летучих крезолов; наиболее распространенным способом получения крезолов является обесфеноли - вание воды экстракцией органическими эфирами, практически нерастворимыми в воде; технико-экономические показатели способа недавно удалое^ улучшить благодаря использованию как обесфеноленной, так и необработанной надсмольной воды для извлечения крезолов из легкой фракции масла;
Из продуктов, получаемых при крекинге нефти;
Синтезом: из толуидинов через диазосоединения; из хлор - толуолов (нагреванием со щелочами, гидроокисями щелочноземельных металлов либо с водяным паром в присутствии катализаторов — активированной глины или трифосфата кдльция); из толуол - сульфокислот (щелочным плавлением).
В последнее время значительно увеличивается производство крезолов в Японии [32], где вводятся в действие новые мощности по технологии фирмы «Sum. im. oto». Сырьем служит толуол и пропилен. Если при традиционном способе производства выход ле-крезола составлял 50—52%, то по новой технологии он возрос до 61—62%.
Ксиленолы
Содержание ксиленолов в жидких продуктах коксования зависит от температуры переработки угля. В коксовой смоле содержится 0,7—0,8% ксиленолов, а в смоле полукоксования — до 5%. Наибольшее количество ксиленолов выделяется при гидрировании угля. Ксиленолы присутствуют в средней фракции масла, выделяемого в процессе перегонки смолообразных продуктов.
Смеси, состоящие из крезолов и ксиленолов, в процессе дистилляции могут разделяться на фракции сырых крезрлов и ксиленолов. Фракция сырых м - и тг-крезолов содержит 2,6-ксиленол. Сырой ксиленол разгоняется на 4 фракции с различными температурами кипения. Температуры кипения фракций: первой 207— 211 °С; второй 215—218 °С; третьей 217—221 °С и четвертой 223—225 °С. При охлаждении паров первой фракции выделяется 2,5-ксиленол. В маточном растворе остаются 2,5- и 2,4-ксиленолы^ которые могут быть разделены после сульфирования. Кроме того,
2,4- ксиленол образует с ле-крезолом соединение, кристаллизующееся при 0—10 °С, поэтому его можно выделить из смеси 2,5- и 2,4-ксиленолов указанным выше способом. Из второй фракции селективным обесфеноливанием разбавленным едким натром может быть выделен 2,3-ксиленол. При охлаждении третьей фракции выделяется 3,5-ксиленол, а четвертой — 3,4-ксиленол. Последний может быть также получен в виде труднорастворимой соли натрия.
Синтез ксиленолов до сих пор не нашел промышленного применения, хотя получаемых из каменноугольной смолы ксиленолов уже недостаточно.
Из ксиленольных фракций можно получить определенные ~ксиленолы методом изомеризации при термической обработке на катализаторах. Так, при изомеризации 2,4- и 3,4-ксиленолов при 230—370 °С на окисных алюмосиликатных катализаторах получают смесь, в которой содержится 3,5-ксиленол. Изомер
3,5- ксиленол может быть получен пиролизом 3,5,5-триметил-2-цик- логексена (полученного из изопрена) в присутствии Ре203 или глинозема [31]:
О ОН
Н. с4 1 ^СЙГ Г 1
НзС^^/^СНз НзСК^/^СНз
МНОГОАТОМНЫЕ ФЕНОЛЫ
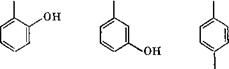
Двухатомные фенолы, например пирокатехин, его гомологи и резорцин, можно получить экстракционным способом. Пирокатехин и его гомологи служат сырьем в производстве дубильных веществ и полимеров, а также применяются в качестве антиоксидантов и пластификаторов в лакокрасочной промышленности. Промышленное получение пирокатехина основано на кристаллизации соответствующей фракции экстракта при нагревании с бензином и ароматическими углеводородами при 70 °С и последующем охлаждении при перемешивании в кристаллизаторе до 5—20 °С. Чем ниже температура смеси, тем лучше кристал - лизуётся Пирокатехин. После удаления растворителя центрифугированием получают технически чистый пирокатехин. Аналогичным образом получают резорцин, а также гомологи пирокатехина и резорцина. Для практических целей перечисленные продукты следует подвергать фракционной разгонке. Структурные формулы многоатомных фенолов приведены ниже.
|
Диоксибензолы ОН ОН ОН
ОН Пирокатехин резорцин гидрохинон |
|
|
||
|
|
||
|
|
||
|
|||
|
|||
|
|
||
![]()
Известны такжя способы получения пирокатехина из о-хлор - фенола щелочным правлением или из фенолдисульфокислоты сплашодшем с КаОН цри 300 °С. В результате реакции образуется пирокатехинмовосульфокис л ота, сульфогрупна которой отще - плявтсй шря нагреванйи с разбавленной серной кислотой.
Резорцин получают как продукт расщепления многих ароматически* «ульфоеовдинений при щелочном плавлении. Источниками получения резорцина являются дизамещенные продукты не только лета-изомеров, а также орто - и ялра-изомеров. Так, при сплавлении с едким натром всех трех изомеров бензолди - сульфокислот и трвх^йзомеров хлорфенолов образуется резорцин.
Гидрохинон был впервые получен перегонкой хицной кислоты. Синтетический гидрохинон можно получить восстановлением хи - нона. Его такте получают по реакции Реппе взаимодействием ацет*яен$ р окисью углерода под давлением и при повышенной темдор&турё в црийуцствии катализаторов:
|
|
|
|

 Опубликовано в
Опубликовано в