ТИПЫ ФЕНОЛЬНЫХ СМОЛ И ИХ СТРУКТУРА
 23 апреля, 2013
23 апреля, 2013  admin
admin Различают два основных типа фенольных смол — новолаки и резолы. Новолаки — растворимые и плавкие продукты, которые отверждаются только под действием отвердителя. Они получаются поликонденсацией при небольшом избытке фенола (фенол : формальдегид = 1 : «< 1) преимущественно в присутствии кислых катализаторов. Поликонденсация новолаков с образованием метиленовых групп приводит к получению линейных полимеров.
Новолаки можно получать и поликонденсацией в щелочной среде при температуре выше 135 °С и при значительном избытке фенола. Образовавшиеся вначале фенолоспирты взаимодействуют с избытком фенола с образованием метиленовых связей.
Резолы представляют собой растворимые реакционноспособные, отверждающиеся при нагревании продукты. Их получают поликонденсацией при соотношении фенола и формальдегида
1 :>1 в щелочной среде. Увеличение количества формальдегида ведет к повышению степени конденсации* Отверждение резолов начинается на стадии резитола — продукта частичной поликонденсации резола, который содержит оксиметильные, метиленовые и метиленэфирные группы, а заканчивается на стадии полностью нерастворимого, ненабухающего и не размягчающегося при нагревании продукта — резита. Резит отличается высокой твердостью, механической прочностью и химической стойкостью. Для получения резита необходимо, чтобы у трифункциональных фенолов на фенольное ядро приходилось по 1,5 диметилэфирных связи. У бифункциональных фенолов имеется лишь по одной связи на фенольное ядро. Поэтому использование только о - и га-крезолов исключает возможность образования сшитых полимеров, для получения которых необходим ж-крезол в смеси крезолов. “Следует отметить, что диметилэфирные связи более стойки к щелочам, чем к кислотам.
Классификация фенольных смол предложена Хултчем [17]. Ниже перечислены имеющиеся в фенольных смолах химические связи и концевые группы (по Хултчу):
I. Химические связи Углеродные:
Метиленовые —СН2— этиленовые — СН2—СН2— виниленовые — СЙ=СН—
Связи С—О:
|
О |
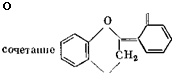 Диметиленэфирные —СН2—О—СН2—
Диметиленэфирные —СН2—О—СН2—
|
Сн2 |
![]() Циклическое (кетоно-эфирное)
Циклическое (кетоно-эфирное)
Связи С—N:(
Диметиленаминные — СН2—NH—СН2
СН2-
Триметиленаминные — СН2—]Ч—СН2— метиленазометиновые — СН2—N=011
II. Концевые группы Кислородсодержащие:
Фенольный гидроксил —ОН хинонокислородный атом = О алкоксильная группа — 0~И Алкильные:
Оксиметильные — СН2ОН
Ал к оксиметильные —СН2—О—И—
Формильные —СНО
Метильные — СН3
Метиленовые =СН2
|
Группы: ■V |
|
Хромановые |
|
I/ |
|
Циклические концевые |
|
О: |

|
А |
|
/' сна |
|
|
Образование новолаков в присутствии кислых катализаторов
Поликонденсация формальдегида с фенолом является реакцией второго порядка. В среде с pH = 1—4 скорость реакции пропорциональна концентрации ионов Н+; при pH = 4—5 скорость реакции минимальна; при pH более 5 скорость реакции пропорциональна концентрации ионов ОН”. Эти факторы свидетельствуют о том, что реакции при разных значениях pH протекают по разным механизмам. Присоединение иона гидроксиметилкар - бония (I) к молекуле фенола [реакция (2)] [18] происходит с наименьшей скоростью. Ниже приведены уравнения реакций, протекающих при образовании новолаков:
СНаО + НА СН2-0-Н + А - (1)
|
|||
|
|||
|
|
||
|
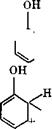
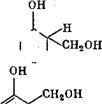
|
4- Ж .сн2-о< |
|
|
|
Быстро - Н+; - Н2о" 1^. |
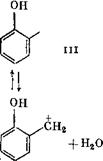
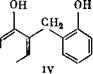
Последующая конденсация оксиметилфенола (II) идет по механизму протонирования, в результате чего возникает оксибензи - лированное производное (III), которое в дальнейшем реагирует с фенолом с образованием бис(оксифенол)метана (IV).
При конденсации о-оксиметилфенола с фенолом вследствие различий в скоростях реакций образуются о, о'- и 0,тг'-диоксиди - фенилметаны в соотношении 1 : 6,1. Присоединение тг-оксиметил - фенола в тгара-положение фенола проходит в 5,67 раза быстрее, чем в орто-положение. Так как число о-положений в фенольном кольце вдвое превышает число тг-положений, то относительные реакционные способности при присоединении о-оксиметилфенола составят п : о = 12 : 1, а для ^-оксиметилфенола п : о — 11,3 : 1.
Энергии активации [12] отдельных стадий реакций свидетельствуют о вероятности взаимодействия указанных выше соединений. Проведенное Влком [19] термохимическое исследование процесса поликонденсации фенола с формальдегидом при оптимальных мольных соотношениях показывает взаимосвязь между энергией активации и мольным соотношением исходных реагентов:
TOC o "1-5" h z Фенол : формальдегид.................................. 1 : 0,8 1 : 1,25 1 : 1,5 1:2
Энергия активации, ккал/моль
При конденсации в присутствии кислого катализатора 20 * 20,4 23,7 23,5
При конденсации в присутствии щелочного катализатора 16,9 17,5 18,5 18,2
Данные по энергиям активации реакций фенола с формальдегидом и оксиметилфенолами приведены в табл. 2.1.
|
Таблица 2Л. Энергии активации
|
Тепловой эффект реакции присоединения составляет 4,8 ккал/моль, реакции поликонденсации — 18,7 ккал/моль, суммарный — 23,5 ккал/моль.
В присутствии кислого катализатора метилольные группы быстро превращаются в метиленовые, поэтому в ново лаках обычно мало реакционноспособных химических связей или групп.
Молекулярные массы новолаков находятся в пределах 1200—1400, что соответствует 12—13 фенольным ядрам в макромолекуле. Теоретически новолаки могут плавиться без изменения размеров молекул.
Отверждают новолаки обычно уротропином (10—15% от массы новолака) при 150—200 °С. Скорость отверждения повышается при добавлении MgO или СаО. Новолаки на основе реакционноспособных многоатомных фенолов, таких как резорцин [48], отверждаются также резолами.
По теории Веглера отверждение новолаков представляет собой сшивание би - или полифункциональными алкилирующими агентами фенолов, связанных метиленовыми группами. При этом образуются соединения, которые содержат метиленовые группы, связанные с протонируемыми гетероатомами. Эти соединения могут переходить в ионы м£тиленкарбония. Оксибензиловые, аминобензиловые спирты, окси - и аминобензиламины, диоксиди- бензиловые эфиры и другие соединения после протонирования также могут являться алкилирующими агентами.
При выборе катализатора поликонденсации необходимо учитывать коррозионную стойкость материала реактора и возможность удаления остатков катализатора из конечного продукта. К легко удаляемым катализаторам относятся соляная и щавелевая кислоты и их смеси. Щавелевую кислоту удаляют либо промывкой, либо разложением — нагревают в вакууме при 180 °С с одновременной отгонкой избыточного фенола. При этом получают практически бесцветные новолаки [44]. При использовании смеси борной и серной кислот в качестве катализаторов получают несшитые новолаки с высокой вязкостью расплава [45].
Для получения смол, которые не должны содержать остатки катализатора, предпочтительно применять трихлоруксусную кислоту. Поликонденсация в этом случае проводится при 60—85 °С. При дальнейшем нагревании до 100—200 °С под давлением три - хлоруксусная кислота разлагается на СНС13 и С02 [46].
При получении новолака на основе фенолов с длинным алкильным заместителем можно применять в качестве катализатора п-толуолсульфокислоту [47].
Новолаки на основе резорцина можно получать и без катализаторов, а отверждать — без нагревания параформальдегидом; Эти новолаки, применяются в качестве водостойких клеев для склеивания на холоду.

 Опубликовано в
Опубликовано в