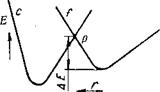СОЕДИНЕНИЕ МЕТАЛЛОВ В ТВЕРДО-ЖИДКОМ СОСТОЯНИИ
 16 февраля, 2014
16 февраля, 2014  admin
admin Соединение разнородных металлов может быть осуществлено, • когда оба металла находятся в твердом состоянии (диффузионная сварка, сварка взрывом, холодная сварка и др.), в жидком состоянии, т. е. когда оба они полностью или частично расплавляются (различные виды дуговой и газовой сварки и др.), а также в твердожидком состоянии. В последнем случае один из металлов в течение всего процесса остается в твердом состоянии, а другой расплавляется.
Возможность сварки (наплавки) разнородных металлов в твердо-жидком состоянии, а также свойства сварного соединения определяют их физико-химические свойства и тип металлохимической реакции между собой и в более сложных системах с другими легирующими элементами и примесями.
Определяющую роль в образовании соединения в твердожидком состоянии играет процесс смачивания. Однако на свойства соединения могут оказывать существенное влияние и другие сопутствующие процессы — растворение, взаимная диффузия, образование промежуточных интерметаллидных, эвтектических и других фаз.
При применении плазменных методов в зависимости от температуры плавления основного и наплавляемого металлов процесс наплавки может протекать как с расплавлением основного металла, так и без его расплавления. Если температура плавления наплавляемого металла близка к температуре плавления основного металла или выше ее, то расплавление основного металла произойдет обязательно. В этом случае соединение наплавляемого и основного металлов происходит в результате образования общей сварочной ванны и ее последующей кристаллизации. Такой процесс ■
соединения получается при наплавке однородных металлов, а также, например, при наплавке нержавеющих сталей на малоуглеродистые и др. Если температура плавления наплавляемого металла значительно ниже температуры плавления основного металла, то в этом случае наплавку можно выполнять таким образом, что основной металл в течение всего процесса остается в твердом состоянии (например, при наплавке меди и ее сплавов на сталь и т. п.). В этом случае, как и в предыдущем, прочная металлическая связь между атомами металла наплавки и основного металла обеспечивается в процессе смачивания, но без образования общей ванны.
Накопленный в настоящее время эксперимент и теоретический анализ, проведенный рядом советских исследователей [46, 83, 103 и др.] показывают, что сварку, наплавку и пайку следует отнести к классу топохимических реакций, для которых характерным является двухстадийность-процесса образования прочных связей между атомами соединяемых веществ. В течение первой стадии происходит образование физического контакта, т. е. осуществляется сближение соединяемых веществ на расстояния, требуемые для межатомного взаимодействия и подготовки поверхностей к взаимодействию. На этой стадии из элементарных процессов важную роль играют процессы электростатического взаимодействия поверхностных атомов. В течение второй стадии — стадии химического взаимодействия — заканчивается процесс образования прочного соединения. Решающую роль на этой стадии играют квантовые процессы электронного взаимодействия [83].
Далее могут протекать процессы релаксационного характера, часто приводящие к снижению достигнутой прочности вследствие рекристаллизации или образования прослоек из хрупких химических соединений или фаз за счет гетерогенной реактивной диффузии. Однако эти процессы могут приводить и к повышению прочности соединения, если вследствие диффузии благоприятно меняется химический состав шва и прилегающих к нему зон, как, например, при некоторых видах пайки.
В случае соединения чистых металлов или твердых растворов процессы электронного взаимодействия сводятся к коллективизации (обобщению) «валентных» электронов положительными ионами, вследствие чего между системой атомов, образующих кристаллическую решетку, возни-кает прочная «металлическая» связь. Особенностью этой связи является отсутствие насыщения, определяемого. валентностью соответствующих атомов.
Поверхности твердых тел в атмосферных условиях, как правило, инертны, так как валентности их атомов насыщены связью с атомами окружающей среды. Классическим примером насыщения является процесс окисления вещества в атмосфере. На окисленной поверхности твердого тела могут идти процессы типа физической адсорбции, обусловленные силами притяжения или силами
|
33 |
Ван-дер-Ваальса. Для осуществления хемосорбции (химической адсорбции) на реальной поверхности требуется затрата энергии на-активацию этой поверхности [46, 90].
Последний процесс можно проиллюстрировать схемой изменения потенциальной энергии при физической адсорбции и хемо - сорбции (рис. 16). Кривая / представляет изменение потенциальной энергии молекулы (атома) при физической адсорбции, кривая С — при хемосорбции. Из сопоставления этих кривых можно видеть, что теплота хемосорбции больше теплоты физической адсорбции и что при хемосорбции молекула приближается к поверхности на более близкое расстояние, чем при физической адсорбции. По мере
|
|
того, как молекула приближается к поверхности, она испытывает вначале влияние физических сил притяжения, которые действуют на больших расстояниях, чем силы химической связи, и, таким образом, изменение энергии молекулы соответствует кривой /. Возможность хемосорбции молекулы и дальней - Рис. 16. Характер изменения шего изменения ее энергии по кривой с потенциальной энергии атома определяется способностью молекулы при физическом адсорбции / г J
И хемосорбции С В зависи - ДОСТИЧЬ точки р, в которой возможен мости от расстояния г от ато - переход. Для этого молекула должна ма до поверхности твердого обладать энергией, большей чем АЕ. тела [46, 90] g приобретении молекулой или атомом
этой энергии и заключается акт активации. Физически этот акт можно интерпретировать как процесс разрыва насыщенных связей на поверхности адсорбирующего тела, который приводит к появлению неспаренных электронов (радикалов), способных участвовать в химическом взаимодействии [46].
Таким образом, протекание в контакте соединяемых материалов процессов электронного взаимодействия различных типов требует определенной величины энергии для активации состояния поверхностей. Эта энергия может сообщаться в виде теплоты (термическая активация), энергии упруго-пластической деформации (механическая активация), электронного, ионного и других видов облучения (радиационная активация).
При сварке плавлением и пайке сближение атомов осуществляется за счет смачивания и активации поверхности твердого материала за счет тепловой энергии. При сварке в твердом состоянии это достигается за счет совместной упруго-пластической деформации соединяемых материалов в контакте, часто в сочетании с дополнительным нагревом.
В каждом из этих случаев для образования соединения требуется определенное время, обусловленное процессами развития физического контакта и химического взаимодействия фаз.
Чем ниже температура процесса, тем легче разделить две основные стадии образования соединения друг от друга. При взаимодействии твердого материала с жидким процесс протекает при высокой гомологической температуре (по отношению к температуре плавления основного металла) и поэтому скорость его высокая. Обе стадии протекают друг за другом в процессе смачивания, и разделить их практически не удается.
Итак, при сварке плавлением, наплавке и пайке обе стадии процесса и следующая за ними диффузия протекают, как правило, настолько быстро, что в случае соединения разнородных материалов с ограниченной взаимной растворимостью практически трудно получить соединения без хрупких интерметаллических прослоек в контакте. Для разработки технологических процессов сварки необходимо иметь представление о допустимой (при сварке плавлением) длительности этих процессов, с тем чтобы правильно выбирать способ и параметры сварки и обеспечивать получение качественного соединения. В работах [46, 103 и др. ] была дана оценка длительности указанных процессов и сопоставлены результаты расчета с имеющимися в настоящее время опытными данными. Эти процессы рассмотрены как для сварки плавлением, так и для сварки в твердом состоянии.
Внутри кристалла каждый атом удерживается в своем положении силами связи, симметрично расположенными относительно окружающих его со всех сторон соседних атомов. На свободной поверхности кристалла или жидкости атом оказывается неуравновешенным вследствие отсутствия связи, с одной стороны (вакуум), или вследствие ослабления связи, обусловленной иными свойствами окружающей среды. Это обстоятельство вызывает повышение энергии поверхностного слоя кристалла. Если для перемещения внутри тела атому необходима энергия Е0, то для выхода атома в окружающую среду ему необходима энергия Еп, причем Еп^> Е0.
При быстром образовании физического контакта, что наблюдается при окунании твердого тела в расплав или при сварке за счет расплавления одного из соединяемых материалов, на границе фаз сначала будет наблюдаться пик межфазной энергии Ег, аналогичный Еп (рис. 17), так как переход атомной системы в новое состояние осуществляется не мгновенно, а за некоторый конечный промежуток времени. Поэтому следует ожидать запаздывания химического взаимодействия фаз, а также задержки диффузионных переходов атомов из одного состояния в другое, пока атом не приобретет энергии, необходимой для преодоления межфазного барьера, или пока не произойдет релаксация пика межфазной энергии. Без учета возможных поверхностных явлений период задержки или ретардации диффузии можно рассматривать как время жизни атома перед потенциальным барьером, т. е.
А-
xp = %QekT (10)
|
|
|
|
|
Рис. 17. Схема изменения потенциальной энергии системы атомов у поверхности кристалла (а) и на границе твердой и жидкой фаз в начальный период их контакта (б) |
|
Ег = |
|
(П) |
|
Определение межфазной энергии представляет большие трудности в нестационарном процессе, так как эта энергия в каждом конкретном случае зависит от особенностей самого процесса, физико-химической природы рассматриваемых фаз и поверхностных явлений. Для ориентировочных оценок периода ретардации можно, по-видимому, принять допущение, что величина межфазной энергии в случае взаимодействия двух конденсированных фаз изменяется (уменьшается) по экспоненциальному закону. При таком допущении период релаксации равен времени уменьшения возмущения (исходной величины поверхностного натяжения) до 1/е от первоначальной величины. Поэтому в первом приближении и для оценочных расчетов величину межфазной энергии можно определить как |
|
энергии активации диффузии в твердой и жидкой фазах. После подстановки (10) в (11) выражение для оценки периода ретардации диффузионных процессов примет вид |
|
где Ет и Еж — соответственно |
|
е[Е. т + Ёж, |
|
,ехр [■ |
|
(12) |
е (Ет + Еж) 2 kT
В качестве примера рассмотрим взаимодействие титана с алюминием при окунании твердого титана в расплавленный и перегретый до различных температур алюминий. Эта пара образует хрупкое соединение ТіА13 с содержанием в нем 37,3% титана. Оценим допустимую длительность контакта титана с жидким алюминием, при которой на межфазной границе не успеет еще образоваться это соединение. При расчете примем, что энергия активации диффузии в титане Ет — 1,7 эв, а титана в жидком алюминии Еж як 0,5 эв. При этих условиях период запаздывания диффузии по уравнению (11) при перегреве алюминия до 973° С составит 170 сек, до 1073° С — 9 сек, до 1123° К — 1 сек, до 1673° К — 0,75 • 10-4 сек.
На рис. 18 представлена зависимость периода задержки (ретар - дации) процесса образования фазы ТіА13 от температуры, полученная опытным путем [95]. Для сравнения на этом же рисунке
приведена зависимость, полученная в работе [83] расчетным путем по описанной выше методике. Из графика видно, что расчетные данные достаточно хорошо согласуются с опытными. Это позволяет, несмотря на принятые допущения, использовать при - 1200 веденную схему для ориентировочных оценок допустимой длительности контакта твердой и ^ ноо жидкой фаз, а также темпера - " туры процесса наплавки, сварки, а в ряде случаев и пайки.
|
Интв) |
омета |
лпиОы |
есть |
||
|
Интер |
Г V 1 |
г - г ■If |
чет |
||
|
900 |
|
50 W0 150 200 250 300 Длительнось контактироОания, сек |
|
Рис. 18. Длительность периода ретардации процесса образования фазы ТіА13 в контакте титана с жидким алюминием в зависимости от температуры [83]: |
|
I & I |
 Опубликовано в Плазменная наплавка металлов
Опубликовано в Плазменная наплавка металлов Комментарии закрыты.