СИНТЕЗ МЕТАНОЛА И УКСУСНОЙ КИСЛОТЫ
 28 апреля, 2013
28 апреля, 2013  admin
admin СИНТЕЗ МЕТАНОЛА
Синтетическим путем метанол получают: из СО и Н2 по реакции:
TOC o "1-3" h z СО+2Н2^СН3ОН (215
Из смеси С02 и Н2 по реакции:
С02+ЗН2->СН30Н + Н20 (216)
И путем окисления СН4 и других углеводородов по реакции
СН.,- 0=СН:!0Н. (217)
Ниже будут рассмотрены способы получения метанола по первым двум реакциям.
Синтез метанола из окиси углерода и из водорода
Реакция образования метилового спирта из СО и Н:
СО+2Н,-*СН:!ОН+24. 685 ккал (218
Протекает с выделением тепла и уменьшением объема; достаточно быстро она проходит лишь в присутствии соответствующих катализаторов.
Следовательно, с повышением температуры равновесие этой реакции будет передвигаться влево, т. е. в сторону разложения метанола на СО и Н2. Поэтому, чем ниже температура, при которой происходит процесс образования CHjOH из СО и Н2, тем больше должно получиться СН3ОН. Однако с понижением температуры в контактной массе скорость реакции, даже в присутствии активных катализаторов, сильно падает. Существует высший и низший температурный предел экономической рентабельности ведения процесса получения метанола. Ниже этого предела вести процесс невыгодно, так как в единицу времени получаются малые зыходы метанола. При температурах выше этого предела выход метанола уменьшается вследствие смещения реакции влево. Поэтому процесс следует вести при оптимальной температуре, характерной для данного катализатора.
При медных катализаторах синтез проводят при температуре 300°. а при цинкхромовых — при температуре от 370 до 400°.
Из уравнения (218) видно, что образование метанола идет со значительным уменьшением объема. Следовательно, по известному правилу, повышение давления должно способствовать увеличению содержания метанола в смеси. Повышение давления благоприятствует синтезу метанола, так как оно способствует подавлению побочных реакций:
С0-)-ЗН,^СН1 + Н,0 (219)
2CO-f2H2->CH4-f - СО,, (220)
2СО-+СО, ' С, (221)
Которые протекают с уменьшением объема в меньшей степени, чем реакция образования метанола. Поэтому, чем выше давление, при котором протекает процесс, тем выше выход метанола и тем меньше спирт-сырец содержит в себе воды, а неконденсирующиеся газы — углекислоты н метана.
Наивыгоднейшее давление, при котором теперь ведут процесс получения метанола из СО и Н2, равно 180 атм.
Исходные сырые материалы
Газ. Для производства синтетического метанола сырым материалом служит газ — смесь СО и Н2, причем, как это видно из уравнения (218), на один объем СО требуется два объема Н2.
Окись углерода и водород можно получить из водяного газа и газа, получаемого при коксовании каменного угля и при газификации кокса или древесного угля. Газ для синтеза должен быть очищен от инертных газов (С02 и N2), которые, будучи примешаны к реакционным газам, понизят парциальное давление СО и Н2 и тем самым уменьшат скорость реакции синтеза метанола.
Коксовый газ. В сост ав коксового газа входит сравнительно большое количество С02 и углеводородов.
Для удаления из коксового газа С02 его промывают водой со щелочью и под давлением. Для превращения СН4 и С в окись углерода и водород коксовый газ подвергают конверсии, тля чего его пропускают через раскаленный кокс в газогенераторах, работающих периодически. Сначала вдувают воздух и дри этом получают воздушный газ, используемый в качестве горючего, и затем, когда температура в основной зоне газификации поднимается до 1000° и выше, доступ воздуха прекращают и подводят газ. Так как процесс термического разложения СН4 и
Сп Hm —процесс эндотермический, то после подвода газа температура в генераторе постепенно начинает падать.
После того как температура в генераторе упадет до 1000°, подвод газов в генератор прекращают и снова вдувают воздух и т. д.
Водяной газ. Водяной газ получается действием перегретых паров воды на раскаленный углерод, в результате чего получается газ следующего состава (в % по объему):
Н......... ... 48,5
СО.................... . 43,6
СО„ ... . . . ,',.4
СН*....................................................... 0,5
N........................................................... 4,0
Всего...................................... Ш0,0
В состав сырого водяного газа, кроме указанных составляющих, входит некоторое количество сероводорода, являющегося «ядом» для катализатора и сильно корродирующим веществом.
Углекислота при восстановлении водородом дает воду и СН4 по реакциям:
СО-.+ iH,->CH4-f-2H20 (222)
CO,-r3H,-*CH:,OH-f Н,0. (223)
В результате этих реакций, во-первых, спирт-сырец обогащается водой и, во-вторых, часть углекислоты непроизводительно переводится в метан, являющийся при синтезе метанола балластом. Поэтому перед проведением синтеза водяной газ должен быть предварительно очищен от содержащихся в нем сероводорода и углекислоты.
Следует отметить, что промышленное значение для синтеза метанола как по качеству газа, так и по легкости его получения, имеет главным образом водяной газ.
Из данных состава водяного газа следует, что объемное соотношение Н2 в газе в два раза меньше объемного соотношения, требуемого по реакции синтеза метанола.
Недостающее количество водорода должно быть введено извне. Для этой цели можно использовать отбросный водород с электролитического завода и водород, получающийся конверсией водяного газа с водяными парами.
Способ комбинирования синтеза метанола с синтезом аммиака и с электролизол! поваренной соли является наиболее экономически выгодным по сравнению со способом получения метанола из водяного генераторного газа, так как для получения последнего требуется установка специальной генераторной станции.
Катализаторы. Промышленное значение для синтеза метанола из громадного числа известных - катализаторов имеют лишь медные
и цинкхромовые катализаторы. Обе эти группы катализаторов по своему действию очень отличаются одна от другой. Медные катализаторы активнее цинкхромовых. Синтез метанола с медными катализаторами проводится при давлении 150 атм и температуре 2003, а при цинкхромовых катализаторах — при давлении 200— 300 атм и выше и при температуре 360—400°.
Выход метанола на 1 л медного катализатора составляет 1,8 л/час, а на 1 л цинкхромового катализатора — от 1 до 1,5 л/час метанола.
Однако медные катализаторы очень чувствительны к антикатализаторам, работают в очень узком температурном пределе, не переносят температурных перегревов и трудно регенерируются.
Цинкхромовые катализаторы, наоборот, не боятся сернистых соединений, очень стойки и легко регенерируются.
Качество метанола
Синтетический метанол-сырец состоит главным образом из метанола и воды с небольшой примесью других органических веществ в количестве, не превышающем 0,2—0,4%. Состав метанола-сырца в % по весу:
|
'.):>.0 0,02 0,014 0.10 0,09 0,034 0,015 |
|
С:.;;ОН .... СНзСООИ , . . Сн3соо. н3 . . Сн3сно .... СН, = снсн. он сн, сосн3. Fe (СО)- .... |
|
|
Следы
Удельный вес метапола-сырца при 15° равен от 0,805 до 0,811.
В случае применения метанола для производства формалина его следует подвергнуть химической очистке и ректификации, чтобы удалить содержащиеся в нем примеси и главным образом Fe(CO)5 и сн3сосн3, которые являются вредными, особенно для медных катализаторов.
|
0,Ь 2,6 5,6 0,55 |
На 1000 м3 водяного газа при 0" и 760 мм рт. ст. требуется:
Ко::сл вт.............................
Электроэнергии в квтч
Воды в м3............................
Пара водяного в т. .
|
|
На 1 т метанола требуется сырые ге;;:1,тт Водяного I (СО (.•."•„ 1:_) м - . .
Водорода в м= ............................................................
Электроэнергии в квтч....................................
Воды в II3..................................................................
|
2 Ло 610 2259 230 5,83 |
Пара водяного вт.......................................................
Схема технологического процесса
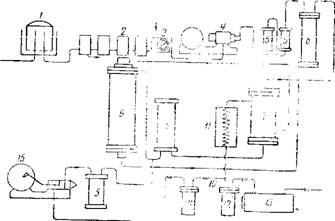
Схема технологического процесса показана на рис. 133. Водяной газ из газгольдера 1 проходит через ряд очистителей 2 полочного типа, соединенных между собой так, чтобы можно было переключить их на любую последовательность или выключать отдельные аппараты для выгрузки и загрузки очистительной массы. Очистители наполняют болотной рудой и известью.
|
Рис. 133. Схема технологического процесса синтеза метанола: 7—газогольдер ддя водяного газа; 2—газоочистители; 3—счетчик; 4—Компрессор; маслоотделители; 6—ресивер; 7—теплообменник; в—форконтакт; 9—Колонна синтеза; 10—Трубопровод холодного газа; 11—конденсатор; 12— приемник метанола высокого давления; 13—сборник метанола; /^--сепаратор; 15—Компрессор |
Очищенный газ, смешанный с водородом в требуемом соотношении, пройдя счетчик 3, сжимается до 300 атм компрессором 4 С водяным охлаждением (перед счетчиком 3 вводится добавочный водород). Для очистки от капелек масла газы пропускают через фильтры и маслоотделители 5. Далее газы поступают в ресивер 6, предназначенный для компенсации колебаний давления, а затем в теплообменник 7, где они нагреваются до 210—225'-; при: этой температуре газы поступают в форконтакт 8, наполненный отработанной контактно!'; массой и предназначенный для задержания контактных ядов, присутствующих в газе. Далее газовая смесь проходит колонну синтеза 9, в которой поддерживается температура 350—300°.
После прохождения через катализатор в колонне синтеза 9 газовая смесь с парами метанола поступает в теплообменник 7, затем в конденсатор 11, из которого конденсат стекает сначала в приемник 12 высокого давления, а затем — в сборник метанола 13.
Газ, по трубопроводу 10 поступает в сепаратор 14, откуда компрессором 15 через маслоотделитель 5 снова подается в колонну синтеза 9, минуя форконтакт.
Синтез метанола из смеси углекислоты и водорода
Из смеси углекислоты и водорода по реакции:
С02+ЗН,^СН;10Н--Н,0 (22)4
С применением катализатора (смесь 75—97% ZnO или, MgO И 25—3% Fe203) получается синтетический 65%-ный метанот (по весу) при давлении 360 атм и температуре 300—325э. Метанол - сырец, полученный по реакции (224), содержит мало органических примесей и при ректификации легко дает чистый метанол.
Поданным Долгова и Карпинского, выход на 1 л/час катализатора равен 215 г СН3ОН в 65%-ном водном растворе (98,4% от теоретического выхода).
После однократной ректификации получается 98—98,5%-ный Метанол.
СИНТЕЗ УКСУСНОЙ кислоты
Синтетическим путем уксусную кислоту можно получить: из карбида кальция (через ацетилен и ацетальдегид по реакции Ку - черова); из этилового спирта; из метанола и окиси углерода; и из ацетона через кеген.
Синтез уксусной кислоты из карбида кальция
Наиболее распространен способ получения уксусной кислоты из карбида кальция, состоящий из следующих стадий:
1. Получение карбида кальция из извести1 и кокса:
2СаО--ЗС2=2СаС,-г2СО-2Ю, 7 ккал. (225)
2. Получение ацетилена из карбида кальция и воды:
CaC2-j-2H20=Ca (OHV —C_H2-f 26, 5 ккал (226)
3. Получение ацетальдегида контактным способом из ацетилена и воды в присутствии сернокислой окиси ртути (HgSO.;),
Причем здесь имеет место следующая реакция:
/Н
СНСН+Н,0=СН.,-С; -1-HgvS К лЗс (227)
■ XN0
4. Окисление ацетальдегида кислородом в уксусную кис юту:
CHs-Cf +0=СКСООН. (228)
ЧН
Получение карбида кальция
Для получения карбида кальция служат специальные электропечи, в которых, при пропускании электрического тока через смесь извести и кокса, при температуре 1500—1600° получается карбид кальция в расплавленном состоянии. После затвердевания карбида кальция в изложницах его дробят, сортируют и герметически упаковывают в железные барабаны.
На 1 т 80%-ного карбида кальция расходуется 900—960 кг негашеной извести, 580—620 кг антрацита или 600—650 кг кокса, 20—40 кг набивных электродов и 2800—3500 квтч электроэнергии.
Получение ацетилена
В специальном аппарате карбид кальция непрерывно, малыми порциями, вводят в воду; происходит реакция:
СаС,+2Н2О^Са(ОН)2 + С2Н,+26:5 кал (229)
CaS+2H20 = Ca(0H)2+H, S (сероводород) (230) Са3Р2-+-6Н20=ЗСа (ОН)2+2РН3 (фосфин). (231)
Чистый ацетилен — бесцветный газ, с ароматным запахом, не ядовитый. Технический ацетилен, вследствие примесей фосфористого водорода и других веществ, имеет неприятный запах и ядовит.
Сероводород и фосфин являются «ядом» для катализатора. Удаление их производится в скрубберах с гератолом (пемзой, пропитанной раствором двухромовокислого натрия и серной кислоты) ; при этом имеют место следующие реакции:
4Na2Cr20T+16H2S0,+3H, S==4Na, S0,4-4Cr2 (SO,)3-r
+ 16H.,0-f3H, S04 (232)
Na2Cr20;-b4H2S04+PH3=Na2S0.t + Cr2(S04)s-f
+4H,0 + H3P03. (233)
Так как серная и фосфористая кислоты не летучи, то ацетилен получается чистым.
Теоретически из одной тоншы карбида кальция при действии воды получается ацетилена 0,405 т или 348 м3 (при 0° С и 760 мм рт. ст.).
Вследствие наличия в техническом карбиде кальция примесей1 выход ацетилена из 1 т карбида практически составляет 260— 310 м3.
Получение ацетальдегида и)з Ацетилена
И воды
При пропускании ацетилена в особом аппарате (гидрататоре) в воду, подкисленную серной кислотой и содержащую катализатор— сернокислую окись ртути (HgS04), при температуре не выше 80°, происходит реакция:
ЛО
CH=CH + H,0->CH. Cf +33,8 ккал. (234)
Н
Ацетальдегид (СН3СНО с температурой кипения равной 20,8°), полученный в виде паров, избыток ацетилена (его берется втрое больше, чем теоретически необходимо) и водяной пар уходят в конденсаторы. Постепенно в гидратоторе накапливается шлам (полимеры ацетальдегида и металлическая ртуть, полученная при побочных реакциях). Его окисляют азотной кислотой. Затем окись ртути (HgO) осаждают едким натром. С серной кислотой она дает катализатор — сернокислую окись ртути (HgS04); шлам лучше окислять в анодном пространстве электролизатора. Выход ацетальдегида равен от 75 до 85% теоретического.
Пары ацетальдегида и воды и газ-ацетилен проходят через конденсатор с холодной водой, затем через конденсатор с раствором хлористого натрия, охлажденным в особой установке до —15°; конденсат — ацетальдегид и вода стекают в сборник, ацетилен возвращают в гидрататор.
Сырой ацетальдегид ректифицируют и получают 98—99% ацетальдегида и от 2 до 1 % воды (по весу).
Окисление ацетальдегида в уксусную кислоту
Окисление ацетальдегида в уксусную ^кислоту идет по уравнению:
2CH3-Cf +0,-»2СНзС00Н. (235)
Н
В действительности процесс окисления ацетальдегида проходит сложнее, чем по уравнению. Он состоит из двух стадий. В первой стадии молекулярный кислород присоединяется к ацетальде - гиду, давая надуксусную кислоту:
СН:|СН0-Ь02->СН3С000Н. (236)
Во второй стадии молекула надуксусной кислоты соединяется ; молекулой уксусного ацетальдегида, давая две молекулы уксусной кислоты:
СН, СОООН+СНяСОН->2СН3СООН. (237)
39 В. H. Козлов, А. А. Нимвицкий
Разложение надуксусной .кислоты протекает весьма бурно вследствие выделения большого количества тепла. Чтобы избежать накопления в системе больших количеств надуксусной кислоты и, следовательно, предотвратить возможность взрыва, необходимо, чтобы превращение надуксусной кислоты в уксусную кислоту происходило все время тотчас по образовании надуксусной кислоты. Для этого прибавляют катализатор — уксуснокислую соль марганца с небольшой примесью уксуснокислой соли кобальта.
Окисление ацетальдегида можно производить как воздухом, так и чистым кислородом.
При окислении воздухом процесс протекает более гладко, с меньшим накоплением надуксусной кислоты и с меньшими производственными расходами по сравнению с окислением чистым кислородом. Чтобы избежать потери альдегида с отработавшими газами (азотом), в этом случае приходится предусматривать для промывки газов специальную скрубберную установку.
Уксусная кислота-сырец содержит значительное количество неокисленного альдегида и уксуснокислые соли Мп и Со и поэтому ее подвергают ректификации. Полученные головные погоны уксусной кислоты и альдегида возвращают обратно на окисление.
После первой ректификации получается продукт — уксусная кислота-сырец с содержанием уксусной кислоты 93% и с некоторым содержанием ацетальдегида. Для получения ледяной уксусной кислоты, лишенной уксусного альдегида, уксусную кислоту - сырец вторично ректифицируют с очисткой перманганатом калия.
Выход уксусной кислоты из ацетальдегида составляет около 90% от теоретического.
Для получения 1 т синтетической уксусной кислоты необходи
Мы (в т):
TOC o "1-3" h z Карбид кальция................................................................. 2,58
Серная Кислота (моногидрат) . . .... 0,29
Ртуть............................................................................ 0,000152
Кобальт уксуснокислый. ............................................ 0,0003
Перманганат калия......................................................... 0,003
Двухромовокислый натрий............................................ 0,0115
Инфузорная земля.................................................... 0,023
Каустическая сода................................................. ... 0,0008
Каменный уголь.............................................................. 0,03
Пар водяной...................................................................... 6,55
и, кроме того, 170 м3 воды и 345 квтч электроэнергии.
Синтез уксусной кислоты из этилового спирта
Для синтеза можно применять этиловый спирт, получаемый гидролизом растительного сырья и синтетически — из этилена, содержащегося в газах крекинга нефти, в газах полукоксования каменного угля или в природном газе.
Получение уксусной кислоты из этилового спирта состоит из двух стадий: 1) получения уксусного альдегида; 2) окисления уксусного альдегида в уксусную кислоту.
Получение уксусного альдегида возможно двумя методами: окислением и дегидрированием.
Получение ацетальдегида методом окисления
Этот метод сходен с методом получения формальдегида и состоит в следующем. Пары этилового спирта в смеси с кислородом или воздухом пропускают через контактный аппарат из медной или серебряной сетки при температуре 400—500°. При пуске аппарата в действие его предварительно подогревают до 500° в токе смеси паров этилового спирта и воздуха. С момента начала реакции нагревание прекращают, так как процесс окисления этилового спирта в альдегид протекет экзотермически и количество выделяемого при этом тепла является вполне достаточным для дальнейшего поддержания процесса.
Для полноты осуществления процесса необходимо вводить в контактный аппарат избыток кислорода против теоретически необходимого. При нормальном процессе в ацетальдегид окисляется около 50%' этилового спирта.
|
(238) |
Некоторая часть спирта теряется, образуя продукты сгорания — С02, СО и Н20, а также продукты дегидрирования:
СН3СНО^СН4+СО.
Выход ацетальдегида от разложившегося спирта возможно получить в пределах 85—90%.
Полученный после охлаждения парогазовой смеси конденсат, содержащий ацетальдегид и непрореагировавший спирт, подвергают ректификации. Ацетальдегид поступает на окисление по описанному выше методу, спирт возвращают в производство.
Получение ацетальдегида методом дет ид рирования
|
(239) |
При пропускании паров этилового спирта над катализатором (мелко раздробленными медью, никелем, кобальтом и др.) при температуре 250—320° имеет место реакция:
С, Н5ОН=СН3СНО+Н2.
Она протекает с поглощением тепла и поэтому требуется непрерывный подогрев контактного аппарата.
Процесс дегидрирования всегда сопровождается побочными реакциями образования С02, СО, СН4 и С2Н4, вследствие чего удельный выход ацетальдегида понижается.
Выход ацетальдегида сотавляет около 90% от разложившегося спирта при количестве прореагировавшего спирта около 40%.
Синтез уксусной кислоты из метанола и окиси углерода
В связи с разрешением проблемы получения метанола из окиси углерода и водорода возникла возможность использовать метанол для новых технических синтезов.
Одним из важнейших путей использования метанола является синтез уксусной кислоты по схеме:
СН3ОН+СО=СН3СООН-Ь35 ккал. (240)
Так как данная реакция сопровождается выделением тепла, то, по известному правилу, с повышением температуры равновесие будет передвигаться в сторону увеличения в газовой смеси СО и СН3ОН, и числовое значение константы равновесия при повышении температуры должно уменьшаться.
Так как образование СН3СООН идет с уменьшением объема, то повышение давления способствует большему выходу кислоты. Наилучшие результаты в смысле выхода уксусной кислоты наблюдаются при температуре 300—350° и давлении 50 атм в присутствии кислых катализаторов (фосфорной кислоты).
Синтез уксусной кислоты из ацетона через кетен
При пиролизе ацетона получаются кетен и метан:
СН3С0СН3-СН2=С=0+СН. (241)
Затем к кетену присоединяется вода с образованием уксусной кислоты:
СН2=С=0+Н20=СН3С00Н. (242)
Пиролиз ацетона производится в медных реакторах при температуре 675—725°; продолжительность контактирования 0,4— 0,6 сек. Выход кетена 80—85%' от количества ацетона, причем более 80% ацетона проходит через реактор без изменения и возвращается в процесс.

 Опубликовано в
Опубликовано в