Вспенивание белковых растворов
 3 декабря, 2012
3 декабря, 2012  admin
admin В ряде отраслей промышленности (производство лекарственных препаратов, дрожжей, сахара) для получения нелевых продуктов используют растворы, содержащие белки, аминокислоты, углеводы, жиры, витамины, неорганические соли и другие соединения, которые обусловливают поверхностно-активные свойства раствора, проявляющиеся в интенсивном вспенивании Так, одной пз причин обильного пенообразования сахарною сиропа является наличие в пем сапонина, гуминовой кнелош, бе - танна п продуктов распада белков — аминов, амидов и аминокислот. Стабильность пепы продуктов бродильного пропзвоаства определяется присутствием альбумина, желатина, солодового экстракта, таннина и др.
Белки, являясь поверхиостно-актнвными веществами, обладают некоторыми особыми свойствами, отличающими их oi синтетических ПАВ н мыл. Такое отличие состоит, например, в необ - братпмостн сжатия монослоев белка: они нерастворимы при сильном сжатии и способны растворяться в воде при обычных условиях. Одно из проявлений специфики свойств расiворов белковых веществ — крайне медленное установление равновесного значения поверхностного натяжения [368]. В ранних работах [47] медленное формирование равновесного адсорбционного слоя объясняли диффузией глобулярных молекул к межфаз - пой поверхности и развертыванием на ней полипептидпой цепн. Согласно современным представлениям [364] диффузия молекул к поверхности не является определяющим фактором длительности процесса. Молекулы белка в адсорбционном слое способны развертываться отдельными участками, причем степень развертывания зависит от вида белковой молекулы, концентрации белка, рН среды и других факторов. Наиболее вероятно, что длинная цепь белковой молекулы находится в некотором промежуточном состоянии, пе являясь пп полностью развернутой, нп полностью свернутой [135]. Б результате развертывания отдельных звеньев макромолекул на границе раздела фаз большинство гидрофобных групп ориентировано к воздуху. Поскольку при адсорбции возможно образование нескольких слоев (при высокой концентрации белка), адсорбционные пленки могут удерживать и неразвернутые нативные молекулы [58].
На межфазную поверхность легче выходят более поверхностно-активные участки, причем некоторые исследователи предполагают, что часть полимерной цепи белка погружена в водную фазу в виде складок и «петель» [135, 369]. По-видимому, если эта модель и реализуется, то лишь в разбавленных растворах.
На поверхности раздела полппентидиая цепь белковой молекулы может располагаться горизонтально, а боковые цепи, являющиеся остатками сложных аминокислот и обусловливающие поверхностную активность белковых молекул, ориентируются по общеизвестному принципу. Вследствие этого поверхностный слой состоит только из ориентированных боковых цепей — остатков аминокислот, которые могут вести себя совершенно автономно. Исследования, проведенные с растворами поливинилового спирта и его производных с различной длиной цепи, позволили выдвинуть предположение [370], развивающее и уточняющее механизм образования адсорбционного слоя высокомолекулярными соединениями. Автор полагает, что при выходе на поверхность раздела макромолекула закрепляется случайными участками, обладающими в том числе н незначительной поверхностной активностью. В процессе теплового движения па поверхности эIи случайные участки заметаются па иные, с большей поверхностной активностью.
О справедливости этого предположения свидетельствуют также исследования структурно-механических свойств сапонинов, которые показывают, что в адсорбционные слои переходят преимущественно более активные компоненты.
Высказанные замечания объясняют известный из практики факт более высокой устойчивости пен белковых растворов, чем пеп па основе мыл и синтетических ПАВ.
Изучение механических свойств поверхностных слоев в растворах сапонинов различных сортов показало [132], что время достижения равновесного поверхностного натяжения (Too при малых концентрациях может существенно различаться при практически одинаковом значении а^. Поскольку стабильность пен выше у сапонинов с меньшим временем достижения равло - весного поверхностного натяжения, авторы предположили возможность образования в этих растворах мицелл, которые могут
солюбплпзп ропать более поверхпосию-актшшыс компоненты, адсорбирующиеся более интенсивно.
Вспенивание белковых растворов частично обусловлено также ирису 1СПП1СМ свободных аминокислот, образующихся н ре.«улыаю гидролиза бел кон. Так, и продукте гидролиза желлтн ны было найдено до Ы)и/о различных амниокнело! oi м. кчы не ходного вещества, а в продукте гидролиза казенна —54%- Известно, что поперхностпо-актпнпые свойства аминокислот зависят от длины п разпетвлеппости углеводородной цени. Низшие аминокислоты (глпкокол, аланнн, серии и др.) ведут себя подобно неорганическим солям, вызывая увеличение поверхностного натяжения воды. С увеличением молекулярной массы аминокислоты отрицательная адсорбция переходит в положительную и, например, а-аминомасляная кислота и последующие гомологи уже понижают поверхностное натяжение воды. Таким образом, количественное соотношение отдельных аминокислот в растворе может оказывай» определенное влияние па его поверхностное натяжение.
Это соотношение может существенно меняться в зависимости от степени расщепления молекул белков. По-видимому, при высокой степени гидролиза белка образуется большое число молекул низкомолекулярных веществ, включая и аминокислоты. Последние могут далее разрушаться в ходе тепловой обработки Продукты распада белковых молекул заметно снижают пепооб - разующие свойства белковых растворов [371], вследствие чего вспениваемость гидролизовапных растворов должна быть хуже, чем негндролизованных.
Однако в некоторых работах указывается па возрастание вспениваемости белковых растворов после тепловой обработки, а также па рост стабильности пепы с увеличением продолжительности нагревания белковой среды [372]. Подобные противоречии можно объяснить различиями в состаис белкового сырья и приготовленных сред, в глубине расщепления белка и другими факторами. Нельзя исключить также влияния методических подходов к оценке пенообразования.
Из других причин, обусловливающих пенообразующую способность белковых растворов, следует отметить вязкость жидкости. Повышение вязкости _
TOC o "1-3" h z , а, см
Раствора, из которого форми - 7 |_______________ ________ -—
|
|
Руюгея пленки цены при азра - / ции, вызывает увеличение ее ЬОО - / стабильности. / /
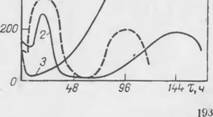
Рис. 94. Зависимость пенообразующей способности культуральных жидкостей от продолжительности ферментации:
1 — стрептомицин; 2 — олеандомнцнн; 3 — окситетрациклни [378].
Неравномерность вспенивания культуральных жидкостей в ходе ферментации (рис. 94) может быть обусловлена выделением в среду продуктов метаболизма, активно влияющих на стабильность пены при взаимодействии друг с другом, а также с пенообразователями исходной среди |373]. Такую же роль, по-видимому, играют продукты распада жиров — пеногаснтслей, вводимых в ферментационные среды. Это проявляется в том, что интенсивность образования пены и се стабильность в аэрируемых средах в присутствии микробных тел увеличиваются.
Определенную роль в стабилизации пены белковых растворов играет рН среды: объем и стабильность пены достигают максимального значения в области рН, соответствующей изо- электрическому состоянию для данного белка [47]. В этих условиях образуются наиболее устойчивые пленки, адсорбционные слои которых обнаруживают реологические характеристики твердообразных систем [374]. В белковых растворах сложного состава обнаруживаются максимальная и минимальная пенообразующая способность в зависимости от рН [372]. Поггому изменением значения рН можно влиять на интенсивность пенообразования рабочего раствора, что используется для предупреждения интенсивного вспенивания мелассы (нейтрализация кислот известковым молоком). Установлено, что объем и стабильность пены, например, пива, сильно увеличивается прн введении незначительных количеств ионов многовалентных металлов.

 Опубликовано в
Опубликовано в