СВОЙСТВА МЫЛА
 10 апреля, 2013
10 апреля, 2013  admin
admin Строение мыла. Развернутая формула строения натриевых и калиевых мыл показывает, что они состоят из двух неравных частей. Левая — их длинная часть — состоит из углеводородных групп, вокруг которых нет электрического поля; правая же—-короткая часть (—COONa или —COOK), содержащая карбоксильную группу, создает вокруг себя электрическое поле. Ниже приведена развернутая структурная формула строения натриевого, мыла стеариновой кислоты:
М I I I I I I I I I I I I I I I X°Ns ннн НН нннннннннннн
Аналогичное строение имеют мыла других жирных кислот.
Левая часть молекулы мыла называется неполярной (не несет электрического заряда), правая — полярной (несет электрический заряд). Каждая из этих частей характеризуется своими свойствами.
Полярные вещества хорошо растворяются в воде и различных водных растворах; неполярные вещества в воде нерастворимы, но хорошо растворяются в жирах, маслах и других неполярных веществах, в том числе и в воздухе. Особенности строения мыла обусловливают его многие свойства, в том числе моющее действие.
Растворимость мыла. Мыла щелочных металлов хорошо растворяются в воде: калиевые мыла растворяются быстрее, чем натриевые. Мыла низкомолекулярных жирных кислот растворяются легче высокомолекулярных; в присутствии мыл из низкомолекулярных кислот улучшается растворимость высокомолекулярных. При одинаковом числе углеродных атомов в молекуле мыла ненасыщенных жирных кислот растворяются лучше мыл из насыщенных кислот. С повышением температуры растворимость всех мыл увеличивается.
Диссоциация — обратимое разложение молекул на более простые молекулы, атомы, атомные группы или ионы. Принято считать, что в сильно разбавленных растворах мыло находится в состоянии истинного раствора. При этом часть его диссоциирует (распадается) электролитически, давая катион металла и анион жирной кислоты по уравнению
RCOONa RCOO~ + Na+.
Степень диссоциации мыла можно изменять. Если из раствора удалять один из ионов или понижать концентрацию их, то диссоциация будет продолжаться и все новые молекулы вещества будут
Распадаться на ионы. Наоборот, если повысить концентрацию раствора мыла или ввести в этот раствор некоторое количество вещества, например едкой щелочи или поваренной соли, дающего ионы сильного основания, то диссоциация будет снижаться.
Г и д р о л и з — реакция обменного разложения между различными веществами и водой. Мыло как соль сильного основания и слабой кислоты в водном растворе подвергается гидролизу, т. е. взаимодействует с водой, распадаясь на жирную кислоту и свободную щелочь по уравнению
ЯСОСЖа + Н20 ИСООН + №ОН.
Гидролиз мыльных растворов увеличивается с понижением концентрации растворов, повышением молекулярной массы жирных кислот и повышением температуры раствора. Мыла ненасыщенных кислот гидролизуются несколько меньше, чем насыщенных. Мыла смоляных кислот подвергаются гидролизу сильнее, чем мыла жирных кислот.
Образующиеся в результате гидролиза молекулы жирных кислот могут взаимодействовать с негидролизованным мылом, образуя кислые мыла по уравнению
ЯСООН + ИСОСЖа ИСООН • КСООМа.
Получающиеся при этом кислые мыла насыщенных высокомолекулярных жирных кислот в разбавленных мыльных растворах и в воде нерастворимы, они представляют собой тонкодисперсные взвеси (суспензии). Кислые мыла ненасыщенных жирных кислот при повышенной температуре в мыльных растворах частично растворяются.
Ассоциация молекул — соединение нескольких молекул одного и того же вещества в одну частицу. В более концентрированных мыльных растворах молекулы мыла начинают ассоциироваться (соединяться), образуя сначала пары молекул, связанные межмолекулярным притяжением групп —СОО№, а затем — более крупные ассоциаты, называемые мицеллами.
Таким образом, в зависимости от концентрации мыльного раствора в нем может находиться значительное количество разных компонентов: растворенные в воде недиссоциированные молекулы мыла, ассоциированные молекулы мыла (мицеллы), диссоциированные молекулы мыла — анионы и катионы, ассоциированные анионы, кислые мыла.
Между этими компонентами устанавливается равновесие, которое зависит от природы жира, концентрации раствора, температуры, наличия других электролитов и т. д.
Способность мыльных растворов к диссоциации, гидролизу и ассоциации обусловливает их сложный химический состав. Сложный состав мыльных растворов определяет их свойства, благодаря которым они отнесены к коллоидным электролитам, т. е. к таким водным растворам, которые ведут себя как электролиты (проводят электрический ток) и наряду с этим обладают некоторыми свойствами коллоидов.
Моющее действие мыла. Как известно, главное свойство всех видов мыла заключается в их способности образовывать водные растворы, которые отмывают различные загрязнения на коже, волосах, разных тканях, на стекле, металле, дереве и на других предметах. Эти водные растворы способны отделять загрязнения •от поверхности, переводить их в раствор и удерживать в нем, не давая обратно оседать на очищаемую поверхность. Моющее действие мыльных растворов сопровождается довольно сложными •физико-химическими процессами, которые обусловлены строением мыла.
Одним из важных свойств этих растворов является их способность понижать поверхностное натяжение на границе с жирами, твердыми телами, воздухом и другими не смешивающимися с водой веществами. По этому признаку раствор мыла в воде относят к поверхностно-активным веществам. Чем выше поверхностная .активность водных растворов мыла, тем больше они понижают натяжение в поверхностном слое, тем выше моющее действие мыла.
Как уже известно, молекула мыла состоит из двух неравных частей — полярной и неполярной. При растворении в воде мыло своей полярной карбоксильной группой погружается в водный раствор, в то время как неполярная углеводородная группа из воды выталкивается. Если в водный раствор мыла попадает капелька жира, масла или другого неполярного вещества, то углеводородная часть растворится в нем, в то время как карбоксил застревает в воде.
Таким образом, мыло связывает водный раствор с нерастворимыми в нем жировыми и жироподобными веществами. Это можно себе представить так, что молекула мыла является булавкой, шляпка которой находится в водном растворе, а острие—-в капельке масла. Так как в растворе находится большое количество молекул мыла, то они образуют вокруг капельки жира сплошной «частокол» в виде довольно прочной упругой пленки, удерживающей капельку в водном растворе. Схематично этот процесс показан на рис. 2.
Благодаря своей высокой поверхностной активности водные растворы мыла хорошо растекаются по поверхности ткани, погруженной в мыльную воду, и хорошо ею впитываются. При этом молекулы мыла обычно погружаются в ткань своей длинной углеводородной частью, а короткая часть — карбоксил как бы «торчит» наружу. В это время между тканью и прилипшими к ней загрязнениями образуются тончайшие пленочки, которые ослабляют силы сцепления ткани с загрязнениями и облегчают отрыв загрязнений от ткани.
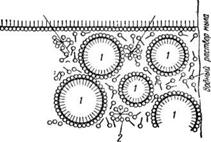
Схематично процесс смачивания ткани, отрыв загрязнений с поверхности и удерживание их в водном растворе мыла представлен на рис. 3.
Пена, образующаяся в моющем растворе, облегчает удерживание отмываемых загрязнений, которые прилипают к поверхности тончайших мыльных пленок, окружающих воздушные пузырьки. Наличие пены является также показателем того, что в моющем растворе еще имеется некоторый запас неизрасходованного мыла.
|
|
|
2 Воздух 2 |
|
' о- |
|
Рис. 2. Схема удерживания капелек жира в мыльном растворе: / — капельки жира; 2 — молекулы растворенного мыла (мелкими кружками обозначены водорастворимые карбоксилы, черточками — жирорастворимая углеводородная часть). |
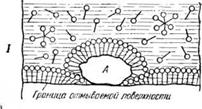
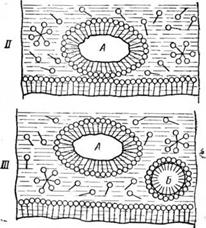 Рис. 3. Схематичное изображение моющего процесса:
Рис. 3. Схематичное изображение моющего процесса:
I—молекулы мыла адсорбируются на твердой грязевой частице и отмываемой поверхности; //—молекулы мыла отделяют грязевую частицу от отмываемой поверхности; Ш — твердая грязевая частица в моющем растворе; А — молекулы мыла адсорбируются на поверхности твердой грязевой частицы; Б — молекулы мыла, адсорбируясь на поверхности жидкой грязевой частицы, своими концами вторгаются внутрь грязевой частицы.
Моющая способность мыла проявляется при сравнительно низких концентрациях его водных растворов (порядка 0,1—0,2% в пересчете на жирные кислоты). На результат моющего действия существенное влияние оказывают следующие факторы: состав жирных кислот, из которых сварено мыло, характер очищаемой поверхности и интенсивность загрязнения, температура при мытье, жесткость воды, характер механического воздействия на очищаемую поверхность и др.
Недостатки мыла. Отличительной особенностью мыла является его сравнительная универсальность при мытье, стирке и чистке.
К его потребительским недостаткам следует отнести чувствительность к качеству воды. В жесткой воде жировое мыло плохо моет, образует липкий осадок. Расход его на мытье и стирку увеличивается. Вредное действие солей жесткости не ограничивается только перерасходом мыла. Если на ткани остаются кальциевые или магниевые мыла, то она быстрее изнашивается ввиду ускорения окисления ее кислородом воздуха. Выстиранная
В жёсткой воде ткань становится грубой, менее эластичной, поры ее забиваются и хуже пропускают воздух, краски становятся блеклыми, и в конечном счете свойства ткани резко снижаются. При мытье головы мылом в жесткой воде волосы склеиваются.
Для борьбы с отрицательным действием солей жесткости воды рекомендуется их предварительно удалять. Для этого воду можно умягчить, применяя специальные порошки, содержащие фосфорные соли, кальцинированную соду, силикат натрия и некоторые другие добавки.
Недостатком жирового мыла является и то, что при растворении его в воде выделяется (в результате гидролиза) некоторое незначительное количество свободной едкой щелочи. Щелочь безвредна для хлопчатобумажных и льняных тканей, но не допускается при стирке шелковых, шерстяных и многих синтетических тканей.
Несмотря на имеющиеся недостатки, мыло является весьма эффективным и универсальным видом моющих средств, особенно для ухода за телом и в ряде других случаев.

 Опубликовано в
Опубликовано в