Структура воды
 16 декабря, 2012
16 декабря, 2012  admin
admin Вода — это весьма активный химический компонент, участвующий вместе с цементом во всех процессах структурообразования цементного геля. От структуры воды зависят ее свойства, проявляющиеся на всех стадиях взаимодействия с портландцементными частицами. Структура воды изучена еще слабо и имеющиеся сведения о ней представляют собой исключительно большое теоретическое и практическое значение для науки о бетоне.
Молекула Н2 состоит из двух ядер, прочно соединенных двумя электронами, которые движутся концентрически, охватывая оба ядра. Электронную структуру такой молекулы часто изображают условным знаком: Я: Я, где буквы означают ядра, а точки — электроны. Иногда точки заменяют чертой, символизирующей валентную связь, т. е. Я—Я.
Как и молекула водорода, молекула кислорода соединяется только одной валентной связью[2]:
|
|
Следовательно, каждая молекула имеет по два непарных электрона и этим объясняется тот факт, что независимо от агрегатного состояния (в жидком, твердом или газообразном) молекула кислорода обладает очень редким для неметаллов свойством притягиваться магнитом.
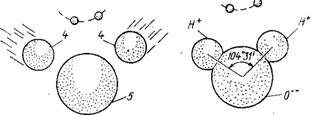
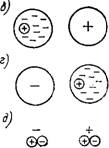
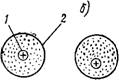
Представим себе атом в виде положительно заряженного ядра, окруженного сферическим облаком отрицательного заряда — это облако образовано электронами в атоме. Среднее положение ядра относится лишь к средним значениям координат, скоростей и т. п. и совпадает с центром сферического облака (рис. 1.4, а). Поскольку электроны в атоме находятся в движении и мгновенное положение центра облака отрицательно заряженных электронов может не совпадать в точности с ядром атома (рис. 1.4,6), то в этот момент атом представляет собой электрический диполь. Такое взаимодействие двух электрических диполей можно уподобить взаимодействию двух маленьких магнитов.
В отличие от флуктуирующих диполей, способствующих возникновению ван-дер-ваальсовых сил, моменты индуцированных диполей как бы закреплены вдоль линий, соединяющих ионьг. В этом случае говорят, что положительный ион поляризовал отрицательный ион. Другими
Рис. 1.4. Схема образования дипольного момента
|
|
|
|
|
Рис. 1.5. Схема ион-дппольного взаимодействия А — атомный диполь (электронное облако смещено направо) взаимодействует с соседним положительным ионом; б—положительный ион водорода (протон) индуцирует диполь на соседнем атоме (слева) |
А — ядро атома (1) в центре электронного облака (2) (средняя ситуация); б —центр электронного облака смещен относительно атомного ядра (ситуация в большинстве случаев) (3—Диполь); в и г —два противоположно заряженных иона; д — взаимные индуцированные дипольные моменты
Словами, электронное облако в целом слегка двигается в направлении положительного иона и в результате отрицательный ион приобретает кроме электрического заряда еще и диполь - ный момент. Точно так же и отрицательный ион поляризует положительный, отталкивая его электронное облако. На рис. 1.4, в, г, д Показано направление индуцированных диполей обоих ионов. Сопоставляя схемы на рис. 1.4, в, г, д и 1.3,6, можно заметить, что сила взаимодействия между индуцированными диполями добавляется к силе электростатического (кулоновского) притяжения между ионами (рис. 1.5,а). Положительные ионы могут поляризовать не только отрицательные, но и нейтральные (не взаимодействующие) атомы. В этом случае протон (положительный ион) может тесно сблизить два атома; находясь между ними, протон поляризует оба атома и возникшие индуцированные диполи притягиваются друг к ДРУГУ (Рис- 1.5,6). Межатомные силы, соответствующие такому механизму взаимодействия, определяют водородные связи.
|
|
|
|
|
*) |
Водородная связь определяет форму взаимодействия
Между молекулами воды и служит одной из причин, побуждающих молекулы ассоциировать в группы из двух, четырех и восьми молекул. Это явление обусловливает аномальные физические свойства воды и льда. Диполь - ный момент является весьма важной характеристикой молекулы, определяя, в частности, ее способность притягивать другие молекулы. По сравнению с многими жидкостями дипольный момент воды имеет наибольшую величину.
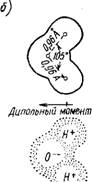
Указанное выще расположение электронов в Н2 и 02 обусловливает неравномерность распределения положительных и отрицательных зарядов в каждой молекуле. При совмещении центров тяжести положительных и отрицательных зарядов в одной точке молекула имеет равномерное распределение электронов, осуществляющих валентную связь между атомами, и называется неполяр - ной (например, у молекул газов N2, 02, Н2 и др.). Если электроны, связывающие атомы, несколько смещены в сторону одного из них, то вследствие возникновения асимметрии отрицательных зарядов в молекуле электрические центры тяжести положительных и отрицательных зарядов не совпадают. Подобные молекулы имеют два полюса, создающие вокруг молекулы силовые поля, а поэтому называются полярными. Поскольку в молекуле Н20 положительные и отрицательные заряды размещены асимметрично, образуя положительный и отрицательный полюса, молекула воды является полярной.
Чем больше расстояние между «центрами тяжести» положительных и отрицательных зарядов, тем большей полярностью обладает молекула. Количественной характеристикой полярности молекулы служит дипольный момент, который и определяется произведением расстояния (в см) между электрическими центрами тяжести положительных и отрицательных зарядов в молекуле 1 на величину заряда q (в абсолютных электростатических единицах), т. е. x=lq. Для воды Jll=0,39• 10~8Х Х4,77- Ю~10= 1,86-10~18.
Рассмотрим механизм образования молекулы воды и ее дипольной структуры.
Атом кислорода состоит из ядра и двух концентрических оболочек. Во внутренней — Кв размещены два электрона, а во внешней L — шесть электронов при двух вакансиях (рис. 1.6,а). Меньший по величине атом водорода имеет ядро и одну оболочку, в которой поме-
1 F О у
Ь а ^У
|
|
|
Дипольный момент |
|
- ад-ь |
|
Рис. 1.6. Схема образования молекулы воды А — расположение положительно заряженных двух атомов водорода по отношению к отрицательно заряженному атому кислорода; б — дипольный момент молекулы воды; 1 — вакансии; 2— К-оболочка; 3 — L-оболочка; 4 — водород; 5 — кислород |
4/ п^-2 >Л • ГЛ
Щается единственный электрон. При достаточно близком расположении внешних электронных оболочек атомы этих активных элементов, стремясь к равновесию, обмениваются электронами. Атомы водорода захватывают по одному электрону у атома кислорода и в результате такого взаимодействия происходит стяжение атомов, которое приводит к образованию молекулы воды.
При формировании диполя молекулы воды важное значение имеет пространственное расположение атомов
|
"Ч' о Ч 0 |
Водорода. Устойчивое их расположение достигается, если угол Н—О—Н равен примерно 105°, расстояние между ядрами кислорода и водорода равно 0,96-10"8 см, а между ядрами водорода — 1,53 • 10~8 см. Таким образом, молекула воды — Н20 представляет собой комбинацию
двух ядер атома водорода и одного ядра — кислорода, расположенных в углах равнобедренного треугольника (с ядром кислорода в его вершине) и погруженных в электронное облако, составленное из 10 электронов при общем радиусе молекулы в 1,38-10-8 см (рис. 1.6,6).
Молекулы воды отличаются большой устойчивостью в том отношении, что они не меняются в условиях, в которых другие молекулы распадаются на ионы. Но вместе с тем, хотя молекула воды и оказывает сопротивление распаду на ионы, сама по себе молекула имеет много общего с ионами (рис. 1.6,6); молекулу воды можно квалифицировать как ион кислорода О - с присоединенными к нему двумя ионами водорода Н+ Такое сочетание придает молекуле воды свойство ориентироваться в электрическом поле своим положительно заряженным концом по направлению к отрицательному полюсу и отрицательно заряженным — к положительному полюсу. Ориентируясь в таком направлении, молекулы воды стремятся нейтрализовать электрическое поле. Это означает, что необычайно большой дипольный момент молекулы воды придает ей аномально большую диэлектрическую постоянную и если принять эту величину для вакуума за единицу, то для воды она равна 81. Другими словами, в воде два электрических заряда будут притягивать или отталкивать друг друга с силой, равной 1/81 той силы, с которой они притягивались бы или отталкивались в вакууме. Этим отчасти определяется необыкновенная способность воды растворять различные вещества, молекулы которых соединены главным образом ионной связью.
Наличие дипольного момента у молекулы воды не может служить единственной причиной, приводящей к ассоциации, т. е. к образованию агрегатов из большого числа молекул. Необходимо еще рассмотреть природу сил, которые действуют между отдельными молекулами воды [61, 103].
Как известно, между молекулами любого вещества всегда существует слабое притяжение, которое возраста, ет при более тесном их сближении. Эти межмолекуляр - ньге (ван-дер-ваальсовы) силы возникают потому, что взаимное притяжение между ядром одной молекулы и электронами другой оказывается несколько большим, чем взаимное отталкивание их электронов и ядер.
Коль скоро жидкость не может начать испаряться прежде, чем тепловое движение не преодолеет ван-дер - ваальсовы силы, то количество движения, необходимое для этого, должно изменяться пропорционально силе притяжения между молекулами жидкости. Если это правило применять к воде, то окажется, что точка ее кипения находится примерно при 193 К, а точка замерзания при 183 К. Между тем, как известно, эти точки определяются соответственно 373 К и 273 К. Очевидно, что другая, более мощная сила, чем ван-дер-ваальсова, связывает молекулы воды. Эта сила и определяет упомянутую выше водородную связь, которая по своей природе электростатична. Как это было показано на рис. 1.6, два атома водорода, делящие электроны с атомом кислорода, обнажают фактически свои ядра и каждый из положительных зарядов может притянуть любой другой единичный (непарный) электрон. Поскольку у атома кислорода имеется два непарных электрона, молекула воды способна образовать четыре водородные связи, поэтому две дипольные молекулы воды, взятые порознь, обладают меньшей способностью нейтрализовать электрическое поле, чем те же молекулы, объединенные в один комплекс. В результате дипольный момент удваивается. Способность воды создавать водородные связи и может объяснить ее необычайно большую диэлектрическую постоянную, которая в свою очередь определяет необыкновенные свойства воды как растворителя.
Водородные связи между молекулами воды обусловливают необычную силу их сцепления, проявляющуюся в поверхностном натяжении воды и ее способности прилипать к различным веществам, вызывая их размягчение. Например, при смачивании водой стекла образуются водородные связи между обнаженными ядрами водорода молекулы Н20 и атомами кислорода, участвующими в строении поверхности стекла, которое состоит в основном из плавленого кремнезема — Si02. Аналогичным образом происходит этот процесс при смачивании водой других веществ, в составе которых находятся атомы кислорода.
Вода является неоднородной жидкостью. Согласно полимеризационной теории, молекулы воды могут существовать в форме: Н20 — гидроля (одиночные молекулы), (Н20)2 — дигидроля (двойные молекулы) и (Н20)з — тригидроля (тройные молекулы). Замерзшая вода состоит преимущественно из молекул тригидроля, имеющих наибольший объем. В парообразном состоянии
|
ТАБЛИЦА 1.2. СООТНОШЕНИЕ МЕЖДУ ТИПАМИ МОЛЕКУЛ ВОДЫ В % (ПО PAMAH-PAO)
|
При температуре более 373 К вода состоит главным образом из молекул гидроля, так как их оживленное тепловое движение при 373 К нарушает ассоциацию молекул. В жидком же состоянии вода представляет собой смесь гидроля, дигидроля и тригидроля, соотношение между которыми зависит от ее температуры. При изучении так называемых полосных спектров в воде определены соотношения между этими типами молекул, данные в табл. 1.2.
Дигидроль и тригидроль могут образоваться в результате притяжения противоположных диполей молекул воды (рис. 1.7, а).
Согласно другой теории (Барнал и Фаулер), сформулированной на основании данных рентгеноструктурного анализа, вода может иметь скрытую кристаллическую структуру, поэтому при изучении ее спектров сделано предположение, что при плотном расположении молекул воды (например, атомов в кристаллической решетке металлов) плотность ее равнялась бы примерно двум.
|
|
|
|
|
Рис. 1.7. Структура воды А — образование диполями воды ди - тидроля и тригидроля; б — расположение тетраэдров, составленных молекулами воды в двух соседних слоях (крестиком обозначены молекулы воды внутри тетраэдра) |
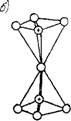
Коль скоро такая плотность возможна в особых случаях (об этом далее), следует полагать, что структура обычной воды более «рыхлая». Дифракционная картина рентгеновых лучей показала, что молекулы воды стремятся располагаться тет - раэдрически. При этом одна молекула находится в середине тетраэдра, а другие четыре окружают ее, помещаясь в углах тетраэдра на расстоянии
около 2,8-Ю-8 см. Тетраэдры, включающие пять молекул воды, связаны (другими подобными тетраэдрами) послойно, имея общие углы, а с лежащим выше слоем — своими вершинами. При этом третий и четвертый слои повторяют это строение. Описанная структура является сравнительно «пористой» и по аналогии со строением минерала тридимита ее называют тридимитной структурой воды.
Внутри каждого тетраэдра связь между молекулами воды осуществляется по тетраэдрическим направлениям, т. е. атом кислорода одной молекулы электростатически уравновешивается четырьмя атомами воды (двух соседних молекул воды), расположенными относительно атома кислорода тетраэдрически; в этом случае на связь с ним атомы водорода затрачивают только половину свое, го заряда, т. е. 0,5 q> так, что другая половина отдается соседним двум атомам кислорода. Таким образом, связь с соседними двумя молекулами воды осуществляется в трех направлениях и тем самым создается сетка, в которой каждый атом кислорода тетраэдрически окружен четырьмя атомами водорода. В свою очередь каждая молекула тетраэдрически окружена четырьмя молекулами воды (рис. 1.7,6).
Кристаллическая структура льда относится к тридимитной с водородными связями между своеобразно расположенными парными электронами молекул воды. По мере повышения температуры от 273 К до 277 К лед превращается в воду и в ней постепенно образуется другая структура, в которой тетраэдры из молекул воды располагаются не в виде слоев, а по направлениям ориентации водородных связей.
Как известно, плотность воды увеличивается с понижением ее температуры, и это происходит до тех пор, пока она не достигнет 277 К. В этой точке соотношение форм агрегатов молекул воды таково, что плотность ее будет наибольшей и влияние водородной связи становится сильнее, чем тенденция молекул воды сжиматься— сокращаться вследствие уменьшения их подвижности при более низкой температуре. Полное замещение тридимитной структуры происходит при температуре максимальной плотности воды, т. е. 277 К. Возникающая при этом так называемая кварцевая структура сохраняется до 423 К, постепенно уступая беспорядочному движению неориентированных молекул воды.
Следовательно, во всем интервале температур выше 273 К структура воды не является однородной и наряду с микрообъемами воды, имеющими кристаллическое строение, в ней содержатся микрообъемы с беспорядочно движущимися молекулами воды. Эти виды структур на являются стабильными; одновременно протекают процессы, обусловливающие как разрушение кристаллической решетки, так и переход неориентированных молекул в положение, при котором формируется кристаллическая структура воды. Даже при наибольшей ее плотности (соответствующей 277 К), когда молекулы расположены более или менее компактно по спирали вдоль линий, совпадающих с направлением водородных связей, между отдельными комплексами молекул остаются бреши— дырки; они служат резервными микрообъемами, которые могут быть заполнены молекулами воды под влиянием силового поля, способствующего их переориентации.
Вода не является простым химическим соединением, выражающимся формулой Н20 и характеризующимся молекулярной массой 18,016. Самая чистая вода, которую можно получить, содержит незначительное количество вещества того же химического состава, что и вода, но с молекулярной массой 20. Молекулы этой воды состоят из атомов водорода с удвоенной атомной массой по сравнению с атомами обычного водорода. Двойная масса этих атомов обусловливается тем, что их ядра содержат, кроме единственного протона, составляющего ядро обычного водорода, еще один нейтрон. Из-за особых свойств аномального атома водорода ему присвоено название дейтерий (тяжелая вода). Описывается он формулой Д20, кипит при 374,4 К и замерзает при 276,8 К.
В настоящее время известен третий изотоп водорода— тритий и три изотопа кислорода с атомной массой 16 (обыкновенный кислород), 17 и 18. Поскольку каждый из трех изотопов водорода соединяется с каждым из трех изотопов кислорода в соотношении 2 : 1 и каждый изотоп образует ионы, любая проба чистой воды является смесью не менее 18 различных молекулярных соединений плюс 15 различных видов ионов, что составляет 33 различных химических вещества.



 Опубликовано в
Опубликовано в