ПРОИЗВОДСТВО И ПРИМЕНЕНИЕ НИТРОБЕНЗОЛА
 12 августа, 2013
12 августа, 2013  admin
admin Нитробензол получают с выходом 96-98 % нитрованием бензола смесью азотной и серной кислот [350].
В США объем производства нитробензола в 1995 г. составил 748 тыс. т [456]. Фирма «BASF Corp.» планирует в 2000 г. построить новый завод по производству нитробензола мощностью 160 тыс. т/год и на его основе анилина мощностью 120 тыс. т/год в г. Гейсмар (шт. Луизиана, США) [457].
В России нитробензол производится в ОАО «Камтэкс - хим - пром» (г. Пермь) и технический нитробензол - на ГП «Завод им. Я. М .Свердлова» (г. Дзержинск, Нижегородская обл.) [330].
Нитробензол можно получать также парофазным нитрованием бензола разбавленной HN03 на цеолитах типа Y, ZSM-5, мор - дените и клиноптилолите, причем наиболее активен последний катализатор [458]. Теми же исследователями фирмы «CU Chemie Uetikon AG» запатентовано получение нитробензола парофазным нитрованием бензола при 127-250°С водной HN03 с концентрацией более 50 % (мае.) в присутствии Н-морденита с соотношением Si02/Al203 свыше 12 и содержанием Na20 до 0.5 % [459], а также в присутствии клиноптилолита с размером кристаллов менее 1000 нм при 2 7-250 °С [460].
Установлено, что активными катализаторами парофазного нитрования бензола являются монтмориллонит с введенными ионным обменом катионами металлов, а также смешанные оксиды Ъп. или Т1; выход нитробензола составляет 80-90 %, продолжительность работы катализатора - до 480 ч [461]. Обработка смешанных оксидов на основе ТЮ2 или Zr02 серной кислотой при 500 °С и частичная нейтрализация гетерополикислот с помощью Се или Т1 повышает активность катализаторов. Так, на катализаторе ТЮ2-Мо02 в соотношении 4:1, обработанном Н2в04 при 500 °С, выход нитробензола составляет 87 %, продолжительность работы катализатора более 528 ч [462].
В качестве катализатора парофазного нитрования можно использовать нанесенную на 8Ю2 в количестве 10 % (мае.) Н2804, причем высокую активность катализатора удается поддерживать введением следовых количеств Н2804 в исходную разбавленную азотную кислоту (массовое соотношение Н2804/НЖ)3 = 1/5000) [463].
Для получения нитробензола предложено также проводить парофазное нитрование бензола при 105-130 °С на цеолите типа Р или мордените с одновременной отгонкой из реакционного пространства образующейся воды [464].
Нитрование бензола может проводиться не только азотной кислотой, но и оксидами азота, например N02, при этом наиболее активен смешанный оксидный катализатор \Ю3-Мо03 [465].
Процесс жидкофазного нитрования бензола 95-100 %-й НЖ)3 может осуществляться и без использования Н2804. Так, нитрованием бензола 98 % - й Н1>Ю3 при 10-60°С в течение 5 мин получают нитробензол, а при 65 °С в течение 30 мин - динитробензол, не содержащий примесей нитрофенолов [466].
Одним из важнейших и наиболее старых направлений использования нитробензола остается производство анилина. Как известно, еще в 1842 г. Н. Н. Зинин открыл реакцию получения ароматических аминов восстановлением нитросоединений с помощью Н28, ^Н4)28 или сульфидов щелочных металлов:
АгЖ)2 + ЗН28 — АгГШ2 + 2Н20 + ЗБ
Благодаря открытию этой реакции стало возможным промышленное производство анилина из нитробензола. Ранее анилин получали из индиго.
|
169 |
![]() В 1854 г. А. Бешан открыл реакцию восстановления ароматических нитросоединений до аминов действием железных стружек в разбавленных кислотах, главным образом в соляной ки-
В 1854 г. А. Бешан открыл реакцию восстановления ароматических нитросоединений до аминов действием железных стружек в разбавленных кислотах, главным образом в соляной ки-
1 2 — 1 2Я-1
Слоте, или в растворах электролитов (FeCl2, NH4C1, СаС12 и др.). Процесс Бешана широко применялся в промышленности для производства анилина вплоть до начала 60-х годов XX века, когда строительство новых производств по этому методу прекратилось [467].
В1872г. М.М. Зайцев открыл реакцию восстановления нитросоединений водородом в присутствии катализаторов, получив анилин пропусканием смеси паров нитробензола и Н2 при 150 °С над палладиевой чернью. С середины 50-х годов XX века газофазное восстановление нитробензола водородом — основной промышленный метод производства анилина [468].
Жидкофазное восстановление нитробензола возможно при 160-170°С и давлении водорода ниже 1.1 МПа на Ni- или Pd- катализаторе с одновременной отгонкой воды и анилина за счет теплоты реакции. Затраты на сырье при этом на 0.7-1 % ниже, однако капитальные затраты значительно выше, чем при газофазном процессе [469].
Газофазное восстановление нитробензола осуществляется в трубчатом реакторе при 250-350 °С на Ni - или Си-содержащем катализаторе [250]:
C6H5N02 + 3H2 —► C6H5NH2 + 2Н20 + 443.8 кДж/моль
Для получения 1 т анилина расходуется 1.35 т нитробензола, 800 м3 Н2 и 1 кг катализатора.
Для парофазного гидрирования нитробензола чаще всего применяют катализаторы на основе меди, на которых ароматическое кольцо плохо гидрируется, и поэтому в качестве основного продукта получается анилин. Катализатором служит Си Ре - нея, полученная из сплава Си-Al, оксидные Си-Сг-катализато - ры, Ni Ренея. Перспективно также использование восстановленных железных катализаторов, промотированных 5 % (мае.) V205 и 1 % (мае.) СиО. Так, при 200-215°С и давлении водорода 2.5- 5.0 МПа конверсия нитробензола составляет 98-99.9 % и выход анилина 97-99.5 % [470].
Продолжается поиск более эффективных катализаторов для газофазного восстановления нитробензола. Так, при модифицировании Pd-катализатора на керамической подложке V и РЬ при проведении гидрирования при 230-300 °С селективность образования анилина повышается на 0.6 % , достигая 99-99.2 % [471]. Та же фирма «Bayer AG» запатентовала в качестве катализатора для получения ароматических аминов газофазным гидрированием Pd, модифицированного 0.5-2% (мае.) РЬ, на графите или графитсодержащем коксе. Селективность образования анилина
Составляет 99.88-99.95 %, причем катализатор не дезактивируется после 3000 ч работы [472].
Для синтеза анилина из нитробензола в паровой фазе предложен также катализатор следующего состава, % (мае.): N1 12-19; Си 1-3; V 3-4; Ка 0.03-0.4; носитель А1203 - остальное [473].
Парофазное гидрирование нитробензола до анилина возможно также при 155-240°С с использованием катализатора, включающего СиО, ZnO, Сг203 и А1203 [474], или при 180-280°С на аналогичном катализаторе, в состав которого вместо Сг203 входят СаО и N10 или Мп304 [475].
Фирма «МНвш Тоа1Би СЬеппса^» запатентовала способ по - ? лучения высокочистого анилина жидкофазным гидрированием нитробензола с использованием анилина в качестве растворителя в присутствии катализатора — нанесенных на гидрофобный уголь Р<1 или Рс1 и Р1, а также промоторов - гидроксидов, карбонатов или бикарбонатов щелочных металлов, ацетата или нитрата Zn [476-478]. Образующиеся анилин и воду непрерывно отгоняют, поддерживая концентрацию анилина в реакционной смеси не более 0.01 % (мае.), что ингибирует образование побочных продуктов. Степень чистоты получаемого анилина составляет 99.99 % (мае.).
Выделение анилина из продуктов гидрирования нитробензола предложено проводить вакуумной ректификацией по трехколонной схеме в присутствии промоторов очистки анилина - фенилендиаминов, дифениламина, аминофенолов или их смеси [479].
Эффективным катализатором гидрирования нитробензола может служить комплекс 11и(Ш), нанесенный на модифицированный стирол-дивинил ьный сополимер [480].
Разработан процесс восстановления нитробензола до анилина в жидкой фазе на стекловолокнистых катализаторах, полученных пропиткой носителя водным раствором Рс1С12. Использовали
1- 3 % - й раствор нитробензола в 2-пропаноле, полная конверсия в анилин происходила через 1 ч. Преимущества процесса по сравнению с традиционным катализатором: высокая активность, возможность осуществления непрерывной схемы, ликвидация стадии фильтрации продукта от диспергированного катализатора [481].
Восстановление нитробензола до анилина возможно действием СО в присутствии воды в среде метилового или этилового спирта при использовании Рс1-катализатора и ЕеС13 как соката - лизатора. Так, при 180°С и продолжительности процесса 3 ч конверсия нитробензола составляет 98 % при селективности об
Разования анилина 100 % [482]. В качестве восстановителя нитробензола до анилина вместо водорода можно использовать также метан в присутствии воды, что позволяет снизить энергозатраты и упростить процесс [483].
Фирма «First Chefnical Corp.» запатентовала способ совместного производства анилина и ж-фенилендиамина из бензола. Нитрование бензола проводится в двух реакторах: сначала до нитробензола отработанной нитрующей смесью со второй стадии, затем смесью концентрированных HN03 и H2S04 с получением смеси нитробензола и 1,3-динитробензола в массовом соотношении 70 : 30. Далее гидрирование нитропроизводных бензола ведется на Pd/C-катализаторе с образованием смеси анилина и ж-фенилендиамина в приблизительно таком же соотношении [484].
Восстановлением нитробензола цинком в щелочной среде получают гидразобензол, который в результате бензидиновой перегруппировки, открытой Н. Н. Зининым в 1845 г., под действием минеральных кислот превращается в бензидин (4,4'-диаминоди - фенил). Бензидин широко применялся для производства азокрасителей и мягчителей для резин, однако из-за канцерогенности с середины 70-х годов XX в. масштабы его производства сократились, а в ряде стран применение бензидина запрещено.
Восстановлением нитробензола цинковой пылью в щелочной среде получают азобензол, применяющийся в производстве гид- разобензола [356].
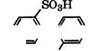
Сульфированием нитробензола 25%-м олеумом при 70 °С с последующим высаливанием производят натриевую соль ж-нит - робензолсульфокислоты, применяющуюся в производстве мета- ниловой кислоты, бензидин-2,2'-дисул ьфокислоты, лекарственных препаратов. Так, метаниловая кислота получается восстановлением ж-нитробензолсульфокислоты под действием Fe в H2S04, гидразина в водно-спиртовой щелочи или гидрированием в присутствии Pd или Ni [318]:
|
|
Ж-Нитробензолсульфокислота восстанавливается сероводородом в растворе ЫаНБ или Ъп в щелочном растворе до азобензол-3,3'-дисульфокислоты, затем до гидразобензол-3,3'-дисульфокислоты, которая под действием концентрированной НС1 перегруппировывается в бензидин-2,2'-дисульфокислоту:
•*, <V HO3S. ____________________________________ HO3S _______ *+'" f«J}J
|
H03S |
![]()
 2 0-n°2 —► N=N-^~^ —► Я<(
2 0-n°2 —► N=N-^~^ —► Я<(
HO3S. SO3H
—*- v3-“NH—NH xlv —h2n—^ y—^ 7—nh2
Восстановлением ж-нитробензолсульфокислоты действием Al в разбавленной H2S04 при 100 °С получают 5-амино-2-гидрокси - бензолсульфокислоту:
S03H ___ so3h
Ai + H2S°4- h. n^Q-oh
Ж-Нитробензолсульфокислота применяется также в качестве окислителя в производстве красителей и в фотографии.
Реакцией нитробензола с хлорсульфоновой кислотой и последующим взаимодействием с NH3 и чугунной стружкой получают 3-аминобензолсульфамид, который используется для получения азокрасителей.
Каталитическим карбонилированием нитробензола в жидкой фазе в присутствии алифатического спирта получают эфиры N-фе - нилкарбаминовой кислоты. В качестве каталитической системы при этом используют металлический Pd или его хлориды, порошок Fe и 12 в пиридине или алифатическом третичном амине. Так, при 180°С и начальном давлении СО 5 МПа конверсия нитробензола составляет 98 %, селективность образования этилового эфира N-фенилкарбаминовой кислоты 98 % [485]. Эфиры N-фе - нилкарбаминовой кислоты применяются в производстве урета - нов и далее полиуретанов.
Те же эфиры могут быть получены взаимодействием анилина со спиртом и СО в присутствии нитробензола и Pd-Fe-V-ката - лизатора при 190°С [486].
Взаимодействием нитробензола, бензонитрила и основания при пропускании воздуха может быть получен М-(4-нитрофе- нил)бензамид, гидрированием которого на Rh, Ru, Ni Ренея синтезируют n-нитроароматические амиды. Реакцией последних с NH3 получают n-аминоароматические амины - мономеры для производства полиамидов [487].
Фирма «Bayer AG» запатентовала способ получения 4-амино- дифениламина гидрированием нитробензола Н2 в присутствии
оснований, например [(СН3)4М]ОН • хИ20, гетерогенного катализатора - Р(1/С в инертном апротонном растворителе (метил - трет-бутиловом эфире) при 80 °С и давлении 0.5 МПа [488] .
При взаимодействии 4-аминодифениламина с кетонами в присутствии Н2 и катализаторов гидрирования получают, например, К-(4-метилпентил-2)-К'-фенил-п-фенилендиамин - ан - тиозонант для каучуков и других полимеров [489].
Реакцией нитробензола и анилина или их производных в присутствии оснований и апротонных растворителей также получаются нитродиариламины. Так, из нитробензола и анилина и трет-бутилата калия в диметилсульфоксиде получают нитродифениламин с селективностью 82 % ив качестве примеси - фе - назин (дибензопиразин) [490].
Взаимодействием нитробензола с НС1 и СО в присутствии катализатора, например Р<1С12, и трифенилфосфина при 130°С степень превращения нитробензола составляет 100 % и получается реакционная смесь, содержащая, % (мае.): о - и п-хлоранилины, анилин - 45, 35 и 15 соответственно [491].
Щелочным нитробензольным окислением лигносульфонатов в присутствии катализаторов окислительно-востановительного типа - антрахинона, о-фенантролина получают ароматические оксиальдегиды - ванилин (4-гидрокси-З-метоксибензальдегид), сиреневый альдегид [492, 493]. В результате использования каталитических добавок суммарный выход ароматических альдегидов, например, при переработке лигнина из древесины осины повышается с 39.1 до 61-64.7 %.
В качестве катализатора окисления лигносульфонатов могут быть использованы СиО [494] или раствор Си804 [495]. Образующийся ванилин экстрагируют на Сясьском целлюлозно-бумажном комбинате бензолом, за рубежом - бутанолом или изопропиловым спиртом [494], можно также использовать смеси пропиловых спиртов с гексаном, этилацетатом или диизопропи - ловым эфиром [496].
Ванилин применяется как ароматизатор в пищевой промышленности, душистое вещество в парфюмерии, для придания блеска покрытиям в гальванотехнике и для синтеза лекарственных средств, например фтивазида. Сиреневый альдегид является полупродуктом для синтеза триметоприма - компонента медицинских препаратов типа бисептола и бактрима [497].
Нитробензол предлагается использовать и для окислительного дегидрирования с целью получения винилароматических и винилгетероциклических соединений. Так, дегидрированием этил - бензола в присутствии нитробензола можно получать стирол и анилин [102]. Нитробензол применяется также в качестве растворителя, например эфиров целлюлозы, и как компонент полировальных составов для металлов.
Нитрованием нитробензола смесью HN03 и H2S04 с последующей обработкой раствором Na2S03 получают ж-динитробен- зол, применяющийся в производстве ж-фенилендиамина, ж-нит - роанилина, ж-нитроанилинсульфокислоты.
Нитрование бензола до ж-динитробензола обычно проводится в две стадии - сначала до нитробензола, затем до динитробензолов при повышении температуры до 90 °С. Полученная смесь динитробензолов содержит ж-, о - и п-изомеры, % (мае.): 90-91, 8-9 и 1-2 [350].
Восстановлением ж-динитробензола в присутствии катализаторов (Ni, Pt, Pd) получают ж-фенилендиамин [498]. Гидрирование ж-динитробензола водородом может проводиться в метаноле при 105-150°С и давлении 3.5-15 МПа на скелетном никелевом катализаторе [499].
Ж-Фенилендиамин применяется в производстве полимеров для термостойких волокон, азокрасителей, отвердителей эпоксидных смол. Так, в Японии на основе ж-фенилендиамина производится сравнительно дешевый полиэфиримид Aurum. На основе ж-динитробензола получены диариловые эфиры, 3-амино - феноксифталевая кислота и ее производные, мономеры для по- лиэфиримида LARC-CPI [500].
Аминированием ж-динитробензола при 20 °С раствором КМп04 в жидком аммиаке получен 2,4-динитроанилин с выходом 60- 70 % [501]. 2,4-Динитроанилин используется в синтезе азокрасителей и взрывчатых веществ.
Нитрованием ж-динитробензола смесью HN03 с олеумом получают 1,3,5-тринитробензол - более мощное взрывчатое вещество, чем тротил. Восстановлением 1,3,5-тринитробензола производится 1,3,5-триаминобензол, гидролизом которого получают флороглюцин [350]. Флороглюцин применяется как азосоставляющий компонент светочувствительных бумаг и пленок.

 Опубликовано в
Опубликовано в