ПРИМЕНЕНИЕ ФЕНОЛА
 9 августа, 2013
9 августа, 2013  admin
admin Основные промышленные и перспективные направления применения фенола представлены на схеме (рис. 8).
Наиболее крупнотоннажным потребителем фенола в последние годы стало производство бисфенола А - 2,2-бис(4-гидро - ксифенил)пропана. В промышленности бисфенол А получают конденсацией 2-15-кратного избытка фенола с ацетоном при 40-80 °С в присутствии минеральных кислот (H2S04, HCl), ионообменных смол (КУ-1, КУ-2, СБС и др.), кислот Льюиса, а также промоторов, например меркаптанов, тиогликолевой кислоты, тио - карбоновых кислот [210].
Так, при взаимодействии фенола с ацетоном в присутствии сульфокислотных ионообменных смол, модифицированных меркаптанами, при добавлении 0.6-5 % (мае.) воды конверсия ацетона составляет 94.7 %, селективность образования бисфенола А
94.7 % [211].
В качестве катализатора предлагается также использовать газообразный НС1 и проводить синтез при температуре от -10 до + 10 °С [212] либо катионообменную смолу гелевого типа в колонном реакторе, в который один из реагентов подается сверху, а другой - снизу [213].
Полная конверсия ацетона достигается при получении бисфенола А в двух или более последовательно соединенных реакторах с постепенным повышением температуры от 61 до 71 °С [214]. Для повышения выхода бисфенола А запатентовано использование полимерных мембран, проницаемых для выделяющейся при конденсации воды [215].
Сообщается о строительстве японской фирмой "Chiyoda Corp." нового завода по производству 70 тыс. т/год бисфенола А, где будет использована в качестве катализатора ионообменная смола с новым промотором, позволяющим снизить капитальные затраты на 30 %. Конверсия ацетона при 100 °С составляет 95 %, селективность образования бисфенола А 90 % [216].
(СН3)2С=0
Альдегиды
Т_________ дегилные
—► (СбН50)2С0
"► ^у>—МН;
Г.--- /
|
^Нз |
![]()
|
Н2С—СН2 Л—З^сни V ------------ *■ И'С6Н4(ОСН2СН2), °Ч><’ |
 !СМОЛЫ
!СМОЛЫ
|
ОН |
![]() /
/
~ =/СН3
(СНз)зСОН^ НО-—^ У-С(СН3)3 алкилфеноло-формальдегидные
~’ ОН
(СН3)3С 1 С(СН3)3
Н2С—С(СН3)2 ^ Уу
ОН ОН
СН3ОН г |^у СНзОН^ |^У
О^оснз
|
Смолы |
![]() Нсн=сн2
Нсн=сн2
СООН
С02, МаОН
ОН
|
|
|
Ин °2КХКН2 V |
|
КтаНЭ |
|
СО(МН2)2 |
|
—- С6Н5ОСОШ2 |
|
=^ОН |
|
Сн2о |
|
(СР3)2С— |
|
О°-о —** н°-^~У-С(СГзЬ^С~У~0Н |
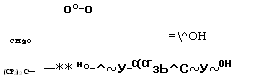 |
|
|
|
|
|
 |
|
|
|
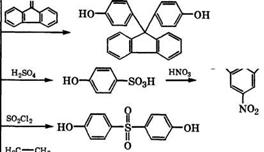
Рис. 8. Направления использования фенола
Основная примесь к бисфенолу А - о, п-изомер
^ С(СНз)2 ^—он ОН
Который образуется обычно в количестве 3-8 % (мае.) [212,214]. Очистку бисфенола А можно проводить кристаллизацией аддукта бисфенола А с фенолом в каскаде аппаратов с последовательным удалением фенола [217]. По другому способу к аддукту перед удалением фенола отгонкой в вакууме добавляют небольшое количество алифатической карбоновой кислоты или ее соли до pH около 5, что снижает окрашивание бисфенола А. Испарение фенола проводится в двух аппаратах пленочного типа с использованием водяного пара в качестве отдувочного газа [218]. Высокочистый бисфенол А применяется для производства неокрашенных поликарбонатов.
Производство чистого бисфенола А возможно также промывкой аддукта с фенолом специально очищенным фенолом с помощью сильнокислой ионообменной смолы и последующим разложением промытого продукта [219].
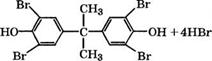
Бромированием бисфенола А получают тетрабромпроизвод - ные, применяющиеся для получения самозатухающих полимерных композиционных материалов и эпоксидных смол:
|
СН3 |
|
|
Более эффективный процесс - окислительное бромирование с участием гипохлорита натрия, при котором выделяющийся НВг окисляется до брома и протекает сопряженный многостадийный процесс:
ЛтаОС1
(С6Н4ОН)2С(СН3)2 + 2Вг2 —► (ВгС6Н3ОН)2С(СН3)2 + 2НВг ---------------------- ►
—► (Вг2С6Н2 ОН)2С(СН3)2 + 2Н20 + 2ЫаС1
Подают Вг2 и №00 последовательно при 20-40 °С, расход брома при окислительном бромировании снижается вдвое, выход целевого продукта 96.5 % [220].
Поликонденсацией бисфенолаА с фосгеном получают поликарбонаты, с эпихлоргидрином - эпоксидные смолы, с галоген - ангидридами терефталевой и изофталевой кислот - полиарила - ты, с дигалогендифенилсульфонами - полиариленсульфоны. Формилированием бисфенола А получают феноло-формальдегид- ные смолы.
Второе по значимости направление применения фенола - производство феноло-альдегидных смол [221]. Кроме фенола и бисфенолов для их получения в меньшей степени используются также крезолы, ксиленолы, 4-/прет-бутилфенол, 4-кумилфенол, резорцин и др. В качестве альдегидных компонентов чаще всего применяется формальдегид в виде водного раствора - формалина, гексаметилентетрамина, параформа, триоксана, реже - фурфурол, ацетальдегид и высшие алифатические альдегиды.
В зависимости от соотношения формальдегида и фенола получают резольные (термореактивные) или новолачные (термопластичные) смолы. Резольные смолы образуются при молярном избытке СН20 (п > 1), при этом получаются реакционноспособные метилолфенолы
С6Н50Н + лСН20 —► НОС6Н5_п(СН2ОН)„ (п = 2-3)
И олигомерные метилольные производные:
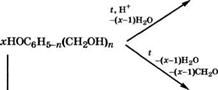 (НОСН2)л_1(НО)С6Н5_л НОС6Н5_п(СН2ОН)и_1СН20 [— СН2С6Н5_п(0Н)(СН20Н)п_2СН20—]х_2 сн2
(НОСН2)л_1(НО)С6Н5_л НОС6Н5_п(СН2ОН)и_1СН20 [— СН2С6Н5_п(0Н)(СН20Н)п_2СН20—]х_2 сн2
130 °с —(л:-1)СН20
(НОСН2)п_1(НО)С6Н5_п НОС6Н5_п(СН2ОН)п_1[-СН2С6Н5_п(ОН)(СН2ОН)п_2-]х_2 сн2
С6Н5_п(ОН)(СН2ОН)„_1
*СвН5ОН I
——►СН2[-С6Н4(ОН)СН2С6Н4_п(ОН)(СН2ОН)и_2СН2-];,_1С6Н4ОН
(ЛГ“1)1120
Резольные смолы синтезируют'в водной среде при температуре около 100 °С в присутствии основных катализаторов (КаОН, Ва(ОН)2, 1ЧН3). Отверждение резольных феноло-формальдегид- ных смол - продолжение реакций конденсации метилольных групп проводится при 130-200 °С или в присутствии кислотных катализаторов: п-толуолсульфокислоты, бензолсульфокислоты, Н3Р04 при более низких температурах.
Новолачные (термопластичные) смолы образуются при недостатке СНгО (п < 1), они не способны к дальнейшим реакциям поликонденсации без введения дополнительного количества формальдегида, так как в их молекулах отсутствуют метилольные группы. Новолачные смолы синтезируют в водных растворах в присутствии кислотных катализаторов (HCl, H2S04, Н3Р04, /i-толуолсульфокислоты, кислот Льюиса) или в расплавах фенолов и производных формальдегида (параформа, уротропина). Отверждение новолачных смол проводится с помощью уротропина или параформа, а также изоцианатов, реагирующих с гидроксильными группами при 150-180 °С. В процессах отверждения часто используются реакционноспособные растворители - фурфурол, фурфуриловый спирт, а также модифицирующие добавки - анилин, меламин, капролактам.
Важное направление использования фенолов - производство диарилкарбонатов, которые можно получать различными способами:
Взаимодействием фенолов с фосгеном
2С6Н6ОН + СОС12 —(С6Н50)2С0 + 2НС1 взаимодействием фенолов с арилхлоркарбонатами
С6Н5ОН + С6Н50С(0)С1 —► (С6Н50)2С0 + НС1 ;
Прямым карбонилированием фенолов
2С6Н5ОН + СО + 72 02 — (С6Н50)2С0 + Н20 11
Переэтерификацией диалкилкарбонатов фенолами (RO)2CO + 2С6Н5ОН —► (С6Н50)2С0 + 2ROH
Так, взаимодействием фенола с фосгеном, взятых в мольном соотношении 2:1, при 140 °С в присутствии порошка ТЮ2 получают дифенил карбонат с селективностью 99.5 % при конверсии фенола через 2 ч 12.5 % [222]. В качестве катализаторов могут быть использованы цеолиты [223] или пудра А1203 [224]. В последнем случае при проведении реакции в расплаве фенола ди - фенилкарбонат образуется с селективностью 99.5 % и конверсией фенола через 2 ч при 140 °С, равной 41 %.
Более высокий выход продукта обеспечивается при взаимодействии фенолов с арилхлоркарбонатами: при использовании в качестве катализатора силиката Ti(III) при 165 °С, эквимоляр - ном соотношении фенола и фенилхлоркарбоната уже через 15 мин степень конверсии реагентов достигает 98 % и выход дифенил - карбоната превышает 95 % [225]. Фенилхлоркарбонат может быть получен фосгенированием фенола при 140 °С в присутствии трифенилфосфита с селективностью 95 % [226].
|
О, |
|
О |
|
V |
|
/ |
|
АгО |
|
ОАг |
|
Запатентован способ получения диарилкарбонатов декарбо - нилированием диарилоксалатов в присутствии триарилфосфина или триарилфосфиноксида в качестве катализатора при 180- 350 °С [227]: О II АгО—С—ОАг + СО Прямое карбонилирование фенолов проводится в присутствии соединений палладия, сокатализаторов и органических оснований. Так, запатентовано использование в качестве катализатора PdBr2 [228-230], сокатализатора - ацетилацетоната Mn(II) [229, 230], органических оснований - фенолята Na, четвертичных аммониевых оснований [Bu4N]Br [229], 1,2,2,6,6-пентаме - тилпиперидина [228]. Выход дифенилкарбоната повышается при непрерывной отдувке азотом реакционной воды [230]. При карбонилировании фенола в присутствии ацетатов Pd и Со, [Bu4N]C1 и бензохинона, парциальном давлении 02 1.4 МПа и СО 1.84 МПа выход дифенилкарбоната за 13 ч достигает 30 % [231]. При карбонилировании фенола с ацетатом Pd в качестве катализатора и с [Bu4N]Br, а также комплексом 3,3'-диамино-]Ч- метилдипропиламинокобальтодисалицилата с пиридином при общем давлении СО + 02 1.12 МПа выход дифенилкарбоната составляет 41.3% [232]. Фирма «General Electric Со.» запатентовала катализатор карбонилирования фенола - 2,4-пентандиоат Pd, а также сокатализаторы - соли Со, бис[3-(салицилалами- но)пропил]метиламин или хинолин в присутствии гексаэтил- гуанидинийбромида. При проведении реакции в течение 2 ч при 110 °С выход дифенилкарбоната составил 42%, а его чистота 94 % [233]. Таким образом, возможно получение дифенилкарбоната без использования фосгена, однако при этом процесс проводится при более высоком давлении и продукт получается с меньшим выходом. Переэтерификацию диалкилкарбонатов или арилалкилкар - бонатов фенолом проводят в колонных аппаратах совмещенного реакционно-ректификационного тшга в присутствии в качестве катализаторов ацетата РЬ [234], Bu2SnO [235], титанатных эфиров [236]. При проведении процесса в двухколонной системе при температуре около 200 °С в присутствии РЬ[0(0)ССН3]2 из диме - тилкарбоната и фенола получают дифенил карбонат с селективностью 98 % и выходом 82.8 % [234]. Процесс может проводиться в каскаде, включающем от двух до десяти реакторов: сначала |
 |
Образуется преимущественно алкиларилкарбонат, а затем путем дальнейшей переэтерификации и диспропорционирования - ди - арилкарбонат [237, 238].
Очистка дифенил карбоната от примесей диалкилкарбоната, алкилфенилкарбоната, фенола и катализатора возможна сочетанием ректификации с фракционной кристаллизацией расплава [239].
Каталитическим гидрированием фенола получают циклогек- санон или циклогексанол в зависимости от состава катализатора. Получение циклогексанона для использования в производстве капролактама предпочтительнее, так как позволяет исключить энергоемкую стадию дегидрирования циклогексанола. Гидрирование фенола в циклогексанон изучалось в жидкой [240] и паровой фазах [241-243] на нанесенных палладиевых катализаторах.
Исследована кинетика гидрирования фенола на Рс1/А1203 (0.95-2 % (мае.) Рс1) при парциальном давлении водорода 1—
3 МПа и температуре 160-200 °С. Установлено, что реакция имеет второй порядок по водороду и ее кажущаяся энергия активации равна 56.8 кДж/моль [244]. Селективность образования циклогексанона повышается при использовании Р(1М£0, а также при введении щелочных или щелочноземельных добавок (Са, К, Се) в Рс1/А120з [245]. Палладиевый катализатор, нанесенный на прокаленные гидроталыдиты с мольным отношением М£/А1 = = 2-10 более активен, чем Рс1, нанесенный на А1203, Са0-А1203, 8Ю2 и М&0: конверсия фенола 40 %, селективность образования циклогексанона достигает 95 % [246].
Исследована также селективность нанесенных на уголь платиновых катализаторов с различными модифицирующими элементами при 200 °С и атмосферном давлении. Установлено, что входящий в сплав с Pt элемент оказывает существенное влияние на селективность: катализаторы Р^Сг/С и Р^У/С высокоселективны в образовании циклогексанона, а Р^2г/С - циклогексанола [247].
Гидрирование фенола в циклогексанон возможно и на мембранных катализаторах - фольге толщиной 100 мкм из бинарных сплавов Рс1 с Ни и КЬ. Наиболее активен сплав Рс1 с 9.8 % (мае.) Ки: при 147 °С конверсия фенола составляет 40 %. Для полного превращения фенола при 167 °С и нагрузке по фенолу 0.6 моль/(м2 ч) необходим большой избыток водорода - объемное соотношение Н2: фенол свыше 22. Отмечается, что на мембранных Рс1—Ии-катализаторах возможно получение циклогексанона с селективностью около 85 % при степени превращения фенола более 90 % [248].
Гидрирование фенола в циклогексанол протекает с селективностью 98-99 % при практически 100 % - й конверсии на №-Сг - катализаторе в паровой фазе при 130-150 °С и давлении 1.5—
2.5 МПа [249].
Фенольный метод получения капролактама через циклогексанол с последующим дегидрированием в циклогексанон сохраняет промышленное значение.
Аммонолизом фенола по процессу фирмы "На1соп" в присутствии катализаторов на основе А1203 в промышленности производится анилин [250]. Недостатки процесса по сравнению с более широко распространенным нитробензольным методом: более высокая стоимость сырья, повышенные энергозатраты. Однако процесс имеет и важные преимущества: значительно меньшие капитальные затраты и сравнительная экологическая чистота. При нитробензольном методе производства анилина существуют серьезные проблемы сточных вод, загрязненных биохимически неразрушаемым нитробензолом, и утилизации отработанной серной кислоты [251].
Анилин получают из фенола действием МН3 в паровой фазе в присутствии катализатора, полученного кальцинированием А1203 при 400-600 °С. Реакция проводится при 300-450 °С, давлении 0.7-2.8 МПа и объемной скорости 0.03-0.3 ч1 [252]. Процесс ам - монолиза возможен в кипящем слое катализатора - микросфе - ■ических частиц, представляющих собой оксиды А1 и Mg [253]. ' качестве катализатора могут использоваться смеси А1203-8Ю2 с содержанием 8Ю2 не более 20 % (мае.), модифицированные не более 0.5 % (мае.) оксида щелочного металла [254].
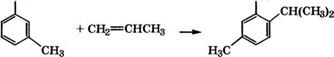
Алкилфенолы, получаемые в основном алкилированием фенолов олефинами, имеют важное практическое значение для производства поверхностно-активных веществ, присадок к топливам и маслам, пластмассам, каучуку, резине [210]. Для получения алкилфенолов алкилированием фенола олефинами раньше в промышленности в качестве катализатора применяли серную кислоту. Однако при этом образовывались нежелательные побочные продукты (алкилсульфоэфиры, фёнолсульфокислоты, сульфоны, кислые смолы), сточные воды, загрязненные фенолом. Более эффективные катализаторы алкилирования фенолов - арилсульфокислоты, у-А1203, цеолиты, ионообменные смолы.
Промышленное применение получил процесс алкилирования фенола высшими олефинами на катионите КУ-2 - сульфированном сополимере стирола с дивинилбензолом. Принципиальная технологическая схема процесса представлена в монографии [255]. Алкилирование фенола олефиновой фракцией 90-140 °С, полученной крекингом н-парафинов, проводится при 125-135 °С, объемной скорости 0.5 ч-1, мольном отношении фенол : олефи - ны =2:1. При этих условиях селективность образования моно - алкилфенолов составляет 82%, диалкилфенолов - 12% [256]. При алкилировании фенола линейными олефинами преобладают орто-производные, а разветвленные олефины направляются преимущественно в пара-положение. Диалкилпроизводных образуется больше при алкилировании линейными олефинами. Эти данные объясняются пространственными препятствиями.
Селективное орто-алкилирование фенола олефинами протекает при использовании в качестве катализатора у-А1203 [257]. Как следует из результатов алкилирования фенола на у-А1203 марки А-1 с удельной поверхностью 200 м2/г при оптимальных условиях (200 °С, объемная скорость 1 ч”1, мольное отношение фенол : олефин =1:1), для орто-алкилирования фенола необходимы ос-олефины (табл. 38) [258]. При других положениях двойной связи степень превращения олефинов резко снижается.
При повышении молярной массы алкилирующего агента выход о-алкилфенолов снижается при сохранении селективности их образования.
Селективное пара-алкилирование фенола осуществляется на деалюминированных цеолитах типа У с мольным отношением 8Ю2/А1203 = 5-100, модифицированных фтором (НЕ, СЕ3803Н), или на цеолитах типа (3 при 80-140 °С [259]. Так, при алкилировании фенола ноненом в мольном отношении 1.34 : 1 на цеолите типа У (8Ю2/А1203 = 46) в адиабатических условиях при 120 °С в первой секции реактора, давлении 0.8 МПа и объемной скорости
|
ТАБЛИЦА 38 Результаты алкилирования фенола олефинами [258]
|
Подачи реагентов 1 ч”1 степень превращения фенола составила 72 %, содержание монононилфенолов в реакционной массе 50 % (мае.) при массовом отношении о-/п - 9.4 и монононилфе - нолы/динонилфенолы 6.4.
Высокая селективность образования п-октил - и п-нонилфено- лов отмечается также на катализаторе, содержащем нанесенную гетерополикислоту Н481^12О40/8Ю2. /шра-Селективность составляет 90 %, а селективность по орто-производным - 10 %. Катализатор активен и стабилен [260].
Селективное бутилирование фенола в /гора-положение олефи- нами или спиртами с образованием п-трет-бутилфенола осуществляется в присутствии цеолитов типа г8М-12, (3 или МСМ-22 [261]. В качестве бутилирующего агента при реакции с фенолами может использоваться метил-трет-бутиловый эфир: селективность и распределение продуктов приблизительно такие же, как и при применении изобутилена, однако скорость реакции с эфиром меньше [262]. Алкилирование фенола трет-бутанолом на цеолите типа Н-(3 исследовано в работе [263]: изучено влияние температуры, объемной скорости подачи сырья, мольного соотношения реагентов и кислотности цеолита на степень конверсии и селективность образования продуктов.
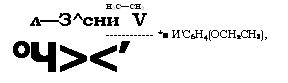
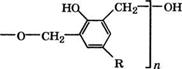
Взаимодействием алкилфенолов с этиленоксидом в присутствии щелочей или СН3(Жа получают оксиэтилированные ал - килфенолы, применяющиеся в качестве неионогенных ПАВ [264, 265]:
(П-1)СН2—СН2
ИСбЩОН + СН2—СН2 —► НС6Н40СН2СН20Н ------------------------------- —►
—► НС6Н4(ОСН2СН2)пОН
Алкилфенолы более реакционноспособны по отношению к оксиду этилена, чем спирты. Оксиэтилированные алкилфенолы - смесь олигомеров с распределением п, близким к пуассоновско - му, с примесями полиэтиленгликолей и катализатора. С повышением степени оксиэтилирования консистенция меняется от жидкой до пастообразной и воскообразной твердой. При п < 4 получают маслорастворимые ПАВ, при. п = 4-5 они дают эмульсии в воде, а при п > 5 становятся водорастворимыми [266].
В России наибольшее применение находят эмульгаторы ОП-4, ОП-7 и ОП-Ю - оксиэтилированные фенолы с К ~ С8 С10, различающиеся значениями п: 3-4, 7 и 10 соответственно. Применяется также смачиватель ДБ - [(СН3)3С]тС6Н5_т(ОСН2СН2)пОН, где т = 1-2, п = 6-7.
Оксиэтилированные алкилфенолы с неразветвленными алкильными радикалами относятся к полностью биоразлагаемым, а с разветвленными радикалами - к слаборазлагаемым с биораз - лагаемостью до 40 %.
В составе моющих средств могут использоваться и продукты взаимодействия алкилфенолов, например нонилфенола, со смесью пропиленоксид/этиленоксид в мольном отношении (5-15)/1 [267].
Оксиэтилированные алкилфенолы применяются в качестве смачивателей, антистатиков, солюбилизаторов, деэмульгаторов нефтяных эмульсий, диспергаторов кальциевых мыл, агентов для увеличения нефтеотдачи пластов, ингибиторов коррозии при обессоливании нефти, компонентов технических моющих и очищающих средств [265].
Оксиэтилированные алкилфенолы используются и для получения анионных ПАВ, например динатриевых солей моноэфира сульфоянтарной кислоты и полиоксиэтилированных алкилфенолов [268].
На основе алкилфенолов и оксиэтилированных спиртов производятся анионные ПАВ эфирокарбоксилатного типа ЩОСН2СН2)пО(СН2)тСООМе, где II - алифатически-ароматический радикал, содержащий не менее 8 углеродных атомов, п = 1-100, т = 1,2, Ме — щелочной или щелочноземельный металл, КН4, амин или этаноламин [269].
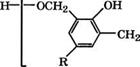 Алкилфенолы, особенно п-трет-бутил-, /1-амил-, /г-октилфе - нолы, при конденсации с избытком формальдегида в щелочной среде при 60-80 °С дают резольные (термореактивные) алкилфе - ноло-формальдегидные смолы с концевыми метилольными группами [221]:
Алкилфенолы, особенно п-трет-бутил-, /1-амил-, /г-октилфе - нолы, при конденсации с избытком формальдегида в щелочной среде при 60-80 °С дают резольные (термореактивные) алкилфе - ноло-формальдегидные смолы с концевыми метилольными группами [221]:
|
|
В кислой среде и при избытке алкилфенолов образуются но- волачные (термопластичные) смолы с концевыми фенольными ОН-группами.
Алкилфеноло-формальдегидные смолы применяются как пленкообразователи лакокрасочных материалов и в качестве основы клеевых композиций.
Взаимодействием алкилфенолов с молярной массой 200-800 с серой в присутствии водных растворов гидроксидов щелочных металлов при 145-175 °С получают алкилфенолсульфиды (на-
Пример, ДОДеЦИЛ еНОЛСуЛЬфИД), ИСПОЛ 3 tJMb. lt; дли 1фииооид1/1иы
Присадок к смазочным маслам [270].
На основе алкилфенолятов получают детергентно-диспер - гирующие присадки к моторным маслам. Объем производства алкилфенольных присадок только в России в 1998 г. составил 11 330 т. Алкилфенольные присадки первого поколения (ЦИАТИМ-339, ВНИИНП-360, БФК, ИХП-101, ВНИИНП-370) имели невысокую щелочность и проявляли недостаточный уровень нейтрализующих свойств. В настоящее время широко применяются сверхщелочные карбонатированные серосодержащие алкилфеноляты, представляющие собой коллоидные дисперсии карбоната Са, стабилизированные в углеводородной среде поверхностно-активным алкилтиофенолятом Са. Наиболее распространенная присадка - ВНИИНП-714 на основе изононилфено - лята Са, осерненного элементной серой. В результате последующей карбонатации щелочное число присадки 140-170 мг КОН/г. Производится она в ПО «Нафтан» (г. Новополоцк) и стоит дешевле алкилсалицилатных присадок.
В 1998 г. освоено также производство присадки В-7120, представляющей собой карбонатированный серосодержащий алкилфенолят Са со щелочным числом 207 мг КОН/г. Содержание металла в этой присадке значительно выше, чем в НП - 714 - 7.8 и 4.6 % (мае.) соответственно. Присадка В-7120 предназначена для моторных масел высоких серий и масел для судовых дизельных двигателей, работающих на высокосернистом топливе [271].
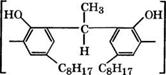
Конденсацией дисульфидов алкилфенолов или их олигомеров, выпускаемых отечественной промышленностью, с формальдегидом получают экстрагенты Рс1 и других элементов, нашедшие применение в технологии [272, 273]. Так, эффективный экстрагент Рс1 - смеси три-н-октиламина с олигомером октофор Юв [274]:
-СН2С ОН НО, сн2-
|
Н- |
Ці = С8Н17)’ (£ = С8Н17и
П-трет-Бутилфенол применяется для получения специальных лаковых смол и добавок к адгезивам на основе различных эластомеров [275]. При конденсации гс-алкилфенолов с ацетиленом в присутствии органических солей Zn или Сс1, например ацетата цинка, при 170-220 °С образуются полимерные продукты типа:
|
|
Которые также используются в качестве добавок к адгезивам на основе эластомеров. Конденсацией п-трет-бутилфенола с сульфидами Са или Ва получают присадки к маслам, а с ди - или монохлоридом серы - димерные и полимерные алкилфенольные сульфиды - ингибиторы коррозии и антиоксиданты.
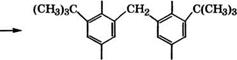
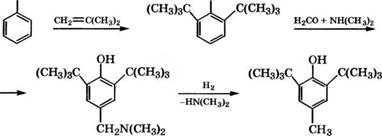
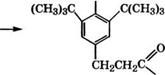
В качестве антиоксиданта широко применяется 2,6-ди-трет - бутил-4-метилфенол, выпускающийся под торговыми названиями ионол, агидол-1 и др. Ионол получают алкилированием л-кре - зола изобутиленом. Разработан также способ получения ионола из фенола [276]:
|
ОН ОН
|
Аминометилирование 2,6-ди-трет-бутилфенола проводится при 80-100 °С в растворе метанола, последняя стадия - гидроге - нолиз при 140-160 °С в присутствии сплава № с А1, Сг или Си в качестве катализатора. Выход ионола в расчете на фенол 70 %. Ионол используется как антиоксидант для синтетических кау - чуков, резины, пищевых жиров (разрешенные добавки - до 0.02 % (мае.)), витаминов, полиолефинов, поливинилхлорида и других пластмасс, реактивного топлива.
Окислением 2,6-ди-трет-бутилфенола, растворенного в вод - но-ацетонитрильном растворе НС104, действием Се(С104)4 в водной НС104 получают с выходом 95 % 3,3',5,5'-тетра-трет-бутил- 4,4'-дибензохинон [277]. Он используется как ингибитор в процессах окисления, акцептор водорода в процессах дегидрирования, как реагент, повышающий устойчивость каучуков к механической усталости, и как полупродукт при получении соответствующего бисфенола.
Алкилированием 2,6-ди-трет-бутилфенола метилакрилатом в присутствии щелочного катализатора (2,6-ди-трет-бутилфено- лята калия или натрия и соответствующего гидроксида щелочного металла) получают с выходом 95 % метиловый эфир 3-(4- гидрокси-3,5-ди-т/?ет-бутилфенил)пропионовой кислоты [278]:
|
ОН
|
|
ОН
|
ОСНз
Полученный эфир является основным полупродуктом в промышленном производстве фенольных термостабилизаторов полимерных материалов типа фенозан 23, фенозан 28.
Введение БН-группы в положение 4 2,6-ди-трет-бутилфе - нола увеличивает антиоксидантные свойства. Фармацевтической промышленностью производится антиатеросклеротический препарат пробукол - дитиокеталь ацетона с 2,6-ди-/тгрет-бутил-4- меркаптофенолом. Его получают взаимодействием 2,6-ди-трет - бутилфенола с 82С12, последующим восстановлением образующегося дитиопроизводного до меркаптана и конденсацией последнего с ацетоном в среде ледяной уксусной кислоты [279].
|
Их |
![]()
|
Кі |
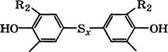
![]() При взаимодействии 2,6-диалкилфенолов с серой в присутствии щелочей получают 4,4’-тиобисфенолы [280]:
При взаимодействии 2,6-диалкилфенолов с серой в присутствии щелочей получают 4,4’-тиобисфенолы [280]:
Где Ид, 1?2 - алкилы С^-Сю, х - 1-4
Применение водных растворителей - спиртов с 10-50 % (мае.) воды позволяет получать продукт с высоким выходом и высокой степенью чистоты. 4,4'-Тиобисфенолы применяются как антиоксиданты или синергистические добавки к другим антиоксидантам.
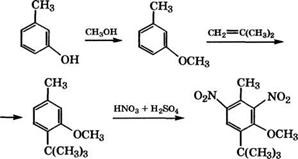
Метилирование фенола используется в промышленности для производства анизола, крезолов и ксиленолов. Коксохимическая
промышленность не удовлетворяет полностью потребности в крезол ах. о-Крезол и 2,6-ксиленол получают совместно метилированием фенола метанолом в присутствии у-А1203 [281]. Для сохранения активности катализатора и обеспечения высокой селективности образования целевых продуктов процесс проводят в паровой фазе при атмосферном давлении и мольном соотношении метанол : фенол = 0.6. При недостатке метанола снижается опасность образования полиметилфенолов, практически исключается разложение метанола. Температура процесса 280-330 °С, объемная скорость подачи сырья 0.8-1 ч”1. При этих условиях конверсия фенола 40 %, метанола 94 %, селективность образования о-крезола и 2,6-ксиленола составляет 66 и 19 % соответственно. При температуре ниже 280 °С снижается конверсия фенола и в основном образуется анизол, а свыше 360 °С снижается селективность орто-метилирования фенола. Недостатки промышленного процесса - невысокая степень конверсии фенола, низкая селективность образования наиболее дефицитного продукта - 2,6-ксиленола.
Разработаны варианты метилирования фенола на различных катализаторах с получением широкого ассортимента продуктов (табл. 39). Возможно преимущественное получение анизола (варианты 3 и 4), о-крезола и 2,6-ксиленола (вариант 2), смеси кре - золов с преобладанием о-изомера (вариант 6). В последнем варианте использовался фторированный А1203 марки И-62 производства ПО "Ангарскнефтеоргсинтез" с содержанием фтора 3,5 ± ±0.5 % (мае.) [282]. В этой же работе приведена принципиальная технологическая схема процесса метилирования фенола метанолом с получением о-крезола, смеси крезолов (трикрезола), ксиленолов.
Компания "General Electric" запатентовала цинксодержащий катализатор орто-алкилирования фенола. Так, при использовании катализатора, полученного при массовом соотношении ZnO :
: MgC03 = 1 : 90, содержании воды в исходной метанол-фенольной смеси 20 % (мае.), температуре 440 °С, давлении 0.18 МПа получен продукт следующего состава, % (мае.): фенол - 41.37, о-крезол - 50.82, 2,6-ксиленол - 6.31, 2,4,6-триметилфенол - 0.35 [283].
Японская компания "Asahi Chemical Industry" разработала технологию совместного получения о-крезола и 2,6-ксиленола метилированием фенола метанолом в кипящем слое катализатора [284]. Использован железованадиевый оксидный катализатор на кремнеземном носителе, легированном металлами. Кремнеземная подложка предотвращает истирание и выкрашивание катализатора. Степень чистоты получаемого о-крезола - 99.9 % (мае.), 2,6-ксиленола - 99.8 % (мае.).
|
Варианты метилирования фенола метанолом с целью получения о-крезола (I), 2,6-ксиленола (II), анизола (III) и дикрезола (IV)
|
Железованадиевый или Ее-У-Мп-катализатор, нанесенный на широкопористый силикагель, запатентован для получения
2,6- ксиленола Институтом катализа СО РАН [285]. Содержание активных компонентов в катализаторе не менее 30 % (мае.) при атомном соотношении Ее : V : Мп = (0.5-1): (1— 0.5): (0.05- 0.5), катализатор имеет крупные поры радиусом более 15 нм, удельный объем пор 0.5-1.5 см3/г.
Алкилированием фенола метанолом в присутствии воды в движущемся слое катализатора, полученного диспергированием в водно-щелочной среде суспензии М^О и промоторов в поли - этоксисилоксановом растворе, достигнута селективность образования 2,6-ксиленола 90.6 % при 100 % - й конверсии фенола [286].
Преимущественное получение 2,6-ксиленола обеспечивается и при метилировании фенола метанолом на катализаторе, содержащем оксиды в атомном соотношении Ее : : Со = 100 : 2.5 : 1.
Так, при 367 °С конверсия фенола составляет 97.7 %, выход о-крезола - 21.3 % , 2,6-ксиленола - 76.7 % [287].
Для повышения выхода продуктов и удлинения срока службы катализатора предложено промотировать у-А1203 оксидами ванадия и циркония в количестве 0.1-1.5 % (мае.) при их массовом соотношении 15 : 1. При 300 °С конверсия фенола 45.79 %, селективность по о-крезолу - 78.17 %, 2,6-ксиленолу - 19.95 %. Срок службы катализатора до регенерации - 2500 ч [288].
В Японии производится около 10 тыс. т/год синтетического
О-крезола, из которых 80 % идет на производство о-крезольных новолачных эпоксидных смол, а остальное количество - на получение слоистых пластиков. В США половину производимого о- крезола потребляет промышленность полупроводников, остальное - сельское хозяйство и химическая промышленность. В Европе 20 тыс. т/год о-крезола потребляется производством инсектицидов [284].
Сульфированием о-крезола концентрированной Н2804 с последующим нитрованием смеси полученных сульфокислот Н]ЧОз производится 4,6-динитро-о-крезол. Он применяется для получения инсектицидов и гербицидов [289].
Взаимодействием о-крезола с КаМ02 в среде трифторуксус - ной и ледяной уксусной кислот в присутствии ацетата меди при 5-10 °С может быть получен медный комплекс 2-метил-6-нитро - зофенола, последующим окислением которого получают 6-нит - ро-о-крезол, использующийся как инсектицид, а также как промежуточный продукт в производстве красителей [290].
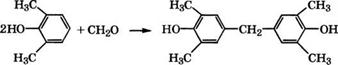
Конденсацией 2,6-ксиленола с формальдегидом в воднощелочной среде получают с выходом 98.5 % 4,4'-дигидрокси- 3,3’,5,5'-тетраметилдифенилметан, применяющийся в качестве полупродукта для синтеза поликарбонатных, полиэфирных или триазиновых смол [291]:
|
|
2,6- Ксиленол используется для производства полифенилен - эфирных смол, модифицированных стирольными полимерами, которые отличаются высокой теплостойкостью, негорючестью, улучшенными электроизоляционными свойствами, стабильностью. Эти смолы применяются в космической технике и автомобилестроении. Потребление модифицированных полифени - ленэфирных смол только в Японии составляет 80 тыс. т/год
[284].
Конденсацией о-крезола с формальдегидом в присутствии кислотных катализаторов получают бис[гидрокси(метил)фенил]ме - тан, каталитическим расщеплением которого при 270-350 °С в присутствии катализаторов Ni-Mo, Co-Mo, Ni-W, Co-W или их оксидов на А1203 или алюмосиликатах можно получать
2,4- ксиленол [292]. 2,4-Ксиленол используется для получения антиоксидантов и гербицидов.
Анизол - ценное сырье для получения метоксихлора [2,2,2-три- хлор-1,1-бис(/г-метоксифенил)этана] по реакции с хлоралем [293]:
2СН3ОС6Н5 + CClgCHO —► (СН3ОС6Н4)2СНСС13
Технический продукт содержит 12 % (мае.) о, п-изомера и является малотоксичным (для крыс ЛД50 6 г/кг ) и высокоэффективным аналогом ДДТ, эффективным при борьбе с колорадским жуком. Анизол применяется также в фармацевтической промышленности [294], в качестве растворителя, при синтезе красителей, термостойких анизоло-формальдегидных смол линейной структуры с температурой размягчения выше 270 °С [295], для производства душистых веществ - обепина, 4-ацетиланизола [296].
Ацилирующими агентами при получении 4-ацетиланизола могут служить: ацетилхлорид в присутствии катализатора ZnCl2/ цеолит H-Y, модифицированного микроволновым облучением (конверсия анизола 51 % и соотношение я/о-изомеров 94/6) [297]; уксусный ангидрид - реакция проводится в нитробензоле при использовании в качестве катализатора катионообменных мезопористых глин - Fe3+ и Zn2+-M0HTM0pnrLn0HHT0B [298]; уксусная кислота - на катализаторе H-ZSM-5 (Si/Al = 30) [299]. Однако в последнем случае селективность образования 4-ацетиланизола низка (0.5 %), в то же время селективность ацили - рования с участием пропионовой кислоты возрастает до 60 %, а при использовании масляной и высших кислот достигает 80 %.
4- Ацетиланизол (или n-метоксиацетофенон) имеет запах цветов гелиотропа или боярышника, применяется при составлении парфюмерных композиций и мыльных отдушек, в качестве заменителя более дорогих гелиотропина и анисового альдегида.
Анизол получают О-метилированием фенола. При использовании в качестве катализатора у-А1203, модифицированного КОН, мольном соотношении метанол : фенол = 3.1: 1, температуре 280 °С, бъемной скорости подачи сырья 0.7 ч”1 конверсия фенола составляет 55.4 %, селективность образования анизола - 88 % [296]. В той же работе приведена принципиальная технологическая схема получения анизола и его выделения, включающая пять ректификационных колонн.
Аналогичные показатели при О-метилировании фенола достигнуты при исползовании в качестве катализаторов и ортофосфатов редкоземельных элементов (La, Ce, Sm) или их смесей с Cs, щелочноземельными металлами: конверсия фенола 53 %, селективность образования анизола 89 % [300].
Более высокие конверсия фенола - 64.6 % и селективность по анизолу - 92.1 % достигаются при алкилировании метанолом на сульфатах Мп и К на у-А1203 (5.5 % (мае.) Мп, 3.9 % (мае.) К)
при 300 °С. Близкие результаты получены и при использовании катализатора К2804-КА1(804)2/у-А1203 [301].
Разработан новый метод селективного О-метилирования фенола и п-крезола с помощью диметилкарбоната и катализатора ПЭГ-1000, а также К2С03 в качестве основания. При атмосферном давлении и температуре 160-200 °С получают анизол или п-метиланизол соответственно с высоким выходом [302].
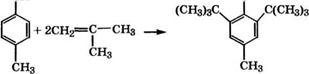
П-Крезол применяется для производства антиоксидантов. Алкилированием изобутиленом получают 2,6-ди-трет-бутил-4- метилфенол(ионол):
|
|
|
ОН |
|
ОН |
![]()
|
ОН |
![]()
|
СН2=С(СН3)2 |
![]()
|
СН3 |
![]()
![]()
|
ОН |
![]()
|
СН3 |
![]()
|
,С(СНз)з |
![]()
|
Сн2о -н2о |
![]()
|
ОН |
![]()
|
ОН |
![]()
|
СН3 |
![]()
|
СН3 |
![]()
|
Этот антиоксидант (торговое название в России агидол-2) применяется в качестве неокрашивающего стабилизатора для СК, резин, полиолефинов, ударопрочного полистирола, как ан - тиокислительная присадка к топливам и смазкам, добавка к пищевым продуктам и косметическим средствам. Получение его возможно также трансалкилированием п-крезола ионолом в присутствии сульфокатионитов, модифицированных солями Ее, Со или № при 85-100 °С [303], или в среде |
![ПРИМЕНЕНИЕ ФЕНОЛА подпись: этот антиоксидант (торговое название в россии агидол-2) применяется в качестве неокрашивающего стабилизатора для ск, резин, полиолефинов, ударопрочного полистирола, как ан- тиокислительная присадка к топливам и смазкам, добавка к пищевым продуктам и косметическим средствам.
получение его возможно также трансалкилированием п-крезола ионолом в присутствии сульфокатионитов, модифицированных солями ее, со или № при 85-100 °с [303], или в среде](/img/678/image149.gif) Алкилированием п-крезола изобутиленом и последующей конденсацией 2-трега-бутил-п-крезола с формальдегидом синтезируют другой антиоксидант - бис(2-гидрокси-5-метил-3-трет - бутилфенил)метан:
Алкилированием п-крезола изобутиленом и последующей конденсацией 2-трега-бутил-п-крезола с формальдегидом синтезируют другой антиоксидант - бис(2-гидрокси-5-метил-3-трет - бутилфенил)метан:
Водно-углеводородной эмульсии с использованием 15-20%-го водного раствора формальдегида и Н2804 в количестве 0.5-1 % (мае.) [304].
Взаимодействием п-крезола в расплаве с С12 или 802С12 в присутствии кислот Льюиса (ЕеС13, А1С13) и небольших количеств дифенилсульфида получают 2-хлор-4-метилфенол [305], применяющийся в синтезе средств защиты растений и лекарственных препаратов.
Этерификацией п-крезола уксусным ангидридом в присутствии кислотных катализаторов, окислением полученного полупродукта кислородсодержащим газом в уксуснокислой среде при 100-110 °С в присутствии солей Со, Zr и бромидов К или Ка с последующим гидролизом возможно получение п-оксибензойной кислоты [306]. п-Оксибензойная кислота применяется в производстве З-нитро-4-оксибензойной и 4-метоксибензойной кислот, красителей, фармацевтических препаратов, пестицидов, жидкокристаллических соединений.
Окислением п-крезола воздухом в метанольном растворе в присутствии соединений переходных металлов (например, тет- раарилпорфирина железа) и гидроксидов щелочных металлов можно получать 4-оксибензальдегид [307], который используется для производства противоореольных красителей в фотографии.
Ж-Крезол применяется для получения 2-изопропил-5-метил- фенола (тимола):
|
|
|
ОН |
|
ОН |
|
137 |
![]() Алкилирование ж-крезола пропиленом проводится при 360- 365 °С и 4.8-5 МПа в присутствии активированного А1(ОН)3. Тимол используется как антисептик и противоглистное средство, для синтеза индикаторов (тимолфталеина, тимолового синего). Гидрированием тимола в присутствии П получают ментол:
Алкилирование ж-крезола пропиленом проводится при 360- 365 °С и 4.8-5 МПа в присутствии активированного А1(ОН)3. Тимол используется как антисептик и противоглистное средство, для синтеза индикаторов (тимолфталеина, тимолового синего). Гидрированием тимола в присутствии П получают ментол:
|
|
|
ОН |
|
ОН |
10-.1284
Ментол - душистое вещество с запахом мяты, применяющееся в парфюмерной, пищевой, кондитерской, ликероводочной и табачной промышленности, компонент лекарственных средств (валидола, бороментола).
Лг-Крезол используется также для получения амбрового мускуса - 2,6-динитро-3-метокси-4-трет-бутилтолуола [308]:
|
|
Амбровый мускус - душистое вещество, применяющееся в парфюмерии.
Смесь всех изомеров крезола (трикрезол) применяется для производства крезоло-формальдегидных смол, более эластичных, чем смолы феноло-формальдегидные или полученные на основе отдельных изомеров, пригодных для получения лаков [282]. Трикрезол в смеси с фенолом применяется также в качестве экстрагента в дуосол-процессе для селективной очистки смазочных масел от смол и полициклоаренов.
Смесь м - и п-крезола (дикрезол) используется для производства трикрезилфосфата, применяющегося в качестве пластификатора полимерных материалов, экстрагента металлов, в производстве электроизоляционных материалов [282].
Из каменноугольной смолы получают техническую смесь ксиленолов трех марок: А - с содержанием 2,4-ксиленола не менее 40 % (мае.), Б - с содержанием 3,5-ксиленола 65-75 % (мае.) и В - с содержанием 3,5-ксиленола не менее 30 % (мае.) [309]. Ксиленолы применяют в производстве электроизоляционных материалов, огнестойкого турбинного масла, лаков, пластмасс, присадок к нефтепродуктам, пестицидов.
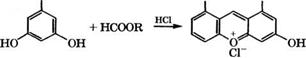
3,5- Ксиленол производится из изофорона, получаемого в свою очередь тримеризацией ацетона в присутствии оснований, сопровождающейся внутримолекулярной кротоновой конденсацией:
![]()
|
-сн4 СНз Н3С сн3 |
![]() 3(СНз)2С=0
3(СНз)2С=0
Получение 3,5-ксиленола проводится контактированием изо - форона с водяным паром при 550 °С в присутствии 8Ю2 с нанесенным на поверхность катализатора оксидом железа [310].
Метилированием 3,5-ксиленола метанолом в присутствии у-А1203 при 260-330 °С можно получать 2,3,5-триметилфенол и в качестве побочного продукта - 2,3,5,6-тетраметилфенол [311-313]. Последовательным окислением и восстановлением 2,3,5-триметил - фенола получается 2,3,5-триметил-/г-гидрохинон, конденсацией которого с изофитолом или фитолом производится витамин Е.
2.3.5.6- Тетраметилфенол может быть использован как антиоксидант.
2,3,5- Триметил-/г-гидрохинон можно получать также из
2.3.6- триметилфенола, синтезируемого алкилированием ж-кре - зола метанолом в присутствии А1203, оксидов Се и Мп или Ее-У - бронзы на носителе. Однако выход 2,3,6-триметилфенола ниже, чем 2,3,5-триметилфенола из 3,5-ксиленола.
Окислением 3,5-ксиленола водным раствором Се(СЮ4)4, содержащим НС104, в органическом растворителе (двухфазной системе) получен 2,6-диметил-тг-бензохинон с выходом 70-93 % [314], использующийся в синтезе лекарств и химикатов для сельского хозяйства.
Нитрозированием фенола и его гомологов нитритом натрия в присутствии серной кислоты [315] или трифторуксусной и ледяной уксусной кислоты, а также моногидрата ацетата меди [290] при 0-10 °С получают п-нитрозопроизводные фенола. Нитрози - рование фенола можно проводить в водной среде сжиженным азотистым ангидридом в присутствии катализатора - ?Ш4С1 или соляной кислоты [316]. Окислением нитрозофенолов азотной кислотой при 10-25 °С получают нитрофенолы. Так, при окислении /г-нитрозофенола без предварительного выделения его из реакционной смеси 87 % -й НЖ)3 получают гс-нитрофенол с выходом 92 % на исходный фенол [ЗГ5].
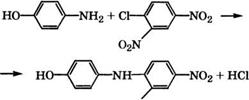
Гидрированием нитрофенолов в присутствии катализаторов, например Рс1/С, получают соответствующие аминофенолы [317]. Аминофенолы применяются в производстве красителей, лекарств, проявителей.
Так, из /г-аминофенола и 2,4-динитрохлорбензола получают краситель дисперсный желтый прочный 2К [318]:
|
|
/г-Аминофенол получают также из нитробензола - восстановлением цинковым порошком в водном растворе МН4С1 [319], каталитическим гидрированием в присутствии Р1;/С [320]:
О1-м°2 + 2Н2 —► НО-^0>-КН2 + Н20
В качестве носителя могут использоваться также цеолит гБМ-5, 8Ю2, А1203[321].
В НИОПиК разработан непрерывный процесс производства /г-аминофенола из нитробензола с выходом 40-45 % [322]. Реакционная смесь отводится из реактора в сепарационное устройство, позволяющее полностью отделить катализатор, который может работать без регенерации 40 ч.
Очистка /г-аминофенола, полученного гидрированием нитробензола, от канцерогенной примеси - 4,4'-диамино дифенил ового эфира, а также от о-аминофенола возможна двухступенчатой экстракцией: сначала примеси экстрагируют анилином, а /г-ами - нофенол остается в водной фазе, затем на второй стадии примесь анилина из водно-аминофенольной фазы экстрагируют толуолом [323]. Водную фазу можно без выделения /г-аминофенола ацети - лировать с получением 1Ч-ацетил-/г-аминофенола - полупродукта синтеза лекарственных препаратов.
С более высоким выходом /г-аминофенол получают омылением /г-нитрохлорбензола раствором щелочи с последующим восстановлением нитрогруппы На28.
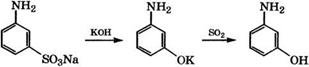
Ж-Аминофенол получают взаимодействием резорцина с 1ЧН3 [324, 325] или плавлением Ма-соли метаниловой кислоты с КОН при 250 °С:
|
|
О-Аминофенол производится омылением о-нитрохлорбензола раствором КаОН с последующим восстановлением о-нитрофено - ла водородом в присутствии №-Сг-катализатора.
/г-Аминофенол и его производные - метол (]Ч-метил-/г-амино - фенолсульфат), /г-оксифениламиноуксусная кислота, амидол (ди - гидрохлорид 2,4-диаминофенола), а также о-аминофенол применяются в качестве проявителей в фотографии.
Окислением /г-аминофенола эфирным раствором Ag20 получают гс-хинонимин:
|
ОН О
]ЧН2 |
Хинонимины являются основой хинониминовых красителей, применяющихся для крашения бумаги, в полиграфии, лакокрасочном производстве, фотографии.
Непосредственным окислением /г-аминофенола и ж-аминофе - нола на окрашиваемом материале получают оксидационные красители - соответственно коричневый для меха А и коричневый для меха [326].
Взаимодействием о-аминофенола с муравьиной кислотой или ее гомологами синтезируют бензоксазол и его производные, применяющиеся для производства цианиновых красителей [327]:
|
|
Конденсацией /г-аминофенола с анилином при 170-200 °С в присутствии ]ЧН4С1 получают 4-оксидифениламин - антиоксидант для бензина и трансформаторного масла:
|
|
При взаимодействии ж-аминофенола с гидрохлоридом анилина получается 3-оксидифениламин, применяющийся для производства азо - и оксазиновых красителей.
Взаимодействием /г-аминофенола с НС1 в смеси растворителей уксусная кислота - НС1 - вода получают тетрахлор-1,4-бен- зохинон с выходом 96.6 %, применяющийся для производства фунгицидов [328].
Из лг-аминофенола по реакции Кольбе — Шмитта действием С02 в присутствии ИаНСОз при 100 °С синтезируют гс-аминоса - лициловую кислоту (ПАСК), использующуюся в качестве противотуберкулезного средства [329]:
|
СООН |
Карбоксилированием фенолята натрия по реакции Кольбе - Шмитта: действием С02 при 185 °С и давлении 0.6 МПа - производится салициловая кислота [318]. При использовании фенолята калия в этой реакции в качестве активного продукта при 220 °С получается n-оксибензойная кислота (выход 80 %).
Лг-Оксибензойную кислоту получают одним из следующих методов: щелочным плавлением Na-соли 3-карбоксибензолсуль - фокислоты при 210—220 °С; окислением 3-гидроксибензальдегида кислородом воздуха; гидрированием эфиров 3-нитробензойной кислоты в присутствии Ni Ренея с последующим диазотированием эфира аминокислоты и разложением соли диазония при 100 °С разбавленной H2S04.
Наибольшее применение среди оксибензойных кислот находит салициловая кислота. Она является хорошим антисептиком, входит в состав мазей, паст, присыпок, растворов для лечения кожных заболеваний (так, "салициловый спирт" - в действительности этанольный раствор салициловой кислоты).
Производство салициловой кислоты в России осуществляется в ОАО "Полифарм" (г. Челябинск) и на Краснозаводском химическом заводе в Московской области [330].
Взаимодействием салициловой кислоты с фенолом и РОС13 получают салол (фенилсалицилат), также использующийся в качестве антисептика:
|
|
Метилсалицилат, бензилсалицилат используются в производстве душистых веществ.
Взаимодействием салициловой кислоты с ацетилхлоридом получают аспирин (ацетилсалициловую кислоту):
|
|
||
|
|
||
|
|||
![]()
![]()
Ацетилсалициловая кислота в России производится в ЗАО "Медисорб" (г. Пермь) и ЗАО "Алтайвитамины" (г. Бийск) [330].
Жаропонижающими, противовоспалительными и болеутоляющими средствами являются также салицилат натрия и са - лициламид.
Взаимодействием салициловой кислоты с анилином в присутствии РС13 получают салициланилид:
|
|
Салициланилид применяется как фунгицид для неметаллических материалов и в качестве антисептика в производстве пленочных материалов и искусственной кожи.
Фирма «Rhodia Chimie» запатентовала способ получения 5-аминосалициловой кислоты, применяемой в фармацевтике, ^гидрированием 5-нитросалициловой кислоты в среде соляной и..уксусной кислот в присутствии катализатора - Pd или Pt (1 %) на активированном угле. Реакцию ведут при 30 °С и давлении Н2
0. 3 МПа до прекращения поглощения Н2. Выход 5-аминосалициловой кислоты, осажденной раствором аммиака, составляет 92 % [331].
Сульфированием салициловой кислоты олеумом или концентрированной H2S04 получают сульфосалициловую кислоту (2-гид - рокси-5-сульфобензойную кислоту) [332]:
|
|
|
ОН |
|
ОН |
|
S020H |
Сульфосалициловая кислота применяется в аналитической химии, обладает, как и ее соли, антисептическим действием.
Алкилированием алкилсалицилатов поли-а-олефинами, например метилсалицилата димером 1-децена в 1,2-дихлорэтане в присутствии катализатора 8пС14, предложено получать дизельные смазочные детергенты [333].
Салициловый альдегид получают по способу Рашига из о-кре - зола через карбонаты или фосфаты с последующим их гидролизом, например [334]:
/СН3 / СНС12 /СН0
У - ОН + СОС12 (/ т—О—) СО
2^ ОН+СОС12 —► Уу /°~кС0 ~
Другой промышленный способ получения салицилового альдегида основан на использовании реакции Раймера - Тимана - формилировании фенола при нагревании с хлороформом и щелочью [335]:
ОН ОН ОН
|
+ СНС13 60~70°с-» Г 1 |
![]() ,СНО
,СНО
Возможно получение салицилового альдегида из фенола и по реакции Даффа - действием уротропина и Н3В03:
ОН ОН
, N4(ch2)c JyCH°
И НзВОз^
Салициловый альдегид получается также при электрохимическом восстановлении салициловой кислоты.
Конденсацией салицилового альдегида с уксусным ангидридом в присутствии ацетата Na в промышленности производится кумарин:
|
А |
Сно сн3—С ^
+ О - i---- ► L I 1 + CH3COOH + н2о
Он сн3-с( 4‘"VS>
О
Кумарин применяется как душистое вещество в парфюмерной и табачной промышленности, а также в качестве добавки к электролиту при никелировании.
Салициловый альдегид используется также для производства инсектицида - диоксокарба, как промежуточный продукт в синтезе красителей, в парфюмерии.
Окисление салицилового альдегида по реакции Дейкина пероксидом водорода в щелочной среде приводит к образованию
Пирокатехина, а в нейтральных условиях получается салициловая кислота.
При циклизации оксимсульфата салицилового альдегида образуется бензизоксазол:
(Ш + ^ .ОН * _
НзЫОвОз г «Г ЫаНС03
|
|
На2804, (С2Н5)20 Ц. X.
СНО СН=М)803
При взаимодействии фенолят-аниона салицилового альдегида с солью винилфосфония образуется илид и далее после внутримолекулярной конденсации Виттига - хромен [336]:
|
ОН CH2=CH—PPh3 |
![]()
![]() CCu. - 00
CCu. - 00
СНО ^ СНО PPh3
Алкилсалицилальдоксимы предложено использовать в качестве экстрагентов для цветных, редких и тяжелых металлов [337], в частности для эффективного извлечения меди из кислых водных растворов [338].
Взаимодействием фенолята натрия с хлорбензолом в присутствии Си получают дифенилоксид. Дифенилоксид выделяют также из поглотительной фракции каменноугольной смолы двухстадийной ректификацией с последующей кристаллизацией [309]. Как побочный продукт он образуется в производстве фенола гидролизом хлорбензола.
Компания "The Dow Chemical" запатентовала способ получения дифениловых эфиров дегидратацией фенолов в присутствии деалюминированных цеолитов типа Р, L или морденита. Так, при газофазной дегидратации фенола при 300 °С над морденитом (Si02/Al203== 113) при конверсии фенола 32.9% селективность образования дифенилоксида составляет 84.9 % [339].
Компания "UOP" также запатентовала способ получения диа - риловых эфиров дегидратацией фенола или крезолов при 420- 480 °С с использованием катализатора, содержащего частично восстановленный W03, нанесенный на огнеупорный неорганический оксид (А1203, ТЮ2, Zr02) [340].
Дифенилоксид в России производится в ОАО "Аромасинтез" (г. Калуга) [330].
Смесь 73.5 % (мае.) дифенилоксида и 26.5 % (мае.) бифенила применяется в качестве высокотемпературного теплоносителя под названием дифениловая смесь или даутерм А [341]. Реже как высокотемпературный теплоноситель используется даутерм В - смесь дифенилоксида и нафталина.
Дифенилоксид применяется также как душистое вещество для ароматизации мыла и моющих средств.
Бромированием дифенилоксида избытком Вг2 в присутствии А1Вг3 в галогеналкане (дибромпропане, хлороформе или СС14) при 50-60 °С получают декабромдифениловый эфир - антипире- новую добавку к полимерам, изоляционным материалам [342]. Полибромпроизводные дифенилоксида со средним числом бро - мирования 7—7.8 можно получать многоступенчатым способом с использованием на начальной стадии гг-катализатора и на стадии окончательного бромирования - Ее-катализатора [343].
Региоселективным нитрованием дифенилоксида при 15°С действием концентрированной Н1ЧОй и Н2804 или СЕ3803Н получают преимущественно 4,4’-динитродифенилоксид [344]. Аналогично могут быть получены и другие пара-производные 02КФХФ1Ч02, где Ф = С6Н4, X = 0С(0)0, С(СН3)2, С(СЕ3)2, 802, в, СО, СН2, СНК, СИ2. Полученные соединения используются как промежуточные продукты для синтеза конденсационных полимеров - полиамидов, полиимидов, полиамидоимидов.
Каталитической изомеризацией дифенилоксида при 200 °С в присутствии Ма можно получать фенилфенолы, применяющиеся в качестве антисептиков и при синтезе неионогенных ПАВ [210].
Взаимодействием алкилфенолов с МН3 в присутствии аналогичного замещенного циклогексанона и катализатора, например Рс1/С, при 150-300 °С можно получать симметрично замещенные диалкилпроизводные дифениламина. Так, из 4-нонилфенола получается 4,4’-динонилдифениламин, применяющийся в качестве антиоксиданта [345].
Конденсацией фенола с формальдегидом при 50-90 °С в присутствии хелатообразующей смолы фосфорного типа, например содержащей остатки РО(ОН)2, получают смесь дигидроксидифе - нилметанов с соотношением изомеров, % (мае.): 2,2'-, 2,4'- и 4,4'- соответственно 15.6, 46.9 и 37.5 [346]. Полученная смесь может быть использована для производства эпоксидных смол.
Взаимодействием фенола с 1,5-диалкил-1,4-циклогексадиеном в кислой среде могут быть получены 1,3-бис(4-оксифенил)-1,3-ди- алкилциклогексаны - сырье для получения поликарбонатов с высокой температурой стеклования (10-45 °С), оптически прозрачные, с высокой пластичностью, превосходящие по свойствам поликарбонаты из бисфенола А [347].
Конденсацией фенола с гексафторацетоном получают гек - сафтордифенилолпропан (бисфенол Б), используемый в синтезе поликарбонатов, политиокарбонатов и полиарилатов. Присутствие атомов фтора способствует улучшению механических свойств полимеров, фторсодержащие полиарилаты не поддерживают го-
Рения. С эпихлоргидрином гексафтордифенилолпропан образует диэфир: 😕
№
Но—С-^^—ОН + 2С1СН2—сн—сн2 С¥3 О
|
С(СР3)2 + 2НС1 |
![]()
|
/ О |
![]() Н2с^снсн2о—^^—
Н2с^снсн2о—^^—
Полученный диэфир и гексафтордифенилолпропан используются в качестве агентов вулканизации фторкаучуков, обеспечивающих получение резин с высокой твердостью и хорошей адгезией к металлам.
Взаимодействием фенола с ацетиленовыми производными формулы ХС6Н4УС6Н4С=СРЬ (X = Р, С1, N0,; У = СО, 802, С(СГ3)2) предложено получать реакционноспособные олигомеры с концевыми фенилэтинильными группами, которые могут использоваться как композитные связующие и адгезивы [348].
Взаимодействием одноатомных или полифенолов с арен- сульфонилхлоридами получают ариларенсульфонатные эфиры [349]:
Реакцию проводят в присутствии катализатора - 4-(диметил-.
Амино)пиридина. Получен также ряд дисульфонатных производных типа: 1
Полученные ариларенсульфонатные эфиры проявляют хорошую стабильность в нейтральной или кислой среде при температуре 225-300 °С (в то время как сложные эфиры пентаэритрита или карбоксилатные сложные эфиры стабильны лишь до 200- 235 °С) и могут применяться в качестве смазочных масел, например, в авиационных двигателях.
Сульфированием фенола с последующим нитрованием п-фе - нолсульфокислоты получают пикриновую кислоту (2,4,6-три-
нитрофенол) [350]. Пикриновая кислота применялась ранее как бризантное взрывчатое вещество для снаряжения боеприпасов, однако вследствие склонности к образованию высокочувствительных к удару пикратов металлов она была вытеснена другими взрывчатыми веществами. При окислении пикриновой кислоты гипохлоритами в присутствии воды образуется хлорпикрин (три - хлорнитрометан). При восстановлении пикриновой кислоты, например, КаНв получается пикраминовая кислота (2-амино-
4,6- динитрофенол). Хлорпикрин и пикраминовая кислота применяются при синтезе красителей.
В России пикраминовая кислота производится в ОАО "Бера - тон” (г. Березники Пермской обл.) [330].
Взаимодействием фенола с серной кислотой в среде мезити - лена в присутствии ароматической полисульфокислоты при температуре 120 °С и выше получают 4,4'-дигидроксидифенилсуль - фон (бисфенол в), использующийся для получения теплостойких полимеров и искусственных волокон [351].
Аминометилирование фенолов осуществляется действием формальдегида и солей аммония в водной среде. Так, при взаимодействии фенола с 37%-м раствором формалина и 40%-м раствором 1ЧН4С1 при 60 °С получается НС1 • Н21ЧСН2С6Н4ОН с выходом 82 % [352]. Аминометилированные фенолы используются как отвердители эпоксидных смол и как промежуточные продукты органического синтеза.
Стерлитамакский нефтехимический завод запатентовал способ получения 2-(К,1М-диметиламинометил)фенола взаимодействием фенола с формальдегидом и бис(1Ч,]ЧГ-диметиламино)мета - ном в среде алифатических спиртов С^—С4 при 65-130 °С. Полученное фенольное основание Манниха может применяться в качестве отвердителя эпоксидных смол, а также в синтезе стабилизаторов и присадок к полимерным материалам и нефтепродуктам [353].
Компания "Техасо СЬегтсаГ' запатентовала способ получения феноксиэтанаминов реакцией фенолов с 2-К-оксазол-2-ином (И = Н или алкил С]-С18) с последующим гидролизом образующегося амида водой в присутствии Н3Р04. Феноксиэтанамины получаются с выходом 98 % и выше и не требуют очистки при использовании в термореактивных смолах, получении лекарственных средств и ПАВ [354].
Пиролизом фенола, дифенилоксида или о-фенилфенола над оксидами металлов получают дибензофуран [355, с. 167-170]. Производные дибензофурана обладают анестезирующей, бактерицидной и противовирусной активностью.
Конденсацией фенола с о-крезолом в присутствии А1С13 синтезируют дибензопиран (или ксантен). Пиролизом салициловой кислоты, ее ацетата или ариловых эфиров получают 9-ксантон:
|
О
|
Из флороглюцина синтезируют соли ксантилия [355, с. 36-
38]:
|
ОН ОН ОН
|
Соли ксантилия и 9-ксантон применяются в синтезе ксанте - новых красителей, лекарственных средств.
Совместным окислением фенола с п-арилендиамином или л-аминофенола с ариламином К2Сг207 или КаСЮ получают ин - доанилины [356]:
|
|
Индоанилины можно получать также нитрозным способом - взаимодействием п-нитрозоариламина с фенолом или п-нитро - зофенола с ариламином. Индоанилины широко используются для получения сернистых красителей присоединением группы БН с последующей окислительной циклизацией при 100-120 °С в водном растворе Ка2в:
|
Н I
|
Индоанилины применяются также для производства оксази-. новых и тиазиновых красителей.
Взаимодействием фенола с оксидом этилена при 220-250 °С в присутствии щелочных катализаторов [357] или с этиленглико - лем [358] получают монофениловый эфир этиленгликоля, применяющийся как растворитель ацетатов целлюлозы, природных и синтетических смол, в синтезе пластификаторов и как компонент медицинских мазей и косметических кремов.
Этерификацией РОС13 смесью фенола с ксиленолами предложено получать огнестойкие жидкости [359].
Бромированием фенола действием Н202 на бромистые соли металлов в растворе H2S04, при котором происходит одновременно генерация брома и регенерация НВг, предложено получать 2,4,6-трибромфенол, применяющийся для производства антипиренов [360].
Взаимодействием фенолята натрия с карбамидом при 100- 180 °С получают фенилкарбамат с выходом 73.3 % [361].
Сульфированием фенола моногидратом H2S04 при температуре до 100 °С получают смесь фенол-2- и фенол-4-сульфокислот в соотношении 2:3. Сульфирование фенола концентрированной H2S04 при 110 °С приводит к образованию фенол-4-сульфокисло - ты с выходом 95 %, а при взаимодействии фенола с олеумом - фенол-2,4-ди - и фенол-2,4,6-трисульфокислоты [362].
Фенолсульфокислоты - промежуточные продукты в производстве красителей, резиновых клеев, лекарственных средств. Нитрование фенол-4-сульфокислоты смесью HN03 и H2S04 при
5- 8 °С приводит к 4-гидрокси-2-нитробензолсульфокислоте, нитрование в более жестких условиях - к 2,6-динитрофенолу.

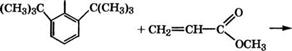


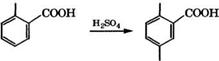
 Опубликовано в
Опубликовано в