ОБЩИЕ СВЕДЕНИЯ О ПРОЦЕССЕ ЭЛЕКТРОЛИЗА И ЕГО ПРИМЕНЕНИИ ДЛЯ МИКРОДОЗИРОВАНИЯ ЖИДКОСТЕЙ
 7 октября, 2014
7 октября, 2014  Oleg Maloletnikov
Oleg Maloletnikov |
Рис. 25. |
Процесс электролиза воды является наиболее, простым методом получения водорода и кислорода. Разложение воды электрическим током на водород и кислород впервые было осуществлено в 1789 г [Л. 24]. Однако практическое значение электролиза воды начинает приобретать только после изобретения в 1870 г. динамомашины. В 1888 г. Д. А. Лачинов сконструировал первый аппарат для электролитического. получения водорода и кислорода. В своих работах Д. А. Лачинов изложил методику получения водорода и кислорода не только при нормальном, но и при повышенном - давлении.
Анализ возможности применения кислорода и водорода для микродозирования жидкостей требует изучения их физико-химических свойств.
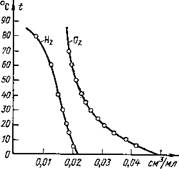
В воде и в других растворителях водород растворяется в очень незначительном количестве. Растворимость водорода и кислорода в воде в зависимости от температуры пока - что кислород в воде растворяет-
зана на рис. 25, из которого видно, ся незначительно.
В обычных условиях молекулярный водород в химическом отношении малоактивен і[Л. 27—29]. Реакция водорода с кислородом при температуре ниже 700°С происходит весьма медленно и чем ниже температура, тем медленнее идет реакция. Вычислено, что при обыкновенной комнатной температуре требуется около 106* 109 лег, чтобы 15 см3 смеси водорода и кислорода превратились в воду. Это свойство смеси газов электролиза воды позволяет непосредственно применять их для микродозирования жидкостей [Л. 30].
Для нормального протекания электролиза воды немаловажную роль играет также выбор электролита.
Известно, что дистиллированная вода имеет. электрическую проводимость от 1-Ю-6 до 4-Ю-8 Ом-1 • см-1, т. е. 1 мм3 такой воды обладает сопротивлением, равным сопротивлению медной проволоки сечением 1,0 мм# и длиной 200—400 тыс. км |[Л. 25]. Вследствие такой малой электрической проводимости чистая вода непригодна для процесса электролиза Но вода, подкисленная или содержащая растворенные соли или гидроокиси щелочных металлов, хорошо проводит ток.
В современной практике электролиза воды в качестве электролита применяют исключительно растворы едкого калия или натрия, так как кислые электролиты вызывают сильную коррозию аппаратуры. Выбор щелочи зависит от условия работы микродозатора.
Обычно, когда электролиз ведут при более низких температурах, применяют едкий калий, так как в этих условиях он имеет
большую электрическую проводимость, чем едкий натрий. При ВЫСОКИХ температурах едкий калий вызывает сильную коррозию аппаратуры, и стоимость его выше, чем стоимость едкого натрия. Поэтому при высокой температуре в процессе электролиза применяют едкий натрий.
|
Таблица 1 Удельное электролитическое сопротивление водных растворов щелочей (Ом-см) для массовой концентрации NaOH и КОН
|
|
Примечание: В числителе—параметры для NaOH, в знаменателе—для КОН. |
Для уменьшения потери напряжения в электролите немаловажную роль играет также выбор концентрации раствора, обладающего минимальным сопротивлением.
Известно, что удельное сопротивление водных растворов едких щелочей зависит от концентрации электролита и температуры электролиза.
іКак видно из данных табл. 1 [Л. 25], с повышением температуры значение минимального удельного электролитического сопротивления перемещается в сторону более концентрированных растворов. Следовательно, концентрацию раствора, обладающего минимальным сопротивлением, необходимо выбирать в соответствии с предполагаемой температурой процесса электролиза.
Свойства растворов едкого калия и едкого натрия, а также низкие пределы температур (25—30°С) протекания электролиза обусловили применение в микродозаторе в качестве электролита 30,0%- ного раствора едкого калия с удельным электрическим сопротивлением 1,042 Ом-см.
На нормальное протекание процесса электролиза боДы - cytuecf - венно влияют следующие факторы: перенапряжение водорода и
кислорода, плотность тока, газонаполнение электролита, расход энергии.
Перенапряжение газов (разность между равновесным и наблюдаемым потенциалом разряда иона) электролиза не является постоянным, а зависит от температуры электролита, материала электрода, времени электролиза. При оценке перенапряжения водорода и кислорода приходится пользоваться опытными данными. Но и они дают лишь приблизительную оценку перенапряжения.
|
Концентрация щелочи, % Рис. 26. |
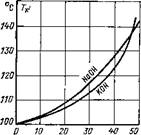
На. перенапряжение влияет не только материал, но также и состояние поверхности электрода. На шероховатых поверхностях перенапряжения меньше, чем на гладких и блестящих. Это объясняется тем, что действительная рабочая поверхность шероховатых электродов значительно больше, чем геометрическая, вследствие чего на шероховатых поверхностях плотность тока, приходящегося на единицу (площади электрода, меньше, чем на гладких. Снизить перенапряжение можно уменьшением плотности тока, выбором материала электрода й повышением температуры электролита. Однако повышение температуры электролита при нормальном атмосферном давлении ограничено температурой кипения Тк электролита и усиливающейся» коррозией железных частей электролизера (рис. 26) [Л. 25]. Выбор материала электрода ограничивается его экономической доступностью. Учитывая это, в качестве материала для электрода и корпуса электролизера авторами выбрана сталь марки Х18Н9Т.
Плотность тока является одним из основных факторов, влияющих на рациональное и нормальное протекание процесса электролиза. Она должна находиться в пределах от 200 до 300 А/м2|[Л. 24].
В зависимости от конструктивных размеров электрода и величины микродозирования жидкости в разработанном автором микродозаторе расчетная плотность тока изменяется в пределах 20— 30 мА/см2.
Газонаполнение электролита определяется отношением объема газовых пузырьков к общему объему (в процентах) электролита (жи д кость + газ) в процентах 1[Л. 24]. При большой плотности тока электролит при электролизе наполнен поднимающимися пузырьками газов, которые уменьшают свободное сечение электролита. Газонаполнение зависит от плотности тока, температуры электролита, его вязкости, размеров газовых пузырьков, конструкции электролизера и определяется опытным путем. Уменьшение газонаполнения путем увеличения расстояния между электродами и снижения плотности тока нецелесообразно, так как увеличение омического сопротивления электролита соответственно увеличивает расход электроэнергии и снижает производительность электролизеров.
Газонаполнение надо уменьшать, строго придерживаясь расчетной плотности тока, подбором формы электродов и удалением газовых пузырьков в направлении движения тока. Кроме того, при
меняют некоторые добавки к электролиту, например тонкий порошок графита, в присутствии которого мелкие пузырьки газа соединяются в более крупные и быстрее удаляются из электролита.
На расход электроэнергии весьма существенное влияние оказывает перенапряжение газов на электроде, газонаполнение электролита и сопротивление электролита.
Теоретический расход электрической энергии на 1 м3 водорода и 0,5 м3 кислорода при температуре 0° и давлении 760 мм рт. ст. составляет 2,95 кВт-ч.
Количество электричества, затраченного на электролиз, определяют умножением среднего значения тока / (в амперах) на длительность электролиза t (в секундах).
Один кулон при нормальных условиях (0°С, 760 мм рт. ст.)
теоретически выделяет 0,1741 см3 газовой смеси. Таким образом,
теоретическое значение объема газа, выделяющегося при нормаль
ных условиях [Л. 26],
у = 0,1741 (1)
где /1, h — соответственно ток в начале и конце электролиза; t — время электролиза.
Для образования 1,0 м3 водорода и 0,5 м3 кислорода при нормальных условиях теоретически расходуется 805 г воды [Л. 25].
Если газы, выходящие из электролизера, уносят с собой водяные пары, то действительный расход воды увеличивается. Количество водяных паров, уносимых газами, зависит от температуры электролита, давления насыщенных водяных паров и давления выделяющихся газов.
В промышленных условиях для компенсации расхода воды на разложение и унос ее газами в виде водяных паров в электролизер непрерывно или периодически добавляют новые порции воды.
В отличие от промышленных установок в разработанном электролизере микродозатора не требуется непрерывное добавление новых порций воды в связи с тем, что температура электролита изменяется в пределах от 25 до 30°С и образование водяных паров пренебрежимо мало. Количество воды, заполняющей электролизер, достаточно для длительного времени работы микродозатора. Ниже дается принцип действия разработанного микродозатора жидкости непрерывного действия.

 Опубликовано в
Опубликовано в