ИОННАЯ ЭЛЕКТРИЧЕСКАЯ ПРОВОДИМОСТЬ ЦЕМЕНТНОГО ГЕЛЯ
 17 января, 2013
17 января, 2013  admin
admin В период коагуляционного структурообразования цементного геля физико-химические процессы обусловливаются гидратацией и гидролизом цементных частиц. При одновременном воздействии воды на различные цементные минералы [5] алюминаты значительно быстрее реагируют с ней, нежели 2Ca0Si02. При образовании ЗСаОА12Оз выделяется 123,9 кДж на моль вещества, а при гидратации же ЗСаО — по меньшей мере 195,3 кДж на моль. Следовательно, в молекуле алюмината по отношению к воде запас свободной энергии составляет около 1829,1 кДж на моль. Естественно, что частица цемента, содержащая большое количество алюминатов, будет сравнительно быстрее распадаться на ионы< Двухкальциевый силикат при своем образовании выделяет 118,86 кДж на моль, а при полной гидратации — 130,2 кДж на моль, т. е. запас энергии у 2Ca0Si02 не превышает 11,34 кДж на моль, поэтому гидратироваться он будет значительно медленнее.
Эти явления в определенной степени обусловливают наблюдающиеся отклонения от обычных адсорбционных закономерностей, когда количество жидкой фазы, адсорбированной частицами цемента, растет не пропорционально изменению его удельной поверхности. Сравнительно быстрый распад на ионы при взаимодействии с водой частиц, богатых алюминатными соединениями, ведет к резкому увеличению дисперсности адсорбента.
Причина избирательной адсорбции — наличие на поверхности частиц с ионной кристаллической структурой остаточных (некомпенсированных зарядов). Вследствие большой диэлектрической проницаемости воды при взаимодействии диполей ее молекул с твердой фазой ослабляются силы связи между частицами минералов цемента и поверхностными ионами, которые легко диссоциируют, переходят в жидкую фазу и в зависимости от валентности располагаются на различных расстояниях от поверхности частиц. В результате нарушается взаимная компенсация зарядов и вокруг отдиссоциированных ионов и на поверхности минералов образуется адсорбционный и диффузный слои. При этом ионы, находящиеся в твердой фазе, притягивают противоионы жидкой фазы, облекаясь тем самым в гидратные оболочки. В процессе гидролиза минералов возрастает концентрация ионного раствора.
Отрицательно заряженные ионы, остающиеся при диссоциации на поверхности частицы, образуют по схеме Гельмгольца внутреннюю обкладку двойного электрического слоя. Отдиссоциированные ионы, несущие положительный заряд (так называемые компенсирующие ионы), составляют внешнюю обкладку этого слоя. Компенсирующие ионы притягиваются электрическими силами к отрицательно заряженной внутренней обкладке двойного слоя. В то же время они стремятся равномерно распределиться во всем объеме системы под влиянием теплового движения.
Часть компенсирующих ионов, непосредственно примыкающих к поверхности частицы, мало подвижна, так как она лежит в слое молекул воды, адсорбированных поверхностью. Ионы, находящиеся за этим адсорбированным слоем, образуют диффузный слой, плотность которого постепенно уменьшается по мере удаления от поверхности частицы. Катионы этого слоя легче вступают в реакцию обмена, чем катионы малоподвижного гельм - гольцевского слоя, непосредственно примыкающего к поверхности частицы.
Концентрация катионов диффузного слоя, находящихся в кинетической зоне с окружающим раствором, убывает по мере удаления от поверхности частиц твердой фазы, становясь в итоге равной концентрации катионов. в окружающем растворе. В связи с этим наибольшая плотность положительного заряда соответствует слою,
|
|
|
Ll § |
|
Ч"4 6 ИJ N. IS- |
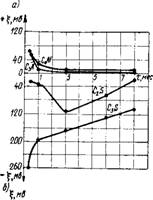
Рис. 4.3. Изменение величины и знака ^-потенциала в процессе твердения цементного геля
А — кинетика ^-потенциала минералов клинкера; б — влияние фазовых превращений на изменение ^-потенциала
В %мес
Расположенному ближе других к поверхности частицы.
При исследовании изменения ^-потенциала в упрочняющемся со временем цементном геле с учетом поверхностной проводимости были использованы клинкерные минералы: С3А, C4AF, C3S, C2S. Установлено [93], что гидросиликаты кальция, возникающие при гидратации C3S и C2S, имеют отрицательный заряд, а продукты гидратации С3А и С4А заряжены положительно. Гидроалюминаты характеризуются относительно меньшими абсолютными величинами g-потенцтиала, чем тоберморитопо - добные гидросиликаты, образующиеся в виде коллоидных дисперсий (рис. 4.3,а).
В течение индукционного периода ^-потенциал изменяется малоощутимо, а затем по мере образования кри - сталлогидратных комплексов, т. е. становления кристаллизационной структуры цементного камня, ^-потенциал уменьшается. В более поздние сроки твердения, когда интенсивность фазовых превращений замедляется и поверхностные свойства кристаллогидратных структур
стабилизируются, ^-потенциал приближается к своему постоянному значению (рис. 4.3,6).
Толщина двойного электрического слоя, а следовательно, и сольватной оболочки значительно влияют на объемные изменения цементного геля. В процессе образования пересыщенного ионного раствора развитые диффузные слои на частицах цемента сжимаются, и это сопровождается изменением ^-потенциала. При сжатии диффузной части двойного электрического слоя частицы сближаются и происходит контракция объема упрочняющегося цементного геля, т. е. его контракционная усадка.
Таким образом, частица вместе со слоями ионов на ее поверхности в целом электроотрицательна из-за равенства зарядов потенциал-определяющих и компенсирующих ионов. Понятие о знаке заряда и величине его относится только к частице без отдиссоциированных ионов или без диффузного слоя. Определенному распределению ионов различного знака на поверхности раздела твердой и жидкой фаз соответствует определенное распределение ^-потенциала.
Образующийся ионный раствор в результате гидратации и гидролиза цементных минералов придает цементному гелю свойство проводить электрический ток. Основным компонентом, влияющим на электропроводность цементного геля, является гидрат окиси кальция Са(ОН)2. Это вещество мало растворимо, так как 0,17% Са(ОН)2 делает раствор насыщенным. Вместе с тем Са(ОН)2 является в определенной степени сильным электролитом, так как почти все его растворимые молекулы диссоциируют на ионы, поэтому с увеличением концентрации вещества в растворе до определенного предела возрастает концентрация свободных ионов.
Вместе с увеличением концентрации гидрата окиси кальция Са(ОН)2 электропроводность системы также растет и, как это показано в работе [162], она увеличивается до 5%-ной концентрации Са(ОН)2; дальнейшее повышение концентрации ведет к понижению электропроводности жидкой фазы цементного геля.
Исследования подтверждают [28], что в результате гидролиза С3А и других минералов, входящих в состав портландцемента, происходит их диссоциация с последующим распадом на катионы и анионы. Анионами трехкальциевого алюмината являются (ОН)-и А1(ОН)~.
Как это следует из рис. 4.4, диссоциация минералов C4AF и С3А на ионы завершается практически к 5-м суткам, минерала C3S — продолжается в течение месяца, a C2S — в течение более продолжительного времени. В связи с этим возрастает концентрация ионов кальция в жидкой фазе, способствующая увеличению ее удельной электропроводности при 298 К на определенной стадии формирования структуры цементного геля.
Модель электрической проводимости цементного геля можно представить в виде цепи, состоящей из непро - гидратированных цементных ядер и жидкой фазы, заполняющей пространство между ними. Электропроводность цементного геля связана не только с соответствующими параметрами жидкой фазы; она зависит также от соотношения объемов твердой и жидкой фаз и строения капиллярно-поровых каналов (их длины, поперечного сечения и извилистости) в исследуемый период времени. Перечисленные факторы влияют на объемную электропроводимость Yv.
- Поверхность цементных частиц имеет отрицательный заряд, что обусловливает адсорбцию положительных ионов кальция и других отдиссоциированных минералов цемента. Вследствие такого перераспределения зарядов в диффузной оболочке сосредоточиваются в основном отрицательные ионы гидроксила. По мере удаления от поверхности твердых частиц суммы зарядов анионов и катионов постепенно выравниваются, а свободный раствор (в межзерновом пространстве) становится электрически нейтральным. Одновременно под действием электромолекулярных сил в растворе электролита перераспределяются ионы по концентрации: в непосредственной близости от поверхности частиц она значительно выше, чем в остальном объеме. При этом в пределах диффузных слоев сольватных оболочек концентрация катионов и анионов постепенно изменяется.
Предположим [10], что свободный раствор жидкой фазы насыщен только гидратом окиси кальция, концентрация которого составляет 1,3 г/л (соответственно 1,76-Ю-5 г/моль). Для оценки концентрации такого раствора определим его ионную силу по формуле
Г = 1/2 2 CiZi9 (4.4)
Где Сг и Zi — соответственно концентрация ионов одного типа в г-моль/л и их валентность.
Подставляя в (4.4) соответствующие значения, получим
Г = -»-.(0э0176.1 -2? + 0,0176-2.12) = 0,053.
Судя по полученному результату, раствор Са.(ОН)2с концентрацией 0,0176 г-моль/л относится к разбавленным растворам, что дает право воспользоваться закономерностями, присущими сильным электролитам для разбавленных растворов. В связи с - этим удельная электропроводность раствора электролита выражается уравнением
= аСК + »о)> (4'5>
Где а — коэффициент диссоциации ионов; Fa — число Фарадея; И0 и v0 — соответственно истинная скорость движения катионов и анионов; С — концентрация раствора электролита.
Пользуясь законом Стокса, для движения ионов получим следующие выражения скорости движения катионов и анионов соответственно:
Щ = /к/(6ягк т]с); V0 = /а/(6яга Ric). (4.6)
Подставляя эти значения и0 и V0 в (4.5), получим
Х, = (aCFA)/(6Jiric) (/к/'к + /а/'а). (4-7)
Где / — сила, действующая на ион; г — радиус иона; т]с— вязкость среды.
|
(4.8) |
Концентрация электролита в свободном растворе равна постоянному числу в то время, как в диффузном слое сольватной оболочки концентрация — величина переменная и складывается из концентраций катионов и анионов в зависимости от электрического потенциала в рассматриваемой точке и составляет, по Больцману, соответственно (г-ион/мл):
ZK FA К а Tj)
Г —с Р —С Р RT
ZA Fa
CB = C^e ОТ
Суммарная концентрация положительных и отрицательных ионов в рассматриваемой точке жидкой фазы равна
/ Fa 'zaFa
C = CK+Ca = CooU *Т ет 7 (4.9)
13* 195
Подставив (4.9) в (4.7), получим окончательное уравнение для удельной электропроводности раствора:
Где Соо — концентрация раствора, г-моль/л; ZK и Za — валентность катионов и анионов; R — газовая постоянная; Т — абсолютная температура раствора; — электрический потенциал в рассматриваемой точке.
Наиболее неопределенной величиной в выражении (4.10) является вязкость раствора. Согласно закономерностям для сильных электролитов, насыщенный раствор малорастворимого вещества (каким является гидрат окиси кальция) имеет ничтожную вязкость, в связи с чем и подвижность ионов близка к максимальной. Для указанного случая удельная электропроводность выражается зависимостью
2 f ZK Fa za Fa
%t = YC~{U+V) V ^J , (4.11)
Где и=и0^а и L/=I>0JFa — подвижность ионов в бесконечно разбавленном растворе.
Допустим, что вязкость во всех точках диффузного слоя сольватной оболочки одинакова, а подвижность ионов— постоянная и максимальная, т. е. для подвижности ионов диффузного слоя принимаем те же значения, что и для свободного раствора в соответствии с (4.4). Таким образом, формулы (4.10) и (4.11) соответствуют удельной электропроводности жидкой фазы, включая сольват - ную оболочку вокруг частиц цемента.
Значительный интерес представляет вопрос о зависимости электропроводности диффузного слоя сольватной оболочки от его толщины. Зная закон изменения удельной электропроводности жидкой фазы (4.11), можно записать
Г
Если принять, что Dx = Dy= 1, то (4,12) можно выразить в следующем виде:
Т S = Hidz> (4ЛЗ)
Подставив (4.11) в (4.13), получим
2 Ffil^X
V, = Т с°°{U+V) J г + Dz- (4Л4)
Интегрирование ведем по переменной ф, и для определения функции Vi|) воспользуемся уравнением Пуассона:
4я
Уф — — — р, (4.15)
8
Д2 г|? D2 Ib д2 г|) где Щ = —— 4- —— + —— — оператор Лапласа. Дх2 Df/2 Dz2
Избыточная плотность заряда ионов р представляет собой сумму электрических зарядов катионов и анионов в единице объема раствора:
Р = <7к + <7а - (4.16)
В свою очередь, согласно распределению Больцмана:
ZK FA К а ф
RT .
(4.17)
A a -
Принимая во внимание (4.8), (4.16) и (4.17), получим выражение для избыточной плотности электрического заряда ионов в единице объема жидкой фазы:
Za Fa ZK Fa
P = -2FaC00{e - e RT ') . (4.18)
Располагая систему координат над адсорбционным слоем на поверхности цементной частицы, получим, что в направлении плоскости, параллельной поверхности твердого тела, электрический потенциал изменяться не будет. Следовательно:
Д*Ц/дх* = дЦ)!ду* = 0. (4.19)
Коль скоро величина электрического потенциала изменяется только по оси, перпендикулярной к поверхности зерна, т. е. по оси z, то, учитывая (4,14), (4.18) и (4.19), получим уравнение Пуассона для рассматриваемого случая:
TOC o "1-3" h z / Z F Z F Х
Д2ф 8я ^ / - а а и. - к а *
_ 1 _ Г П Г, DT * л DT "
= —— F.Cl е RT * — е RT * I . (4.20)
Dz^ в /
После преобразования и взятия интеграла, предположив, что Za= 1 и ZK=2, имеем
24 яС,.
——If. (4.21)
ERT y
Проинтегрировав (4.21) от г|) до и от О до 2, где фо — электрический потенциал на поверхности цементной частицы, получим
Выражение (4.22) представляет собой функцию распределения электрического потенциала в диффузном слое сольватной оболочки в зависимости от расстояния от поверхности твердой фазы.
Чтобы найти функцию электропроводности диффузного слоя сольватной оболочки в зависимости от его толщины, определим из (4.21) значение Dz через Dty и подставим его в (4.14):
|
(4.24) |
2Fe Fa
У Г8
После интегрирования и соответствующих преобразований получим искомую зависимость для электропроводности диффузных слоев сольватных оболочек в цементном геле (поверхностная электропроводимость) в функции от электрического потенциала г|э и максимального потенциала н а поверхности цементной частицы:
У =(W) Т/+
Y* V ^ ; V 6я Ьа ^ ^
Для анализа полученных уравнений (4.9), (4.22) и (4.24) на рис. 4.5 изображены кривые изменения С, ф и у6у построенные в соответствии с ними в зависимости от 2* при значении 8=81 и г|)0= 100 мВ.
Рассматривая полученные графические зависимости можно заключить, что концентрация ионов в наиболее плотной части диффузного слоя во много раз выше,
В функции расстояния от поверхности цементной частицы.
Чем в свободном растворе. Наиболее активной зоной физико-химических превращений является диффузный слой цементной частицы, так как именно здесь, вследствие максимальной концентрации ионов, создаются наиболее благоприятные условия для образования кри - сталлогидратных комплексов.
Чем меньше свободной воды в цементном геле, тем точнее электропроводность будет отражать свойства гидратных оболочек, изменяющихся в связи с фазовыми превращениями, происходящими на поверхности цементных частиц в процессе упрочнения цементного геля. Таким образом, из приведенного следует, что изменение полной электрической проводимости жидкой фазы отражает кинетику физико-химических процессов, обусловливающих трансформацию цементного геля в камне - видное состояние.
Необходимо отметить, что, согласно [62], активная поверхностная проводимость характерна и для адсорбционного слоя ионов, хотя подвижность их в нем во много раз меньше, чем в диффузном слое и свободном растворе. Однако теоретически вычислить подвижность ионов адсорбционного слоя или определить ее экспериментально для цементного геля представляет пока большую трудность. Несмотря на то, что в приведенном выше выводе принята во внимание проводимость только диффузного слоя, тем не менее следует предположить, что в этом процессе участвуют и ионы адсорбционного слоя.

 Опубликовано в
Опубликовано в