Адсорбция ПАВ
 3 декабря, 2012
3 декабря, 2012  admin
admin |
Wp = арг + аТ1 — атр = амг + отг — атм |
Адсорбция молекул ПАВ и ионов электролитов па поверхности очищае мого объекта и частицах загрязнений способствует уменьшению сил адгезии частиц к поверхности и увеличивает стабильность образующейся под влия-
|
Г - Ю^мг/см2 |
|
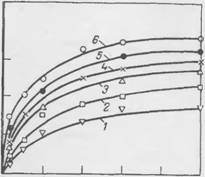
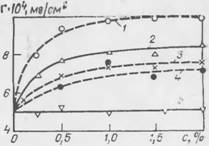
Рис. 71. Кинетические кривые сорбции сульфонола НП-1 стеклом (I), эмалями на основе эпоксидных смол Э-5 (2), Э-11 (3), нитроэмалью (4), перхлор - внниловой эмалью (5) и алюминием (6). О Ю 20 30 Т, мин |
|
|
Г-Ю^мг/см2
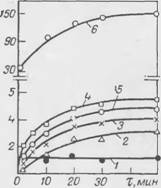
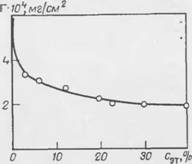
Рис. 72. Кинетические кривые сорбции перхлорвиниловой эмалью сульфонола НП-1 при различных концентрациях: / — 0,0625; 2 — 0,125; 3 — 0,25; 4 — 0,5; 5—1,0; 6 — 2.0%.
Иием моющего раствора суспензии (эмульсии), препятствуя обратному осаждению загрязнений. Адсорбция алкилсульфатов и алкилбензолсульфоиатов на текстильных материалах заканчивается примерно через 3—4 мин [289]. Значительно медленнее протекает адсорбция па стальных, керамических, полиэтиленовых материалах и особенно — на кварцевой пыли.
В работе [290] представлены результаты изучения адсорбции сульфонола НП-1, меченного атомом серы, на некоторых лакокрасочных покрытиях (ЛКП) и других материалах. Количество адсорбированного сульфонола Г (в мг/см2) определяли по уравнению
Г = a'/(a"S)
Где а'—радиоактивность поверхности площадью S, имп/мни; а" — удельная радиоактивность сульфонола с учетом естественного распада, нмп/(мш1-мг).
На рис. 71 приведены кинетические кривые адсорбции сульфонола из 0,25%-ного водного раствора на различных ЛКП, стекле и алюминии при 20 "С. Адсорбция на ЛКП протекает относительно медленно и практически заканчивается лишь через 40—50 мин. Исследованные покрытия резко не различаются по способности к адсорбции сульфонола, несмотря на значительное различие в химической природе плеикообразователей и входящих в состав ЛКП компонентов (пигменты, пластификаторы и др.).
Адсорбция сульфонола лакокрасочными покрытиями, мало отличающимися по шероховатости и средним размерам пор, определяется особенностями строения поверхности, имеющей своеобразную мозаичную структуру, что и приводит к нивелировке этой величины для различных покрытий
Гидрофильное стекло, обладая незначительной шероховатостью в отсутствие пористости, практически мгновенно сорбирует предельное количество сульфонола, которое значительно меньше, чем при сорбции на ЛКП. Алюминий в обычных условиях покрыт оксидной пористой пленкой толщиной 13—25 им, которая хорошо сорбирует сульфонол.
|
10* |
|
147 |
В табл. 10 приведены некоторые фпзпко-хнмнчеекпе характеристики использованных поверхностей п величина максимальной адсорбции ими сульфонола НП 1. Шероховатость покрытий определяли с помощью профилографа ИЗП-174, а пористость — по методике Манегольда.
Таблица Ю. Максимальная сорбции сульфонола ПП-1 некоторыми материалами
|
Материал |
Шероховатость (средний размер выступов), Л-Ю5, см |
Средний рал - мер пор, Г-10*. см |
I 10 мг/см* |
|
Перхлорвиииловая эмаль |
75 |
8,2-9,9 |
5,4 |
|
Эмали Iia основе эпоксидных смол |
|||
|
Э-11- |
31 |
— |
4,0 |
|
Э-5 |
25 |
— |
2,9 |
|
Нитроэмаль |
118 |
7,4-8,2 |
4,7 |
|
Алюминий |
31 |
— |
155 |
|
Стекло |
1 |
1,04 |
На рнс. 72 представлены результаты изучения кинетики адсорбции суль - онола НП-1 из растворов различной концентрации перхлорвиниловой эмалью, нализ этих данных показывает, что в равновесных условиях процесс подчиняется уравнению Ленгмюра, величина равновесной адсорбции Г со составляет 3,14-10-9 моль/см2.
Путем измерения количества сорбированного ПАВ можно определить площадь сорбирующей поверхности [291]. Поверхность перхлорпшшлоной эмали, занятую сорбированным сульфополом (оншешельно геометрической площади), рассчитывали по уравнению
S = TXNAS0
Где NA — число Авогадро; S0 — площадь, занимаемая молекулой сульфонола в адсорбционном слое.
Если принять постоянной концентрацию сульфонола в растворе до и после сорбции па поверхности образца (в условиях опыта она уменьшается менее чем на 0,1%), то величина Г«, может быть рассчитана графически по кинетическим адсорбционным кривым. По данным работы [292] для сульфонола S0= =40-Ю-16 см2, и тогда 5=7,55 см2/см2, т. е. сорбирующая поверхность превышает геометрические размеры образца примерно в 7,5 раза.
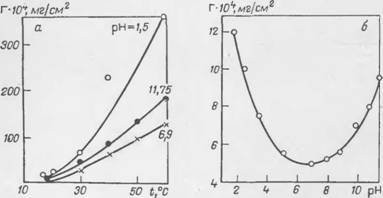
Данные о влиянии температуры и рН среды на степень сорбции сульфонола НГ1-1 перхлорвиниловой эмалью представлены на рис. 73 (0,25%-иый водный раствор, экспозиция 50 мин). Как известно, с повышением температуры сорбцня коллоидных электролитов на поверхности раздела раствор — твердое тело уменьшается. Кривые на рис. 73, а показывают, что с повышением тем-
|
Рис. 73. Влияние температуры (а) и рН (б) на величину сорбции сульфонола НП-1 перхлорвиниловой эмалью. |
Рис. 74 Влияние компонентой моющих средегн на сорбцию сульфонола НП-1 перхлорвнниловой эмалью:
I — тринатрнПфосфат; 2 — гсксамстафосфл! натрия; 3 — карбонат натрии; 4— сульфит
Натрия; 5 — харбоксимстишцсллюлоза. Концентрация сульфонола — 0.5%; экспозиция — 30 мин.
Пературы сорбция сульфонола на эмали расчет. Аналогичные данные получены в работе [293]. Для объяснения этой зависимости было выдвинуто предположение о влиянии набухания покрытий на их сорбционпую способность. Однако экспериментальная проверка показала, что степень набухания исследованных ЛКП в водных растворах сульфонола НП-1 при обычной температуре не превышает 1% и повышение температуры в пределах 18—50 СС существенно не влияет па набухание. Очевидно, увеличение сорбциониои способности нсрхлорининлоной эмали следует объяснить изменениями в Eipynypc покрытий. Это подтверждается, например, Icm, что нрн пагрснаимн чи Ioioi Цвет покрытия и выделяется хлористый водород.
Из рис. 73, б следует, что адсорбция сульфонола существенно зависит от рН раствора. Максимальная сорбция наблюдается в области малых значений рН, что обусловлено приобретением поверхностью положительного заряда. После закрепления на полярных участках поверхности аниона сульфонола (благодаря электростатическим силам или химической связи) и образования первого сорбционного слоя возможно формирование второго слоя. Увеличение сорбции сульфонола из щелочных растворов объясняется некоторым разрыхлением поверхностного слоя эмали в щелочной среде. В нейтральной среде сорбция сульфонола из раствора минимальна. Аналогичные данные были получены в работе [294].
Таким образом, сорбция сульфонола наиболее полно протекает в кислых и щелочных растворах. Это объясняет высокую эффективность щелочных моющих растворов для очистки различных поверхностей. Использование кислых растворов ограничивается их корродирующим действием на металлы.
Изучалось влияние некоторых компонентов моющих средств на сорб - ционную способность некоторых ПАВ по отношению к ЛКП, а также исследовалась сорбция активаторов моющего действия, в частности фосфатов натрия, в присутствии ПАВ различных типов. Все исследованные вещества, кроме карбоксиметилцеллюлозы, увеличивают сорбцию ПАВ (рис. 74). Такая зависимость связана с изменением мицеллярного состояния ПАВ в присутствии солей, в результате чего происходит снижение ККМ и ослабление сил отталкивания между молекулами ПАВ [295]. При этом может образовываться двойной слой сорбирующихся молекул. Влияние исследованных солей на сорбцию сульфонола объясняется изменением рН раствора:
Концентрация соли, % 0,1 0,2 0,3 0,4 0,5 рН 0,2%-ного раствора сульфонола в присутствии
TOC o "1-3" h z Na2S04 5,5 4,8 4,8 4,7 4,7
Na3P04 10,9 11,1 11,2 11,3 11,3
Na2C03 Ю,1 10,2 10,3 10,4 10,5
Влияние фосфатов на сорбцию сульфонола НП-1 увеличивается в ряду NaH2P04<Na2HP04<Na3P04, что соответствует увеличению рН растворов этих солей.
|
|
|
|
|
0/7=7 |
|
СПАВ' ■ |
|
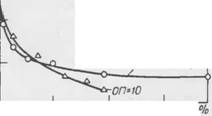
Рис. 75. Влияние неионогенных ПАВ на сорбцию сульфонола НП-1 перхлорвиниловой эмалью. Рис. 76. Влияние этанола на сорбцию сульфонола НП-1 перхлорвиниловой Эмалью. |
|
Г-Ю^мг[см2 6 |
Сорбция сульфонола в присутствии неионогенных препаратов ОГ1-7 и ОП-Ю, как и следовало ожидать, уменьшается (рис. 75) вследствие вытеспе - ния молекул сульфонола с межфазной поверхности раствор — ЛКП. Кроме того, на величину сорбции может влиять изменение мицеллярного состояния раствора в смесях анионоактивного и неиопогенного ПАВ [295]. Введение в раствор сульфонола небольших количеств этанола (2—3%) существенно снижает сорбцию; дальнейшее увеличение концентрации спирта (вплоть до 40%) фактически ие оказывает влияния на сорбцию ПАВ (рис. 76). Следует иметь в виду, что при значительных количествах спирта в растворе изменяются свойства среды, окружающей мицеллы, например увеличивается ее растворяющая способность.
|
Таблица 11. Адсорбция фосфатов натрия (Г-10* в рг/см2) на перхлорвиниловой эмали в присутствии ПАВ
|
|
А. В зависимости от времени контакта; концентрация ПАВ — 0,3%; концентрация фосфата — 0,5%.
|
|
Б. В зависимости от концентрации фосфата; концентрация ПАВ — 0,3%; время контакта—1,5 мин. |
|
С, 125 |
0,45 |
|
0,25 |
0,75 |
|
5 |
0,95 |
|
1,0 |
1,15 |
|
1,5 |
1,20 |
|
2,0 |
1,15 |
|
0,50 1,00 1,80 2,40 2,25 2,40 |
|
0,8 0,9 2,0 2,5 2,7 2,9 |
|
8,6 10,35 11,6 13,4 14,4 15,9 |
|
1,15 1,55 1,80 2,15 2,10 2,10 |
|
2,10 2,85 3,75 4,20 4,40 4,40 |
|
2,05 2,30 2,75 3,40 3,25 3,50 |
|
1,8 2.5 3.6 4.1 4.2 4.0 |
|
2,7 5,0 7,6 9,4 11,2 12,5 |
|
1,20 2,00 2,75 3,35 3,40 3,50 |
|
3,9 6,0 8,8 10,2 11,6 13,0 |
|
1,5 2,4 3,4 3,9 3,9 4,0 |
Данные о сорбции фосфатов натрия в присутствии некоторых ПАВ в зависимости от времени контакта и от концентрации фосфата приведены в табл. 11. Сорбция фосфатов увеличивается при введении в раствор ПАВ. Меньшее влияние оказывают сульфонол и вспомогательное вещество ОП-Ю, а наибольшее — катионоактивный Арквад-18. Это можно объяснить более сложным строением молекул Арквада-18 и большим числом слоев сорбированных молекул на поверхности покрытия в присутствии неорганических ионов. Увеличение сорбции фосфатов в присутствии моющих веществ имеет место также на тканях.
В соответствии с представлениями, изложенными в работе [290], увеличение адсорбции фосфатов в растворах Арквада-18 можно обьясшпь образованием бимолекулярного адсорбционного слоя. Возрастание адсорбции в ряду NaH2P04 < Na2HP04 < Na3P04 объясняется увеличением молекулярной массы солн и валентностью кислотного остатка, определяющих прочность связи с молекулами ПАВ. Данные табл. 11 в основном подтверждают рассмотренные выше закономерности о влиянии ПАВ на адсорбцию фосфатов.
Эффективность адсорбции ПАВ на пыли зависит от природы активных функциональных групп, имеющихся па поверхности частиц пыли: полярные группы являются активными адсорбционными центрами, взанмодействующи ми с ПАВ [297].

 Опубликовано в
Опубликовано в