КОРРОЗИОННЫЕ свойства ВЫСОКОЛЕГИРОВАННЫХ СТАЛЕЙ
 8 января, 2014
8 января, 2014  admin
admin При контактировании с агрессивной средой металлы могут претерпевать коррозионное разрушение (разъездание), степень которого зависит от химического состава и структуры металла, характера агрессивной среды, температуры этой среды и других условий эксплуатации. Коррозия металлов может быть химпческой или электрохимической.
Химическая коррозия представляет собой процесс образования химического соединения при прямом химическом взаимодействии металла с соприкасающейся с ним агрессивной средой (сухими газами, дистиллированной водой) без появления электрического тока.
При соприкосновении стали с воздухом в условиях высоких температур на ее поверхности образуется тонкий слой окисла. С повышением температуры и продолжительности нагрева толщина окисной пленки увеличивается. При определенной критической (для стали данного состава) температуре пленка растрескивается и отделяется от металла, обнажая его поверхность, вследствие чего окисление металла продолжается. Критическую температуру, при которой наблюдается растрескивание и отделение от поверхности металла окисной пленки после длительного нагрева, называют температурой окалиностой- кости данной стали. При температурах ниже критической образуются сплошные пленки окислов, плотно прилегающие к поверхности металла и предохраняющие его от дальнейшего окисления.
|
|
|
1200 ^1100 t 1900 7С0 |
|
Содержание Сг, % |
|
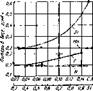
Рис. 39. Кривые влияния хрома на окалпиостой- кость аустенитных (!) и феррнтных (2) сталей [7], |
Главным элементом, сообщающим окэлиностойкость стали, является хром (рис. 39). Влияние никеля на окалино - стойкость менее значительно. Окалино - стойкость высокохромистых сплавов повышают также кремний и алюминий, Положительное влияние на окалино - стойкость стали (в частности хромони - кельмарганцевой) оказывает азот [116] при умеренном его содержании.
Присутствие серосодержащих газов в рабочей атмосфере ускоряет разрушение поверхности металла при высоких температурах, особенно если этн газы являются восстановительными (разлагающими окисную пленку). При этом вместо окисной пленки образуются сульфиды, не противодействующие дальнейшей коррозии вглубь металла. Высокохромистые (25—28% Сг) ферритные стали в этих условиях более стойки против разрушения, чем хромоникелевые. Электрохимическая коррозия[2]—это растворение металла в электролитах с появлением электрического тока: электронного в металле и ионного в электролите.
Как известно, электролитами могут быть различные кислоты и их водные растворы, щелочи п их растворы, растворы солей
в воде (в том числе морская вода), а также вода, содержащая растворенный воздух.
Характерной особенностью электрохимической коррозии является то, что общая реакция химического взаимодействия электролита с металлом, например цинка в растворе серной кислоты: Zn + H2SO4 = ZnSO* + Н2, при электрохимической коррозии разделяется на два параллельных процесса: а) анодный — процесс перехода металла в раствор в виде гидротированных ионов с оставлением эквивалентного количества электронов в металле и б) катодный — процесс ассимиляции этих электронов какими - либо деполяризаторами, т. е. атомами, молекулами или ионами раствора, которые могут восстанавливаться на катоде. Иначе говоря, один процесс — окислительный — растворение металла с отдачей электронов, а второй — восстановительный — выделение водорода, выделение металла из раствора с присоединением электронов.
Интенсивность электрохимической коррозии металлов зависит от характера раствора электролита (кислота, щелочь, раствор газов), концентрации этого раствора и его температуры, а также от электрохимических свойств металла: от энергии выхода ион - атома из кристаллической решетки в раствор, т. е. от так называемого потенциала растворения данного металла.
Коррозия возможна в том случае, если металл, погруженный в электролит, обладает макро - или микронеоднородностью по химическому составу и физико-химическим свойствам, вследствие чего одни его места в данном электролите будут обладать меньшим, а другие—большим электрохимическим потенциалом, т. е. если металл в данных условиях будет представлять либо макроскопический гальванический элемент, либо системы многоэлектронных микроскопических элементов.
Участки поверхности металла с более низким потенциалом оказываются анодами и растворяются, электроны при этом перемещаются к участкам с более высоким (менее отрицательным или более положительным, чем у данного анода) потенциалом — к катоду.
Причиной различия потенциалов стали могут быть включения. неравномерно распределенные примеси и легирующие элементы в металле, неравномерная газонасыщенность, неодинаковый наклеп металла, наличие в нем нескольких различных по составу структурных составляющих, например наличие карбидов или боридов в ферритной или аустенитной стали, феррита и аустенита в двухфазной стали и т. д. Причиной коррозии может быть также различие в электрохимических свойствах тела и границ зерен. При полностью однородном металле коррозия его может быть вызвана неоднородностью концентрации раствора, неравномерностью напряжений в металле и т. д.
Коррозия может быть равномерная и сосредоточенная. Для надежной работоспособности изделий в условиях агрессивной среды необходимо исключить возможность сосредоточенной коррозии и выбрать сталь такого состава, чтобы равномерная коррозия ее по всей поверхности не превышала бы 0,1 г/ж2 • ч или глубина коррозии была бы не более 0,1 мм за год.
Различают несколько видов сосредоточенной коррозии нержавеющих сталей и их сварных соединений, из которых главными являются следующие: межкристаллитная — коррозия вглубь металла по границам зерен, точнее, по пограничным слоям зерен; структурно-избирательная — преимущественное растворение одной из структурных составляющих металла; точечная, или так называемая питтинговая коррозия. Все эти виды коррозии являются следствием химической или физической неоднородности металла.
Структурно-избирательная коррозия чаще наблюдается в сварных соединениях из нержавеющих сталей и поэтому будет рассмотрена ниже.
Межкристаллитная коррозия является наиболее опасным видом коррозии металла, так как при незначительной общей потери металла разрушение (разъедание) происходит по границам зерен в толщу его (рис. 40), что может привести к быстрому выходу изделия из строя.
При контактировании агрессивной среды со сталью, склонной к межкрнсталлитной коррозии, неустойчивые пограничные зоны зерен металла вступают в химическое взаимодействие с этой средой и быстро растворяются в ней. При этом металлическая связь между зернами нарушается. Приложение даже незначительной нагрузки к такому металлу приводит к его разрушению (рис, 41).
Природа межкристаллитной коррозии аустенитных нержавеющих сталей в настоящее время изучена недостаточно, и существующие теории не во всех случаях позволяют объяснить восприимчивость металла к межкристаллитной коррозии. Однако практические меры, предотвращающие появление этого вида коррозии, хорошо известны и широко применяются в металлургии и сварке нержавеющих сталей.
Наиболее распространенной теорией, объясняющей причины межкристаллнтной коррозии аустенитных сталей, является так называемая карбидная теория, или теория обеднения. Сущность ее состоит в следующем.
Аустенит представляет собой твердый раствор хрома, никеля, марганца и других элементов в железе. Углерод обладает ограниченной растворимостью в аустените. При комнатной температуре стабильное содержание углерода в твердом растворе аустенита не превышает 0,02—

Рис. 40 Межкрпсталлптная Рис. 41. Внешний вид изогнутых образцов
коррозия стали Х18Н10 пос - стали Х18Н10, испытанных на склонность
ле провоцирующего нагрева к межкрнсталлитиой коррозии по методу
при температуре 650° С 2,5 ч, AM:
X150. п-в состоянии поставки; б —после провоциру
ющего нагрева прн 650“ С 2,5 н.
ее охлаждении от высоких температур он фиксируется в виде пересыщенного (нестабильного) твердого раствора. При этом сталь не подвергается межкристаллнтной коррозии. Однако последующий нагрев металла в интервале критических температур (500—800° С) приводит к тому, что избыточный углерод выделяется из твердого раствора по границам зерен в виде сложных карбидов (рис. 42) железа и хрома [(Сг, Fe)3C или (Fe, Сг)2зСа], в которых преобладает хром. Вместе с карбидами, по-вндимому, выделяются в этих условиях и нитриды (Fe, Cr)N. В результате выделения богатых хромом карбидов (карбидонитридов) содержание хрома в пограничных слоях аустенитных зерен уменьшается до 12% и менее (рис. 43) и становится недостаточным для коррозионной стойкости металла в условиях воздействия агрессивной среды.
Сталь стойка против коррозии в кислотах, щелочах и растворах солей при содержании в ней более 12% хрома. Стойкость стали в окислительных средах, например в азотной кислоте, тем
|
Рис. 42. Микроструктура стали 0Х17Н5Г9АБ, хбОО: о-в состоянии поставки: б —после провоцирующего негрева ори 650* С 2,5 ч. |
выше, чем больше в ней хрома. Если в стали содержится 12% и менее хрома, она становится некоррозионностойкой в ряде сильных агрессивных сред. Кроме того, благодаря разному содержанию хрома в центральных зонах и в пограничных слоях аустенитных зерен, такой металл при контактировании с агрессивной средой (электролитом) становится системой гальванических микропар, в которых карбиды и тело зерна служат катодами, а обедненные хромом пограничные слои его — анодами. Вследствие этого растворение (разъедание) обедненных слоев зерен (анодов) происходит весьма быстро, значительно быстрее, нем растворение 10—12%-ной хромистой стали с равномерным распределением хрома.
Появление склонности аустенитной стали к межкристаллитной коррозии тем вероятнее, чем Продолжительнее (в пределах от секунд до нескольких часов) металл находится нагретым в критическом (опасном) интервале температур и чем выше содержание углерода в нем. Однако после весьма длительного нагрева (сотни часов и более) при этих температурах стойкость металла против межкристаллитной коррозии восстанавливается.
При этом чем выше температура нагрева в интервале 500—800° С (и тем более при 850—900°С), тем меньшая продолжительность нагрева требуется для восстановления стойкости металла против межкристаллнтной коррозии (рис. 44). Опыты показывают, что для этого достаточно 2—3-часового отжига при температуре 850—875° С.
|
О? |
d |
|
|
-- |
Н |
|
|
мичесхои |
|
продолшительность нагрева,» Рнс. 44. Схема влияния температуры и времени выдержки на склонность аустенитной стали и аустенитных швов к межкристаллнтной коррозии [146, 265], |
Рнс. 43. Схема распределения хрома по зерну аустенитной стали типа 18-6, склонной к межкристаллнтной коррозии;
а — в закаленном состовнин (нет коррозии); б —после нагрева в критическом интервале температур (есть коррозия) (/ — тело еустенитного зерне; 2 —карбиды
Восстановление стойкости металла против межкристал - лекня хрома), литной коррозии в данном случае обусловлено тем, что при весьма длительной выдержке при критических температурах, или отжиге при 850° С, после выделения карбидов происходит диффузия хрома из центральных зон аустенитных зерен в обедненные пограничные слои их, в результате чего содержание хрома по всему сечению зерна выравнивается,
После закалки в воде или на воздухе от температуры 1050— 1100° С аустенитная сталь становится невосприимчивой к меж - кристаллитной коррозии. При нагреве металла до таких температур карбиды хрома растворяются в аустените и при последующем быстром охлаждении фиксируются в нем, а содержание хрома по телу зерна выравнивается.
Предотвратить межкристаллитную коррозию аустенитной стали можно максимальным уменьшением содержания углерода в металле или введением в него карбидообразующих элементов, обладающих более сильным сродством к углероду, чем Хром. Такими элементами являются титан, ниобий, тантал, Связывая
хромом логран
избыточный углерод стали в прочные карбиды, нерастворимые в аустените при указанных температурах закалки, эти элементы исключают возможность выделения карбидов хрома из твердого раствора и обеднение хромом границ аустенитных зерен при нагреве в критическом интервале температур. При стабилизации аустенитных сталей титаном содержание его должно быть в 5— 7 раз больше, чем избыточное (более 0,007—0,01%) содержание углерода.’
Для полного предотвращения восприимчивости аустенитной стали к межкристаллитной коррозии без стабилизации титаном или ниобием необходимо снизить содержание в ней углерода до 0,007—0,01%, что практически пока не осуществимо. Вместе с тем, опыты показывают (см. гл. V), что достаточно снизить содержание углерода до 0,03%, чтобы чистоаустенитная сталь, в том числе и с азотом, не содержащая стабилизирующих элементов, оказалась стойкой против межкристаллитной коррозии как в закаленном состоянии, так и после повторных нагревов в критическом интервале температур продолжительностью до
2— 2,5 ч.
Наличие ферритной фазы в аустенитном металле уменьшает (хотя при повышенном количестве углерода и отсутствии стабилизирующих элементов полностью и не предотвращает) склонность его к межкристаллитной коррозии. Ниже на примере сварных швов будет показано, что при наличии ферритной фазы необходимость стабилизации металла титаном или ниобием для предотвращения восприимчивости к межкристаллитной коррозии отпадает, если содержание углерода в нем не превышает 0,06%, При таком количестве углерода повышение содержания азота до 0,25% в двухфазной аустенитно-ферритной стали не оказывает отрицательного влияния на стойкости ее против межкристаллитной коррозии (см. гл. VI).
Как и в случае аустенитных сталей, углерод, а также азот могут быть причиной восприимчивости к межкристаллитной коррозии высокохромистых ферритных сталей. Однако в отличие от аустенитных ферритные стали становятся восприимчивыми к межкристаллитной коррозии после высокотемпературного нагрева и быстрого охлаждения; последующий отпуск при температуре 760—850° С делает эти стали невосприимчивыми к этому виду коррозии. В связи с этим ферритные стали поставляются промышленности в состоянии после закалки и отпуска (отжига).
Титан в количествах, полностью связывающих избыточный углерод и азот в карбонитриды, уменьшает склонность феррит -
ной стали к межкристаллитной коррозии. Для приобретения восприимчивости ферритной стали, содержащей титан, к межкристаллитной коррозии требуется более длительный, чем для стали без титана, высокотемпературный нагрев и последующее быстрое охлаждение. Обычно содержание титана в высокохромистых ферритных сталях в 5—10 раз превышает содержание углерода.
Высокотемпературный нагрев различной продолжительности и более-менее быстрое последующее охлаждение металла соответствует сварочному термическому циклу. Поэтому чаще межкристаллитная коррозия ферритных сталей, особенно не стабилизированных или недостаточно стабилизированных титаном, обнаруживается в сварных соединениях. В связи с этим более подробно природа этого вида коррозии ферритных сталей будет рассмотрена в разделе сварки этих сталей.
Точечная коррозия может быть как в сварных соединениях, так и в основном металле вдали от шва. Она чаще происходит в средах, содержащих ионы хлора (в том числе в морской воде). Причины точечной (питтинговой) коррозии рассмотрены в работе [192].
Сульфидные и ферритные включения, а также обедненные хромом участки в аустенитных сталях повышают склонность ее к питтингу. Возможность питтинговой коррозии во многом зависит от состава нержавеющих сталей и наличия в них неметаллических включений. Положительную роль в повышении устойчивости стали против этого вида коррозии играют хром, молибден, кремний, ванадий, никель, азот. Причем положительное влияние никеля и азота связано с образованием более стабильной гомогенной структуры.
О влиянии состава и структуры нержавеющей стали на стойкость против питтинга можно судить из данных, приведенных ниже [121]:
|
Марка стали |
Потенциал прибоя в 3%-ном растворе NaCl
|
0Х21Н6М2Т |
|
0,563 0,428 0,298 0,193 0,023 |
|
0X2JH5T 0X2JH3T ХІ7АГ14 Х14Г14НЗТ Х18Н10Т |
|
|
Стойкость против питтинга оценивается по потенциалу пробоя пассивирующей пленки в соответствующей среде, определяемому по специальной методике. Кроме потенциала пробоя, исследуемые стали испытывали [121] в растворе хлорного железа в течение 37 суток, что позволило оценить устойчивость металла против питтинга. Испытания показали, что на стали Х14Г14НЗТ питтинг появился уже через 6 суток, на стали Х17АГ14 — через 23 суток, а на стали 0Х21НЗТ—после 34 суток. На сталях 0Х21Н6М2Т и 0Х21Н5Т в этих условиях питтинговой коррозии не было обнаружено. Как следует из вывода, сталь 0Х21Н6М2Т, несмотря на двухфазную ферритно-аустенитную структуру, имеет наиболее высокий потенциал пробивания Еп и, следовательно, наилучшую в данных условиях стойкость против точечной коррозии; сталь же Х14Г14НЗТ с аустенитной структурой имеет наименьший потенциал пробоя и претерпевает точечную коррозию. Сталь марки 0Х21Н5Т с несколько меньшим содержанием никеля (на 0,7%), чем у стали 0Х21Н6М2Т, и без молибдена имеет меньший потенциал пробоя. Снижение никеля с 5—6% до 3,2% в стали с 21% Сг еще больше снижает Еп. Уменьшение содержания хрома до 17% и замена никеля марганцем и азотом (сталь Х17АГ14) уменьшает Еи до 0,193 в, а снижение хрома до 14%, даже при наличии некоторого количества никеля (3%), несмотря на гомогенную аустенитную структуру стали уменьшает Еа до минимума (0,023 в). При этом потенциал пробивания, а следовательно, и стойкость против точечной коррозии стали Х14Г14НЗТ оказываются ниже, чем стали Х1810Т.
|
12 ... ^ Содержание Сг,% Рис. 45. График влияния хрома на потенциал железохромистых сплавов в нормальном растворе сульфатного железа в присутствии воздуха 147]. [269]. |
Таким образом, сопротивляемость нержавеющей стали точечной коррозии обеспечивается наличием в ней достаточно высокого содержания хрома, никеля, молибдена, кремния и ванадия. Марганец, титан, ниобий несколько уменьшают стойкость стали против питтинга [191]. Состав стали определяет также общую коррозионную стойкость ее в той или иной коррозионной среде. Причем влияние легирующих элементов на коррозионную стойкость в различных средах не одинаково [56].
Коррозионная стойкость сталей в окисляющих средах. Резкий скачок потенциала в положительную область и соответственно повышение коррозионной стойкости стали, особенно в окисляющих средах, наблюдается при содержании хрома более 12% (рис. 45) [47, 269].

Рнс. 46. Графики влияния хрома па коррозионную стойкость железохромистых сплавов в кнпяшей азотной кислоте концентрации -
/ — 65%; J-50% [47, 52).
При дальнейшем увеличении количества хрома более 15—16% коррозионная стойкость металла возрастает, хотя и с постепенным уменьшением интенсивности этого роста (рис. 46) [47, 52]. Влияние никеля на коррозионную стойкость сталей в окисляющих средах (в том числе в азотной кислоте) значительно меньше. Поэтому, например, высокохромистые без - никелевые ферритные стали 0Х17Т и тем более Х25Т и хромоникелевые ферритно-аустенитные малоникелевые 0Х21Н5Т, 0Х21Н6Б, 0Х21АН5 по коррозионной стойкости не только не уступают, но в ряде случаев даже несколько превосходят хромоникелевые аустенит - ные стали 0Х18Н10 и Х1810Т.
Влияние хрома на коррозионную стойкость стали одни исследователи объясняют появлением на поверхности металла плотной пассивирующей пленки окислов, а другие — образованием на этой поверхности адсорбированного или химически сорбированного слоя кислорода [275]. Причем пассивирующая способность хрома сильно зависит от характера агрессивной среды: от ее окислительно-восстановительного потенциала. Так, например, присутствие в нормальном растворе сульфатного железа вместо воздуха более сильного окислителя — перекиси водопода сообщает пассивность стали не прн 12% Сг, а уже при 9% Сг [269]. Если же через раствор сульфатного железа пропускать водород, то даже при 22% Сг сталь еще не пассивируется [238], и в этом случае для обеспечения коррозионной стойкости в сталь необходимо вводить никель.
Кроме основных легирующих элементов (хрома, никеля), кор - * розионная стойкость стали во многом зависит от содержания до - полнительных легирующих элементов и примесей. На рис. 47 приведены графики влияния углерода, азота, марганца и крем - - ния на коррозионную стойкость в азотной кислоте хромоникеле -
вой стали типа 18-8 [3]. Коррозионная стойкость стали в этой кислоте ухудшается с повышением содержания углерода и кремния и не изменяется с увеличением количества азота и марганца. Однако при чрезмерном увеличении количества марганца коррозионная стойкость стали при том же содержании хрома в окисляющих средах несколько ухудшается, хотя и не существенно [128, 146, 207, 234, 278). В азотной кислоте повышенной концентрации отрицательное влияние на коррозионную стойкость стали оказывает также молибден. Например, введение в хромоникеле - вую сталь типа 18-8 2—3% молибдена увеличивает скорость коррозии ее в гомогенном состоянии (после закалки) в кипящей 65%- ной азотной кислоте в два раза
|
0.5 !.0 1.5 2,0 МП Содержание примеси.% Рис. 47. Графики влияния примесей в аустенитной хромоннкелевой стали типа 18-8 на коррозионную стойкость ее в кипящей 65%-ной азотной кислоте (274]. |
[НО].
Как будет показано ниже на примере сварных швов, общая коррозионная стойкость хромоникелевого металла в азотной кислоте концентрации до 65% при высоких температурах прн легировании ванадием и кремнием сильно снижается. Вместе с тем в более концентрированной азотной кислоте при повышенных температурах кремний оказывает положительное влияние на общую коррозионную стойкость хромоникелевых чистоаустенитных сталей, особенно при низком содержании углерода. Исследовав технологические, механические и коррозионные свойства хромоникелевых чистоаустенитных сталей типа 20-20 с весьма малым количеством углерода и различным содержанием кремния. А. А. Бабаков, Т. А. Жадан и Т. Н. Шаронова пришли к выводу, что оптимальное содержание кремния в такой стали — 5%. К сожалению, при сварке плавлением такой стали, особенно толщиной свыше 5—6 мм, приходится сталкиваться с большими трудностями из-за образования трещин в металле шва.
Весьма важным для коррозионной стойкости стали является не только и даже не столько общее содержание углерода (в обычно встречающихся в практике преде - лах), а в каком виде он находится в металле — в твердом растворе нли же в карбидах. Аустенитные стали в гомогенном состоянии даже при содержании до 0,2% С имеют достаточно высокую коррозионную стойкость. Отпуск же, способствующий выделению карбидов из твердого раствора, резко ухудшает стойкость стали против коррозии (рис. 48).
|
содершаниг '.У - |
Рис. 48. Графики влияния содержания углерода и продолжительности повторного нагрева при 650° С на коррозионную стойкость в кипящей 65%-пой азотной кислоте предварительно закаленной от 1050° С хромонн - келевой стали состава: 17,9—18,4% Сг; 9,0-10,7% Ni; 0.47—0,59% Si, 0,47—0,90% Мп, Продолжительность повторного нагрева: I — 0 мин: 2-15 мин: з - I V 4-8 <; 1-72 ч [Эл -
Коррозионная стойкость ферритных высокохромистых сталей с повышением содержания в них углерода ухудшается несколько больше, чем хромоникелевых аустенитных вследствие меньшей растворимости углерода в феррите по сравнению с аустенитом.
Отрицательное влияние углерода на общую коррозионную стойкость стали после отпуска обусловлено образованием гальванических микроэлементов карбиды — твердый раствор, уменьшением содержания хрома в твердом растворе вследствие его отбора выделяющимися карбидами [47, 110], а также местными напряжениями в решетке твердого раствора, создаваемыми дисперсными карбидными частицами. Последние заслуживают особого рассмотрения, так как в ряде случаев обусловливают локальную (сосредоточенную) коррозию металла.
П. Д. Робертсон, Р. С. Брей [178], применив общие принципы старения сплавов [158], утверждают, что только присутствие второй фазы, хотя бы и выделившейся в форме дисперсных частиц недостаточно для наблюдаемого эффекта старения (упрочнения) Лишь при когерентной связи частиц выделяющейся фазы с мат рицей, т. е. на стадии предвыделения, имеет место воэникнове ние внутренних напряжений вокруг зародышей новой фазы и свя занное с этим упрочнение металла. Образование напряжений
в решетке матрицы при этом обусловлено разницей в расстояниях между атомами на плоскостях сопряжений матрицы и зародышей, а также различием в удельных объемах матрицы и заро - Действительно, выделение избыточной фазы, в том числе и карбидов, нельзя представить иначе, как процесс, протекающий во времени и включающий несколько стадий. Первая стадия — накопление растворенных атомов (в данном случае углерода, хрома, марганца) в пограничных зонах зерен до уровня состава новой фазы с сохранением когерентной связи зародышей с матрицей. Вследствие этого решетка в местах сопряжений выделяющейся фазы с матрицей находится в упругодефор - мированном состоянии. Вторая стадия — выделение и рост (коагуляция) новой фазы (карбидов, карбонитридов) с разрывом когерентности с матрицей и снятием упругих напряжений решетки.
|
дышей новой фазы [63]. |
|
t |
||
|
! |
--- Vr |
|
|
-v |
їь_ |
|
Рис. 49. Графики влияния температуры одночасового повторного нагрева стали Х18Н10Т (1) и 0Х21Н5Т (2) на скорость коррозии в 56%-ной кипящей азотной кислоте. |
Снятием напряжений в связи с полным выделением карбидов, по-видимому, и обусловлено некоторое улучшение коррозионной стойкости стали при увеличении продолжительности провоцирующего нагрева, например, более 8—24 ч в случае, представленном на рис. 48. Есть основание полагать, что карбиды выделяются не все сразу: в то время как часть карбидов выделилась, другие находятся на стадии предвыделения, а третьи — на стадии накопления элементов. Как следует из рис. 49 [89], полное восстановление коррозионной стойкости (в том числе и остаренной аустенитной стали) происходит при термической обработке (нагрев выше 900 до 1100° С, быстрое охлаждение), обеспечивающей растворение и фиксирование углерода в твердом растворе. Ферритные стали в этих условиях, наоборот, становятся восприимчивыми к межкристаллнтной коррозии.
Коррозионная стойкость сталей в неокисляющих средах. Сплавы, содержащие свыше 12% Сг, коррозионностойки в большинстве агрессивных сред. Однако все сплавы системы хром —■ железо нестойки в соляной, фосфорной и пла
виковой кислотах, в галоидных кислотах (особенно в хлоридах), а также в растворах серной кислоты и в других сильных неокисляющих растворах, в том числе в растворах органических кислот.

Рис. 50. Графики влияния концентрации кипящей муравьиной (а) п щавелевой (б) кислот на коррозию хромоникелевой стали с 0,03% С. 17,0—18,7% Сг, 13,6—24.0% Ni я различным содержанием молибдена: 1-2.7% Мо; г-э.5% Мо: з-і.7% Мо 11541, продолжительность испытаний 168 ч.
Повышение коррозионной стойкости железо-хромистых сплавов в неокислительных средах обеспечивается легированием их никелем э количестве более 10%. Вместе с тем, в ряде сред, например в слабой серной кислоте, уксусной и др., содержание никеля в стали может быть меньше 10% (сталь 0Х21Н6М2Т).
Легирование хромоникеле - вых аустенитных сталей молибденом, а в ряде случаев медью и сурьмой, способствует дальнейшему повышению коррозионной стойкости их в слабых, содержащих ионизированный водород кислотах [48].
Коррозионная стойкость сталей в органических кислотах. В ряде отраслей промышленности, в том числев целлюлозной, аппаратура подвергается воздействию органических кислот таких, как муравьиная, щавелевая, уксусная, не имеющих окисляющей способности, Для изготовления такой аппаратуры обычно применяют хромони - кельмолибденовые аустенитные стали Х17Н13М2Т и X17H13M3T. Для изготовления аппаратуры, работающей в среде уксусной и слабой муравьиной кислот, может также применяться сталь 0Х21Н6М2Т. Для более сильных кислот этого типа таких, как кипящая муравьиная и, особенно, щавелевая кислоты, в сталь необходимо вводить до 5% Мо (рис. 50) с соответствующим повышением содержания никеля (до 20—24%) с целью предотвращения образования ферритной фазы.
Высоконикелевые аустенитные стали, содержащие 3,5— 5,0% Мо, кроме стойкости в неорганических кислотах, обладают также высокой стойкостью против точечной коррозии, а сталь с 4,5—5,0% Мо — также против действия некоторых агрессивных соединений хлора (двуокись хлора, гипохлориты и хлораты).
Коррозионная стойкость сталей в серной кислоте. По экспериментальным данным [257], хромоникелевые стали, содержащие до 10% Ni, по коррозионной стойкости в разбавленной серной кислоте даже уступают сталям без хрома, т. е. хром при низком содержании никеля ухудшает коррозионную стойкость стали в этой кислоте. При содержании же никеля свыше 10% вплоть до 28—30% хром в количестве от 15 до 20% оказывает благоприятное, хотя и не столь существенное влияние на стойкость стали против действия серной кислоты. Однако хромоникелевые стали без молибдена являются практически не стойкими в серной кислоте средних концентраций. Только очень разбавленные или очень концентрированные растворы серной кислоты оказывают малое воздействие на нержавеющие стали [191].
Повысить коррозионную стойкость хромоникелевой стали в серной кислоте можно дополнительным легированием электроположительными элементами, в том числе молибденом и медью [10, 67, 188, 190, 183, 226, 245]. При добавлении к хромоникелевой стали 2,0—3,5% Мо последняя становится стойкой в серной кислоте низких и средних концентраций ПпИ низких и умеренных температурах. Например, стали марок 0Х21Н6М2Т, Х17Н13М2Т п X17H13M3T стойки в серной кислоте концентрации до 10% при температуре до 50° С и концентрации до 20% при 30° С. Несколько более коррозионностойкой в серной кислоте является сталь 0Х21Н6АМ2 [104] и 00Х17Н16МЗБ, наиболее стойкой—сталь 0Х23Н28МЗДЗТ [67].
Температуру и концентрацию серной кислоты, в условиях воздействия которых аустенитная сталь достаточно стойка, можно повысить путем дополнительного легирования медью и кремнием. Влияние молибдена и меди на коррозионную стойкость хромоникелевой аустенитной стали с 17—18% Сг и 13—20% Ni в средах, содержащих серную кислоту, хорошо видно из данных, приведенных в табл. 12 [257]. Для получения чистоаустенитной структуры при увеличении содержания молибдена необходимо повысить содержание никеля. Так. в стали с 2,7% Мо содержалось 13,0— 14,5% Ni, а при 4,5—4,7% Мо — до 20% N1.
Хромоникельмолибденомедистая чнстоаустенитная сталь 0Х23Н28МЗДЗТ, разработанная ЦНИИЧМ, вполне коррозионно- стойка в водных растворах серной кислоты концентрации до 40% при температуре до 70° С. Естественно, что при более низких температурах концентрация может быть несколько выше.
Если концентрация и температура серной кислоты не превы
шают указанных для стали данного состава, то через некоторое время происходит быстрое пассирование стали путем образования на ее поверхности защитной пленки, состоящей главным образом из труднорастворимых сульфидов и оксидов [257]. Следует отметить, что при концентрации около 100% серная кислота действует как сильный окислитель. Пассирование металла при этом происходит, как и в азотной кислоте.
Повторный нагрев хро - Таблица 12
|
Дополнительное |
Убыль тол мм/год. ретур |
™Г‘ |
|
85®С |
1 юас |
|
|
2,7% Мо 4,7% Мо 4,5% Мод 1,5% Си |
0,019 0,010 0,004 |
Более 75 5.3 0,6 |
* Состав водного раствора: 160 г/л серной кислоты (HjSO») + 330 г/л надсерно - кислого аммония [<NH<)sSaOe] + 40 г/л сернокислого аммония [(NbL,)aSOi]. Продолжительность испытания 168 ч.
МОНИКельмолибдеНОМеди - Коррозионная стойкость СТОЙ стали ухудшает ее хромоникелевой аустенитной стали KnnnniHCiHHvm гтойкпгть r с Раэличным содержанием молибдена коррозионную стойкость в в растворе сернокислого аммония * серной кислоте (рис. 51) подобно уменьшению стойкости хромоникелевой стали в азотной кислоте. Это свидетельствует, по-види - мому, о том, что не обеднение твердого раствора хромом является главным фактором, обусловливающим столь существенное ухудшение коррозионной стойкости стали при повторном нагреве, так как общая коррозионная стойкость стали в серной кислоте мало зависит от возможного в данном случае изменения содержания хрома в твердом растворе, а больше — от содержания никеля, концентрация которого в твердом растворе не изменяется при выделении карбидов. Главной причиной отмеченного ухудшения коррозионной стойкости как в азотной, так и в серной кислотах при повторном нагреве стали являются напряжения в решетке, возникающие в процессе предвыделения карбидов.
Коррозионная стойкость сталей в фосфорной кислоте. На ряде химических предприятий аппаратура работает под воздействием фосфорной кислоты, относящейся к весьма агрессивной среде. Иногда в фосфорной кислоте присутствуют примеси других соединений, которые нередко усиливают агрессивность среды. Так, по данным опытов Л. И. Посы - саевой. скорость коррозии хромоникельмолибденовых аустенитных сталей в 32%-ной экстракционной фосфорной кислоте
(32% Р2О5 + 2% F + 1,6% S03) при температуре 70° С больше, чем в чистой 32%-ной Р2О5 [169]. Влияние легирующих элементов в аустенитной стали на ее коррозионную стойкость в этой среде отличается от их влинния на коррозионную стойкость стали того же класса в серной кислоте. Коррозионная стойкость хромоникелевых аустенитных сталей с добавкой молибдена и меди в 32%-ной экстракционной фосфорной кислоте при 70°С зависят главным образом от содержания молибдена, в меньшей степени— от содержания хрома и незначительно— от количества никеля и. тем более, меди. Положительное влияние молибдена до 3,0—4.5% на коррозионную стойкость стали в данных условиях особенно заметно при содержании в ней 21—23% Сг; хром в количестве до 23% увеличивает коррозионную стойкость стали только в присутствии молибдена.

пературы повторного нагрева стали Х23Н23МЗДЗ на ее коррозионную стойкость в растворах серной кислоты различной концентрации при 80° С:
J —10%; 2—25%; 3 — 35%; < — 50%. 5-70%, 6-80% [5].
Повышение количества никеля в стали от 20 до 24% не влияет на ее коррозионную стойкость в этом растворе. Дальнейшее увеличение содержания никеля до 28% (и даже до 42%) лишь немногим повышает стойкость стали против действия 32%-ной экстракционной фосфорной кислоты. Положительного влияния меди при этом не обнаружено. Весьма примечательно, что сталь указанного оптимального состава с 0,01% С в опытах не имела преимущества в части коррозионной стойкости в опробованной среде перед стабилизированной титаном или ниобием сталью идентичного состава с 0.05% С. Как показали исследования автора удовлетворительной коррозионной стойкостью в фосфорной кислоте обладают сварные соединения из стали 00Х17Н16МЗБ, разработанной автором с сотрудниками совместно с работниками Северо-Донецкого химкомбината. Некоторое увеличение содержания хрома и никеля в основном металле и шве и наличие азота в последнем несколько улучшает общую коррозионную стойкость сварных соединений в экстракционной фосфорной кислоте.
Весьма перспективными являются хромоникельмолибденовые аустенитные стали с весьма низким содержанием углерода, дополнительно легированные азотом, например 000Х20Н16АМЗ.




 Опубликовано в
Опубликовано в