ВЫДЕЛЕНИЕ И ОЧИСТКА НАФТАЛИНА
 30 июля, 2013
30 июля, 2013  admin
admin Ректификацией каменноугольной смолы выделяют: легкое масло (80-160 °С), перерабатываемое совместно с «сырым бензолом»; фенольную фракцию (165-210 °С); нафталиновую фракцию (216-230 °С); поглотительную фракцию (235-300 °С); антраценовые фракции - первую (280-360 °С) и вторую, более высоко - кипящую (температура 50 % - го отгона около 400 °С), а также пек
[15] . Типичный состав нафталиновой, поглотительной и антра-
43
Ценовой фракций, наиболее важных источников полициклоаре - нов, представлен в табл. 14.
В нафталиновой фракции концентрируется 80-85 % нафталина от ресурсов его в каменноугольной смоле.
Технический нафталин выделяют из нафталиновой фракции кристаллизацией - прессованием или дистилляцией. Производство дистиллированного нафталина получило меньшее развитие в России из-за большого расхода 94 % - й Н2804 (более 8 % от нафталиновой фракции), значительных потерь нафталина (6-8%), большого количества отходов - отработанной Н2804, кислой смолки, промывных сточных вод [3, 218].
На Фенольном заводе разработана и опробована очистка нафталина от бензотиофена нафталинсульфокислотой, которая действует как катализатор. Потери нафталина при этом способе очистки минимальны - 0.02-0.03 % [219].
На ряде зарубежных установок используется каталитическая гидроочистка нафталина от бензотиофена - процесс «Юнион Фай - нинг», в результате которого из 95 %-го технического продукта
|
ТАБЛИЦА 14 Содержание основных компонентов во фракциях каменноугольной смолы, % (мае.)
|
|
Методы очистки нафталина от бензотиофена и других примесей
|
Получают 98 % - й нафталин, причем содержание бензотиофена снижается с 3.5 до 0.04 - 0.10 % [2^0]. При гидроочистке, как и при сернокислотной очистке нафталина, бензотиофен, являющийся ценным сырьем органического синтеза, уничтожается.
Перспективно выделение нафталина чистотой 95-97 % ректификацией, однако из-за невысокого коэффициента относительной летучести ключевой пары компонентов бензотиофен - нафталин (а = 1.09) требуется колонна эффективностью 55 теоретических тарелок при высоких флегмовых числах 15-31 [221].
Перспективны также процессы очистки нафталина от бензотиофена и других примесей, основанные на применении селективных растворителей: экстрактивная кристаллизация, экстракция, экстрактивная и азеотропная ректификация (табл. 15).
Наибольший интерес представляют методы выделения бензотиофена из смесей с нафталином, основанные на применении смеси полярных растворителей и насыщенных углеводородов [201]. Введение последних приводит к повышению селективности и коэффициентов разделения при экстракции.
В табл. 16 представлены результаты экстракционной очистки нафталина от бензотиофена смесями полярных растворителей и гептана. В табл. 17 и 18 приведены калориметрические данные
Об энтальпиях растворения соответственно нафталина и бензотиофена в полярных растворителях [214]. По методике [215] рассчитаны также энтальпии сольватации (АНсольв), энтальпии образования полости в структуре растворителя (АНпол), энтальпии взаимодействия (АНВЗ) и их специфическая составляющая (АНсп).
ТАБЛИЦА 16
|
Результаты разделения смесей нафталина и бензо(Ь)тиофена одноступенчатой экстракцией смешанным растворителем Соотношение экстрагент : сырье = 5:1 мае. Соотношение полярный : неполярный растворитель =1:1 мае.
|
|
Энтальпии взаимодействия нафталина с полярными растворителями при 25 °С, кДж/моль
|
|
Пропионитрил |
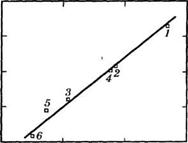
Специфические взаимодействия полярных растворителей с бензотиофеном более сильные, чем с нафталином, что обусловлено большей электронодонорной способностью бензотиофена. Соответственно и энтальпии сольватации при растворении бензотиофена по абсолютной величине выше, чем для нафталина. Как следует из рис. 3, выполняется линейная корреляция между степенью
|
ТАБЛИЦА 18 Энтальпии взаимодействия бензо(Ь)тиофена с полярными растворителями при 25 °С, кДж/моль
|
90
|
Рис. 3. Зависимость степени извлечения бензо(Ь)тиофена а от энтальпии сольватации бен - зо(Ь)тиофена полярными растворителями Нумерация точек соответствует табл. 16 |
 _ 80
_ 80
И сс
А
~ 70
С
А"
60 50
TOC o "1-5" h z 45 50 55 60
ЛЯсолыз, кДж/МОЛЬ!
Извлечения бензотиофена и энтальпиями сольватации, описыт ваемая уравнением:
А = 2.81 (-АНС0ЛЬВ) - 79.7 :
с коэффициентом корреляции г = 0.984 и средним квадратичным отклонением 8 =2.17.
Ранее были определены предельные парциальные энтальпии смешения различных аренов с ацетонитрилом и рассчитаны энтальпии общего и специфического взаимодействия (табл. 19) [216].
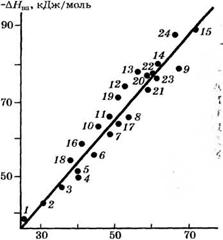 Установлена линейная зависимость энтальпий взаимодействия от молярной рефракции аренов (рис. 4), выполняющаяся с коэффициентом корреляции г = 0.970. Энтальпия специфического взаимодействия коррелирует с энергиями резонанса аренов (г = 0.954). Специфическое взаимодействие аренов с ацетонитрилом усиливается также с уменьшением потенциалов ионизации аренов, однако в этом случае проявляется лишь приблизительная корреляция (г ==
Установлена линейная зависимость энтальпий взаимодействия от молярной рефракции аренов (рис. 4), выполняющаяся с коэффициентом корреляции г = 0.970. Энтальпия специфического взаимодействия коррелирует с энергиями резонанса аренов (г = 0.954). Специфическое взаимодействие аренов с ацетонитрилом усиливается также с уменьшением потенциалов ионизации аренов, однако в этом случае проявляется лишь приблизительная корреляция (г ==
= 0.900).
Определены предельные парциальные термодинамические функции смешения аренов с ацетонитрилом [217].
Рис. 4. Зависимость энтальпии взаимодействия ароматических углеводородов с ацетонитрилом от молярной рефракции углеводородов; г = 0.970 Нумерация точек соответствует табл. 19
|
Энтальпии межмолекулярного взаимодействия ароматических углеводородов с ацетонитрилом при 298.15 К, кДж/моль
|
Как избыточные свободные энергии смешения Д6?°, так и энтальпии смешения возрастают с увеличением числа конденсированных колец и уменьшаются с увеличением степени ненасыщенно - сти молекул, например, при переходе от аценафтена к аценафти- лену. Кроме того, основной вклад в ДС° вносит АН°. В связи с этим закономерности влияния строения аренов на обе эти величины идентичны, и они в равной мере могут быть использованы для оценки результатов разделения углеводородов с помощью селективных растворителей.
При очистке нафталина от примесей индола также могут быть использованы методы экстрактивной кристаллизации или экстракции селективными растворителями. Индол в отличие от нафталина способен к образованию не только л-комплексов, но и
|
Энтальпии взаимодействия индола с полярными растворителями при 25 °С, кДж/моль
|
Водородных связей между группой ЫН и протоноакцепторным центром в молекуле растворителя.
В табл. 20 приведены предельные парциальные энтальпии растворения индола в полярных растворителях, а также энтальпии общего и специфического взаимодействия [222]. Энтальпии специфических взаимодействий разделены на две составляющие - энтальпию образования 71-комплексов {АНКсв) и энтальпию водородной связи (АНИсв). Значения энтальпий образования л-ком - плексов рассчитывались с использованием установленной линейной корреляции между ДЯд. св и энергиями резонанса ароматических соединений [223], а значения АНп_св - по разности:
АНн_св = АНсв-АНя_св
Как следует из представленных в табл. 20 данных, доля АЯН. СВ от АйГсп составляет от 45 % для системы индол - ацетонитрил до 56 % в случае наиболее сильного электронодонорного растворителя - гексаметилфосфортриамида. Энтальпии &Нп_св для систем индол - полярные растворители коррелируют с донорными числами Гутмана с высоким коэффициентом корреляции г = 0.998.

 Опубликовано в
Опубликовано в