Система литий-вода
 26 мая, 2013
26 мая, 2013  admin
admin Электрохимическая система может быть представлена в виде
(–) Li│LiOH │ H2O (Me) (+)
Где Me – это инертный катод, не участвующий в токообразующей реакции. Его изготавливают из недорогих металлов (железо, сталь, никель). Токообраующие реакции имеют следующий вид:
На аноде Li → Li+ + e Е–о = –3.056 В
На катоде Н2О + е → 0.5 Н2 + ОН - Е+о = –0.836В
Суммарная Li + Н2О → Li+ + ОН - + 0.5 Н2↑ Ео = +2.22 В
Электролитом является щелочной раствор гидроксида лития, который образуется сам за счет реакции лития с водой. Такие ХИТ изготавливают в резервном исполнении, т. е. без электролита. В таком неактивном состоянии источник может храниться длительное время (более 10 лет). Приводится в действие заполнением морской водой. Генерация электроэнергии протекает параллельно с прямой химической реакцией лития с водой, но эта реакция в концентрированной щелочи протекает довольно медленно, так что потери лития за счет саморастворения невелики. В результате источник Li/H2O может работать несколько часов, обеспечивая очень высокие плотности тока (до 0.5 А/см2) и очень большую удельную энергию (до 3000 Вт·ч/кг, сравните с другими электрохимическими системами). Система Li-H2O – одна из самых энергоемких, но кратковременного действия. Основное применение – морское (гидроакустические буи, погружные аппараты, торпеды). Конструкции – самые разнообразные. Обычно требуется максимальная мощность, которая достигается при рабочем напряжении 1.2 В и плотности тока 0.3 А/см2 (см. рисунок).
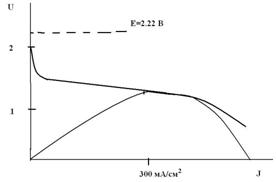
Кривые U – J и P – J для источника Li/H2O (схематично).
Но система Li/H2O – это скорее исключение. Длительно работающие ЛИТ удалось создать только с применением неводных растворителей.

 Опубликовано в
Опубликовано в