Сегрегация серы в сварных швах
 23 апреля, 2016
23 апреля, 2016  admin
admin Появление кристаллизационных трещин в сварном шве во многом определяется ликвационной неоднородностью металла. Как известно [281], при кристаллизации первые порции затвердевшего металла содержат наименьшее количество примесей. Примеси, оставшиеся в жидком металле, оттесняются от поверхности растущих кристаллов. При этом, поскольку вероятность захвата примесей кристаллами будет уменьшаться, концентрация растворенного вещества перед растущими кристаллами будет увеличиваться. По мере сближения зерен в зависимости от условий охлаждения то или иное количество примесей будет оседать на поверхности зерен. Наибольшее скопление примеси будет на зернах, которые затвердевают последними.
Поскольку процесс перемещения атомов примесей диффузионный, т. е. связан со временем, на ликвационные процессы заметно будут влиять скорости охлаждения и кристаллизации металла. Причем, чем ниже эти скорости, тем выше степень межзеренной ликвационной неоднородности.
Для сварочных процессов, характеризующихся высокими скоростями кристаллизации и охлаждения, ликвационные процессы протекают в меньшей мере, чем в крупных слитках. Однако и в условиях сварки наблюдается ликвационная меж - зеренная неоднородность [215], и степень ликвации зависит
|
Таблица 17. Значения относительной сегрегации примеси при различных условиях
Примечание. Над чертой приведены значения Cg (х)/С0 при х = 0, мкм, под чертой — при лг = 1,0 мкм. |
от химического состава металла, содержания ликвирующего компонента, режимов сварки и т. д.
Рассмотрим особенности сегрегации серы, которая является одной из основных причин образования кристаллизационных трещин при сварке углеродистых и низколегированных сталей. Как известно, сера относится к компонентам, весьма склонным к сегрегации в металле, что, в частности, было отмечено в гл. III. Из формулы (III.7) следует, что концентрация примеси в расплаве на границе с кристаллом изменяется по экспоненте и во многом зависит от величины коэффициента распределения элемента Кр. Если Кр — 10~2, то концентрация этого компонента на межфазной границе будет в 100 раз больше начальной концентрации.
В табл. 17 [342] даны изменения относительной сегрегации примеси Cs (х)/С0 в зависимости от скорости кристаллизации расплава v3, величины коэффициента распределения элемента Кр при расстоянии от поверхности кристалла, равном 0,1 и 1,0 мкм. При этом было принято, что коэффициент диффузии постоянен и составляет 5 • 10“1 м2/с.
Как видно, величина относительной сегрегации возрастает с уменьшением скорости кристаллизации и величины коэффициента распределения примеси и проявляется в большей мере вблизи поверхности кристаллов.
Значения коэффициентов распределения для элементов Р; Mn; С; 02; S; А]; Si; Ті и Zr в 6-железе, полученные для бинарных систем, согласно [342], соответственно равны 0,2; 0,15; 0,25; 0,1; 0,002; 0,6; 0,7; 0,6 и 0,5. Следовательно, при одинаковых условиях на границах зерен будет концентрироваться в первую очередь сера и кислород, а затем Mn, Р, С, Zr, Ті, А1 и Si. Поэтому образование на границах зерен сульфидов возможно даже при низком содержании серы в металле.
Из сравнения величин коэффициентов распределения становится ясным и положительное влияние марганца в разрушении пленки FeS.
Из практики известно, что Мп в большей мере снижает опасность появления кристаллизационных трещин, чем Zr и Ті, хотя последние образуют более устойчивые сульфиды, чем марганец. Это можно объяснить следующим образом. Очевидно, относительная скорость образования сульфидов во многом зависит от поверхностной концентрации реагирующих компонентов. Поэтому присутствующие, в поверхностном слое S, Мп, Zr и Ті будут иметь одинаковую тенденцию к образованию сульфидов в том случае, если изменение свободной энергии в процессе образования сульфидов будет одинаковым, т. е. AGs—м и = AGs—zr — AGs—то
Преимущественное образование сульфидов тем или иным компонентом будет происходить, если соответствующее его реакции отрицательное значение AG, величину которого следует определять с учетом поверхностной концентрации компонентов, будет большим.
Поскольку величина Кр для Мп значительно ниже, чем у Zr и Ті, то марганец будет сегрегировать к границам зерен примерно в 10 раз больше, чем Zr и Ті, и вероятность образования сульфидов марганца будет выше, чем образование сульфидов циркония и титана. Поэтому, так как межатомные силы Мп—S значительно выше связи атомов Fe—S, наличие Мп в расплаве будет в большей мере способствовать разрушению сульфидных пленок FeS, чем наличие Zr и Ті. Низким значением коэффициента распределения (Кр <С 0,02) редкоземельных элементов [30] можно объяснить значительное снижение вредного влияния серы при введении этих элементов в металл.
Таким образом, свойства границы между кристаллом и расплавом, ее состав будут иметь важное значение в процессе образования кристаллизационных трещин. Поэтому рассмотрим термодинамические особенности системы зерно — расплав.
Если в металле имеется і примесей (/ = 1,2,_________ ) в количестве
Ni и их химический потенциал р, отличен от химического
потенциала матрицы ц0, то энергия системы [115, 172]:
G = TSa + — PV + п^з,
1=0
где Т — абсолютная температура; 5Э — энтропия; Р — давление; V — объем; о — поверхностное натяжение; А3 — площадь зернограничной поверхности.
Приняв для простоты, что имеем бинарный раствор (і= = 0,1), и сравнив энергии системы с границей G и однородной системы 0„ при условии, что они содержат одинаковое количество атомов матрицы N0 и примеси Nu а р., = р0, получим
G0 = TS°3 + PolV + nX-W
G = TS3 - f n0N - f — PV + oA3.
 ASadT + AN'dii, ~ AV'dP + do = 0,
ASadT + AN'dii, ~ AV'dP + do = 0,
откуда
Система (V.13) представляет собой адсорбционную изотерму Гиббса. Следовательно, изменение энергии в системе с границей обусловлено адсорбцией компонентов на межзеренную границу.
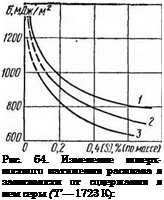
Аналогичность процессов сегрегации и адсорбции [315] позволяет использовать формулы, применяющиеся для описания процессов адсорбции при изучении сегрегации элементов. Это особенно важно для установления взаимного влияния компонентов на сегрегационную способность друг друга. Так, достоверно установлено [280, 290], что наличие углерода в расплаве Fe—С—S повышает поверхностную активность серы. Имея зависимость изменения поверхностного натяжения рас
плава от концентрации компонента о = f (С) (рис. 64), можно легко графически определить величину адсорбции. Для этого на графике о — f (С) в точках, для которых требуется найти величину адсорбции Га, проводят касательные до пересечения с осью абсцисс. Тангенс угла, образованного этими линиями, будет равен ~ [111]. Зная
 эту величину, можно определить значение Га, воспользовавшись уравнением Гиббса:
эту величину, можно определить значение Га, воспользовавшись уравнением Гиббса:
![]()
![Сегрегация серы в сварных швах Подпись: 7 — [С] — 1,25 %; 2 — [С] — 2.2 %; 3 - [С] - 4.0 % (по массе).](/img/3120/image249.png) С da RT dC ’
С da RT dC ’
где R — газовая постоянная.
Следует уточнить, что уравнение (V.14) справедливо лишь для двухкомпонентных систем. Однако, поскольку в рассматриваемой системе взаимодействие углерода с серой будет незначительным, содержание углерода можно принять постоянным и уравнение (V.14) использовать при расчетах, считая, что в качестве растворителя использован сплав железо — углерод.
Расчетное определение величин адсорбции серы при различных концентрациях в металле углерода показывает, что с увеличением содержания углерода адсорбция серы возрастет. Это должно привести к повышению поверхностной концентрации серы на границе с кристаллом, что следует из выражения [75]:
[S]„ob = [S]o6 + VraN0 100 %. (V.15)
Рм
Здесь [SJnoB и [S]06 — соответственно поверхностная и объемная концентрация серы в расплаве; М — молекулярная масса адсорбирующего компонента; рм — плотность металла; N0 — число Авогадро.
Расчеты, проведенные с помощью уравнения (V.15), свидетельствуют о том, что содержание серы в поверхностном слое значительно превышает ее содержание в объеме и с возрастанием концентрации углерода в расплаве эта разность увеличивается. Повышение сегрегации серы с увеличением содержания углерода в металле подтверждается и экспериментами [191, 215].
Таким образом, наличие углерода в расплаве, повышая поверхностную активность серы, будет способствовать возрас
танию ее концентрации на границе с кристаллом, что облегчает выделение сульфидов на поверхности зерен. По-видимому, это может быть одной из причин повышенной склонности метал та шва к образованию кристаллизационных трещин при увеличении в металле содержания углерода.
С этих позиций можно объяснить и снижение вероятности образования трещин при введении в металл кислорода. Конечно, в какой-то мере это связано с образованием оксидных неметаллических включений и выделением на них сульфидов. Однако поскольку кислород и сера повышают поверхностную активность друг друга [201], то увеличение их концентрации в слое металла, прилегающего к поверхности кристалла, создает благоприятные условия для образования двухкомпонентных (оксисульфидных) включений. Образование таких включений требует меньших затрат энергии, чем образование однокомпонентных включений [116, 230].
Таким образом, даже такое весьма краткое рассмотрение влияния отдельных компонентов (С, 02) на сегрегацию серы в металле позволяет в какой-то мере объяснить влияние этих компонентов на образование кристаллизационных трещин с учетом поверхностной активности серы и вида образующихся сульфидов.
Нужно также отметить, что величина относительной сегрегации примесей уменьшается с уменьшением величины зерен [342], а это приведет к снижению опасности появления кристаллизационных трещин.

 Опубликовано в
Опубликовано в