ПРОЦЕСС ГОРЕНИЯ
 7 декабря, 2011
7 декабря, 2011  admin
admin Пиролиз или термическое разложение биомассы происходит при достаточно высоких температурах с образованием смеси горючих газов, которые сгорают с кислородом воздуха. При низкотемпературном пиролизе образуется значительное количество углистого остатка.
При пламенном сгорании газов высокая скорость тепловыделения и тепловой поток, содержащий достаточное количество энергии для распространения фронта пламени, обеспечивают газификацию сырья (рис. 10). При значениях температуры или интенсивности теплового потока ниже определенного уровня может иметь место медленное горение или неполное сгорание твердой углистой фазы, сопровождающиеся дымлением или эмиссией недоокисленных продуктов пиролиза. Подобное можно наблюдать при сжигании клетчатки небольшой плотности
Или другого пористого материала. Углистое вещество окисляется медленно за счет диффузионно проникающего воздуха. Скорость тепловыделения небольшая при отсутствии значительных тепловых потерь. Тепловой поток обеспечивается конвекцией или теплопроводностью.
При полном сжигании постоянная скорость сгорания однородного топлива определяется как
Ir = — (3)
At
Где Ir-интенсивность реакции, АЯ-теплота сгорания, dw/dt-скорость перемещения масс.
Для биомассы, используемой в качестве топлива, это уравнение дает приближенную скорость тепловыделения при постоянной скорости сгорания. Состав и АН продуктов пиролиза могут изменяться, а полнота сгорания при равновесном состоянии не зависит от dw/dt. Для того чтобы определить скорость тепловыделения и генерируемую энергию в чистом виде, необходимо учитывать содержание влаги и неорганических веществ в топливе.
Теплота сгорания АнЦр определяется расчетным путем при допуще-
ніш, что горение топлива происходит в соответствии с реакцией
Топливо + 02 -> С02 + н20 (4)
При температуре 25°С.
Поскольку в действительности Горение происходит при более высоких температурах (х°С), то
АНХ° = ДЯг205р + ff5°c Ср(С02) dT+
+ jfs* Cp(H20) dT+ ДНІс5пар(Н20) -
-125 Ср(топлива)dТ - |2°5° Ср(О2)dT. (5)
Уравнение (5) учитывает изменение теплоемкости продуктов сгорания при увеличении температуры от 25 до х°С и теплоты парообразования воды. Для С02, Н20 и 02 значения теплоемкости могут быть определены с помощью интегральных уравнений Спенсера, поскольку теплоемкость является функцией только температуры. В соответствии с этими расчетами для повышения температуры С02, Н20 и 02 от 25 до 400°С требуется соответственно 89,24; 174,8 и 86,99 кал/г. Теплота парообразования воды при 25°С равна 582,3 кал/г. Количество вещества, содержащего 1 г сухого горючего, рассчитывается на основании элементного анализа по содержанию углерода и водорода и при допущении, что разность приходится на кислород или продукты, теплоемкость которых остается постоянной. Единственным экспериментально определенным показателем является теплоемкость топлива, измерение которой производится с помощью дифференциально сканирующего калориметра. В табл. 6 приводятся экспериментально определенные ДНгор и поправки для расчета значений ДНгор различных топлив. Поправки на температуру по сравнению с суммарной теплотой сгорания невелики, хотя ими, безусловно, нельзя пренебрегать. Важным фактором при расчете является корректировка на теплоту испарения воды, образующейся в процессе сгорания вещества. Наибольшие поправки приходятся на целлюлозу с относительно высоким содержанием водорода. Поправка уменьшается для лигнинового топлива, имеющего мо-
|
Таблица 6. Теплота сгорания древесных топлив
|
Лекулярную структуру с большей ненасыщенностью. Поскольку доля теплоемкости образующихся газов по сравнению с теплотой парообразования невелика [уравнение (5)], поправка на теплоту сгорания будет изменяться с температурой незначительно.
Приведенные выше поправки были определены на сухую массу без учета содержания азота в воздухе. Для топлива с содержанием у% влаги потребуются дополнительные поправки, определяемые следующим уравнением:
АЯв*;ага = АН* - ^ 582,3 - ^0,435 (х - 25). (6)
Это уравнение учитывает количество горючего вещества, а также энергию, затрачиваемую на испарение и нагрев паров содержащейся влаги.
Аналогичным образом вводятся поправки на содержание неорганических веществ, особенно для топлива, состоящего из городских и сельскохозяйственных отходов, в которых содержится большое количество золы. Система сжигания топлива конструируется таким образом, чтобы снизить до минимума потери тепла, обусловленные содержанием в топливе влаги и продуктами сгорания; для этого горячие газы пропускают через свежее топливо. Кроме того, для увеличения эффективности топлив процесс горения следует проводить при более высоких температурах с тем, чтобы, насколько это возможно, полнее использовать тепло горячих газов.
Эффективность сгорания топлива и системы в целом зависит также от количества и температуры поступающего воздуха, содержащего около 21% кислорода и 78% азота. При недостатке кислорода происходит неполное сгорание топлива, а наличие в системе избытка воздуха приводит к ее охлаждению.
Теоретические расчеты скорости горения dw/dt (или динамики пламени) значительно сложнее, чем приведенная оценка теплоты сгорания. Скорость горения топлива определяется тепло - и массопередачей в системе, а также составом топлива и размером его частиц. При низких температурах скорость горения определяется кинетикой пиролиза; при высоких температурах, когда реакции протекают с большими скоростями, определяющим фактором становится тепло - и массопередача. Топлива с малыми размерами частиц, имеющими соответственно большую поверхность, сгорают быстрее, чем древесное топливо больших размеров, например бревна. Теоретические основы этого явления были установлены на, модельных образцах в идеализированных условиях. Выявленные законы могут быть использованы для определения основного направления процесса, однако из-за сложности последнего количественная оценка с их помощью довольно затруднительна.
Так, например, исследования кинетики горения клетчатки хлопчатника в стекле показали, что в интервале температур 259-341 °С субстрат
активируется под действием промежуточных продуктов, а также с изменением физических и химических факторов, образуя около 200 глю - козных соединений. Активированные молекулы в последующем подвергаются пиролизу, результатом которого являются летучие и углистые вещества. Кинетика пиролиза клетчатки может быть описана с помощью следующей модели:
Летучие вещества
TOC o "1-3" h z ^ w
К; v Клетчатка «Активная клетчатка» ^ , (7)
Wcell Wa
Углистое вещество + газы
|
Где D(Wcell) dt D(WA) Dt |
TOC o "1-3" h z Wc Wg
= ki [Wceii], (8)
= ki[Wctll]-(kv + kc)[WAl (9)
DWr
. -^ = 0,35kc{WAl (10)
В случае пиролиза чистой клетчатки в вакууме величины ки kv и кс соответственно равны Лс,= 1,7-1021е~(58000/Л7) мин-1, kv = = 1,9- 1016е~(47 3001 RT> мин~ 1 и /сс=7,9-1011<Г<36ооо/*7>мин-1.
В этом исследовании для решения или сведения к минимуму проблемы массопередачи путем удаления летучих веществ и предотвращения их вторичных реакций в нагретой зоне использовался вакуум. Несмотря на то что для сведения к минимуму проблем теплопередачи брались небольшие образцы, экспериментальные возможности были все же ограниченны, поскольку при температуре выше 400°С субстрат охлаждается вследствие быстрого образования продуктов пиролиза и ход реакции определялся в большей степени теплопередачей, чем кинетикой процесса.
Горение топлива начинается с пиролиза поверхностного слоя, который при соприкосновении с тепловым потоком термически разлагается на горючие летучие вещества и углистое вещество. Углистый «слой» по мере продвижения фронта пиролиза или нагретой зоны становится толще, и усиливается выделение летучих продуктов. Температурный профиль в поперечном сечении под действием теплового потока увеличивается, а под влиянием затраты теплоты на испарение продуктов пиролиза снижается. Такая система не может рассматриваться как чистая физическая модель, поскольку выделяющиеся продукты пиролиза могут реагировать с остающимся углистым слоем. Более фундаментальные сведения, чем данные о термической диффузии, необходимы для оценки
Температурного уровня превращений по схеме Н20 + С -» СО + Н2.
Скорость горения летучих веществ в большой степени зависит от аэродинамической характеристики системы. Горение летучих веществ в быстром и турбулентном потоке может быть объяснено с помощью теории диффузионных пламен. В соответствии с этой теорией соединения топлива реагируют с активными радикалами особенно с 'ОН, рассеянными в зоне горения, образуя вторичные свободные радикалы, которые затем окисляются. Следовательно, контакт между исходными компонентами топлива и окислителем незначителен.
|
(12) |
Анализ реакций окисления в зоне горения в случае относительно простых топлив выходит за пределы настоящей статьи. Однако следует отметить, что промежуточные превращения продуктов пиролиза не ограничиваются только реакциями между свободными радикалами. Наряду с ними имеют место реакции расщепления, дегидратации и дис - пропорционирования рассмотренных выше соединений типа Сахаров. В ходе этих реакций образуются промежуточные ненасыщенные продукты, последующая полимеризация и дальнейший пиролиз которых могут вызывать образование в газообразной фазе углистых частичек или сажи. Образование сажи при температурах около 700°С может происходить также по реакции
2СО?± С02 + С.
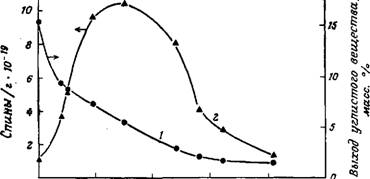
Остающееся после удаления летучих продуктов пиролиза углистое вещество характеризуется очень высокой пористостью и реакционной способностью, а также значительной адсорбционной способностью благодаря большой поверхности. Физико-химические свойства углистого вещества зависят от условий пиролиза. Исследования обуглероженной целлюлозы показали, что углистое вещество, образующееся при температуре 550°С (температура, легко достижимая в процессе пиролиза), имеет максимальную реакционную способность при наиболее развитой поверхности. Кроме того, для него характерна высокая концентрация свободных радикалов углерода (рис. 11).
Адсорбция поверхностью углистого вещества инертных газов (N2 или С02) представляет собой быстрый и обратимый процесс. Химическое взаимодействие на активных участках с кислородом представляет собой высокоэкзотермический процесс, протекающий с конечной скоростью при увеличении температуры. Хемосорбция кислорода углистым веществом сопровождается образованием оксидов (С-О и С = О), присутствие которых может быть обнаружено с помощью метода инфракрасной спектроскопии. Начальная теплота хемосорбции очень высокая (примерно 110 ккал/моль 02), но по мере сокращения активных участков она снижается, достигая уровня ~ 75 кал/моль 02. В то же время энергия активации (уравнение Еловича) линейно возрастает (от 13
до 25 ккал/моль при поглощении от 0 до 2,5 моль 02/г угтастого вещества).
|
(13) (14) |
Дальнейшие исследования показали, что образующееся из целлюлозы углистое вещество высокопирофорно и в контакте с кислородом может спонтанно воспламеняться при относительно низкой температуре. Механизм происходящих при этом реакций окисления неясен. Можно предположить, что первоначально молекулы кислорода адсорбируются поверхностью активных участков (С*), которые удерживают свободные радикалы. Как видно из рис. 12, в результате взаимодействия адсорбированного кислорода в последующем со свободными радикалами образуются С02, СО и новые радикалы. При 500°С такие комплексные реакции могут быть представлены в следующем виде:
02 + С -> С02 АН = - 88,5 ккал/моль, 02 + 2С -»• 2СО АН = - 22,9 ккал/моль.
На неполное окисление углистого вещества до СО расходуется лишь 1 /4 энергии, выделяемой при полном окислении углерода, и 1 /2 суммарной энергии по связываемому количеству кислорода. Поскольку реакции окисления углерода при достаточном количестве кислорода происходят активно и экзотермично, их скорость и, следовательно, скорость выделения тепла быстро увеличиваются. Это в свою очередь приводит к увеличению поверхностной температуры, в результате чего часть энергии излучается в окружающую среду.
|
Іг |
|
X |
|
|
|
О |
|
Too |
|
600 |
|
700 |
|
800 |
|
900 |
|
Рис. 11. Масса остаточного углистого вещества (1) и концентрация свободных радикалов (2) при различных температурах процесса пиролиза. |
|
Soo |
|
T, °С |
Отношение С0/С02 зависит от содержания различных анионов
|
О2 - Молекулярный кислород |
|
С(02)* Адсорбированный кислород |
И катионов в окисляющемся веществе: фосфаты и бораты увеличивают отношение С0/С02 и тем самым замедляют процесс горения; ионы натрия и калия уменьшают отношение С0/С02 и промотируют горение Ч
Горение со свечением в большой степени зависит от диффузионного проникновения кислорода в углистое вещество и от противоточной эмиссии СО и С02. В таком потоке в зависимости от условий СО окислится в С02 на раскаленной поверхности углистого вещества или может выводиться из зоны реакции, как это происходит при медленном горении. СО2 может частично обратно диффундировать в слой углистого вещества, где может восстановиться до СО. Оставшееся в продуктах горения количество СО не только уменьшит теплосъем, но и увеличит токсичность отходящих газов и загрязнение окружающей среды.
Интересно отметить, что при обогреве домов углем растительного происхождения раскаленный уголь покрывается золой, снижающей скорость горения и предотвращающей попадание токсичного СО в окружающую атмосферу.
* * *

 Опубликовано в
Опубликовано в