Превращения В карбонатных системах
 4 ноября, 2011
4 ноября, 2011  admin
admin Наиболее детально реакции взаимодействия карбоната кальция с щелочными карбонатами и сульфатами изучены в технологии производства стекла.
В работах Г. Таммана, В. Ольсена [ I 14] показано, что в стекольных содовых шихтах до взаимодействия компонентов с кремнеземом (ниже 600°С) образуется двойной карбонат Na_>Ca(C03)2. Диаграммы состояния систем NaC03 - СаСО. ч, К2С03 — CaC03, Na2C03 — К2С03 — СаС03 впервые получены П. Ниггли в 1913—1919 гг. [98, 115] ив дальнейшем уточнены Крёгером и др. [116, 117]. Согласно последним данным, Na2Ca(C03)2 плавится инконгруентно при 813°С и образует эвтектику вместе с Na2C03 и расплавом молекулярного состава 3Na2C03 • 2СаС03 около 780°С. Соединение К2Са(С03)2 плавится конгруентно при 814°С и образует две эвтектики: при 750°С с К2С03 и 790°С с СаС03; состав, по различным данным, находится в пределах 37—40 мол.% СаСОэ для первой эвтектики и ЗСаС03 • 2К2С03 —- для второй. Предполагалась возможность образования при давлении С02 более 50 атм соединения 2СаС03 ■ К2С03 [116]. В системе Na2C03 — СаС03 установлена область существования твердых растворов с содержанием до 28 мол.% СаС03. При увеличении концентрации кальцита в твердом растворе до 10—15 мол. % температура плавления возрастает от 860 до 873°С. П. Ниггли подчеркивал, что иссле-
44
Дование диаграммы в области плавления фаз затруднено в связи с тем, что, строго говоря, изучается система не совсем постоянного состава вследствие возможной потери С02 при диссоциации. Предполагая узкую область устойчивости, авторы [118] высказывали сомнения относительно возможности появления двойных карбонатов в процессе нагрева стекольных шихт. В технологии производства цемента двойные карбонаты впервые были идентифицированы И. Г. Лугининой [21, 119], показавшей их роль как интенсификаторов низкотемпературного взаимодействия в цементных смесях.
Исследования влияния щелочных сульфатов на превращения кальцита при нагревании весьма ограничены. Имеющиеся данные относятся в основном к процессам стекловарения, где изучены взаимодействия в присутствии восстановителя—углерода. Впервые эти исследования были проведены К. Г. Лакс - маном в 1764 году [120]. В последующих работах [115, 114, 120—122] показано, что в указанных условиях могут образоваться промежуточные продукты: CaS04, Na2C03, Na2Ca(C03)2, Na2S03, Na2S, CaS, Na2Ca(S04)2 и др. В своих выводах авторы единодушно утверждают, что взаимодействие между СаС03 и Na2S04 или K2S04 без восстановителя не протекает и возможна лишь последовательность реакций:
Na2S04 + 2С = Na2S + 2СОз, N%S + CaCQj = CaS + Na*C03, СаСрз + Na2CQ3 = Na2Ca(CO^)2.
С учетом высокого содержания щелочей и серы в обжигаемом в печи материале и известных из литературных источников ранних (первичных) взаимодействий примесей с карбонатом кальция нами продолжены исследования системы СаС03 с щелочными карбонатами и сульфатами. Первоначально для сравнения результатов были получены исходные кривые комплексного термического анализа (КТА) карбоната кальция при его разбавлении инертной добавкой MgO в том же количестве, в каком в последующем вводились примеси (рис. 20). На этом же рисунке приведены данные по системе СаС03 — Si02.
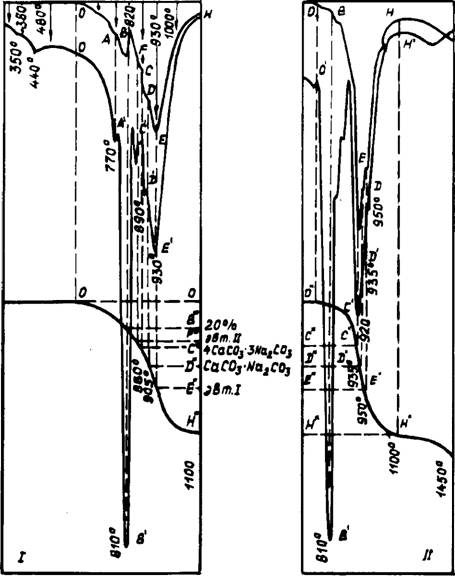
Результаты КТА смеси 2СаС03 + Na2C03 (рис. 21) свидетельствуют о многоступенчатой диссоциации карбоната кальция. Для идентификации тепловых эффектов проведен рентгено - фазовый анализ (РФА) промежуточных продуктов обжига в воздушной среде. Фиксированные температуры в интервале 300—1100°С обозначены на рис. 21 сечениями 1 —10.
45
Рис. 20. Результаты КТА смесей 66% СаСОз + 34%
MgO(l) и SiOi (И)
Проведенные исследования позволяют утверждать, что образование двойных карбонатов происходит уже при температуре
350—380°С (дифракционные отражения 6,0; 4,3 А). При 480°С эти максимумы приобретают заметную величину, постепенно возрастая к 710°С. Раннее образование двойных карбонатов связано, по нашему мнению, с модификационными превращениями Na2C03 при 350 и 440°С, которые в результате эффекта Хедвалла существенно интенсифицируют реакцию взаимодействия.
Справедливость данного вывода дополнительно подтверждается тем, что под воздействием реакции CaC03 + Na2C03 = = Na2Ca(C03)2 температура модификационного перехода у—Р Na2C03 снижается с 486 до 440°С. При 700°С остается некоторое количество Na2C03, которое вместе с Na2Ca(C03)2 дает эвтектический расплав при 770—780°С (А—А7). В последующем в присутствии жидкой фазы в реакцию интенсивно вступает
|
12 З * S 6 7 В 9 Ю
Рис. 21. Результаты КТА смеси 2СаСОз+Мв2СОя в воздухе (I) и Среде С02+Н20 (II) |
Остаточное количество Na2C03, и вследствие образования двойного карбоната состав переходячі область системы Na2Ca(C03)2 — СаС03 с кристаллизацией" расплава, что отмечается повышением температуры на кривой ДТА и подтверждается отсутствием отражений Ыа2СО$ на ^^■кетствующей рентгенограмме (сечение 5 при 790°Q. Пр^И^С происходит плавление Na2Ca(C03)2 с избыточным количеством СаС03 (В—В7).
47
Т а б,1 и її а 11
Интенсивность диссоциации карбонатов в зависимости от состава смесей
|
V |
Вы |
•имение С |
О. |
|||||
|
X X |
Доля, |
К, С '-10 J |
-JL |
Процессы, влияющие на выделение СО? в системе Ма_>СО. і СаСО:* |
Причина изменении скорости выделения COj |
|||
|
Ь- |
І Н |
СаСО, |
2СаСО, + N;ivCO( |
СаСО., |
2СаОО. + NaoCO. i |
£ |
||
|
1 |
380 650 760 |
3,8 |
0,9 7,3 |
1,9 |
0,2 2,9 |
1,6 |
Na2CO., + CaC03^Na2Ca (CO.,) 2 |
Эффект Хедвалла |
|
2 3 |
770 803 |
4,9 10 |
9,2 19 |
2.3 4.4 |
2,9 5,6 |
1,3 1,3 |
Плавление Na2CO;j — Na2Ca (СО f) 2 Кристаллизация Na2Ca(C03)2 —СаСОз |
Увеличение P(JQ Усвоение а2СО< |
|
4 5 |
810 860 |
12 32 |
20 25 |
4,9 14,5 |
2,5 6,4 |
0,5 0,4 |
Плавление Na2Ca(СО;<)2 - СаСОч Разложение эвтектики II 2Na2C03-3CaC0;( |
Увеличение Р<-(), Преодоление а расплава |
|
6 7 |
880 905 |
49 66 |
33 50 |
27,6 49,4 |
8,6 15,1 |
0,3 0,3 |
3Na, COl( ■ 4СаСОї + СаО + C02 f — -*Na2Ca(C0:ih + Ca0 + C02t-^ |
|
|
8 9 |
930 960 1 100 |
90 100 |
67 78 100 |
265 |
31.1 38.2 |
0,1 |
ЗЫа2С03-2СаС0.ч(эвт. І) +Са0 + С02|^ Na2CO. i + CaO + C02 f |
Повы шение основности расплава |
Рассмотрим последовательность выделении С02 из системы. Имеющиеся в литературе данные противоречивы. Отдельные исследователи [117] считают, что двойные карбонаты тормозят выход С02 из смеси, другие же [119, 123], напротив, признают за ними минерализующее действие как ускорителей диссоциации карбоната кальция. Следовательно, необходимо более детально и постадийно изучить указанный процесс.
Первоначально от 610 до 770 и 810°С (точки О, А, В, рис. 21, табл. 11) выделение С02 из смеси происходит интенсивней, чем из карбоната кальция, разбавленного в том же соотношении инертной добавкой — MqO (рис. 20). В присутствии Na2C03 потеря массы к 810°С составляла 20%, а с MgO — 12%. При 760°С константа скорости реакции (К) соответственно равна 2,9 • 10~2 и 1,9 • КГ2 с"1. Ускорение диссоциации может быть объяснено эффектом Хедвалла вследствие структурных перестроек кальцита при взаимодействии с Na2C03. Подобного же мнения придерживаются авторы [124].
После плавления вещества существенно замедляется выход С02 из системы — кратковременно в точке А и постоянно после точки В. Вероятно, это связано с повышением парциального давления С02 в образце, т. к. газовой фазе необходимо преодолевать энергию поверхностного натяжения пленки расплава.
Последующие ступени на кривых ДТА и ДТГ объясняются следующим образом. На участке В—С разлагается несвязанный карбонат кальция, при 880°С и составе 4СаС03• 3Na2C03 на рентгенограмме отсутствовали отражения кальцита. Дополнительно проведенные исследования при парциальном давлении С02 в 1 атм показали, что двойной натриево-кальциевый карбонат представляет собой твердый раствор, ограниченный составами СаС03 • Na2C03 и 4СаС03 • 3Na2C03. В присутствии СаО растворимость СаСОэ уменьшалась.
На участке С—Д (880—905°) выделяется С02 из избыточного растворенного кальцита 4СаС03 * 3Na2C03
3Na2Ca (С03)2 + СаО + С02. Точка Е соответствует эвтектике 2CaC0s-3Na2C03 и, следовательно, от точки Д до Е из расплава диссоциирует избыточный по отношению к эвтектическому составу СаС03. После 930°С (точка Е'"), несмотря на то, что в системе осталось еще 33% неразложившегося карбоната кальция, наблюдалось резкое замедление диссоциации СаС03. Скорость выделения С02 здесь практически на порядок ниже, чем для СаС03, разбавленного MgO, и составляет соот-
49
Ветственно К = 0,31 и 2,65 с-1.
Установленная нами зависимость—резкое снижение скорости диссоциации карбоната кальция в момент достижения эвтектической точки — в дальнейшем использовалась для быстрого определения эвтектического состава в карбонатсодержа - щих системах. Конечное разложение СаС03 в смеси с Na2C03 заканчивалось лишь при 1100°С, т. е. на 140°С выше, чем чистого карбоната кальция (рис. 20, 21). Остается необъясненным эффект в точке F. Как будет показано далее, перегиб в точке F обусловлен образованием ранее неизвестной эвтектики состава ЗСаС03- 2Na2C03, вызывающей торможение диссоциации СаС03.
Таким образом, проведенные исследования внесли определенную ясность в процесс диссоциации карбоната кальция с добавкой карбоната натрия. На начальной стадии, вследствие проявления эффекта Хедвалла, при взаимодействии Na2C03 с СаС03 ускорялась диссоциация последнего. В последующем в результате образования термодинамически более устойчивого двойного карбоната и возникновения расплава, особенно эвтектического состава, диссоциация существенно замедлялась и заканчивалась при более высоких температурах. Здесь проявились основные принципы кислотно - основного взаимодействия. В соединении Na2Ca(C03)2 кислый оксид С02 дополнительно связан с более основным щелочным оксидом, и поэтому выделение С02 из комплекса будет происходить труднее и при более высокой температуре, чем из кальцита.
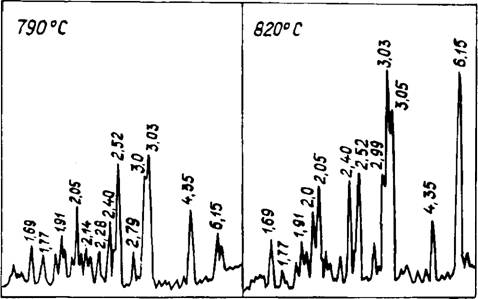
При анализе рентгеновских данных двойного карбоната следует обратить внимание на различную интенсивность максимумов (рис. 22). Так, до температуры плавления соли при 790°С величина отражения d = 6,15А в 3 раза ниже, чем d = = 2,52 А; через 30° при 820°С, напротив, высота первого пика в 3 раза выше второго. Подобное соотношение сохранялось до 880°С, когда в двойной соли еще имелся избыточный карбонат кальция. После обжига при 920°С, когда появлялся Na2C03
К с к самостоятельная фаза, соотношение пиков 6,15 и 2,52А выравнивалось. Имеющиеся в различных источниках [119, 125, 126] рентгеновские данные этой соли достаточно противоречивы, поэтому автором проведены дополнительные исследования для уточнения значений и интенсивностей дифракционных отражений двойных карбонатов. Синтез соединений с различным соотношением исходных компонентов производился нагревом до 860°С (выше температуры плавления составов) в
50
|
Рис. 22. Превращения в смеси СаСОз + ЫагСОз при нагревании |
Лабиринтных тиглях с одновременным КТА на дериватографе MOM. Лабиринтные тигли обеспечивали атмосферное парциальное давление С02 в системе, что предотвращало диссоциацию карбоната. Контроль осуществлялся по отсутствию потери массы вещества. Результаты РФА продуктов синтеза представляют достаточно интересную зависимость. При мольном отношении CaC03:Na2C03 менее 1,2:1 максимальную интенсивность кмеет пик 2,52А, затем 4,37; 2,99; 6,15 А. При увеличении доли СаС03 на 33 мол. % (отражения кальцита отсутствуют) максимальное значение переходит на d = 6,ISA, затем 3,07, 2,52;
2,05А.
При уменьшении количества СаС03 в смеси 2СаС03 -(- + 3Na2C03 высота пика 6,15 А снова уменьшалась до уровня d = 2,52 А. В присутствии СаО уменьшалась растворимость СаС03 в соединении, и максимум 6,15 А для состава 4СаС03 • • 3Na2C03 снижался. В смеси 2СаС03 + 3Na2C03 с добавлением СаО пик 6,15 А, напротив, увеличивался. Рентгеновские характеристики двойного карбоната в зависимости от состава и условий синтеза сведены в табл. 12. Величины межплоскостных расстояний изменяются незначительно, в отдельных случаях в третьем знаке после запятой, поэтому в таблице приведены средние значения. Существенные отличия наблюдались в интенсивности отражений.
51
|
|
|
Рис. 23. Диаграмма состояния системы СаСОз—ЫагСО} при парци - альиом дм лен ии С02 кПа. |
Проведенные исследования позволили уточнить диаграмму состояния системы Na2C03 — СаС03 (рис. 23) с конкретизацией области существования двойных карбонатов. Установлено, что двойные соли образуют непрерывный ряд твердых растворов с предельными границами от 4CaC03-3Na2C03 до СаСОз *
• Na2C03. Максимальную температуру плавления — около 806°С имел состав 6СаС03 • 5Na2C03. С увеличением доли карбоната кальция до ЗСаС03 • 2Na2C03 температура плавления снижалась на 3—4°С, что свидетельствует о существовании ранее неизвестной второй эвтектики в точке F. Согласно [118], двойной карбонат СаС03 • Na2C03 плавится инконгру - ентно с образованием перитектики. Уточненная нами диаграмма исключает такой вариант и свидетельствует, что инвариантная точка несколько смещена вправо, где твердый раствор состава 6СаС03 • 5Na2C03 плавится без разложения.
Комплексный ТА смеси 2СаС03+Na2C03 в среде С02 и водяных паров при парциальном давлении около 30 кПа, т. е. в условиях, соответствующих атмосфере промышленных печей, показал те же зависимости. В среде С02 процессы диссоциации существенно смещены в область высоких температур (рис. 21). Перегибы кривых ДТА и ДТГ соответствуют составу 4СаС03 •
• 3Na2C03. В атмосфере водяных паров происходит более интенсивное взаимодействие СаС03 с Na2C03, в результате
52
Чего в твердой фазе заканчивается образование двойного карбоната, и поэтому на кривой ДТА не проявлялся эффект при 770°С. Возгонка Na2C03 из смеси начиналась при температуре 1250°С.
Т а блица 12
|
Рентгеновские характеристики двойных карбонатов в системе СаС03 — Na2C03 в зависимости от условий синтеза
|
|
1 2 03 *5 6 7 В 9
Рмс. 24. Результаты КТА смеси СаСОз+К2СОз в воздухе (I) и среде С02+Н20 (II) |
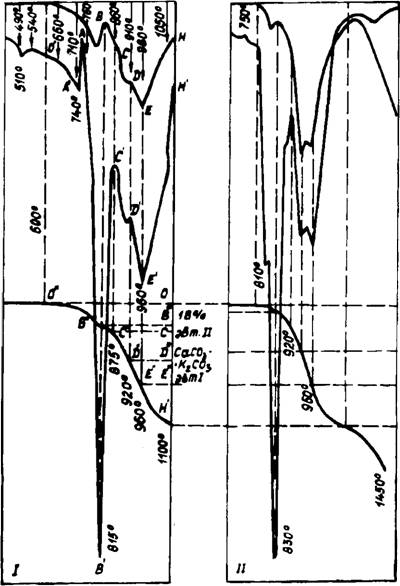
Последовательность процессов в системе СаС03—К2С03 (рис. 24, 25) аналогична наблюдаемой в системе СаС03 — Na2C03. Взаимодействие начиналось несколько позднее и заметно при 490°С. При 540°С четко проявляются новообразования двух фаз: К2Са(С03)2 и, как будет показано далее, фаза, более обогащенная СаС03. К 7Ю°С двойной карбонат
К2Са(С03)2 с основным максимум 3,19 А и новая фаза с d =
54
|
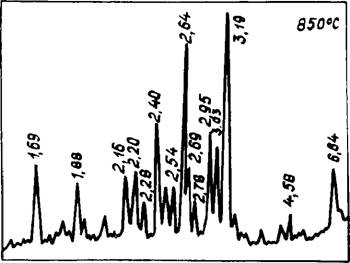
Рис. 25. Рентгенограмма смеси СаСОз + К2СО3 при 850°С |
= 2,95 А имеют практически равное соотношение, при этом в значительном количестве присутствовали несвязанные К2С03 и СаС03. Вследствие этого в начале плавления эвтектического состава (740—750°С) наблюдалось интенсивное взаимодействие компонентов с кристаллизацией расплава и значительным разогревом смеси (точка А7). Дальнейший ход процесса достаточно наглядно демонстрируется КТА и рентгенограммами. Заканчивалась диссоциация СаС03 при 1100°С, одновременно происходила интенсивная возгонка К2С03.
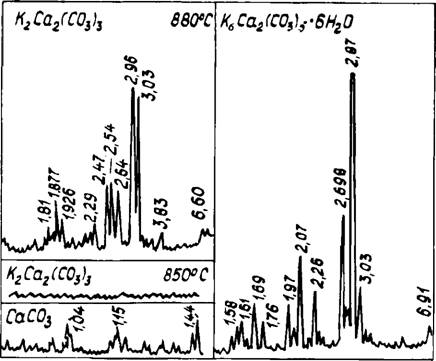
Отличительной особенностью данной системы по сравнению с системой СаС03 — Na2C03 является наличие двух самостоятельных соединений. Специально проведенным синтезом при парциальном давлении С02 в одну атмосферу нами получен двойной карбонат состава К2Са2 (С03)3 (рис. 26). Рентгеновские характеристики приведены в табл. 13. В связи с тем, что некоторые максимумы совпадали с основными рентгеновскими отражениями кальцита, дополнительно проводились РФА в пределах двойных углов от 64 до 110° и кристаллооптические определения. Приведенные на рис. 26 рентгенограммы однозначно свидетельствуют об отсутствии кальцита в составе соединения К2Са2(С03)3. Исследования иммерсионных препаратов под микроскопом подтвердили монофазность соединения с показателями преломления Nq= 1,530 и Np = 1,525.
Оба состава двойных карбонатов образуют ограниченные
55
Т а б л и п а 13
|
Рентгеновские характеристики ^Ca^CO^bj
|
Области твердых растворов между собой и с исходными компонентами, которые распространяются на 2—3 мол. % от стехиометрического состава. На рентгенограммах при этом наблюдалось некоторое изменение величин межплоскостных расстояний. При избытке К2С03 двойные карбонаты активно поглотают влагу из атмосферы и гидратируют с образованием кристаллогидрата К6Са2(С03)5 • 6Н20. На рис. 26 приведена рентгенограмма данного соединения. Следует отметить, что в некоторых источниках [127] фазе с приведенными рентгеновскими отражениями приписывается состав боичлита К2Са(СОэ)2. Однако специальная проверка на количественное содержание Н20 и стехиометрию компонентов, а также сопоставление максимумов с данными Винчела [128] подтверждают, что полученные рентгеновские характеристики соответствуют кристаллогидрату приведенного состава.
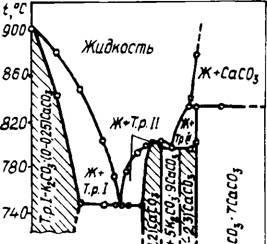
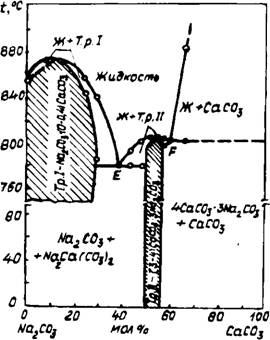
На основании термических, рентгеновских и петрографических исследований автор построил уточненную диаграмму состояния системы К2С03 — СаС03 (рис. 27). В отличие от работы [126] показана возможность образования соединения К2Са2(С03)3 не при высоких давлениях С02(более 50 атм), а при атмосферном давлении углекислоты и даже в открытой системе. Кроме того, установлена область существования твердых растворов (заштрихованная часть диаграммы). Компоненты К2С03 и К2Са(С03)2 образуют эвтектику при мольном отношении около 5К2С03 • ЗСаСОа с температурой плавления 745°С, а в системе К2Са (С03)2 — К2Са2 (С03) 3 состав эвтектики 2К2С03 • ЗСаС03, температура плавления 795°С. Соединение К2Са (С03)2 плавится конгруентно при 800°С, а К2Са2(С03)3 — с разложением при температуре 830°С на жидкость и СаС03.
56
|
Рис. 26. Рентгенограммы К2Са(СО:1Ь; СаСОз и К6Са2(СО;})5 ■ 6Н20 |
Окончательное плавление данного состава происходило при 835°С.
Следует обратить внимание на тот факт, что при 900°С до разложения кальцита расплав состоял из 33 масс. % К2С03 и 67% СаС03. Следовательно, при 2—4% К20 в материале вращающейся печи, содержание К2С03 может составлять 3—6% и вместе с СаС03 образовать 10—20% жидкой фазы в зоне декарбонизации, что сравнимо с количеством высокотемпературного расплава при спекании клинкера. По скорости истечения через калиброванное отверстие определена вязкость расплава, которая при 860°С составила около 1 мПа • с, т. е. сравнима с вязкостью воды. Таким образом, в присутствии незначительного количества калиевых соединений в обжигаемой смеси в зоне декарбонизации печи могут образоваться двойные карбонаты К2Са2(С03)3 и К2Са(С03)2, которые обеспечивают получение значительного количества высокоподвижного расплава, интенсифицирующего образование низкоосновных клинкерных минералов.
В среде С02 + Н20 процессы в системе К2С03 — СаС03 протекают так же» как в атмосфере воздуха, лишь незначитель-
57
|
«•jf w+cc- 500 КгС03 ~9кгС03-дСа ео: |

|
Во 100 CaCOj |
|
МОП У о |
20
Иёсо5
Рис. 27. Диаграмма состояния системы СаСОз—К2СОз при парциальном давлени СО2 101,3 кПа
Но повышается температура диссоциации карбоната кальция, особенно на начальной стадии. Под воздействием водяных паров существенно ускоряются все реакции, и в значительной мере интенсифицируется возгонка К2СОэ из-за образования более летучих гидрооксидов.
Рассмотрим системы СаС03 — R2S04. Как уже отмечалось, указанные системы изучались при стекловарении в присутствии восстановителя. Относительно взаимодействий в окислительной среде имеется лишь упоминание, что СаС03 и Na2S04 образуют эвтектический расплав при 795°С [114, 120]. В цементных вращающихся печах сульфаты щелочных металлов являются наиболее распространенными примесями, поэтому представляется целесообразным детальное исследование процессов в системах СаС03 — R2S04.
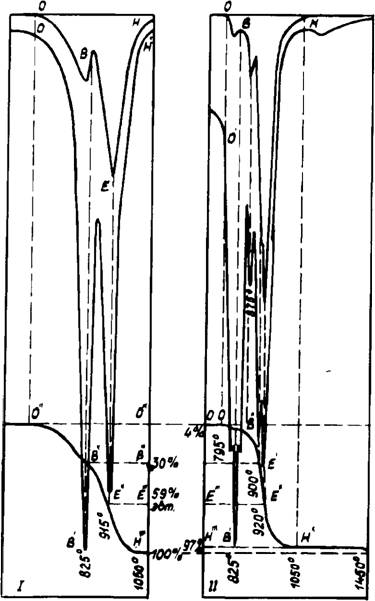
Комплексный ТА смеси 2СаС03 + Na2S04 (рис. 28) показал, что на начальной стадии в воздушной среде, так же, как при добавке R2C03, ускорялась диссоциация СаС03, затем после плавления эвтектики (825°) наблюдалось первое торможение выхода С02> и при достижении эвтектического состава 6Na2S04 • 5СаС03 — второе значительное замедление указанного процесса. Рентгенофазовым и петрографическим анализами
58
|
Рік. 28. Результаты КТА смеси СаСОз + Na2S04 В воздухе (І) и среде С Or (II) |
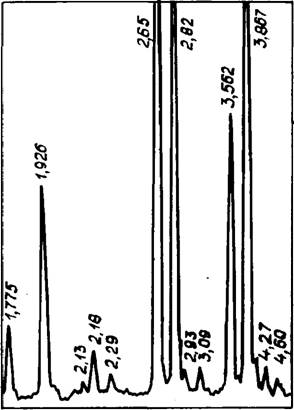
Установлена область существования твердых растворов между высокотемпературной а — модификацией Na2S04 и СаС03, которая при комнатной температуре ограничивается составами 10Na2S04 • СаС03 — 4Na2S04 * СаС03. Рентгеновские характеристики (рис. 29, табл. 14) твердого раствора (полученные при использовании в качестве внутреннего стандарта MgO) соответствуют а — Na2S04, в зависимости от соотношения ком-
59
|
Рис. 29. Рентгенограмма 4Na2S04 • CaCCb |
Понентов изменяются межплоскостные расстояния и интенсивность максимумов. Сравнительные данные, приведенные в табл. 14, показывают, что при внедрении СаС03 в Na2S04 вначале происходит сжатие решетки, а затем после достижения отношения Na2S04:CaC03 = 4,5:1 — снова расширение. Это свидетельствует о том, что в решетку а — Na2S04 при наличии избытка СаСОэ может внедриться более 20 мол. % карбоната кальция. Кроме того, фаза 4Na2S04 • СаС03 с Ng = 1,468; Np= 1,46 и Nm = 1,466 обладает более высокой энергией связи элементов кристаллической решетки, и поэтому у нее выше температура плавления.
Диаграмма состояния системы Na2S04 — СаС03, впервые изученная автором, подтверждает, что максимум на ликвидус - ной кривой находится в области твердых растворов состава 4,5 Na2S04 • СаСОэ с температурой плавления 915°С, что на 30° выше температуры плавления Na2S04 (рис. 30). Диссоциация СаС03, внедренного в решетку Na2S04, наступает при температуре выше 960°С, что свидетельствует об увеличении
60
Т а б л и ц а 14
|
Рентгеновские характеристики ряда твердых растворов N&2S04 — СаС03
|
Энергии связи С02 в карбонате кальция. В данном случае, вероятно, мы имеем фазу, принадлежащую к бертоллиду Курнакова, когда «соединение, на котором основана фаза, лежит за пределами области гомогенности» [129, 130]. Установленная автором температура плавления эвтектики равна 825°С, состав — 6Na2S04 • 5СаС03. При первичном нагреве смеси СаС03 + Na2S04 при 795°С на кривой ДТА наблюдается небольшой эндотермический эффект, который увеличивается при изменении концентрации СаСОэ от 2,5 до 9 мол. %. РФА образцов до и после эффекта, показал, что здесь заканчивается растворение СаС03 в а — Na2S04 и возможно образование временного расплава в тройной системе СаС03— Na2S04 — твердый раствор. При охлаждении и повторном нагреве любого состава термический эффект при 795°С не воспроизводился.
При нагреве смеси СаС03 + Na2S04 в воздушной среде, как
61
О
^UNa^SO^CacOjKaai3 t
0
|
T°c |
|
|
|
920- |
|
880 |
|
04 a |
|
800- |
|
2 40 і
|
|
Рис. 30. Диаграмма состояния
|
Маг50± мили/о сас02
И следовало ожидать, не обнаружено обменных реакций. Действительно, свободная энергия Гиббса реакции
|
|
Рассчитанная для 1100 К (823°С) по методике [131] с использованием приведенной энергии Гиббса Ф"тпо уравнению
Ag(;=ащ>98- дф; - т,
Равна Л G°ioq = 36,76 кДж/моль. Большое положительное значение AG процесса свидетельствует о невозможности прямой реакции и о сдвиге термодинамического равновесия влево, к исходным компонентам. В среде С02 и особенно атмосфере продуктов горения газообразного топлива заметны обменные химические взаимодействия. Так, на кривых ДТА и ДТГ (рис. 28) проявляются дополнительные термические эффекты, при этом конечная потеря массы несколько меньше, чем в воздушной среде, вследствие образования комплексных карбонат- содержащих солей. Петрографическим и рентгенофазовым анализами при соответствующих температурах установлены соединения, приведенные ниже.
62
|
|
|
---------- g. І0°/о |
|
*т9клнм<а БСоСОгЖгЗО* 69<Ґo ЮО*/о |
|
Рис. 31. Результаты КТА смеси СаСОз+ K2SO4 в воздухе (I) и Среде С02 (II) |
В системе СаС03 — K2S04 процессы протекают несколько иначе, чем в смеси с сульфатом натрия. В воздушной атмосфере (рис. 31) вследствие более высокой температуры плавления эвтектики (около 880°С), когда разложилась значительная часть СаСОэ, не удается идентифицировать ее состав. Вероятно, небольшая доля СаС03 внедряется в K2S04, т. к. на последней
63
Т а б л и її а I 5
Состав соединений, полученных при нагреве смеси 2СаС03 + Na2S04 в среде продуктов горения пропана
Температура, °С
|
740 |
|
760 |
815
2їа >SOi • Na»CO. 3Na->SO. i • CaSOj Na2CO:i 2Na, SO, • a, CO. 3Na, S(VCaSO, CaS04; CaO Na2Ca(CO.,h
2Na, S01.Na2C0
а>Са(СОі); 3Na, SO,-CaSb, CaO; CaSOj
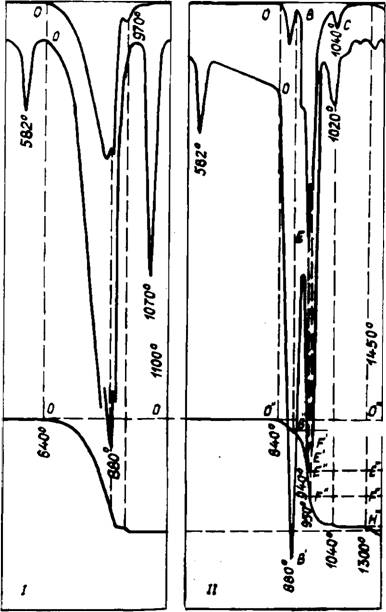
Стадии диссоциации карбоната наблюдалось заметное торможение потери массы. Дополнительно это подтверждено РФА по уширению межплоскостных расстояний кристаллической решетки K2S04 в присутствии СаСОэ, а также снижением в среде С02 величины и температуры (с 1070 до 1020°С) эффекта плавления K2S04. Величины потери массы при этих температурах показывают, что в K2S04 может раствориться до 5 мол. % или 3 масс. % СаС03.
Путем КТА в среде С02 (рис. 31—2) в лабиринтных тиглях установлен состав эвтектики — 6СаС03 • 5K2S04 с температурой плавления 880°С. В окислительной среде возгонка щелочных сульфатов начиналась после 1300°С. Водяные пары значительно ускоряют летучесть сульфатов после 1100—1200°С, и к 1450°С K2S04 и Na2S04 практически полностью возгоняются.
Обменная реакция СаС03 + K2S04 CaS04 К2С03 в окислительной среде вправо не идет, свободная энергия Гиббса ее AG® = +56,32 кДж/моль. Следовательно, равновесие сдвинуто влево к исходным компонентам.
В продуктах горения газообразного топлива, т. е. в атмосфере промышленных печей при 810—840°С установлены соединения 2CaS04 • K2S04, CaS04, К2Са(С03)2 и К2Са2(С03)3, что свидетельствует о химическом взаимодействии, протекающем в среде С02 и Н20.
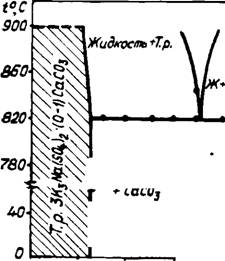
Во вращающихся печах наиболее распространенными примесями являются щелочные сульфаты при отношении K2S04 к Na2S04 как 3:1, что соответствует составу глазерита. Поэтому интересно проследить, как данный состав сульфатов повлияет при нагревании на превращения СаС03. Установлено, что эвтектика в системе глазерит — карбонат кальция близка к составу 5СаС03 • 4K3Na (S04)2 при массовом содержании кальцита около 27% и температуре плавления 820°С. В глазерите
64
|
II |
|
О 20 K3Na(SQ<)z |
|
СаСОг |
|
'Рис. 32. Диаграмма состояния си - Yqo стемы СаСОз—K3Na(S04)2 при пар- СаСОї Им*льиом давлении С02 101,3 кПа |
|
40 60 ИОЛ We |
Способно раствориться до 10 масс. % СаС03. Диаграмма состояния системы глазерит — карбонат кальция показана на рис. 32.
Таким образом, в результате проведенных исследований установлено, что щелочные карбонаты и сульфаты в газовой среде промышленных печей взаимодействуют с карбонатом кальция. При этом образуются двойные соли и твердые растворы различных составов, которые на начальной стадии ускоряют, а на конечной — задерживают диссоциацию СаС03. В реальных промышленных условиях при концентрации щелочных оксидов 2—4% может образоваться до 10—20% расплава в интервале 800—900°С, что значительно ускорит реакции низкотемпературного взаимодействия между основными компонентами портландцементной шихты.
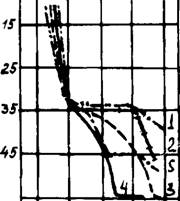
Газовая среда влияет не только на скорость декарбонизации кальцита, но и на интенсивность возгонки щелочных солей. Для уточнения этого была приготовлена смесь, состоящая из СаС03 с 20 масс. % K2S04. Изучалось влияние воздушной, окислительной, нейтральной, восстановительной и изменяющейся в процессе анализа среды. Результаты приведены на рис. 33 и показывают, что действительно газовая среда задерживала начало диссоциации карбоната кальция приблизительно на 100°С по сравнению с воздушной.
Особо сильное воздействие оказывала атмосфера на лету-
65
|
S |
|
|
|
Щ |
|
Рис. 33. Влияние газовой среды на возгонку K2SO4 из смеси СаСОз— |
|
SS О |
|
K2SO4 |
700 300 Н00 1300 1500 Температура, °С 1—воздушная; 2—окислительная; 3—нейтральная; 4—восстановительная; 5—от 0 до 1000°С и от 1150 до 1400°С—окислительная, от 1000 до 1150—восстановительная
Среда
Честь сульфатов калия: чем выше восстановительная способность среды в печи, тем интенсивней идет возгонка. В окислительной среде улетучивание K2S04 наступало с 1320°С, в восстановительной — уже с 900° и заканчивалось к 1200°С. В печи в результате плохого смешения топлива с воздухом или направленности факела на материал может возникнуть местная восстановительная атмосфера (режим 5, рис. 33). Как установлено, даже кратковременное воздействие восстановительной среды при температурах от 1000 до 1150°С резко ускоряло возгонку S03 в этом интервале, которая прекращалась около 1320°С при смене среды на окислительную.


 Опубликовано в
Опубликовано в