Превращения В карбонат-силикатных системах
 4 ноября, 2011
4 ноября, 2011  admin
admin Реакции в карбонат-силикатных системах в присутствии щелочных соединений достаточно подробно исследованы при высоком содержании Si02 в шихте при производстве стекла [120, 117]. Показана возможность образования низкоосновных силикатов кальция и щелочей при температурах ниже 1000°С, при этом важная роль отводится двойным карбонатам — R2Ca(C03)2. В технологии цемента также детально изучено взаимодействие между двумя основными компонентами сырьевой смеси СаС03 и Si02 [39, 42, 132—135]. Общее мнение сводится к тому, что твердофазовые реакции в основном проте-
•6
кают выше 1100°С с образованием C2S. Исследованиями [136] установлено, что уже при относительно низкой температуре в реальных портландцементных смесях реакции протекают с участием жидкой и газообразной фаз, вследствие чего заметное взаимодействие между СаС03 и Si02 может наступать уже при 750—800°С.
Большая роль при этом принадлежит легкоплавким щелоче - и серосодержащим примесям. Многочисленными работами [22, 39, 85, 42, 137—147] установлено, что до 1200°С щелочные соединения ускоряют процессы образования низкоосновных силикатов кальция, особенно C2S. О воздействии их при высоких температурах имеются противоречивые мнения, в отдельных случаях отмечается каталитическое действие R20 на алито - образование [143, 148], однако подавляющее число авторов [42, 83, 85, 144, 149—151] считают, что щелочные примеси задерживают усвоение извести на конечной стадии обжига при 1400—1450°С. По влиянию сульфата кальция все исследователи пришли к выводу, что CaS04 ускоряет процессы клинкерообразования на всех стадиях обжига [152—163]. В последние годы в работах [100, 105, 113, 164—166] и нашими исследованиями [33—35, 167] показана существенная роль промежуточных, временно существующих фаз в процессах клинкерообразования. В присутствии щелоче - и серосодержащих примесей при определенных условиях синтеза получены двойные соли: карбонаты, сульфаты щелочных металлов и кальция, си - ликокарбонат и силикосульфат кальция различных составов.
Имеющиеся литературные данные о роли R20 и S03 в основном носят качественный характер; практически отсутствуют количественные данные по содержанию промежуточных новообразований при обжиге портландцементных смесей. Кроме того, влияние указанных оксидов рассматривается при их ограниченном содержании, как незначительных примесных добавок. В первой главе показано, что суммарное содержание R20 и S03 в материале промышленных печей иногда превышало сумму двух основных оксидов шихты (А1203 + Fe203), и поэтому, исходя из реальных производственных условий, необходимо исследование процессов в системе СаС03 — Si02 при высоком содержании щелочей и серы. Кроме того, необходимо оценить взаимное влияние физико-химических и тепловых процессов, протекающих в указанных условиях.
Для исследования готовились смеси из карбоната кальция и кремнезема, рассчитанные на образование C2S, C3S и смеси
67
|
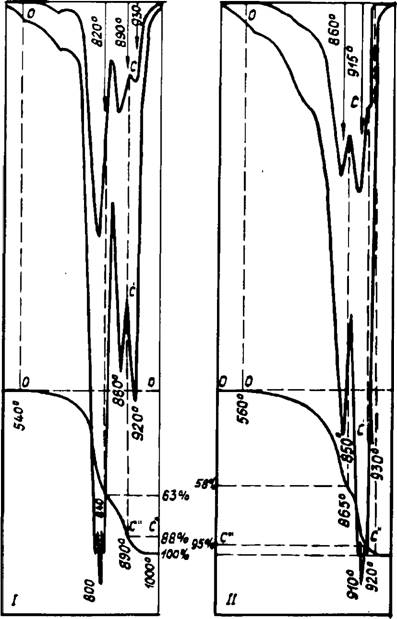
Рис. 34. Результаты КТА смеси 2,7 СаСОз + SiOj> с добавкой 8% (К2СОз (I) и 8% K2S04 (II) в воздушной Атмосфере |
Силикатов кальция с КН = 0,9. К смесям добавлялись примеси в виде сульфатов или карбонатов калия (5%) и натрия (3%) или только калия (8%). Смеси обжигались при различных температурах от 600 до 1450°С. В продуктах обжига определялась СаОсв. Состав и последовательность выделения новообразований устанавливались по данным изучения микропре-
68
|
1 2 З
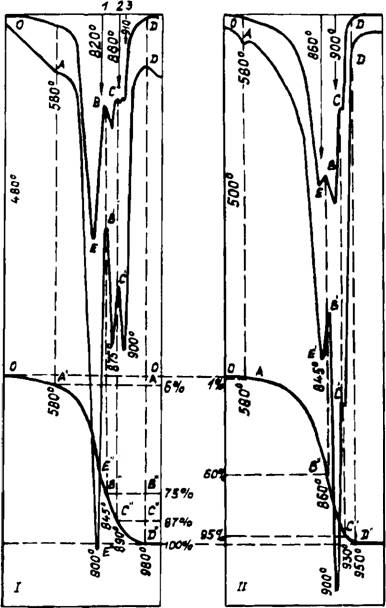
Рис. 35. Результаты КТА смеси 2,7 CaC0iH-Si02 с добавкой 8% К2СОз (I) и 8% K2S04 (II) в среде продуктов горения газообразного топлива |
Паратов в иммерсии, РФА и КТА.
Результаты анализов показали, что при добавлении щелочных солей взаимодействия в смеси СаСОэ — Si02 значительно усложняются. Комплексный ТА повышенной чувствительности, проведенный в воздушной атмосфере, в среде С02 и продуктах горения пропана, во всех случаях выявил три ярко выраженных
69
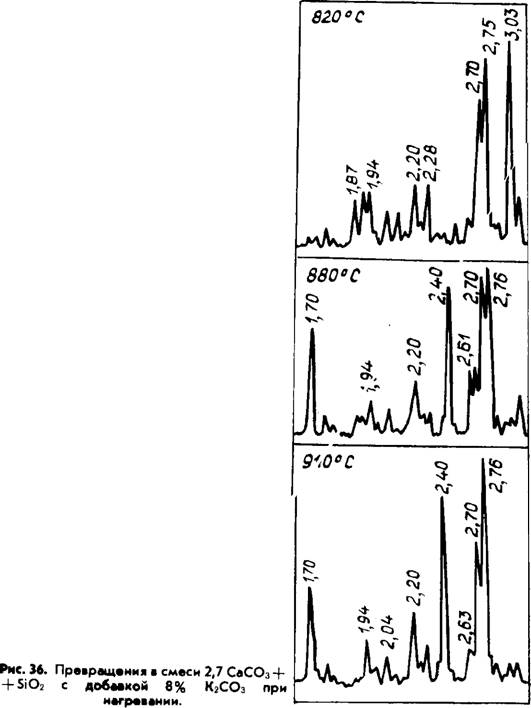
Эндотермических эффекта. Имеющиеся литературные данные, в том числе и наши ранние работы, не совсем точно трактовали значение отдельных эффектов, т. к. не учитывали значительное торможение процесса диссоциации карбоната кальция при образовании расплава в системе. Для примера на рис. 34, 35 приведены результаты КТА смеси 2,7 СаС03 + Si02 с 8 масс. % К2С03 и K2S04. В смесь Si02 вводилась в виде безводной кремниевой кислоты. Расшифровка отдельных эффектов с помощью РФА (рис. 36) показала, что на первой и второй стадиях (сечения 1 и 2) С02 выделяется из несвязанного СаС03. Плавление части смеси при 800 и 845°С приводит к резкому снижению скорости диссоциации СаС03. В последующем в сечениях С—С" при 890 и 920°С соответственно в I и II смесях заканчивается разложение чистого карбоната кальция, и С02 начинает выделяться из промежуточных комплексных фаз.
Рентгеновский анализ свидетельствует, что такими фазами в первой системе являются К2Са(С03)2 и 2 C2S • СаС03, во второй — спуррит. Необходимо подчеркнуть, что в обоих случаях первичной силикатной фазой является двухкальциевый силикат а'т — модификации. Причем в смеси с К2С03 ортосили - кат кальция образуется интенсивно при относительно низких температурах. При 840—850°С после возникновения расплава количество ц', — C2S достигает максимального значения. В это же время практически отсутствует свободная известь, а К2С03 связан в двойной карбонат. Последующий нагрев смеси до 880°С (сечение 2) приводит к образованию спуррита из двух - кальциевого силиката и кальцита и диссоциации остаточного СаС03 с выделением избыточного оксида кальция. Обычно считалось, что спуррит может образоваться лишь в среде углекислого газа. Данные эксперименты показали, что при значительной концентрации щелочных солей 2C2S • СаС03 может быть получен и в воздушной среде. На основании КТА установлено, что 13% СаС03 в первой смеси и 5% во второй связаны в промежуточные соединения. Сделанные на основании этого расчеты показали следующий состав в масс. %.
|
7Viiu'p;tr vpa. С |
І |
||||
|
Скч ь |
C,.s |
_'<: S • СаСО. |
K,.Ca(CO, h К, SO, |
СаО |
1 880 47 28 18 7
2 900 53 24 1112
70
|
|
При сравнении результатов КТА и РФА видно, что на начальной стадии диссоциация СаС03 значительно интенсивней протекает при добавлении К2СОа, начало процесса заметно уже при 470°С. Это объясняется тем, что при низких температу-
71
Pax происходит взаимодействие карбонатов
К2С03 + СаСОз = К2Са (СОэ)
Последние образуют с К2С03 эвтектику при 750°С, после чего реакция протекает с значительным количеством расплава, особенно при 800°С. Согласно [ 121 ], в дальнейшем протекает реакция:
2К2Са(С03)2 + Si02 = 2К2С03 + C2S + 2СО?
Высвободившийся К2С03 вновь реагирует с СаС03, и цикл повторяется. Учитывая, что в щелоче-карбонатном расплаве частично растворяется Si02, можно понять, что к 840— 850°С уже весь кремнезем связан в двухкальциевый силикат. Приведенные реакции идентичны и для Na2C03, и поэтому далее будет применяться индекс R.
Реакция (2) объясняет ускорение процесса выделения С02 из карбонатов. Несмотря на то, что температура диссоциации R2Ca(C03)2 выше, чем СаС03, но, вследствие жидкофазного взаимодействия по реакциям (I, 2), происходит постоянное выделение С02 и растворение новых порций СаС03. В стекольных шихтах при избытке кремнезема в данном температурном интервале Si02 взаимодействует с R2C03 и разлагает его с образованием щелочных силикатов. При избытке же СаС03, как установил Ниггли [115], реакция между R2C03 и Si02 не происходит, т. к. сила связи СаО—С02 значительно слабее, чем R20 — С02. Следовательно, в цементных шихтах карбонаты щелочей проявляют себя как типичный катализатор, транспортирующий Si02 и СаС03 через жидкую фазу и тем самым снижающий энергию активации реакций разложения СаС03 и образования C2S. Завершается образование двух - кальциевого силиката при 845°С в сечении В—В", когда разложилось 73% СаСОэ — именно столько, сколько необходимо СаО для связывания Si02 в C2S. До этой температуры выделившаяся известь не остается в свободном состоянии.
|
(3) (4) |
На второй стадии обжига в смеси с К2С03, несмотря на повышение температуры, наблюдается значительное замедление выделения С02. Во-первых, это обусловлено наличием расплава, а во-вторых, завершением реакции (2). На последней стадии после С—С" одновременно протекают реакции:
2QS • СаСОз — 2QS + СаО + СО К2Са(С03)2 = К2С03 + СаО + СО
Причем реакция (3) проходит несколько раньше, д. к. основность К2С03 выше, чем C2S, и поэтому связи в двойном карбонате прочнее, чем в спуррите. Таким образом, температура выделения С02 из соединений увеличивается в ряду:
2C>S • СаСО
СаСО
Где 1 ^ // ^ О
Остается еще объяснить роль щелочных солей при образовании спуррита. При температуре около 800°С в системе СаС03 — C2S силикокарбонат термодинамически более устойчив, чем смесь компонентов, однако без каталитических примесей в смесях CaC03+Si02 реакция 2СаО+Si02 = C2S заметно протекает после 1100°С, когда карбонат кальция уже разложился, и поэтому не присутствуют одновременно необходимые для образования спуррита компоненты. Действительно, при сравнении скорости диссоциации СаС03 в смесях CaC03 + Mg0 и CaC03+Si02 (рис. 20) видно, что до 1000°С Si02 проявляет такую же инертность по отношению к СаСОэ, как и MgO, кривые КТА совершенно идентичны.
|
|
Щелочные соединения, обеспечивающие низкотемпературное плавление вещества, снижают температуру образования C2S до 700—800°С и одновременно задерживают диссоциацию карбоната кальция. Таким образом обеспечивается контакт необходимых фаз; кроме того, вследствие активного расплава, преодолевается активационный барьер и легко получается спуррит. При этом возможно, что, как утверждается в работе [176], процесс идет через образование низкоосновных силико - карбонатов кальция типа тиллеита.
При добавлении менее активных по отношению СаС03 щелочных сульфатов также получается спуррит, но в меньшем количестве. На начальной стадии R2S04 активизируют диссоциацию СаС03 и образование C2S в меньшей степени, чем R2C03. На завершающей стадии выделение С02 заканчивается раньше, чем в смеси 1. Это вызвано тем, что K2S04 в окислительной среде не вступает в обменные реакции с СаС03 и Si02, мине-
73
Рализующее действие иа начальной стадии объясняется образованием расплава при 845°С.
Следует еще обратить внимание на особенность поведения двухкальциевого силиката в приведенных системах. Полученный в присутствии К2С03 в интервале 820—910°С ортосили - кат кальция имеет а^ — модификацию. Сульфат калия стабилизирует а^ — C2S лишь при обжиге до 860°С, после нагрева выше 900°С и последующего охлаждения основные максимумы на рентгенограммах соответствуют р — C2S (рис. 36). Полученные данные свидетельствуют о ранее неизвестных стабилизирующих свойствах K2Ca(C03)2, 2C2S • СаС03 и возможно K2S04 в сочетании со спурритом. Возможно также, что ат — C2S оказывается стабильным в указанных условиях именно потому, что он формируется в интервале температур (720—850°С) существования этой модификации [177].
Таким образом, щелочные примеси, ускоряя образование C2S и задерживая диссоциацию СаС03, создают условия для образования более термодинамически устойчивого соединения — 2C2S • СаС03. Одна из возможных схем процесса:
400_______________________________ 800°с 750 820°с
ПСаС03 + R2C03...-jj R2Ca(C03)2 + (n — 1)СаСО> v^ -►расплав
^ 750—820°c 800—960°с
Расплав + Si02 ат — C2S
І eeoec
4 " 2QS • СаС03.
Исследования, проведенные в атмосфере продуктов горения газообразного топлива на смесях, приготовленных из реактивного карбоната кальция, Вольского песка и щелочных добавок, показали возможность обменных реакций между R2S04 и СаС03, образование щелочных силикатов и несколько иную последовательность реакций.
В шихте, рассчитанной на трехкальциевый силикат со щелочными карбонатами, при нагревании до 800°С отмечается выделение СаО и образование силикатов кальция. Первым при этом появляется спуррит (800°С), затем при 900°С идет разложение его по схеме:
2&0&* SiOb) • СаС03 + 2(2Са0 . Si02) +Са0 + С02.
Двойные карбонаты состава R2Ca(C03)2 обнаруживаются в спеках при 500° и сохраняются до 900°С. Кроме промежуточных карбонатов, обнаружено до 7% щелочных силикатов R20 • Si02
74 (600—900°С) и Na20-СаОSi02 (800— 1000°С). Специально проведенный на высокотемпературной рентгеновской установке синтез показал, что реакции могут протекать по схеме:
Na2C03 + СаС03 + Si02 Na2Ca(C03)2 + SiG* N^O • СаО. Si02 + 2С02,
Причем вторая стадия взаимодействия протекает в атмосфере продуктов горения газа или при скоростном нагреве до 400— 600°С. Связывание значительной доли кремнезема в щелочные силикаты приводит к сохранению до 20% оксида кальция, который остается неусвоенным до 1450°С. При высоких температурах отмечается лишь некоторое количество алитоподобных кристаллов (Ng= 1,690 ±0,003, Np= 1,685 ±0,003). Габитус и низкая анизотропия кристаллов, а также данные рентгено - фазового анализа дают основание считать их принадлежащими алиту, содержащему в кристаллической решетке оксид натрия.
Сульфаты натрия и калия (7,5%) в смеси, рассчитанной на трехкальциевый силикат, образуют меньше щелочных силикатов (до 2%) и двойных карбонатов. Выделение СаОсв, образование спуррита и силикатов кальция (C2S и C3S) наблюдается примерно на 100° С выше, чем в смеси со щелочными карбонатами. При 1100°С в продуктах обжига заканчивается образование белита и остается 22—24% несвязанного оксида кальция. В смеси с 7,5% Na2S04 наблюдается образование алитоподобных кристаллов до 1300°С, но при повышении температуры до 1450°С алит разрушается, выделяя СаО и Na2S04, который возгоняется.
Проведенные опыты подтвердили известный из литературы факт, что щелочные примеси препятствуют образованию алита. Однако остается невыясненным, вызвано ли это торможением реакции между СаО и C2S, например, вследствие подавления растворимости СаО в щелочесодержащей жидкой фазе [22], или оно связано с изменением области устойчивости C3S в присутствии щелочей, т. е. обусловлено указанное явление кинетикой процесса или термодинамикой состояния.
Дополнительные эксперименты показали, что если предварительно синтезированный C3S в смеси с 10 масс. % Na2C03 повторно обжечь при 1450°С в течение 30 мин, то происходит разложение алита. Резкоохлажденные продукты обжига состоят из СаО, р — C2S, небольшого количества C3S и возможно а' — C2S. Потеря массы при этом составила приблизительно долю карбонатной составляющей смеси и, следовательно,
75
Na20 вошел в состав силикатов кальция. В данном эксперименте показано, что оксид натрия вытесняет СаО из C3S не только ниже температуры устойчивости — 1250°С [42], но и в области стабильности чистой фазы при 1450°С. Следовательно, задержка алитообразования в щелочесодержащих смесях проявляется не вследствие кинетических явлений, а термодинамики состояния системы.
Обжиг смеси с добавкой щелочных сульфатов в воздушной среде при 1450°С не привел к разложению C3S, что, вероятно, связано с большой силой связи щелочей в сульфатах и их нейтральностью по отношению к C3S. В то же время синтез трехкальциевого силиката в присутствии R2S04 затруднен, следовательно, эти соли обусловливают кинетику процесса. Действие Кі'СОіі не удалось выяснить, т. к. при примененном режиме тепловой обработки практически возогналась вся соль.
Рассмотрим влияние CaS04 на процессы силикатообразова - ния. Сульфат кальция считается весьма перспективным минерализатором [145, 152, 155], повышающим качество цемента. Одновременно в литературе [178] отмечается затруднение связывания СаО при получении ЗСаО • Si02 с добавкой CaS04. Все исследователи считают CaS04 стабилизатором (3 — формы 2СаО • Si02. В гипсосодержащих смесях обнаружен сульфоалюминат кальция 3(СаО ■ А1203) • CaS04 [39, 156, 83, 179]. Кроме того, делались предположения об образовании в смесях с гипсом силикосульфата кальция [39, 180]. Однако, синтезировать это соединение удалось лишь в 1967 году Гатту и Смиту [105].
Независимо от упомянутой работы, нам удалось в 1968 году не только синтезировать силикосульфат кальция, но и получить кристаллооптические и рентгеновские характеристики нового соединения, изучить гидратационные свойства, выявить влияние на процессы формирования клинкера, т. е. получить данные, которые отсутствовали в работе английских ученых [165, 435].
Кальциевый силикосульфат можно получить при обжиге до 1200°С смесей двухкальциевого силиката и гипса, или известняка и кварца со щелочными сульфатами, или, наконец, при обжиге тонкомолотого портландцементного клинкера с ангидритом. 2C2S-CaS04 образует прозрачные призматические или пластинчатые кристаллы с N = 1,628 и Np = 1,620. По показателям светопреломления 2C2S«CaS04 обнаружен в количестве 5% в продуктах обжига шихт, рассчитанных на ЗСаО • * Si02 и 2СаО • Si02 из смесей СаС03 (известняка) и Si02
76 (кварца) с примесью 7% глазерита. Рентгеновские данные кальциевого силикосульфата приведены в табл. 16.
Синтезировать соединение в чистом виде можно 1 —1,5-часовым резким обжигом при 1200°С (образцы помещаются в разогретую печь) шихты, составленной из ангидрида и у — двухкальциевого силиката по реакции 2(2СаО • Si02) + + CaS04-^2CL, S-CaS04.
Нагрев выше 1300°С и медленное охлаждение приводят к разложению силикосульфата кальция на а' — C2S и CaS04 с последующим переходом ортосиликата кальция в у— C2S.
Как влияет примесь сульфата кальция и кальциевого силикосульфата на клинкерообразование и свойства цемента? Во-первых, медленное охлаждение клинкера в контакте с ангидритом может вызвать разложение уже образовавшегося алита по схеме
2(3CaO-SiOa) + CaS04^2C2S - CaS04 + 2СаО.
|
Т а б jі и ц а 16 Рентгеновские характеристики 2(2СаО • SiO ) • CaSO,
|
Действительно, при нагревании смеси порошка клинкера с ангидритом (30 масс.%) до 1200°С алит полностью распадается, и в продуктах обжига отмечаются кальциевый силикосульфат, алюмоферриты кальция и несвязанный оксид кальция. Во-вторых, подверженность силикатному распаду продуктов высокотемпературного разложения силикосульфата может вызвать понижение активности клинкера и явиться причиной образования клинкерной пыли. В-третьих, кальциевый силикосульфат, подобно спурриту, не гидратируется и не подвергается гидролизу при затворении. Следовательно, образование 2(2СаО * Si02) • CaS04 вследствие указанных выше причин может приводить к понижению активности клинкера.
Роль промежуточных, временно существующих фаз в технологии цемента не ограничивается их влиянием на качество
77
Клинкера. Изменяя последовательность и температуру физико - химических взаимодействий, они оказывают влияние на термохимические процессы, протекающие в отдельных зонах печи, и тем самым — на теплообмен и режимные параметры агрегата. Достаточно сравнить результаты термического анализа смесей 2СаС03 + К2С03 и 2,7 СаС03 + Si02 + 8 масс.% К2С03 (рис. 24, 34), чтобы понять, насколько может измениться тепло - потребление в зоне декарбонизации. Даже качественная оценка результатов КТА показывает, что в интервале температур 700—860°С при сравнимой величине эндотермических эффектов на ДТА-кривых потеря массы вследствие диссоциации карбоната кальция в присутствии Si02 во много раз больше, чем в первой смеси. Специально проведенный ТА и термохимические расчеты, сделанные на основании фазового состава системы при 700 и 860°С, определили следующие значения тепловых эффектов (табл. 17).
Таблица 17
Величины тепловых эффектов в смесях в интервале температур 700—850 °С
|
Наименование процессов |
Размерность |
Смеси |
|
|
2СаС03 + КгСОз |
2,7СаС03 + + Si02 + + 8%КаС0з |
||
|
Общие затраты тепла по Т/ |
Дж |
270 |
410 |
|
Количество разложившегося СаСОз |
Мг |
86 |
398 |
|
Теплота диссоциации СаСОз |
Дж |
143 |
661 |
|
Количество образовавшегося расплава |
655 |
154 |
|
|
(по диаграмме состояния) |
Мг |
||
|
Теплота плавления расплава |
Дж |
131 |
31 |
|
Теплота образования C2S |
|||
|
(экзотермический эффект) |
Дж |
— |
-285 |
|
Невязка |
Дж |
—4 |
+з |
Приведенные данные показывают, что значительная часть тепловых затрат на диссоциацию СаС03 перекрывается экзотермической реакцией образования C2S — 285 Дж. Следовательно, высокая скорость выделения С02 в интервале 700— 860°С объясняется не только каталитическим действием К2Са (С03)2, но и саморазогревом смеси в результате экзотермических реакций.
78

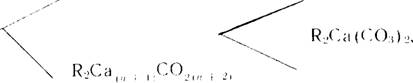
 Опубликовано в
Опубликовано в