О-КСИЛОЛ
 13 августа, 2013
13 августа, 2013  admin
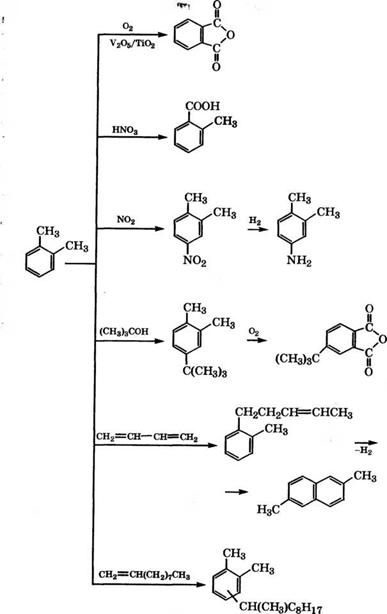
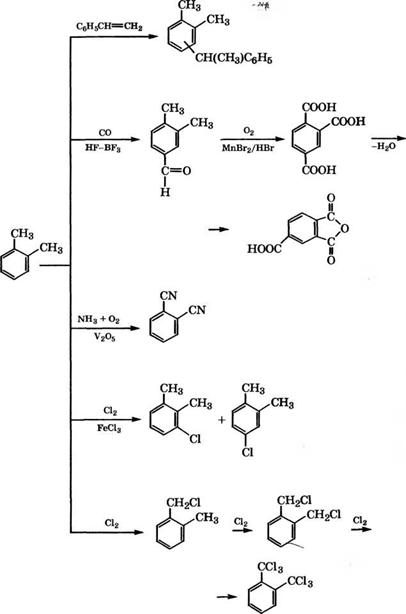
admin Промышленные и перспективные направления использования о-ксилола представлены на схеме (рис. 10).
Основное направление применения о-ксилола - производство фталевого ангидрида. Процессы производства фталевого ангидрида рассмотрены в ряде монографий и обзоров [180-182].
В промышленности фталевый ангидрид получают парофазным окислением о-ксилола или нафталина с использованием стационарных или псевдоожиженных катализаторов на основе V205/Ti02 или V205-K2S04 при 350-450°С. Сырой фталевый ангидрид улавливают из реакционных газов в калориферах, выделяют и очищают ректификацией. Выход фталевого ангидрида при окислении о-ксилола 75-80 %, при использовании нафталина 85-88 %.
Конструкция трубчатого реактора с неподвижным слоем катализатора V205/Ti02 описана в статьях [183, 184]. Максимальная температура процесса 460-480°С, в пересчете на нормальные условия расход сырья составляет 4.5 м3*ч“г, концентрация о - ксилола - 40 г/м3 (по другому варианту с низким расходом воздуха - 60 г/м3). В качестве хладагента используется расплав солей NaN02/KN03. Выход фталевого ангидрида постепенно снижается с 79 до 74 % через 50 дней работы катализатора и далее до 71.3 и 61.1 % - через 20 и 36 мес [185].
Шведская фирма «Neste» разработала новую технологию производства фталевого ангидрида, при которой после обычного реактора с неподвижным слоем катализатора предусматривается адиабатический реактор. Новая технология позволяет повысить качество фталевого ангидрида и его выпуск на 20 %, увеличить срок службы катализатора на 30 %. Срок окупаемости затрат на реконструкцию составляет 1 год [186].
Применение вместо шарикового катализатора регулярно уложенных трубчатых гранул привело к снижению гидравлического сопротивления реактора, снижению расхода энергии на 25 %. Это позволило увеличить мощность реактора на 22 % и повысить селективность процесса за счет выравнивания концентрационных и температурных полей, улучшения теплосъема. Доля продуктов горения (СО + СОо) при замене катализатора снизилась с 21.6 до 18 % [187].
Фирма «Lurgi» повысила концентрацию о-ксилола в рабочем потоке при окислении воздухом на 30 %, доведя ее до 100 г/м3, что привело к снижению инвестиционных затрат [188].
Окисление о-ксилола в неизотермическом режиме на катализаторе в нестационарном состоянии повышает выход фталевого ангидрида [189, 190]. ^
Японская компания «Nippon Shokubai» запатентовала процесс производства фталевого ангидрида парофазным окислением смеси о-ксилола и нафталина воздухом при 300-450°С в трубчатом реакторе с двумя катализаторами. В состав первого по ходу движения реакционной смеси катализатора входит V205/Ti02, промотированный Nb, Р, Sb и щелочным металлом (К, Cs, Rb)
|
Рис. 10. Направления использования о-ксилола 242 |
|
Рис. 10 (продолжение) |
Или Т1. Второй катализатор имеет тот же состав, но отличающийся пониженным содержанием щелочного металла или Т1. В качестве преимущества процесса отмечается высокая производительность катализатора [191].
Активность и селективность по фталевому ангидриду повышается при промотировании промышленного катализатора V205/Ti02 добавкой 0.15 % Li20 [192].
Промотирующее влияние добавок оксидов К, Ва, Bi, W, Sn на каталитические свойства V205/Ti02 при окислении о-ксилола изучено в работе [193]. Отмечается хорошая корреляция при температуре выше 300 °С между кислотно-основными свойствами промотора и выходом фталевого ангидрида, однако при низкой температуре положительный эффект оказывают лишь основные промоторы.
При окислении нафталина или о-ксилола в присутствии V205 + + K2S04 при 360-400°С выход фталевого ангидрида составляет около 90 %. Побочными продуктами являются малеиновый ангидрид и 1,4-нафтохинон, получающиеся с выходом 7-9 и менее 5 % соответственно [194].
Парофазное окисление о-ксилола изучено также на моно - слойном оксиднованадиевом катализаторе, нанесенном на MgF2 [195], а также на Мо03 на различных носителях [196]. Однако выход фталевого ангидрида при использовании этих катализаторов ниже, чем на промышленном катализаторе.
Основной недостаток парофазного процесса окисления о-кси - лола - низкий выход фталевого ангидрида вследствие сгорания значительной части сырья при высокой температуре. Разработан жидкофазный процесс получения фталевого ангидрида совместным окислением о-ксилола и рециклового о-метилтолуилата кислородом воздуха под давлением [197].
Процесс проводится при 180-200 °С и давлении 1 МПа, при этом протекают следующие реакции [198]:
|
О |
|
II |
|
+ |
|
СН3 |
|
СООН |
|
А |
 |
|
|
|
|
|
![]()
![]()
![]()
|
СООСНз |
![]()
|
+ СН3ОН |
![]() СООН
СООН
|
+ н20 |
![]() А
А
|
СНз |
![]() СНз
СНз
Получающаяся при окислении наряду с фталевым ангидридом о-толуиловая кислота этерифицируется метанолом до о - метилтолуилата, который вновь подается на окисление. Выход фталевого ангидрида по этому методу составляет 90 %.
Нитрованием о-ксилола N02 в газовой фазе над цеолитом Р с высокой селективностью получают 4-нитро-о-ксилол [199]. Нитрование о-ксилола можно проводить безводной нитрующей смесью HN03, H2S04 и Н3Р04 при 20 °С. При этом с выходом 76.5 % получается смесь 3- и 4-нитро-о-ксилолов в соотношении 35.7 : : 64.3 [200]. Восстановлением 4-нитро-о-ксилола получают 3,4-кси - лидин, применяющийся для синтеза рибофлавина (витамина В2). Восстановлением различных нитроксилолов производятся изомерные ксилидины, использующиеся в производстве азокрасителей, пигментов, пестицидов [82].
Алкилированием о-ксилола mpem-бутанолом на цеолите CaNa-
Y на алюмосиликате, содержащем Ln, при 135°С с выходом 90- 94 % получен 1,2-диметил-4-трет-бутилбензол, который может быть использован для синтеза 4-трет-бутилфталевой кислоты и на ее основе фталоцианиновых пигментов, пластификаторов, фотоматериалов [201]. 1,2-Диметил-4-трет-бутилбензол можно получать также алкилированием о-ксилола изобутиленом при 190°С и давлении 2.2 МПа на цеолите H-ZSM-12/A1203[202].
Алкилированием о-ксилола 1,3-бутадиеном получают 5-(о-то - лил)-2-пентен и на его основе - 2,6-диметилнафталин, 2,6-на - фталиндикарбоновую кислоту и полиэфиры. В качестве катализатора для алкилирования о-ксилола корпорацией «Атосо» запатентована эвтектическая смесь Na/K, активированная ультразвуковым излучением [203], или смесь Na, К и N, N,N',N'-TeTpa- метилэтилендиамина [204]. При проведении синтеза по первому способу при 125 °С при конверсии о-ксилола 11.1 % селективность его превращения в 5-(о-толил)-2-пентен составляет 77 %.
Компания «Mitsubishi Gas Chemical» запатентовала катализатор алкилирования, получаемый термообработкой смеси Na, СаО или MgO и соединения калия (КОН, К2С03, КНС03) [205]. Этой же компанией предложен катализатор, полученный кальцинированием смеси КОН и А1(ОН)3 при 500-650 °С с последующей обработкой в атмосфере N2 жидким или металлическим Na при 100-300 °С. При использовании последнего катализатора для алкилирования о-ксилола 1,3-бутадиеном выход 5-(о-толил)-
2- пентена достигает 98 % [206].
Смесь диметилнафталинов, полученная из о-ксилола и 1,3-бутадиена, изомеризуется с использованием Н-морденита с последующей кристаллизацией из гептана с получением 2,6-диметил- нафталина чистотой 99.19 % [207].
Алкилирование аренов олефинами в присутствии твердых перфторсульфокислотных катализаторов идет не по боковой цепи, а по ароматическому кольцу. Так, при использовании сополимера перфторвинилового эфира с функциональной группой - 803Н (Альтион) в качестве катализатора алкилирования о-ксило - ла н-деценом-1 при 130 °С получены втор-децил-о-ксилолы с производительностью 5.27 г/г катализатора, более высокой по сравнению с другими катализаторами алкилирования (Кайюп, МФ-4СК, КСМ-2) [208].
Взаимодействием о-ксилола со стиролом в жидкой фазе при 130-170 °С и давлении 0.1-0.5 МПа можно получать 1-фенил-
1- ксилилэтан - экологически безопасную пропитывающую диэлектрическую жидкость. В качестве катализатора предложено использовать аморфный пылевидный адсорбент для защитных покрытий, приготовленный методом совместного осаждения гидроксидов А1 и [209].
Метилированием ксилолов метанолом при 320-400 °С и давлении 0.5-2 МПа в присутствии цеолитов с содержанием Ка 1—
2 % можно получать псевдокумол [210, 211]. Триметилбензолы, в основном псевдокумол, получают и при диспропорционировании о-ксилола, например, в присутствии монтмориллонитов, сшитых с помощью А1203 и Сг203[212].
Карбонилированием о-ксилола в присутствии НЕ-ВЕ3 при температуре ниже 0°С и давлении 2 МПа с последующим окислением полученного альдегида воздухом в присутствии МпВг2/НВг при 220-230 °С, давлении 2-3 МПа и дегидратацией кислоты производится тримеллитовый ангидрид [213].
Окислительным аммонолизом о-ксилола при 380-400 °С в присутствии У205 или аммонолизом фталевого ангидрида при 400 °С на Сг203 получают 1,2-фталодинитрил [108].
Фирма «ВА£>Е АО» в качестве катализатора процесса окислительного аммонолиза ксилолов запатентовала У205/А1203, модифицированный 8Ь203, оксидами и соединениями щелочных металлов [214]. 1,2-Фталодинитрил применяется в производстве фталоцианиновых красителей на основе фталоцианина меди, а также полифталоцианинов и пестицидов [108].
Хлорированием о-ксилола в жидкой фазе при 50-70 °С в присутствии ЕеС13 получают смесь 3- и 4-хлор-о-ксилолов. При фотохимическом хлорировании ксилолов или при хлорировании в присутствии 2,2'-азо-бис-изобутиронитрила происходит замещение атомов водорода метильных групп хлором с образованием ксилилхлоридов, ксилилендихлоридов и гексахлоркси - лолов [97]. Хлорированием о-ксилола в две стадии - сначала в ядро при 20-100 °С в среде Т1С14, затем в боковые цепи при 50- 100°С и ультрафиолетовом освещении получен о-С6С14(СНС12)2 [215].
Окислением о-ксилола НЖ)3, Сг203 или КМп04 получают о - толуиловую кислоту, применяющуюся в производстве красителей и лекарственных средств.

 Опубликовано в
Опубликовано в