НАФТОЛ Ы
 19 августа, 2013
19 августа, 2013  admin
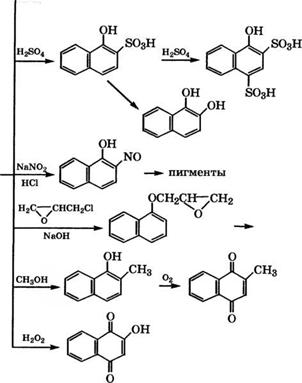
admin Направления использования 1- и 2-нафтолов представлены на схеме (рис. 17).
Карбоксилированием 1-нафтола по реакции Кольбе - Шмитта получают 1-гидрокси-2-нафталинкарбоновую кислоту, которая применяется в производстве цветных фотоматериалов, а также ингибиторов коррозии. Восстановлением 1-гидрокси-2-нафталин - карбоновой кислоты амальгамой натрия в водном растворе в присутствии Н3В03 синтезируют 1-гидрокси-2-нафталинкарбаль - дегид, использующийся в производстве красителей [17].
Сульфированием 1-нафтола 98%-й Н2804 получают 1-гид - роксинафталин-2-сульфокислоту и далее, при избытке Н2804 -
4- гидроксинафталин-1,3-дисульфокислоту. Нафтолсульфокис - лоты применяют в производстве красителей, дигидроксинаф- талинов, кислотно-основных флуоресцирующих индикаторов [18].
|
Клеи |
|
|
|
|
|
|
|
|
|
|
|
|
|
Б03Н |
![]()
|
Н2804 |
![]()
|
ОН |
![]()
![]()
|
ЫН3, (ЫН4)2803 |
![]()
![]() БОзН *Ш2
БОзН *Ш2
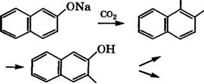
—► азокрасители Рис. 17. Направления использования 1-нафтола (а) и 2-нафтола (б)
|
НООС ОН У красители ° X и —► полиэфиры ^ лекарства п 'Я ‘I Осн2сн—СН2 я И |
|
■СО |
|
Нсоок, со |
|
НООС |
|
Н2с—СНСН2С1 о |
|
Клеи |
|
ОН |
|
ЫаОН |
|
К2со3 |
|
ОК |
|
||
|
||
|
||
|
||
|
||
|
||
 |
![]()
![]()
|
* Н* И И Н {5 Л 8 В >о |
![]()
 РеС1я
РеС1я
СцН5СНгС1 N82003 **
|
МН3 |
1*га4н803
|
; |
![]() Рис. 17 (продолжение)
Рис. 17 (продолжение)
При нитрозировании 1-нафтола нитритом Ыа в кислой среде получают 2-нитрозо-1-нафтол с примесью 4-нитрозо-1-нафтола. Нитрозоформа находится в равновесии с хиноноксимной формой:
|
ОН О
|
Нитрозонафтолы применяются для синтеза пигментов, что обусловлено их способностью образовывать комплексы с солями переходных металлов - Ее, Сг и других [2].
Взаимодействием нафтолов с эпихлоргидрином и щелочью при кипячении в присутствии катализатора - хлорида тетраал - киламмония получены глицидиловые эфиры 1- и 2-нафтолов [44]. Эти эфиры могут быть использованы в качестве связующих для оптически прозрачных клеевых композиций, применяемых в электронике, радиотехнике, волоконнооптических линиях связи.
Алкилированием 1-нафтола метанолом в присутствии оксидного Ее-^й-Сг-К-катализатора [45] или цеолита М^Ьа-У [46] синтезируют 2-метил-1-нафтол. Разработан метод синтеза 2-ме - тил-1,4-нафтохинона (витамина К3) на основе 2-метил-1-нафтола с более высоким выходом по сравнению с окислением 2-метил - нафталина хромовой смесью. Окисление 2-метил-1-нафтола проводится в присутствии ванадийсодержащих гетерополикислот при интенсивном перемешивании на границе раздела фаз: 2-метил-1- нафтол находится в органическом растворителе, а гетерополикислота - в водной фазе. Максимальный выход витамина К3 -
88.9 % получен при использовании гетерополикислоты состава Н5РМо10У2О40 [47].
В Институте катализа имени Г. К. Борескова СО РАН разработан способ получения 2-метил-1,4-нафтохинона окислением 2-метил-1-нафтола или его смеси с 2,4-диметил-1-нафтолом Н202 в присутствии катализатора - водного раствора МоУР-гетеро - поликислоты или ее кислой соли с переходными металлами. Окисление проводится при 40-70 °С в двухфазной системе: окисляемое вещество находится в не смешивающемся с водой растворителе, например хлороформе или трихлорэтилене. Процесс осуществляется при перемешивании в атмосфере инертного газа. Катализатор дополнительно содержит 10-20 % (мае.) уксусной кислоты [48].
Окислением 1-нафтола пероксидом водорода в присутствии ортованадатов щелочных металлов получают 2-гидрокси-1,4-наф - 288
Тохинон (лавсон) - красящее вещество хны, используемой в косметике [2].
Карбоксилированием 2-нафтола по реакции Кольбе - Шмитта при 130 °С получают 2-гидрокси-1-нафталинкарбоновую кислоту, которая при 220 °С изомеризуется в З-гидрокси-2-нафталин - карбоновую кислоту. Ариламиды этой кислоты - азотолы синтезируют по следующей схеме [17]: *
,ОН
|
РС1, |
![]()
![]() ОН
ОН
|
|
|
СОС1 |
![]() Ішн2
Ішн2
СООН
ОН
|
|
И = С6Н5, 2-СН3С6Н4, 2-Ж)2С6Н4, 2- или 4-СН3ОС6Н4
Азотолы применяются для синтеза красителей прямо на волокне.
|
+ СН20 |
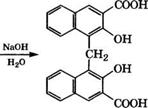
![]() При нагревании З-гидрокси-2-нафталинкарбоновой кислоты с формальдегидом в разбавленной щелочи получается 4,4'-ме- тилен-бис(3-гидрокси-2-нафталинкарбоновая) кислота:
При нагревании З-гидрокси-2-нафталинкарбоновой кислоты с формальдегидом в разбавленной щелочи получается 4,4'-ме- тилен-бис(3-гидрокси-2-нафталинкарбоновая) кислота:
ОН
|
|
СООН
Полученная кислота образует с алкалоидами (хинином, стрихнином) соли, используемые в фармакологии.
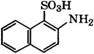
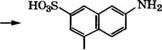
Сульфированием 2-нафтола 96 %-й Н2804 при 10°С получают 2-гидроксинафталин-1-сульфокислоту, при нагревании которой с КН3 и ЫаНЗОз по реакции Бухерера - Лепти при 150 °С образуется 2-аминонафталин-1-сульфокислота [16]. Далее многостадийным синтезом получают 2-амино-5-нафтол-7-сульфокйслоту:
|
Н2!304, ЄОз 110 °С |
![]()
|
НОзБ |
![]()
|
ВОзН |
![]()
|
ЇШ2 |
![]()
 Н20 + Ка2804
Н20 + Ка2804
--------- і
100 °С
|
ОН |
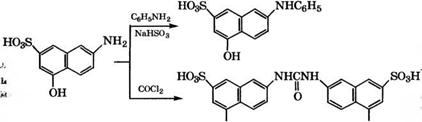
При взаимодействии 2-амино-5-нафтол-7-сульфокислоты с анилином получают 1Ч-фенилпроизводное, а при реакции с фосгеном - алую кислоту, которые используются в производстве азокрасителей:
|
ОН ОН |
Формилированием 2-нафтола по реакции Даффа - нагреванием с уротропином в присутствии СНдСООН и Н2804 при 90-100 °С - получают 2-гидрокси-1-нафталинкарбальдегид, применяющийся в производстве флуоресцентного красителя люмо - гена светло-желтого и оптических отбеливателей бензокумари - нового ряда [17].
Взаимодействием 2-нафтолята калия с К2С03, формиатом калия и СО при 280 °С и последующим подкислением синтезируют 2-гидроксинафталин-6-карбоновую кислоту с выходом 72 % [49]. Эта же кислота, однако с меньшим выходом, получена из 2- нафтилата калия и ж-крезилата калия при 260 °С в присутствии С02 и использовании в качестве растворителя легкой масляной фракции [50]. 2-Гидроксинафталин-6-карбоновая кислота применяется в синтезе красителей, полиэфиров, сельскохозяйственных и лекарственных препаратов.
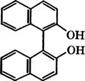
Окислительное сочетание 2-нафтолов в 1,1'-бис-2-нафтолы с использованием воздуха протекает достаточно быстро и с высоким выходом в присутствии в качестве катализаторов твердых кислот Льюиса - РеС13/А1203, ЕеС13/8Ю2, Ее3+/монтмориллонит
[51].
Взаимодействием 2-нафтола с карбонатом щелочного или щелочноземельного металла и бензилхлоридом в инертном растворителе при 60-150 °С получен 2-нафтилбензиловый эфир, применяющийся для получения термобумаги для телефаксов
[52].
Из 2-нафтола взаимодействием с ГШд и сульфитом аммония в мольном соотношении 1:2:2 при 150-180 °С по реакции Бухе - рера получают 2-нафтиламин [16]. 2-Нафтиламин применяется в синтезе красителей, К-фенил-2-нафтиламин - антиоксидант каучуков. В России 2-нафтиламин не производится из-за его канцерогенности.
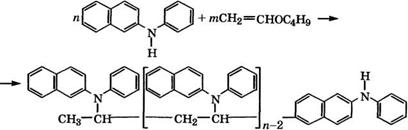
При взаимодействии 1Г-фенил-2-нафтиламина с винилбути - ловым эфиром в присутствии эфирата трифторида бора при 40 °С с выходом 75 % образуется олиго-К-винил-К-фенил-2-нафтил - амин [53]:
|
|
Полученный олигомер - более эффективный ингибитор окисления кумола, чем К-фенил-2-нафтиламин. Кроме того, полимерные и олигомерные антиоксиданты обладают рядом дополнительных достоинств: хорошо совмещаются с полимерами, улучшают их физико-механические характеристики, не выпотевают при переработке и эксплуатации, нетоксичны.
Этиловый эфир 2-нафтола (под названием неролин или бро - мелия) применяется как душистое вещество в парфюмерии. Смеси 2-нафтола с тринитробензолом, 2,4,6-тринитротолуолом, 2,4- динитрохлорбензолом используются в качестве фунгицидов [16].

 Опубликовано в
Опубликовано в