ГОРЕНИЕ ТОПЛИВА
 7 апреля, 2013
7 апреля, 2013  admin
admin 1 При сжигании топлива входящие в его состав горючие элементы ’ соединяются с кислородом воздуха. При этом происходит преобразование химической энергии топлива в тепловую, идущую на нагрев продук- ч тов сгорания топлива.
Принято различать Полное и неполное сгорание топли - В а, процесс протекания которых может идти одновременно, но Конечные результаты будут различны. Полное горение топлива моЖНо харАктеризовать как быстро протекаюший Физико-химический ПроЦесс взаимодействия горючего ¥ёШства Г с окислителем, сопровождающийся интенсивным выделением теплота.../
Химическую' реакцию между веществами А % Б, (протекающую с образованием продуктов М и Я, можно описать стехиометрическим уравнен ием слЕдуЮщего вид а:
Где А, б, м и н'—число молекул, участвующих в простейшем ходе реакции; Q—тепловой эффект реакции.
Подобные уравнения химических реакций отдельных горючих составляющих топлива дают лишь итоговый материальный баланс, но не отражают действительного механизма процесса. Скорость химической реакции зависит от концентрации реагирующих веществ, определяемых стехиометрическими уравнениями типа (2-1), и от температуры. О скорости реакции можно судить по изменению концентрации реагирующих или получаемых <в результате реакции веществ. Обычно реакции горения относятся к реакциям второго порядка (бимолекулярным). Ско - р©еть этих реакций Определяется в соответствии с законом действующих масс следующим образом:
W = kCC, (2-2)
Где K — константа скорости химической реакции; Сь С% — концентрация исходных веществ А и Б; а и Б — число молекул, участвующих
В реакции.
Когда прямая и обратная реакции осуществляются с одинаковыми скоростями, наступает химическое равновесие. Отношение концентраций реагирующих веществ в момент равновесия называют Константой равновесия Кс, которая для газообразных веществ может быть выражена через парциальные давления реагирующих газов, и ее принято обозначать через /Ср. Величины Кс и /Ср связаны между собой уравнением
Kc = Kp(RTfn. (2-3)
В уравнении:
R— газовая постоянная, Дж/(моль-град) или икал/(моль*град);
Т — температура реакции, К;
Ап— изменение числа молей.
Зависимость константы скорости реакции от температуры можно характеризовать экспоненциальным уравнением Аррениуса:
Е
K = k, + e RT, (2-4)
В уравнении:
Ko — предэкспоненциальный множитель;
Е — основание натуральных логарифмов;
R — газовая постоянная;
Е — энергия активации, Дж/моль или ккал/моль.
Из уравнения (2-4) следует, что протекание реакций возможно при столкновении реагирующих молекул, которые обладают определенным запасом энергии, достаточным для разрушения или ослабления внутримолекулярных связей. Величина энергии активации Е и есть этот минимальный запас энергии, обеспечивающий эффективность столкновения и химическое взаимодействие молекул; при отсутствии этой энергии химические реакции горения не происходят. Значение энергии активации для смеси газов обычно составляет величину от 83,8 до 168Х ХЮ3 КДж/моль или от 20 до 40-103 ккал/моль.
Величина предэкспоненциального множителя K0 с. изменением температуры меняется не сильно: примерно Ke= Const]/7
Для выяснения влияния температуры на скорость химической реакции используем способ, предложенный В. А. Спейше^ом [Л. 8], и объе-
41
|
(2-5) |
![]()
|
Шо |
![]() Я Тл)
Я Тл)
В формуле:
Ха)± — скорость химической реакции при температуре Г1=500 К;
Ш2 — то же при 72=1000 К и £=168-103 КДж/моль.
Из расчета получим, что при увеличении температуры в 2 раза скорость реакции изменится в 5-10й раз. Значения констант равновесия зависят от температуры следующим образом:
^ 1п К (3 .(у
ЙТ “~ЯГ2 * Vй
В уравнении:
<2— тепловой эффект реакции, КДж/моль или ккал/моль, при давлении /?=сопз1 или постоянном объеме;
& — константа равновесия, которую можно выразить через концентрации &с или парциальные давления реагирующих веществ £р.
Из последнего уравнения следует, что с ростам температуры величина & в реакциях с выделением теплоты (экзотермических) увеличивается, с отнятием теплоты (эндотермических) уменьшается. Отсюда
|
+ + 0% 02 и / О он о он |
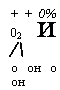
 Видно, что при высоких температурах может происходить диссоциация молекул, например молекул С02; при невысоких температурах диссоциация происходить не будет.
Видно, что при высоких температурах может происходить диссоциация молекул, например молекул С02; при невысоких температурах диссоциация происходить не будет.
Однако закон действующих масс и уравнение Аррениуса недостаточны для объяснения истинного характера протекания реакций горения водорода, углерода и его окиси.
|
Н2 Гх (н) [НІ0І |
![]()
|
Ф - Возбудитель цепи □ - Конечный продукт -Единичный цикл |
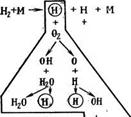
 Наиболее вероятен предложенный академиком Н. Н. Семеновым цепной характер протекания реакций^ горения с наличием промежуточных стадий реакций и соединений с активными центрами. Так, например, соединение водорода и кислорода начинается с распада молекул Н2 на атомы при их столкновении с поверхностью нагретого источника зажигания или другой молекулой М, обладающей
Наиболее вероятен предложенный академиком Н. Н. Семеновым цепной характер протекания реакций^ горения с наличием промежуточных стадий реакций и соединений с активными центрами. Так, например, соединение водорода и кислорода начинается с распада молекул Н2 на атомы при их столкновении с поверхностью нагретого источника зажигания или другой молекулой М, обладающей
/-Единичный и, и,Л ВЫСОКОЙ Энергией: Н2+М-^2Я+М, вслед-
1— И ствие чего каждый из возникших атомов во
|
Рис. 2-1. Схема окисления водорода при цепной Реакции. |
![]() Дорода реагирует (рис. 2-1) затем с молекулой кислорода:
Дорода реагирует (рис. 2-1) затем с молекулой кислорода:
Н+02+ЗН2-^2Н20+ЗН, (2-7)
Образуя начало процесса цепной реакции горения водорода. Подобные процессы очень чувствительны к присутствию ускорителей — катализаторов, образующих промежуточные соединения типа ОН.
Если молекула, обладающая энергией активации, окисляясь, порождает одну новую активную молекулу, которая .продолжает цепь, то процесс называют Неразветвленной цепной реакцией. Если же активная молекула вызывает при реакции образование нескольких новых активных молекул, из которых одна продолжает начатую цепь, а Другие Начинают новые цепи, то такую реакцию называют Разветвленной цепной реакцией.
42
Схема подобной реакции показана на рис. 2-1 для водорода, как наиболее изученная спектроскопическим методом. Скорость течения цепных реакций превосходит скорость течения обычных химических реакций в сотни тысяч раз. Однако результирующая скорость реакции горения определяется скоростью самой медленной реакции, образующей данную цепь. Примерами таких реакций, кроме горения водорода, является горение углерода, имеющего более сложный характер, с участием атомарного водорода, гидроксильных радикалов и других активных центров.
 Г1/еение вкиси углереВа'
Г1/еение вкиси углереВа'
|
|
|
|
|
|
|
|
|
|
|
|
Направление под б од а Воздуха и движения гш秧
•Содержание горючих ф-Содержание волы и шлакя
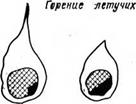
Рис. 2-2. Схема горения твердого топлива.
- подогрев, испарение влаги; II — возгонка летучих; III — горение летучих, образование кокса; IV — горение кокса; V — выгорание кокса; VI — образование шлака.
Процесс горения любой частицы натурального твердого топлива протекает еще более сложным путем и сопровождается комплексом физико-химических явлений: начинается с подогрева топлива, сопровождающегося испарением влаги и возгонкой летучих и продолжающегося до момента воспламенения. Далее происходит горение летучих и кокса, зависящее от контакта с окислителем, зольности топлива, температур и других факторов, и заканчивается образованием шлака.
Схематически эти процессы показаны на рис. 2-2, где они искусственно разделены для возможности представления хода каждого процесса.
Все перечисленные процессы чаще протекают одновременно, чем и определяется сложность их исследования. Необходимо напомнить, что реакции веществ, находящихся в одинаковом агрегатном состоянии, называются Гомогенными; к ним относятся реакции горения газов. Реакции горения жидких и твердых топлив протекают при разном агрегатном состоянии веществ; такие реакции называются Гетерогенными.
Гетерогенные реакции сильно зависят от скорости подвода или переноса окислителя к поверхности горящей частицы — от скорости диффузии. Увеличение скорости подвода окислителя к горящей частице приводит к увеличению скорости реакции до определенных пределов. Если процесс сжигания топлива начинается с подогрева, удаления влаги и возгонки летучих, то в это время цепные реакции протекают медленно. С повышением температуры число активных центров растет, скорость реакции увеличивается, что приводит к вспышке топлива. Температуру, при которой происходит это явление, называют Температу-
Таблица 2*1 Температуры воспламенения некоторых видов топлива
|
|
||
|
|
||
|
550—625 630—672 800—850 540—594 525—588 490—570 400 380 30—90 125 |

|
80 90 90 110 140 300 230 250—400 400—500 500—600 6С0—700 700—750 |
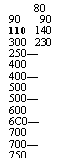
Водород Н2 в смеси с воздухом
Окись углерода СО в смеси с воздухом Метан СН4 Этан С2Н6 Пропан С3Н8 Бутан С4Н10 Бензин Керосин
Дизельное топливо Соляровое масло
Мазут флотский Ф-12
Малосернистый 40 малосернистый 100 многосернистый 200 Древесина Торф
Бурый уголь Каменный уголь Полу антрацит Антрацит Кокс
Рой воспламенения; она зависит от свойств топлива, условий отвода теплоты и некоторых других факторов (табл. 2-1).
Развитие цепной реакции и повышение температуры ограничиваются присутствием замедлителей — ингибиторов, к которым нужно отнести инертные примеси в топочном устройстве — поверхности нагрева, негорящие частицы топлива, холодную обмуровку и другие препятствия, движению молекул. Время сгорания топлива зависит от того, сколь быстро горючая частица встретится с частицей окислителя, который содержится в поступающем воздухе. Иначе говоря, время, необходимое для сгорания топлива, складывается из времени, в течение которого достигается контакт горючего с окислителем, Тф и времени протекания химической реакции тх.'
Т=тф+тх. (2-8)
|
Рис. 2-3. Зависимость скорости горения твердого топлива от температуры и области горения. |
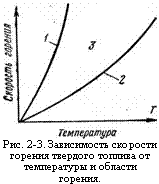 Если время контактирования больше времени химической реакции, то горение относят к диффузионному, в обратном случае горение относят к кинетическому. Изображая графически изменение скорости горения топлива (рис. 2-3) в зависимости от температуры при постоянной массовой концентрации окислителя, можно показать, что В соответствии с уравнением Аррениуса (2-4) скорость реакции с ростом Т Сильно увеличивается (кривая /). Область горения, ограниченная осью ординат и кривой 1, Называют Кинетической; осью абсцисс и кривой 2 — Диффузионной областью горения. Между кривыми 1 и 2 Существует область 3, в которой скорости химических реакций соизмеримы со скоростями диффузии.
Если время контактирования больше времени химической реакции, то горение относят к диффузионному, в обратном случае горение относят к кинетическому. Изображая графически изменение скорости горения топлива (рис. 2-3) в зависимости от температуры при постоянной массовой концентрации окислителя, можно показать, что В соответствии с уравнением Аррениуса (2-4) скорость реакции с ростом Т Сильно увеличивается (кривая /). Область горения, ограниченная осью ординат и кривой 1, Называют Кинетической; осью абсцисс и кривой 2 — Диффузионной областью горения. Между кривыми 1 и 2 Существует область 3, в которой скорости химических реакций соизмеримы со скоростями диффузии.
Представленная на рис. 2-1 схема цепного окисления водорода для случая окисленйя углерода сильно усложняется из-за образования окиси углерода СО, двуокиси углерода С02 (первичные реакции) и появления реакций типа С+СОг=2СО (вторичных реакций). При сжигании натуральных топлив количество параллельно идущих реакций значительно увеличивается, и они накладываются друг на друга. Горение жидкого и твердого топлива
Сопровождается его газификацией, когда процессу горения сопутствует термическое разложение органической массы топлива.
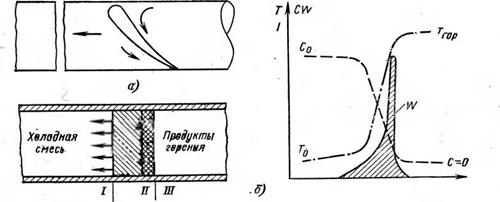
Воспламенение продуктов газификации Или газообразного топлива приводит к образованию Фронта пламени, состоящего из слоя смеси, обычно весьма тонкого, в котором идет процесс горения. Если фронт пламени перемещается в неподвижной среде, то протекающие в нем процессы, по данным В. А. Спейшера [Л. 8] и Н. Л. Стаскевича [Л. 9], могут быть охарактеризованы рис. 2-4.
|
Рис. 2-4. Распространение (а) пламени и изменение (б) температуры Г, концентрации горючего С и скорости реакции а> при сгорании неподвижной газовоздушной смеси В горизонтальной трубе. |
Для возможности характеризовать горение газовоздушных смесей в ламинарном потоке пользуются понятием нормальной скорости распространения пламени:
|
|
(2-9)
Где ын — нормальная скорость распространения пламени, см/с; А — коэффициент температуропроводности смеси, см2/с.
Это приближенное выражение для определения ив получено из анализа размерностей в дифференциальном уравнении теплопроводности с источником и показывает, что нормальная скорость распространения пламени зависит от физических свойств смеси и ее химической активности, так как время сгорания обратно пропорционально скорости химической реакции при температуре горения.
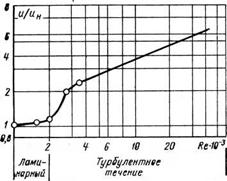
Для движущейся горящей среды имеет значение характер ее движения. При переходе от ламинарного движения к турбулентному меняется не только очертание зоны горения, но и изменяется интенсивность процесса. Некоторое представление о влиянии режима движения смеси на скорость распространения пламени можно получить при рассмотрении рис. 2-5. Из-за больших трудностей проведения теоретических и экспериментальных исследований теория турбулентного горения еще находится в стадии разработки. Следует помнить, что в турбулентном потоке перемещивание происходит не только за счет хаотического движения молекул, но и за счет перемещений молей и значительных объемов газа
Из одного слоя в другой, что интенсифицирует процессы тепломассообмена. Поэтому рядом исследователей предлагается в отличие от модели с фронтом горения иметь модель объемного горения, показанную на рис. 2-6, или ей подобную схему.
|
Газовоздушная продукты смесь |
![]()
|
Газовоздушная смесь и продукты сгорания |
![]()
|
Рис. 2-6. Модель объемного турбулентного горения. |
![]()
 Более сложным ф$ляется процесс горения твердого топлива даже в случае предварительного измельчения его до пылевидного состояния. Многочисленные исследования процесса горения частиц твердого топлива привели к установлению двух основных закономерностей — Закона горения отдельной натуральной угольной частицы и закона распределения частиц полидисперсной угольной пыли по размерам.
Более сложным ф$ляется процесс горения твердого топлива даже в случае предварительного измельчения его до пылевидного состояния. Многочисленные исследования процесса горения частиц твердого топлива привели к установлению двух основных закономерностей — Закона горения отдельной натуральной угольной частицы и закона распределения частиц полидисперсной угольной пыли по размерам.
|
Рис. 2-5. Изменение скорости распространения пламени в зависимости от режима движения сжигаемой смеси газа С воздухом. |
Параллельное выгорание летучих и коксового остатка,-^наблюдаемое при горении угольной пыли, обусловлено различием размеров и форм частиц. Реакционной поверхностью коксового остатка можно считать сферу, к которой равномерно поступает кислород воздуха. Опытами установлено, что в реальных топочных условиях решающую роль играют реакции типа
2С + 02=2С0. (2-10);
Исходя из указанных положений наиболее вероятной схемой процесса горения является горение пылинки в топочной камере в объеме движущегося потока — выход летучих, горение летучих в движущейся среде и горение коксовой частицы с одновременными физико-химически - ми превращениями минеральной части топлива. Эти превращения происходят одновременно с диффузией окислителя к остатку частицы, горением остатка при протекании вторичных реакций продуктов сгорания на раскаленной поверхности частиц или вблизи от нее.
Схематизируя явление, можно исключить из него некоторые стадии и рассматривать горение угольной пыли после ее прогрева как Квази - ст ацио-н арный [процесс. Это позволяет записать ряд дифференциальных уравнений горения, решение которых можно выполнить с помощью электронно-вычислительных машин.
Из-за сложности этих уравнений и возможности решения технических задач с помощью более простых способов, эти уравнения в данном кур - 46
Се не приводятся, ознакомиться с ними можно в специальной литературе, например [Л. 10, 11].
Также представляет собой зону газификации с интенсивно идущим процессом слой топлива на колосниковой решетке с подачей под «его воздуха. В топку поступают газообразные продукты газификации топлива и мелкие твердые частицы горючих веществ, создающие над слоем факел. В факеле и происходит процесс сжигания, протекающий при наличии достаточного количества свободного кислорода в области диффузионного горения. Процесс, протекающий в слое, приводит к развитию высоких температур, что интенсифицирует процесс газификации топлива. По высоте слой принято делить на два участка: кислородный
Таблица 2-2
|
Стадии процесса горения натурального топлива Вид топлива
|
И восстановительный; толщина первого обычно мала, и свободный кислород отсутствует после прохода слоя высотой в два-трн куска топлива. При большом выходе летучих веществ эта зона сокращается, при малом — увеличивается. В той части слоя, где протекает процесс газификации топлива, свободный кислород отсутствует, отмечается даже его недостаток. Вследствие этого процесс горения выносится частично в объем над слоем, куда подается дополнительный воздух. Доступ окислителя к горючему затрудняется шлакообразованием, которое увеличивает газовое сопротивление слоя. Для слоевых топок это вызывает необходимость ограничивать содержание золы в топливе, особенно легкоплавкой, в камерных топках требует периодической очисткй поверхности нагрева от шлака.
В соответствии с изложенным процесс горения натурального топлива можно с некоторой условностью разделить на следующие стадии (табл. 2-2).
Такая разбивка на стадии условна потому, что эти стадии процесса протекают не только последовательно, но и параллельно, накладыва - ясь друг на друга, как это имеет место, например, при испарении влаги и возгонке летучих, возгонке и горении летучих, образовании и горении кокса и т. д. Продолжительность протекания отдельных стадий горения зависит от свойств топлива, конструктивных особенностей топочного устройства и ряда других факторов, из которых главными являются » процессы тепло - и массообмена.
Все это свидетельствует о большой сложности топочных, процессов
• И необходимости рассмотрения любой из конструкций топки с позиций обеспечения наиболее полного сгорания топлива, наименьшего загрязнения поверхностей нагрева в топке, удобства, простоты и надежности работы устройства, быстрого регулирования производительности в достаточно широких пределах без снижения экономичности, обеспечения
Передачи наибольшего количества теплоты радиацией и возможности наиболее полной механизации и автоматизации всех процессов, связанных с работой данного топочного устройства. !

 Опубликовано в
Опубликовано в