АНАТОМИЧЕСКОЕ СТРОЕНИЕ ДРЕВЕСИНЫ И РАСТИТЕЛЬНЫХ КЛЕТОЧНЫХ ОБОЛОЧЕК
 19 марта, 2013
19 марта, 2013  admin
admin Анатомическими элементами древесины являются в подавляющей массе уже отмершие клетки, лишенные протоплазмы и ядра, внутренние полости которых наполнены водой или воздухом. Масса древесины на 90—95% состоит из таких мертвых клеток — трахеид, сосудов и либри - форма.
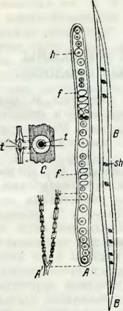
На рис. 1 изображены весенняя (А) и осенняя (В) трахеиды сосны с их окаймленными (h) и простыми (/) порами, при увеличении в 200 раз. На этом же рисунке отдельно представлена увеличенная окаймленная пора (С) с ее перегородкой и утолщением (торусом T), лежащим менаду двумя соседними клеточными стенками. Окаймленные поры никогда не являются свободными отверстиями, служащими для соединения полостей двух соседних клеток; находясь в соседних клетках друг против друга, они разделяются тонкой мембраной, являющейся продолжением первичной стенки. При исследовании обнаженных участков первичпой стенки выяснилось, что они часто оказываются пронизанными тончайшими отверстиями, ведущими из клетки в клетку. В живых клетках эти отверстия заполнены тонкими плазматическими нитями, при помощи которых плазма всех живых клеток организма оказывается соединенной в одно целое. Окаймление в порах представляет как бы купол, нависающий над торусом и обнаженным участком первичной стенки. Этот купол образуется выростом, напластованием прилегающих слоев вторичной клеточной стенки, о которых будет сказано далее. Трахеиды являются отмершими клетками, проводящими воду от корневой системы к кроне. Они почти единственные анатомические элементы в древесине хвойных пород, если не считать незначительных количеств присутствующей здесь древесной паренхимы. Длина трахеид составляет от 1 до 5 мм. Весенние трахеиды имеют широкие полости и тонкие стенки. По мере перехода к осенней части годичпого слоя они становятся более узкополостными, тогда как толщина стенок их обычно несколько возрастает. По данным Мальчевского, для древесины пихты и ели отношение ширины к длине составляет для весенних трахеид 1 : 100, для осенних же 1 : 400. В то время как широкополостные весенние трахеиды являются типичными водопро - водящимн элементами, толстостенные осенние оказываются как бы более сходными с механическими волокнами, обеспечивающими устойчивость ствола.
Сосуды (рис. 2), находящиеся в древесине только лиственных пород, образуются соединением широких коротких клеток, лежащих в продольном направлении ствола, одна над другой. Сосуды иногда видимы
даже простым глазом или при помощи лупы, они образуют весьма длинные мертвые капиллярные трубки вследствие растворения разделяющих их поперечных перегородок. Остатки этих перегородок можно часто видеть в образовавшихся сосудах в форме поперечных диафрагм с одним круглым отверстием. Широкие сосуды наиболее совершенно проводят воду.
|
|
|
H — окаймленная нора; / — простая пора. |
Ширина сосудов колеблется в пределах от 0.02 до 0.5 мм в одной и той же древесине. В весенней древесине содержатся более широкие со-
|
|
Рис. 1. Трахеиды Рис. 2. Различные сосуды
Сосны. липы (А), красного бука (Б),
А — весенняя трахеида; Дуба (О),
H — окаймленная пора; / — простая пора; А' — поперечный разрез весенней трахеиды; В — осенняя трахеида; sh— TJ.
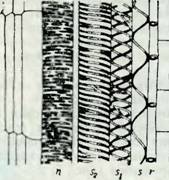
Телевидная пора- с - суды, чем в осенней. Как показано на дсТал„ысн(а™лс, шой по - рИС. 31 стенки сосудов имеют спиральные (s, Sj, s2), кольчатые (г) или сетчатые (п) утолщения. Трубки сосудов не тянутся вдоль всего растения; местами разделяющие их поперечные перегородки сохраняются. У древесных пород расстояния между перегородками в среднем составляют около 10 см, но у дуба достигают 2—3 м. Для стенок сосудов характерны окаймленные поры t1] (рис. 2).
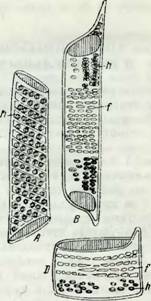
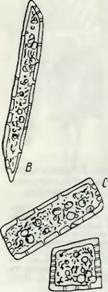
Для поддержания механической устойчивости ствола в древесине служат мертвые клетки либриформа, отличающиеся значительной толщиной стенок. Как показывает рис. 4, волокна либриформа представляют длинные клетки (в несколько миллиметров, а у льна и конопли — в несколько сантиметров). На продольном их разрезе (В) изображены поры в виде тонких канальцев (Р), имеющих в плоскости чертежа вид узких щелей (st), расположенных косо по спирали (щелевидные поры). Характер тонкого фибриллярного спиральпого строения, присущего
клеточным стенкам древесных волокон (трахеид, либриформа), будет детально рассмотрен нами несколько ниже.
|
Рис. 4. Разрезы скле - ренхимного «механического» волокна. |
|
А, В — продольные разрезы; Р — поровые каналы в разрезе, st — поровые каналы в плоскости чертежа (крестообразные щелевидные поры); С — поперечный разрез: на нем видна слоистость оболочки (по Л. А. Иванову). |
|
Не подвергавшихся хими- |
Судя по микрохимическим реакциям окрашивания, наблюдаемым под обыкновенным микроскопом, все эти мертвые анатомические составные части древесины обнаруживают в той или иной степени одревеснение вследствие отложения лигнина в их стенках. Они окрашиваются в красный цвет солянокислым раствором флороглюцина. По удалении лигнина из клеточных стенок теми или ипыми реагентами основное вещество стенок, целлюлоза, окрашивается хлорцинк - иодом в сине-фиолетовый цвет. По уда-
|
Рис. 3. Формы утолщений сосудов. |
П — сетчатые, г — кольчатые; s, s, И s2 — спиральные.
Лении лигнина целлюлозные клеточные стенки становятся растворимыми в мед - ноаммиачном растворе. Более детальное химическое исследование показывает присутствие гемицеллюлоз, а также уроновых кислот в клеточных стенках древесины, ческим обработкам. Лигнин и уроновые кислоты (или близкие к последним пектиновые вещества), входят также в состав межклетного вещества, соединяющего оболочки соседних клеток (см. ниже). Это вещество «срединной пластинки» растворяется при действии на срезы древесных тканей хромовой кислоты или окислительной смеси, состоящей из азотной кислоты и бертолетовой соли. При этом разрушается лигнин первичной и вторичной стенки клеток (см. ниже) и наступает разъединение (мацерация) клеток. Клеточные стенки, содержащие неудаленный лигнин, окрашиваются раствором хлорцинкиода не в фиолетовый, а в желтый цвет. Для открытия пектиновых веществ в растительных тканях применяется при микрохимических окрашиваниях срезов рутениевая красная, хотя, помимо пектинов, этот краситель окрашивает также камеди и слизи.
Живые клетки с плазмой и ядром лишь в небольшом количестве участвуют в строении древесины, они входят в состав ближайших к камбию клеточных слоев, а также в состав древесной паренхимы и паренхимы
сердцевинных лучей. Но по данным Цветковой [2], в ближайших к внешнему камбиальному слою десятках слоев клеток живая протоплазма сохраняется примерно в 50% клеток, она постепенно отмирает по мере
Приближения к концу вегетационного периода.
Живые клетки древесной паренхимы и паренхимы сердцевинных лучей сохраняют в зимний период запасы крахмала и жиров, потребляемых весною, при образовании на дереве новой листвы. Количества крахмала и жиров, отлагаемых осенью в паренхимных клетках, однако, незначительны по сравнению со всей массой древесины. Они связаны с количественным содержанием живых клеток в древесине и с их деятельностью. Имеются указания, что в течение зимнего периода эти запасные - вещества подвергаются некоторым превращениям, причем углеводы частично заменяются жирами.
Паренхимных живых клеток особенно мало у хвойных деревьев, у которых часть запасов хранится зимой в хвое. Древесная паренхима принимает участие у хвойных (сосны и ели) в образовании смолы, выделяемой в особые ходы — смоляные каналы, проходящие между клетками паренхимы (рис. 5, 6).
|
| О '.!-■ О.' |
|
|
|
"Го? А? ы |
|
Ш |
|
О' |
|
Щ |
|
Щп М |
|
Рис. 5. |
|
Клетки древесной паренхимы. А — паренхима ясеня; Б, С, D — паренхима сердцевинных лучей (В — Сук, С и D — дуб). |
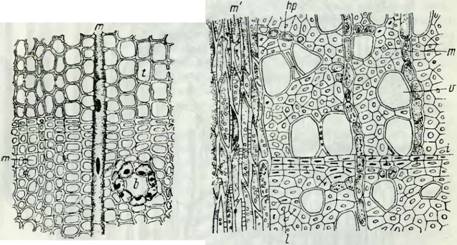
На рис. 7 представлен поперечный разрез через древесину сосны, на котором виден сердцевинный луч (т), состоящий из одного ряда паренхимных, удлиненных, прямоугольных клеток, проходящий в радиальном направлении. На рис. 8 приведен для сравнения поперечный разрез через древесину красного бука, на котором видны широкие сосуды (v), толстостенные клетки либриформа (I), проходящий в радиальном направлении однослойный сердцевинный луч (m) и многослойный сердцевинный луч (m'), состоящий из нескольких рядов живых клеток. Объем клеток сердцевинных лучей составляет в сумме 3—4% от объема древесины ели, до 9% у древесины лиственницы (10—12% у древесины дуба). На срезе (рис. 8) можно еще различить немногочисленные живые клетки древесной паренхимы (Hp), Вытянутые в направлении, перпендикулярном плоскости чертежа, т. е. по длине ствола. Ширина годичных колец весьма изменяется в древесинах разных пород, кроме того, она зависит от условий произрастания. Механическая прочность сухой древесины зависит от породы, процентного соотношения между тонкостенной весенней и толстостенной осенней древесины и от объемного процента свободных пор по отношению к объему твердого вещества. Для механических свойств древесины имеют еще значение: содержание древесной паренхимы, распределение клеток по величине и другие особенности. Следует отметить, что клеточные элементы лиственпой древесины
(либриформ и трахеиды) имеют значительно меньшую (раза в три) длину волокон по сравнению с трахеидами хвойных пород. Для наших отечественных пород Иванов приводит следующие данные о длине и ширине волокон (в мм).
Трахеиды хвойных
Длина Ширина
Сосна...................... 2.6—4.4 0.030—0.075
Ель................................ 2.6—3.8 0.025—0.069
Пихта............................ 2.6—3.5 0.024—0.045
Либриформ лиственных
Длина Ширина
Осина............................ 0.8—1.7 0.020—0.045
Береза........................... 0.8—1.6 0.014—0.040
Тополь.......................... 0.7—1.6 0.020—0.044
Длина клеточных элементов древесины неодинакова в годичных слоях ствола: в молодой древесине волокна более коротки, чем в старой. Неко-
T — весенние (широкие) и tm — Осенние трахеиды; Ь — смоляной ход; т — сердцевинный луч.
Рис. 8. Поперечный разрез через древесину красного бука.
V — сосуд; I — либриформ с толстыми стенками; Т — однослойный, т' — многослойный сердцевинный луч; t — граница слоев; hp — древесная
|
Рис. 7. Поперечный разрез через древесину сосны. |
Паренхима.
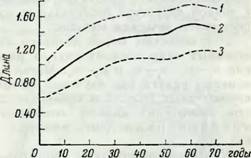
Торое представление об изменении длины волокон, например либриформа осины, дает рис. 9, показывающий результаты измерений Иванова и Грома. Из кривых, основанных на многочисленных наблюдениях, обработанных методом вариационной статистики, видно, что в пределах каждого возраста и даже годичного кольца существуют большие различия в минимальной и максимальной длине клеток.
Прирост древесного ствола происходит в радиальном направлении при деятельности камбиального слоя активных клеток, лежащего между внешним годичным кольцом древесины и лубом. По лубу передается от кроны к стволу, сверху вниз, древесный сок с растворенными веществами — продуктами фотосинтеза, из которых и образуются все веще-
Ства древесины и луба. Камбий состоит из живых клеток, наполненных плазмой, имеющих нежные оболочки. На поперечном разрезе ствола камбиальные клетки расположены в несколько слоев, из которых предположительно только один является собственно камбиальным и образует в наружном радиальном направлении новые клетки луба, а в направлении к древесине — новые древесные волокна. Деление камбиальных клеток происходит в танген - тальном направлении, причем благодаря образующимся перегородкам возникают две узкие клетки: внутренняя и внешняя, каждая со своей протоплазмой. Обе они вначале заключены в общей оболочке, но разделены вновь образовавшейся стенкой. Обе обособившиеся клетки прочно удерживаются образовавшимся межклетным веществом (так называемой срединной пластинкой).
В жизни вновь образовавшейся древесной клетки можно наметить следующие периоды: увеличение ее поверхности, утолщение стенок и лигнификация. Эти три периода не являются строго последовательными и отделенными друг от друга.
В стадии роста древесной клетки ее протоплазма ограничена так называемой первичной стенкой. При последующем увеличении клетки возрастающая поверхность первичной стенки становится тоньше и значительно изменяет свою форму, так как в древесной ткани растущие клетки оказывают значительное давление друг на друга. Динамика клеточного роста и деления клеток не рассматривается в этой краткой главе, эти вопросы более детально описываются в физиологии растений. Вопросы организации древесных клеток, тонкое строение их первичных и вторичных стенок и отложение в них лигнина в последние десятилетия были освещены в превосходных работах ряда ученых: Бэйли и Керра [3' 12], Уор - дропа I4- 7■ 15], Престона [38], Ланге [8- 13> 83], Фрей-Висслинг [6], Мейера [37] и сотрудников руководимых ими лабораторий.
Тонкое строение древесных клеточных стенок
|
Ш |
|
Рис. 9. Изменение длины волокон осины. |
|
Возраст |
|
Значения длины: 1 — максимальное; 2 — среднее; 3 — минимальное. |
Уже старые наблюдения над тонким строением стенок растительных клеток, проведенные в середине и второй половине XIX в. Нэгели, обнаружили способность к двойному лучепреломлению в этих волокнах. В результате этих наблюдений была высказана гипотеза Нэгели о наличии в целлюлозных оболочках и других организованных формах мельчайших кристаллических областей — «мицеллей», как тогда он их назвал. Указания Нэгели о мицеллярном строении растительных клеточных стенок получили подтверждение в двадцатых годах нашего столетия в работах Фрей и др., выполненных методом наблюдения двойного лучепреломления и дихроизма. Этими работами было выяснено, что целлюлоза клеточных стенок обнаруживает весьма значительное «собственное» двойное лучепреломление. Пропитывая клеточные стенки жидкостями
с таким же, как у целлюлозы, коэффициентом преломления, должно было бы ожидать исчезновения двойного лучепреломления, если бы последнее зависело только от формы (пластинчатого строения) клеточных стенок или наличия в них тончайших свободных пустот. Оказалось, что ультрамикроскопические области — мицеллы — клеточных оболочек, сами по себе анизотропны и имеют собственное двойное лучепреломление. Кристаллические высокоориентированные области были обнаружены в тонкой структуре растительных клеточных стенок в 1920 г. также и рентгеноскопическим методом.
Как известно, мерой двойного лучепреломления в трех пространственных направлениях служат разности в коэффициентах преломления пт—ria, пу—и Пр—па. Метод двойного лучепреломления оказал немалые услуги при изучении спирального направления ориентации целлюлозных мицелл в трахеидах хвойных. При этом было выяснено, что ориентация мицелл совпадает со спиральным направлением м и кро фибрилл (см. ниже) в целлюлозных клеточных стенках.
Ультрамикроструктуру растительных клеточных стенок изучали в эти же годы и с помощью наблюдения дихроизма, обнаруживаемого при окраске клеток, например хлорцинкйодом, давно уже применявшимся ботаниками для указания одревеспения (лигнификации), опробковения и кутинизирования клеточных стенок, а также для указания отложений некоторых веществ в клетках. Темно-фиолетовая окраска целлюлозы хлорцинкйодом кажется при рассматривании в поляризационный микроскоп или черной, или бесцветной, смотря по положению оси волокна по отношению к призме Николя. Амбронн, открывший способность к дихроизму окрашенных волокон, обратил внимание на то, что такие краски, как конгорот, магдаларот и др., вызывают то положительный, то отрицательный дихроизм. Красящие вещества, в форме ультрамикрокристал - лов, ориентированно откладываются между мицеллами целлюлозы и действуют как маленькие николи, вследствие чего и проявляется дихроизм волокна. При окраске клеточных стенок акридиновой оранжевой и другими флуоресцирующими в ультрафиолетовом свете веществами, целлюлоза проявляет родственное дихроизму свойство дифлуоресцен - ц и и [*> стр. 80].
В случае лигнифицированных клеточных стенок (отложение аморфного лигнина) получающаяся от действия хлорцинкйода желтая окраска не обнаруживает дихроизма и может отличаться от темно-фиолетовой окраски целлюлозы поворотом поляризатора микроскопа на «бесцветное» положение по отношению к целлюлозе. Так как направление наибольшей абсорбции света при дихроичной окраске целлюлозных клеточных стенок совпадает с продольной осью мицелл (см. гл. Ill), то при помощи окраски хлорцинкйодом можно обнаружить расположение последних в волокне. Этим методом и удалось обнаружить спиральпое расположение мицелл в клеточных оболочках.
Для исследования структуры растительных клеточных стенок широко используется электронный микроскоп. Однако были обнаружены существенные трудности в его применении. Цельные трахеиды оказываются слишком толстостенными для пропускания пучка электронов (с энергией 60—100 кэв). Если клеточные стенки и оказались бы достаточно проницаемыми, то полученное изображение большого числа перекрещивающихся слоев микрофибрилл, спирали которых проходят под разными углами к осп волокна, было бы трудно расшифровать.
Применение очень тонких продольных срезов не раскрывает структуру отдельных слоев клеточной стенки [4], имеющих более или менее цилиндрическую форму. Разделение трахеид на отдельные фрагменты не позволяет определить, с какой стороны — внешней или внутренней — наблюдается фрагмент. Недавно Пейдж i16] разработал методику приготовления к о и и й больших поверхностей по всей ширине клетки, с любой стороны.
Для устранения препятствий, вызываемых непроницаемостью клеточных стенок, для электронов был разработан метод отражательной электронной микроскопии. Пучок электронов направляется на изучаемый препарат под углом около 5°, приближающимся к плоскому углу касания,
|
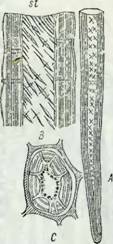
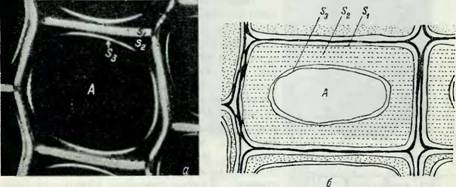
Рис. 10. А) Поперечное сечение древесины сосны {P. radiata), сфотографированное со скрещенными николямп (х 1150) (по Уордропу) |4]. б) Схематическое представление разных слоев клеточной стенки трахеиды. |
Первичная стенка показана черным, s, — наружный слой вторичной стенки; s2 — средний слой вторичной стенки; s3 — внутренний слон вторичной стенки; А — полость клетки.
И наблюдается также под малым углом к плоскости вещества (около 12°). Применение малых углов облучения и наблюдения позволяет получить высокую разрешающую силу, но в то же время дает довольно значительные зоны тени и некоторое искажение. Первоначально исследовалось непосредственно волокно, и в результате действия интенсивного пучка электронов происходила некоторая деградация целлюлозы. В последние годы стали использовать металлические копии («реплики») препаратов, получаемые по методу Бредли. Jayme u. Hunger [16] разработали метод высоковакуумного получения отпечатков поверхностей для стерео - электронного получения тончайших снимков исследуемых препаратов. Метод дает новые возможности детального рассматривания строения трахеидных пор, наблюдения постепенного удаления лигнина при делигни - фикации клеточных стенок и т. п. Мы не описываем здесь рентгенографический метод исследования, так как ему посвящена особая глава этой книги.
Как уже было сказано выше, клеточная стенка вполне сформировавшихся трахеид хвойных состоит из двух структурных частей: первичной стенки и стенки вторичной. Первичная стенка непосредственно после деления клетки и в период увеличения поверхности дочерней клетки является единственной оболочкой, заключающей в себе протопласт.
|
Рпс. 11. Схема организации клеточной стенки трахеиды хвойных (по Уордропу) [4]. |
|
1 — межклеточное вещество; 2 — Первичная стенка (Р) вторичная стенка: 3 —внешний слой (s,); 4 — Средний слой (sz): 5 — внутренний слой (s3). |
В сухом состоянии, как установлено при помощи электронного микроскопа, первичная стенка имеет толщину около 300 А, что примерно равно толщине 3 микрофибрилл. В природном набухшем состоянии толщина первичной стенки оценивается примерно в 0.1 [i (1000 А).
Вторичная стенка, образующаяся позднее, возникает вследствие активной деятельности протоплазмы, откладывающей изнутри слои вторичной стенки на стенку первичную. Вторичная стенка, как показали исследования Керра и Вэйли [3], состоит из трех слоев — наружного слоя slt среднего слоя s2 и внутреннего слоя s3, которые легко отличимы по разнице в их оптических свойствах (рис. 10).
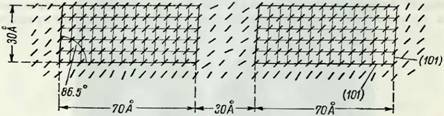
Наблюдения при помощи электронного микроскопа и методами двойного лучепреломления и микроскопии показали, что первичная стенка Р и все три слоя.9,, s2 и S3 стенки вторичной построены из целлюлозных микрофибрилл неопределенной длины (рис. 11), толщина которых неодинакова и составляет менее 100 А, ширина 100—300 А (Уордроп [15]). В первичной стенке Р микрофибриллы целлюлозы образуют неправильную, чрезвычайно сложную сетчатую систему. Эта система, однако, составляет только меньшую часть объема первичной стенки. Другая часть — гемицеллюлозы и лигнин. Общая картина фиброидной сетчатой структуры первичной стенки изображена на электронной микрограмме (рис. 12), взятой из статьи Мейера [37].
Микрофибриллы внешнего слоя sx вторичной стенки образуют две группы встречных перекрещивающихся спиралей (рис. 11 и 13), но структура этого слоя, по мнению ряда исследователей, может быть, является еще более сложной.[1] В среднем мощном слое s2 вторичной стенки, состоящем, в свою очередь, из большого числа концентрических наслоений, микрофибриллы целлюлозы располагаются по крутым спиралям почти в продольном направлении к оси волокна. Внутренний слой Ss, нередко состоящий из почти поперечно лежащих микрофибрилл (может быть, из пересекающихся их спиралей), окружает полость трахеид. Точное расположение микрофибрилл в этом внутреннем слое пока еще не вполне выяснено [14]. В некоторых породах и образцах этот слой может отсутствовать. Иногда микрофибриллы в этом слое направлены почти вдоль оси волокна (у березы и ели).
На рис. 14 дана электронная микрография продольного расположения микрофибрилл во вторичной стенке (слой S2) хвойной древесины Pseudo-
|
Рис. 12. Расположение фибрилл в делигннфи - цированной первичной стенке трахеиды (по Г. Мейеру) [3?|. |
Рис. 13. Электронная ми крография части внешнего слоя вторичной стенки, показывающая структуру не рекрещивающихся микрофибрилл. Урановое затенение. Увеличение X 8000 (по Уордропу) [4J.
|
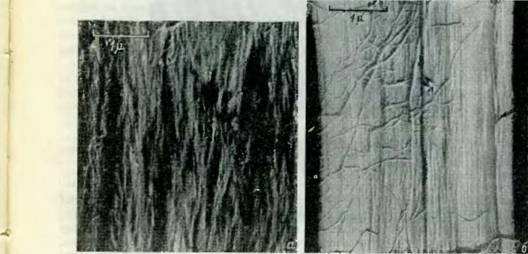
Рис. 14. Электронная микрография вторичной стенки псевдодзуги до (а) и после удаления лигнина (б) (по Уордропу) [4]. |
%
Tsuga Taxifolia. На рис. 14, б для сравнения заснята та же вторична, стенка после удаления лигнина. В этом последнем случае особенно четк видна параллельная направленность микрофибрилл вдоль продольно] оси волокна. На рис. 14, а целлюлозные микрофибриллы плотно за ключены в аморфной массе лигнина и гемицеллюлоз. Исследовател]
|
Рис. 15. Электронная микрография части вторичной стенки Eucalyptus eleofora после делигнификации и кислого гидролиза (по Уордропу) [4]. |
Считают на основании изучения спектров поглощения ультрафиолетовых лучей и электронно-микроскопических наблюдений, что лигнин и прочие инкрустирующие вещества трахеид отлагаются в пространствах между микрофибриллами первичной и вторичной стенки и в срединной пластинке, t ■ Фогелем [в] и Уордропом [7] было показано, что умеренный гидролиз во время делигнификации древесины и последующий гидролиз после делигнификации содействуют агрегированию микрофибрилл в более толстые пучки, как показано на рис. 15.
Давно уже было замечено при микроскопических наблюдениях под большими увеличениями концентрическое строение среднего мощного слоя S2 вторичной стенки. При набухании волокон в медноаммиач - ном растворе, в горячем концентрированном растворе хлористого цинка или в щелочи можно более или менее ясно наблюдать на поперечных сечениях (при сильном увеличении микроскопа) наличие в слое S2 многочисленных концентрических колец [12]. Вся толща слоя S2 оказывается состоящей из чередующихся между собой более плотных (светлых) и менее плотных (рыхлых, темных) концентрических наслоений. Причину этой слоистости в прежнее время объясняли различно, видя ее в неравномерной работе плазмы, отлагающей изнутри вещества, образующие слой s2 вторичной стенки. При последовательном набухании сухих кле-
|
Рис. 16. Поперечные сечения хлопковых волокон А — кольца роста набухших волокон, выращенных в попе - вых условиях; В — срез набухшего волокна, выращенного при постоянном освещении и при постоянной температуре (по Андерсон и Керр)[и]. |
Точных стенок в растворах солей, дающих друг с другом цветные осадки, удавалось наблюдать более интенсивную окраску рыхлых колец по сравнению со светлой окраской колец более плотных. Ланге в последнее время считает, что такое концентрированное пластинчатое строение слоя s2, по-видимому, объясняется небольшими различиями в направлениях фибрилл, образующих эти пластинки.
Недавно было показано при исследовании ультратонких срезов в электронном микроскопе, что каждое концентрическое кольцо слоя s2 имеет толщину 100—200 А. Отсюда видно, что такая пластинка состоит из одного, максимум из двух кольцевых наслоений микрофибрилл.
При изучении концентрической слоистости на поперечных срезах волокон сырого хлопка, состоящего на 90% из чистой целлюлозы, сопровождаемой пектиновыми веществами, жирами и восками, было замечено, что концентрические слои отлагаются в клеточных стенках хлопка не непрерывно. Нарастание каждого слоя, отвечающего одному дневному вегетационному периоду, задерживается ночью. На следующий день начинает образовываться новый слой. В результате такого прерывистого процесса в клетках хлопка наблюдается концентрическое строение. Андерсон и Керр показали, что при выращивании хлопка при непрерывном круглосуточном освещении и постоянной температуре на поперечном срезе хлопковых волокон вообще не образуется концентрических слоев (рис. 16).
В последние годы (1954) полагают на основании исследований, что распределение длинных цепных молекул целлюлозы (С6Н10О5)и, совпадающее с направлением микрофибрилл во вторичной стенке, не является в поперечном сечении однородным и что порядок в расположении этих цепей неодинаков. Из представленной на рис. 17 схемы Фрей-Вислинг [5] 2 Н. И. Никитин
видно, что правильные «кристаллические» участки целлюлозных цепей, проходящих в направлении, перпендикулярном к плоскости чертежа,
/ / ,

|
|
|
/ ' / |
' / / /
|
Рис. 17. Схематическое представление поперечного сечения микрофибриллы (по Фрей-Висслинг). |
Окружены менее правильно расположенными цепями. Последние тоже направлены вдоль фибрилл, но строгий порядок в этой, так называемой
Паракристаллической, части • | отсутствует. Области целлю
Лозы, в которых имеется со - I вершенный порядок в трех
'1ИДН.■.;■ пространственных направле - ' t ЛВИвЯМИ'';^ ниях, называются «м ицел - ' л а м и». Длина мицелл составляет, по Уордропу, 500—
|
|
|
Рис. 18. Электронная-микрография лигнина вторичной стенки, выделенного из поперечного сечения Nothofagus cunninghamii после обработки 72% H2S04 (по Уордропу) [4]. |
(см. J1]). Цепи целлюлозы, состоящие из нескольких ты - К? сяч звеньев ангидроглюкозы A'' J СнН10ОБ, проходят вдоль С « фибрилл и имеют строгий Bnajp трехмерный порядок на мно - j^^^KjfjM. t' гочисленных продольных ftj участках по длине цепей, тогда как между этими участками лежат «аморфные» области, в которых строгий порядок отсутствует и сохраняется лишь общая продольная направленность цепей. Так как рядом ученых было установлено, что рентгенограммы целлюлозных волокон мало изменяются после удаления лигнина из клеточных стенок, большинство исследователей до последнего времени считало, что лигнин не проникает в области внутри мицелл. В новейшее время, однако, в лабо
ратории Уордропа было установлено, что делигнификации целлюлозных клеточных стенок все же ведет к заметпому изменению рентгенограммы целлюлозы. Автором высказано предположение о том, что часть лигнина проникает, может быть, в паракристаллическую фазу и здесь ассоциируется с целлюлозой. Удаление этой части лигнина, возможно, приводит к некоторой дополнительной кристаллизации целлюлозы и к повышению размеров кристаллических участков в микрофибриллах, что ведет к увеличению четкости интерференционных колец на рентгенограммах (см. гл. III). Возможность ассоциации части лигнина не только с гемицеллюлозами, но и с целлюлозой, по мнению Уордропа, до некоторой степени подкрепляется наблюдениями Сена и Вудс, заметившими, что присутствие малых остатков неудаленного лигнина в волокнах джута препятствует полной мерсеризации целлюлозы при обработке волокон растворами едкого натра. Предположение о возможной ассоциации части лигнина с целлюлозой, однако требует дальнейших опытных подтверждений.
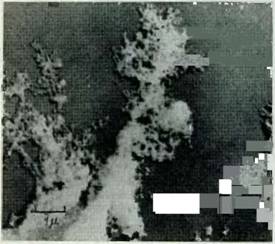
Выше, на рис. 18, приводится электронная микрография тонкого поперечного среза лигнина вторичной стенки Nothofagus Cunninghamii, Выделенного обработкой 72%-й серной кислотой, приводящей к растворению микрофибрилл целлюлозы и сопутствующих полисахаридов. Диаметры пор, видимых на рис. 18, составляют 200—300 А, что несколько превышает толщину микрофибрилл, может быть, потому, что последние набухают перед растворением в 72%-й серной кислоте (Уордроп).





 Опубликовано в
Опубликовано в