АЛКИЛНАФТАЛИНЫ 1
 20 августа, 2013
20 августа, 2013  admin
admin >1
Сульфированием 1-метилнафталина при 20 °С получают 1-ме- тилнафталин-4-сульфокислоту, сульфированием при 110 °С - смесь 3- и 7-сульфокислот, а при 170°С образуется главным образом 1-метилнафталин-7-сульфокислота. При сульфировании
2-метилнафталина сульфогруппа вступает преимущественно в положение 8- при 40 °С, 6- при 90-95 °С и 7- при 160°С [16].
Сульфированием алкилнафталинов Н2в04 или олеумом и нейтрализацией полученных сульфокислот щелочью производятся нафталинсульфонаты. Сульфонат С4Н9С10Н68О3Ка применяется под названием «смачиватель НБ» в текстильной и кожевенной промышленности, а также как смачиватель и диспергатор в производстве дисперсных красителей, эмульгатор синтетических латексов. Смачиватель СВ-101 - (С4Н9)2С10Н58О3Ка, получаемый взаимодействием нафталина с бутанолом и олеумом, - применяется в производстве кинофотоматериалов и текстильной промышленности. Алкилированием нафталина 2-бутеном и последующим сульфированием Н2804 производится некаль - водный раствор смеси моно-, ди - и триизобутилнафталинсульфонатов Ыа, применяемый в производстве синтетических латексов и как текстильно-вспомогательное вещество. Конденсацией нафталин- сульфокислот с формальдегидом и последующей нейтрализацией продукта КаОН получают СН2(С 10Н68О3Ка)2 - диспергатор НФ, используемый в качестве диспергатора и стабилизатора пигментов и красителей в текстильной промышленности, вспомогательное вещество в кожевенном производстве, стабилизатор латексов. Динатриевая соль нафталин-2,6-дисульфокислоты применяется как диспергатор пигментов и добавка в растворы электролитов при нанесении гальванических покрытий [54].
Окислением 1- и 2-метилнафталинов соответственно разбавленной НГТО3 при кипячении и концентрированной НЖ)3 получают нафталин-1- и нафталин-2-карбоновые кислоты (или а - и [3- нафтойные кислоты).
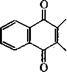
Окислением 2-метилнафталина хромовой кислотой в уксусной кислоте получают 2-метил-1,4-нафтохинон, известный под названием менадион или витамин К3 [55]:
![]() СИ3 ^^А/СНз
СИ3 ^^А/СНз
+ 2Сг03 + ЗН2804 |Т|| +
|
|
+ Сг2(804)з + 4Н20
Недостаток промышленного метода производства витамина К3 окислением 2-метилнафталина хромовым ангидридом или К2Сг207 - наличие хрома в сточных водах и в целевом продукте. Разработан альтернативный метод получения витамина К3 окислением 2-метилнафталина надуксусной кислотой, использованный на установке мощностью 100 т/год [56].
Запатентовано также окисление 2-метилнафталина Н202 в присутствии металл органических соединений рения, например СНдИеОз, с выходом витамина К3 около 100 % [57, 58].
Используется также витамин К4 - диацетат соответствующего гидрохинона, лучше растворимый в воде [16].
Конденсацией 2-метил-1,4-нафтохинона с фитолом в диокса - не при 75 °С в присутствии щавелевой кислоты и последующим окислением полученного нафтогидрохинона Ag20 синтезируют
2- метил-3-фитил-1,4-нафтохинон, или витамин К}:
|
|
|
СН3 |
СН2СН=ССН2СН2СН2(СНСН2СН2СН2)2СН(СНз)2 сн3 сн3
Витамин Кх, как и менадион, является эффективным коагулянтом крови.
Витамины группы К регулируют функции крови, нормализуют обмен минеральных веществ, снижают вероятность канцерогенных заболеваний [59].
Большое число патентов в последние годы относится к получению 2,6-нафталиндикарбоновой кислоты окислением 2,6-ди - алкилнафталинов. Полученная кислота применяется в производстве полиэфиров и полиамидов, из которых изготовляют спецволокна для радиоэлектроники, электротехники, радиотехники, пленки, прочные кордовые материалы для шинной промышленности.
Так, жидкофазным окислением 2,6-диметилнафталина воздухом при 195-250 °С в среде 95 %-й уксусной кислоты в присутствии ацетатов Со, Мп и промотора - НВг при атомном отношении Со : Мп : Br = 1 : 3 : 2 получают 2,6-нафталиндикарбоно - вую кислоту. Выход кислоты повышается с 82 до 93 % при повышении степени чистоты исходного 2,6-диметилнафталина с
98.5 до 99.0 % [60]. Аналогичная каталитическая система предложена и в патенте фирмы «Mitsubishi Petrochemical Со.» [61]. В патенте [62] используется каталитическая система с добавками Ni в атомном соотношении Ni : (Со + Мп) : Вг = (0.05-0.5) : 100 : : (50-100).
Окислением 2,6-диэтилнафталина воздухом при 190 °С и давлении 1.6 МПа в присутствии ацетатов Со, Мп и NaBr в среде уксусной кислоты получена 2,6-нафталиндикарбоновая кислота чистотой 98.5 % с выходом 95.1 % [63].
I ри использовании в качестве сырья 2,6-диизопропил нафталина с теми же катализаторами и растворителем получена 2,6- нафталиндикарбоновая кислота с выходом 87.2%. Продукт очищают этерификацией метанолом в присутствии 96 % - й Н2804, получая с выходом 96 % диметиловый эфир, гидролизом которого в водном растворе КаОН с выходом 96.3 % выделяют
2.6- нафталиндикарбоновую кислоту чистотой 99.9 % [64, 65].
Количество катализатора при окислении 2,6-диалкилнафта-
Линов может быть снижено при добавлении в реакционную среду пиридина, ГШ4Вг [66], этилендиамина, пропиламина или других аминов [67]. В составе каталитической системы кроме Со, Мп, Вг могут находиться Си и другие тяжелые металлы. На стадии окисления 2,6-диалкил нафталина предлагается добавлять смесь эфиров, содержащую диметиловый эфир 2,6-нафталин дикарбо - новой кислоты.
Возможна очистка 2,6-нафталиндикарбоновой кислоты перекристаллизацией из воды в сверхкритическом состоянии, содержащей добавки 2-пропанола, циклогексанола, циклогекса - нона [68].
Примеси альдегидокислоты можно удалять гидрированием при 315-370 °С в среде уксусной кислоты в присутствии Р1, Рс1, Ии или их соединений. Чистая 2,6-нафталиндикарбоновая кислота выделяется затем кристаллизацией [69].
В большинстве патентов предлагается проводить очистку не
2.6- нафталиндикарбоновой кислоты, а ее диметиловых эфиров с применением методов экстракции диметилформамидом [70], перекристаллизации из метанола [71], арена или хлорбензола [72] в сочетании с вакуумной ректификацией.
Возможна очистка нафталиндикарбоновых кислот посредством образования солей с аминами - взаимодействием с МН3 в пиридине [73] или с алифатическими диаминами, например 1,6- гексаметилендиамином [74]. При последующем добавлении в водной среде алифатической дикарбоновой кислоты, например адипиновой, осаждается очищенная 2,6-нафталиндикарбоновая кислота. Остающуюся в растворе АГ-соль можно использовать для получения найлона.
Возможна очистка нафталиндикарбоновых кислот адсорбцией примесей активированным углем с использованием в качестве растворителей алкиламинов и алифатических спиртов. Образующуюся соль нафталиндикарбоновой кислоты и амина разлагают при нагревании и получают 2,6-нафталиндикарбоновую кислоту чистотой 99.5 % [75].
2,6- Нафталиндикарбоновая кислота может быть также получена с выходом 89.5 % окислением 2-алкил-6-ацилнафталина воздухом при 210-220 °С в уксусной кислоте в присутствии катализатора, содержащего Со, Мп, Вг [76, 77].
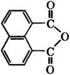
Ангидрид нафталин-1,8-дикарбоновой кислоты (нафталевый ангидрид)
|
|
Применяется в качестве антидота для растений, ослабляющего фитотоксическое действие гербицидов на культурные растения, но не снижающего их активность по отношению к сорнякам.
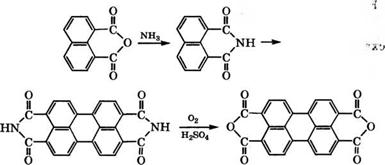
Аммонолизом нафталевого ангидрида при 90-110 °С с последующим щелочным плавлением образующегося нафталимида при 220-225 °С и окислением водного раствора плава гипохлоритом Иа или воздухом в 85 %-й Н2804 получают диангидрид пе - рилентетракарбоновой кислоты [78, 79]:
|
|
1Ч,1[-Замещенные производные диимида периленкарбоновой кислоты применяются как светопрочные пигменты для нитролаков, полимеров и типографских красок.
Взаимодействием нафталевого ангидрида и о-фенилендиами - на получают люминофор, относящийся к группе периноновых красителей [17, 80]:
I Замещенные производные этого продукта конденсации используются также в качестве полимерорастворимых и дисперсных желтых красителей.
Ацилированием 2-метилнафталина или 2,3-диметилнафта - лина в положение 6 с помощью региоспецифического комплекса ацетилхлорида с А1С13, включающего электроноакцепторное нитроароматическое соединение (нитробензол, о-нитротолуол, нитромезитилен) и электронодонорное соединение (гексаметил- бензол, металлоцен), в среде инертного растворителя при 0-40 °С можно получить 6-ацетильные производные. Так, из 2-метилнафталина получен 2-ацетил-6-метилнафталин с селективностью 70.6% при конверсии 2-метилнафталина 85.5%. После перекристаллизации из нонана степень чистоты продукта составляет
98.9 %. Окислением ацетильных производных 2-метил - и 2,3-ди- метилнафталина могут быть получены ди - и трикарбоновые кислоты нафталинового ряда, используемые в синтезе термостойких полимеров [81].

 Опубликовано в
Опубликовано в