АЦЕНАФТЕН
 20 августа, 2013
20 августа, 2013  admin
admin |
|
|
ФЛУОРЕН Окислением флуорена производится 9-флуоренон: |
![]() Окисление может проводиться воздухом в однофазном водноорганическом растворителе, например в водном пиридине, в присутствии NaOH [84]. Окисление флуорена в паровой фазе проводится на У205-Ге203-катализаторах. При модифицировании катализатора Cs2S04 селективность образования 9-флуоренона повышается с 70 до 98 % [85].
Окисление может проводиться воздухом в однофазном водноорганическом растворителе, например в водном пиридине, в присутствии NaOH [84]. Окисление флуорена в паровой фазе проводится на У205-Ге203-катализаторах. При модифицировании катализатора Cs2S04 селективность образования 9-флуоренона повышается с 70 до 98 % [85].
Фирма «Nippon Shokubie Co.* запатентовала газофазный способ получения флуоренона окислением флуорена на V-Cs-K-
S-ТЮг-катализаторе на носителе SiC. При соотношении флуо - рен : 02 = 0.759 : 1, температуре катализатора 430°С, начальной температуре смеси реагентов 140°С и скорости ее подачи в реактор 0.615 ч-1 конверсия флуорена 98.1 %, селективность 96%, выход флуоренона 94.2 % [86].
Компания «The Dow Chemical* предложила получение 9-флуоренона с количественным выходом: флуорен превращают в
9.9- дихлорфлуорен в системе СС14 - 30 %-й раствор NaOH в присутствии [Bu4N]OH, и гидролизом при добавлении H2S04 и перемешивании реакционной смеси получают целевой продукт [87].
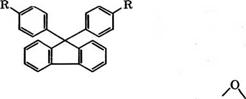
Конденсацией 9-флуоренона с 2 моль фенола производится
9.9- бис(4-гидроксифенил)флуорен, так называемый бисфенол - флуорен, содержащий 97 % 4,4'- и 3 % 2,4'-изомера [88]:
С использованием бисфенолфлуорена можно получать конструкционные полимеры с повышенной стойкостью к растворителям и термостойкостью на основе производных типа
|
|
- диглицидилэфирного мономера, где II = ОСН2СН—СН2, или эпоксиакрилатного мономера, в котором И = = 0СН2СН(0Н)СН20С(0)СН=СН2. На основе этих мономеров синтезированы в том числе оптические полимеры повышенной прозрачности с высоким показателем светопреломления.
Разработана технология производства бисфенолфлуорена с выходом свыше 80 %. Тем самым решена проблема утилизации флуорена, содержащегося в каменноугольной смоле.
Запатентован способ получения бисфенолфлуорена взаимодействием флуоренона и фенола в массовом отношении 1 : 4 в присутствии Р-меркаптопропионовой кислоты при пропускании НС1. Продолжительность реакции 5 ч при 50 °С, затем удаляют НС1 пропусканием азота, отгоняют непрореагировавший фенол, после охлаждения добавляют метанол, воду и осаждают бисфенолфлуорен. Выход продукта 80.2 %, степень чистоты 99 % [89].
Той же японской фирмой «Синнитто кагаку» предложен способ очистки бисфенолфлуорена экстракцией примесей метил - этилкетоном при 50 °С и перекристаллизацией из смеси метанол - толуол при -5°С. Получают очищенный продукт чистотой
99.9 % с выходом 85.6 % [90].
Расщеплением флуоренона с Ка1>Ш2 в толуоле при 95 °С получают 2-фенилбензамид с выходом 90.9 % при продолжительности реакции 4 ч [91].
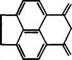
Направления использования аценафтена представлены на схеме (рис. 18).
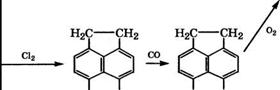
Дегидрированием аценафтена в смеси с воздухом или инертными разбавителями при 300-600°С в присутствии А1203-Мп203- катализатора получают аценафтилен чистотой 95-96 % с выходом 80-95 %.
Аценафтилен полимеризуется при 150-200 °С с образованием полиаценафтилена. Сополимер аценафтилена со стиролом характеризуется такими же механическими и электрическими свойствами, как полистирол, но на 30 °С более высокой теплостойкостью. Аценафтилен используется также для получения сополимеров с винил ацетатом, метилметакрилатом, аценафти - лен-формальдегидных и аценафтилен-феноло-формальдегидных смол.
Парофазным окислением аценафтена воздухом при 450-550 °С в присутствии У205 с выходом 85 % получают ангидрид нафталин-1,8-дикарбоновой кислоты (нафталевый ангидрид). Получение нафталевого ангидрида возможно и жидкофазным окислением аценафтена кислородом при 70-250°С в присутствии резината, стеарата или бората М£, Со или РЬ [16].
Нафталевый ангидрид применяется в производстве дисперсных красителей, синтетических волокон, нафталин - и перилен - тетракарбоновых кислот.
Сополимеры
![]()
|
-н2 |
![]() Полиаценафтилен
Полиаценафтилен
Смолы
<4 /° *°
|
О2 УоО* |
|
|
|
|
|
С12 |
|
СН2(С1М)2 |
![]()
|
А1С1Я |
![]() ЫН
ЫН
ЫН
|
Н2С----- СН2
|
|
|
|
<4 С—с |
![]()
![]()
|
02 |
![]() Индигоидные красители
Индигоидные красители
Рис. 18. Направления использования аценафтена
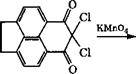
Нафталин-1,4,5,8-тетракарбоновую кислоту получают в промышленности конденсацией аценафтена с малононитрилом, последующим хлорированием дикетимида до хлоркетона и окис-
Лением последнего КМп04. Кислота может быть также синтезирована окислением пирена.
Карбонилированием 5,6-дихлораценафтена в присутствии карбонила кобальта и бензилхлорида при 20-80°С получена
5,6- аценафтендикарбоновая кислота [82, 83], окисление которой - еще один путь синтеза 1,4,5,8-нафталинтетракарбоновой кислоты.
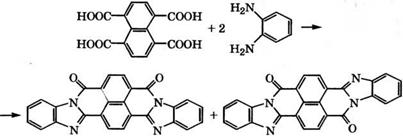
1,4,5,8- Нафталинтетракарбоновая кислота применяется в производстве дисперсных и кубовых красителей. Так, взаимодействием с о-фенилендиамином получают краситель кубовый алый:
|
|
В качестве кубовых красителей используется смесь цис - и транс-изомеров, имеющих цвет бордо и оранжевый соответственно. Краситель дает устойчивые окраски на целлюлозных волокнах, применяется в качестве органического пигмента. Применяется 1,4,5,8-нафталинтетракарбоновая кислота и для производства термостойких искусственных волокон, например по - ли(ароилен-бис-бензимидазолов) [78-80].
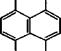
Окислением аценафтена кислородом воздуха в присутствии катализаторов - NaN02, V205, Th02, Мо03 при 250-300°С получают аценафтенхинон. Возможно также получение аценафтен - хинона жидкофазным окислением аценафтена 30 % - м Н202 в уксусной кислоте при 100 °С.
Аценафтенхинон применяется в производстве индигоидных красителей, например диаценафтилендиона - желто-оранжевого индигоидного красителя:

 Опубликовано в
Опубликовано в