Хинондиазидные композиции
 21 ноября, 2013
21 ноября, 2013  admin
admin Композиции хинондиазидных фоторезистов состоят, как правило, из эфира полифенола с 5-сульфокислотой 2-диазо-1-нафта - линона, низкомолекулярной фенольной или крезольной НС с Мп = 500-1-900 или этилакрилат-стирол-метакрилатного сополимера (фирма GAF, США) и растворителя. Кроме этих основных компонентов в состав композиции могут входить промоторы адгезии, красители, индикаторы, пластификаторы, наполнители и др. Фо - торезистные пленки толщиной до 10 мкм формируют из раствора на подложках Si02/Si, анодированного алюминия и других материалов. Под действием дозированного света (экспонирование) нафтохинондиазидный остаток изомеризуется с выделением азота в замещенный кетен; последний быстро гидролизуется, превращаясь в производное инденкарбоновой кислоты. В отличие от исходного диазида, кислота растворима в водных щелочах, что делает возможным проявление фотолизованной пленки; при проявлении на фотолизованных участках с подложки удаляется инденовый и полимерный компонент пленки. Образующийся вы - сокоразрешенный рельеф (до 1000 линий на 1 мм) служит маской при кислотном и щелочном травлении подложки.
Преимуществом этих фоторезистных систем перед другими является высокая светочувствительность и разрешающая способен
ность, низкая чувствительность к кислороду воздуха фотолизатов, стойкость рельефа к травлению. К недостаткам следует отнести неудовлетворительную адгезию ко многим подложкам, применяемым в производстве полупроводников, нестандартность фасовок в результате воздействия условий транспортировки и хранения, плохая воспроизводимость свойств партий из-за самых незначительных нарушений в технологии производства.
II. 1.1.1. Строение, термо - и фотопревращения нафтохинондиазидов
|
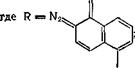
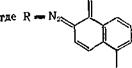
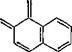
В электронном спектре 1-диазо-2-нафталинона, 2-диазо-1-наф - талинона и его замещенных имеется ряд полос в УФ - и ближней видимой области. Спектры приводятся во многих работах (см.,
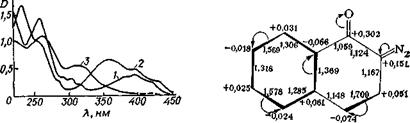
Рис. II. 1. Электронные спектры поглощения 2-диазо-1-нафталинона (/), 2-диазо-1-нафта - линон-5-сульфохлорнда в Смеси 3-метнлпентана с метилцнклогексаиом (16 : 84) при комнатной температуре (2)и после фотолиза в течение 250 с светом к= 340 нм (3) [4]. |
Рис. И. 2. Молекулярная диаграмма 2-диазо-1-нафталинона (электронные плотности на атомах углерода и длины связей рассчитаны по методу ППДП/2) [6].
например, [1—4]) (рис. II. 1), для наиболее интенсивных длинноволновых полос водных растворов 1-диазо-изомера при 385 нм lge = 3,72, 2-диазоизомера при 400 нм lg'e = 3,96, а его 5-сульфокислоты при 388 нм lge = 3,60 [3]. Полосы на границе видимой области спектра обусловливают светочувствительность нафтохинон - дназидных производных при фотолизе ртутными лампами среднего давления. Как показывают расчеты по методу ЧПДП/С, введение электроноакцепторов в положения 4, 5 или 6, а также электронодоноров в положение 4 2-диазо-1-нафталинона сдвигает положение полосы 370 нм в «среднюю» УФ-область спектра [5]. Эти расчеты использованы для синтеза нафтохинондиазидов с заданным положением полосы в спектре, что существенно для создания резистов для средней УФ-области (313 нм и 334 нм).
Как видно из молекулярной диаграммы 2-диазо-1-нафтали - нона (рис. II.2), его хинондиазидная часть сильнее поляризована, чем бензольная; в последней заметно нарушена выравненность связей; 5-сульфохлоридная группа еще более поляризует молекулу, проявляя электроноакцепторное действие. Найдено соответствие между рассчитанными электронными плотностями и химическими сдвигами 13С в спектре ЯМ. Р 13С нафтохинондиазида [6].
В ИК-спектрах 2-диазо-1-нафталинона наблюдаются характеристические полосы при 2152 и 2122 см-1 (С=Ыг), 1615 см-1 (С = 0), а также серия полос ниже 1600 см-1 [3,4]. Частота C=N2 повышена, а С —О понижена вследствие поляризующего взаимодействия хромофоров. Отнесение частот в ИК-спектре 2-диазо-1-нафталинона в эфирах его сульфокислоты сделано в работах [7, 8] и в других исследованиях. Благодаря поляризации 2-диазо-1-нафталинон можно рассматривать как арилдиазоний с сильным электронодонор - ным заместителем О-[9, 10]. При этом орто-диазонафталиноны — слабые основания; для 2-диазоизомеры рКа = 0,86 ± 0,03, для
1- диазоизомера рКа — 0,60± 0,01 [3]. По мнению авторов [11], с уменьшением полярности растворителя (критерий — диэлектрическая проницаемость) увеличивается вклад хиноидной формы в резонансный гибрид хинондиазида, что проявляется в росте интенсивности полосы C = N2 в ИК-спектре (2124 см-1) в ряду диметил - сульфоксид (ДМСО), диметилформамид (ДМФА), дихлорэтан, бензилацетат, диоксан (интегральные интенсивности см. [12]). Ариловые эфиры 5-сульфокислоты 2-диазо-1-нафталинона образуют слабые донорно-акцепторные комплексы в ДМСО и ДМФА [13].
На ртутном капельном электроде в буферных растворах Бриттона-Робинсона с добавкой 10 % этанола восстановление 1-диазо-
2- нафталинона сначала идет с присоединением двух электронов и протона до аниона орто-гидроксинафталиндиимида; в кислой среде он восстанавливается до арилгидразина, а в щелочной — до нафтола, отщепляя азот. Соотношение этих продуктов электродной реакции определяется pH среды [10].
Хинондиазиды весьма реакционноспособны термически, фотохимически и в условиях катализа [14]. Основные направления их превращений связаны с первоначальным выделением азота. Ранние работы по химии и фотохимии нафтохинондиазидов рассмотрены в монографии Динабурга [15].
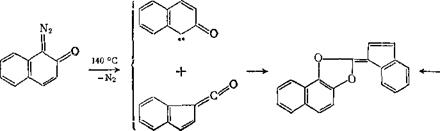
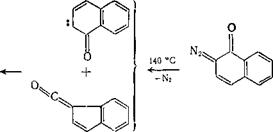
При термолизе 1-диазо-2-нафталинона и 2-диазо-1-нафтали - нона в растворе ксилола и твердых пленках образуется с выходом 30 % одно и то же производное 1,3-диоксола, как считают, в результате взаимодействия промежуточных карбена и кетена [16—18]. Строение одного из первичных продуктов термолиза — карбена — может отвечать ряду синглетных и триплетных состояний; наиболее вероятен синглетный карбен и 1,3-диполь. Однако трудно решить, участвует в реакциях с 1,3-диполярными реагентами промежуточный продукт термолиза или исходный диазоке - тон;
|
|
|
|
Термолиз при 180 °С 1-диазо-2-нафталинона в присутствии фенола или анилина дает фениловый эфир или анилид 3-инден - карбоновой кислоты; с бензиловым спиртом образуется р-нафтол и бензальдегид [19]; 5-п-трет-бутилфенилоксисульфонил-2-диазо-
1- нафталинон в кипящем ксилоле при 130—150 °С или в твердой пленке в присутствии ксиленолформальдегидной смолы образует замещенный сульфонильной группой полициклический 1,3-диоксол и модифицирует соответствующей 3-инденкарбоновой кислотой исходную НС, что констатируется по полосе 1720 см-1 (COOR) и ИК спектре НС и появлению в ее элементном составе серы [20]. Аналогично трисэфир 2,3,4-тригидроксибензофенона и 5-сульфокислоты 1-диазо-2-нафталинона этерифицирует НС соответствующей инденкарбоновой кислотой при нагревании в этой смоле (полоса в ИК-спектре 1730 см-1) [21].
При термолизе изомерных орто-диазонафталинонов в метаноле, этаноле, 2-пропаноле образуются эфиры этих спиртов 3-инденкарбоновой кислоты, соответствующие орто-алкоксинафтолы и на - фтолы, что отвечает превращениям промежуточных кетена и кар - бена [22].
Ниже приведен выход продуктов фотохимического при ХВОЭб = = 278 нм (I) и термического при 180 °С (II), разложения 2-диа- зо-1-нафталинона в спиртах в атмосфере аргона, % [22]:
|
Мета - Этанол 2-Г1ропанол 2-Метил-2-про- нол панол
|
Поскольку нестабилизированные резонансом орго-диазокетоны при прочих равных условиях менее термически устойчивы, а водородные связи с веществом среды за счет С1^ О диазокетона препятствуют резонансу, то в таких средах повышается термическая
лабильность соединений. Ионы металлов (в частности, Ag+, Cu2+) координируются с углеродом группы C = N2, что в случае различных диазокетонов облегчает элиминирование азота (каталитический эффект) [14].
Фотолиз нафтохинондиазидов изучался во многих работах. При этом не наблюдалась фотоизомеризация диазогруппы в ази-
ТАБЛИЦА II. 1. Зависимость квантового выхода фоторазложения 2-диазо-1-нафталинона (А), 1-диазо-2-нафталинона (Б) и 5-сульфокислоты 2-диазо-1-нафталиноиа (В) в различных растворителях от длины волны возбуждающего света
Кв, антовый выход фоторазложения
|
Соединение |
Растворитель
|
404 нм 434 нм |
254 нм 313 нм 365
|
По данным работы [24]
|
|
* Прн 405 нм ** Прн 436 нм |
риновый цикл, как это имеет место при облучении видимым светом замещенных диазоацетамидов, например [23]:
N
N2CHCON(CH2)5 —> II >—CON(CH2)5
w
При фотолизе диазида выделяется азот и образуются различные стабильные соединения.
На примерах 1-диазо-2- и 2-диазо-1-нафталинонов показано, что в пределах концентраций растворов 10~4—1СН М фотолиз идет
По однофотонной схеме, его скорость не зависит от концентрации субстрата. Судя по скорости разложения, свет фотохимически активен во всей области спектра диазидов в различных растворителях (табл. II.1) [24, 25]. Большие расхождения в найденных в разных работах значениях квантового выхода фоторазложения Фрасп хинондиазидов авторы работы [25] объясняют тем, что в работе [24] учитывалось суммарное поглощение света фотолизатом, тогда как в [25] только поглощение хинондиазидом. В полимерных матрицах (ПБА, ПЭА, ПВА, сополимер стирола и бутилмс - такрилата, ПВХ, ПМ. МА, ПС, НС и т. д.) фрасп в 2 раза ниже, чем в растворах [26]. Значительные квантовые выходы разложения диазидов отвечают длинноволновой части спектра [24, 25] (см. также [2] ), что отмечалось и для эфиров сульфокислоты 2-диазо- 1-нафталинона в полимере; в этой части спектра скорость разложения растворов 2-диазоизомера больше, чем 1-диазоизомера, это наблюдалось и для полимерных матриц [27].
Скорость фотораспада эфиров 2-диазо-1-нафталинон-5-сульфо - кислоты и феноло-формальдегидных смол в пленке возрастает при переходе от незамещенных к хлорированным, бромированным и иодированным смолам [28, 29]. В водных растворах не наблюдалось влияния 0,5 моль/л NaBr и Nal на скорость фотораспада изомерных 1,2- и 2,1-диазонафталинонов [24], однако в работе [30] было показано, что 1-бромпропан и иодэтан в концентрациях 0,3 моль/л сильно уменьшают выход фотораспада ■ растворов
1- диазо-2-нафталинона в этаноле и циклогексане, например, C2H5I в циклогексане — в 3 раза. Очевидно, требуется дополнительное изучение влияния соединений тяжелых атомов на фотолиз хинондиазидов в различных средах.
В соответствии с установившимся мнением, кислород не влияет на скорость распада хинондиазидов [24, 30]. Это объясняется малым временем жизни возбужденного синглетного состояния хинон - диазида (~ 10-12 с) и относительно низкой концентрацией кислорода (~10“3 моль/л) в растворе [30]. Квантовый выход распада солей о-гидроксинафтилдиазон&я более чем в 2 раза ниже, чем у соответствующих хинондиазидов [24]; это соответствует наблюдениям, что в кислых средах о-нафтохинондиазиды распадаются медленнее, чем в нейтральных и щелочных [2]. Внутримолекулярная поляризация растворителем повышает скорость фотораспада хи - нондиазида [11]. Очевидно, при фотолизе эта форма соединения наиболее лабильна.
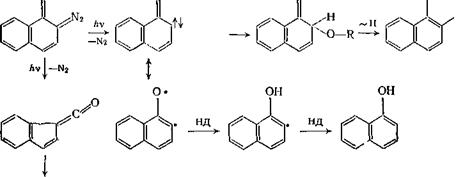
Единственным устойчивым продуктом при фотолизе в различных областях спектра водных растворов изомерных 1-диазо-2- я
2- диазо-1-нафталинонов при комнатной температуре является
3- инденкарбоновая кислота; в спиртах образуются не только ее эфиры, но и соответственно 2- и 1-нафтолы, а также гидроксиал - коксинафталины. З-Инденкарбоновая кислота и ее эфиры (а не
1- изомер [31], как считали ранее) могли бы образовываться непосредственно из кетена — 3-карбонилиндена. Гидроксиалкокси-
нафталины и гидроксинафталины могли возникнуть из соответствующих карбенов путем внедрения в связи Н-OR спиртов или отрыва от них атомов водорода:
|
он |
|
|
|
Инденкарбоновая кислота |
|
О |
|
О |
|
(или ff) |
|
-OR |
|
о |
где Д — доиор водорода.
С батохромным сдвигом полосы актиничного света несколько возрастает относительное количество инденовых производных.
В литературе часто высказывается мнение (см., например, [7, 31]), что кетен образуется из первоначально возникающего карбена, и с этих позиций появление указанных выше продуктов могло быть результатом цепи последовательных реакций. Однако в литературе ни разу непосредственно не зафиксировано образование карбена при фотолизе нафтохинондиазидов, зато при низкой температуре (77 К) многократно наблюдался кетен [32], например, в фотолизатах [7, 8] следующих веществ
|
|
C6H5COC6H4OR-n и 2)8)4-(RO)3C6H3COC6H!
Разогревание на воздухе кетенов всегда дает соответствующие
3- инденкарбоновые кислоты в результате реакции с водой, присутствующей в воздухе, а в вакууме — сложные эфиры 3-инденкарбо - йовой кислоты и фенолов, если в фотолизате содержался замещенный фенол или НС [8]. Фотолиз 1,2- и 2,1-изомерных о-нафтохи- нондиазидов на КС1 при 77 К дал единственный кетен. Это констатировано по полосам в коротковолновой части УФ-спектра фотолизатов в КС1 при 77 К: при 310 нм е = 5,42-103, при 250 нм е = 2,76-104, а также по полосам группы С=С=0 в ИК-спектре.
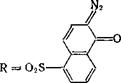
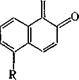
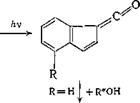
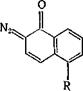
5- Сульфохлоридная группа в ядре 2-диазо-1-нафталинона стаби-
|
лизирует кетен [16]: N2 |
|
О |
|
|
|
|
|
XOOR" |
|
|
|
|
|
R =Н, S02C1 |
|
|
|
ftv |
При инициировании пучком электронов перегруппировки Вольфа в тонкой пленке эфира 4-гидроксибензофенона и 2-диазо-1-наф - талинона наблюдался также соответствующий кетен [33], идентифицированный по ИК-спектру [7, 8].
Фотолиз меченого 13С по С1 2-диазо-1-нафталиноиа привел только к меченной в карбоксиле инден-1-карбоновой кислоте (по данным [31], инден-3-карбоновой кислоте), что может свидетельствовать против образования еще одного промежуточного и нестабильного продукта в реакции — оксиренового производного (см. также [34]). Если же он и образуется, то переходит только в исходный гипотетический карбен, а не в изомерный, что возможно лишь при большой разнице в их энергии. Авторы работы [35] считают, что кетен может образоваться непосредственно из хинон - диазида при согласованном элиминировании азота и сужении цикла.
о
|
|
|
|
|
|
|
соон |
|
|
|
аУ |
|
*соон |
|
|
Именно этот путь сужения цикла представляется теперь наиболее вероятным; он реализуется, по-видимому, из синглетного состояния о-диазокарбонильного соединения, заселяемого при прямом фотолизе. За реакции с сохранением размера цикла ответственно триплетное состояние, склонное восстанавливаться. Подтверждение этому видно при реакциях гетероциклического о-хинон - Диазида. При прямом фотолизе в спирте 6-метил-7-диазо-8-оксо - симм-триазоло [4,3-е] пиридазин на 76% образует продукт перегруппировки Вольфа — 6-метил-7-карбэтоксипиразоло [3,2-с] -симМ - триазол, а при сенсибилизации Акридиновым желтым (£, » 243,6 кДж/моль)—60—70 % продукта восстановления —
6- метил-8-гидрокси-силш-триазоло[4,3-в] пиридазина [36] i N N N N N N
|
|
сенс< без сенс.
I COOC2H5
CHs CHs CH3
На соотношение триплетного (нафталиновые производные) и синтлетного (сужение цикла) путей реакции кроме строения самого диазокарбонильного • производного, по-видимому, сильно влияют среда и температура. В этой связи интересны данные по фотолизу азибензила в 2-метилтетрагидрофуране (выходы в %);
ftv. R—Н
(CeH5)2COCN2CeH5 ------------- ► (СвН5)2С=С=0 + (CeH5)2COCHRCeH5
TOC o "1-5" h z I и
I и
Комнатная температура Прямой фотолиз 98,1 1,2
Комнатная температура Сенсибилизация 40 60
77 К < 5 < 90
Триплетный карбен CeHsCOCCsHs (основное состояние) в этом случае идентифицирован по спектру ЭГ1Р при 77 К, при нагревании он давал главным образом дезоксибензоиновые производные (реакция со средой) и немного дифенилкетена; при комнатной температуре продуктом фотолиза являлся кетен. Очевидно, основное состояние карбена не является промежуточным продуктом перегруппировки Вольфа азибензила [37].
Из приведенного материала следует, что триплетная сенсибилизация для 2-диазо-1-нафталинона по меньшей мере бесполезна, если желательно повысить квантовый выход кетена и соответственно инденкарбоновой кислоты. Известно, что введение триплетных сенсибилизаторов—жетона Михлера, бензофенона, трифенилена — в раствор 2-диазо-1-нафталинона в бензоле или хлороформе с небольшими добавками спиртов, а также в пленку нафтохинондиа - зидного фоторезиста AZ-1350 не влияет на скорость распада хи - нондиазида [37]. Изучая сенсибилизацию красителями фотораспада 2-диазо-1-нафталинона и его замещенных (фрасп = 1-ЬЗ%), авторы нашли, что наиболее эффективны красители с малым энергетическим барьером ‘S— Т в твердой матрице, склонные к переносу электрона; механизм сенсибилизации сложен и требует выяснения [26].
Пирен оказалось возможным использовать как синглетный сенсибилизатор по отношению к диазонафталинонам и тем самым повысить светочувствительность резистных композиций в области 300 нм [38].
Определение степени разложения хинондиазида. В условиях производства и работы с длительно хранившимися образцами фоторезистных композиций желательно уметь определять степень разложения хинондиазида в композиции и тем самым пригодность ее для работы. Разложение происходит в результате постепенного фотолиза композиции и приводит к 3-индеикарбоновой кислоте.
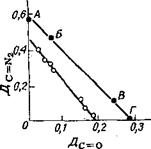
С этой целью находят соотношение оптических плотностей vc_N2 прн 2130 см-1 хинондиазида и vc=o при 1720 см-1 карбоксила инденкарбоновой кислоты при различных степенях разложения, например, исходного анализируемого раствора Б и предельно разложенного в специальном опыте фотолиза при постоянной температуре В. Из линейной зависимости в координатах ДС=М2 н Дс=0 (А и Г — точки пересечения с осями координат) находят степень разложения г) (в %) диазида в любой композиции, например той, параметры ИК-спектра которой отвечают точке Б, по простому соотношению длин отрезков АБ и АГ: т] = (АБ/АГ) ■ 100. Для каждой хинондиазидной композиции, отличающейся строением компонентов, требуется найти свою линейную зависимость (рнс. II. 3) [39]. Метод пригоден для анализа суспензий о-хинондиази - дов в вазелиновом масле, а также слоев на различных подложках. В работе [40] на примере
|
|
Рис. II. 3. Зависимость интенсивностей частот поглощения V.. и V для двух композиций на основе
(j~N п Li—О
5-сульфоэфиров 2-диазо-1-нафталииоиа с разной степенью превращения хииондиазид > инденкарбоновая кислота
[391.
светочувствительных эфиров окснбензофенонов и резистов на их основе найдено, что в пленках резистов замещенные инденкарбоновые кислоты находятся в мономерной, димерной форме и в кристаллическом состоянии, что дает серию полос карбонила в ИК-спектрах слоя, полученных по методике многократного нарушенного полного внутреннего отражения. Очевидно, обсужденный метод анализа резистов требует уточнений. Аналитическая информация о степени фотолиза хинондиазида чрезвычайно важна и в практических аспектах. Например, агрегация молекул производных инденкарбоновой кислоты может привести к их выкристаллизации из слоя, что при последующей работе даст проколы в пленке.
II. 1.1.2. Основные компоненты резистов
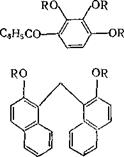
Из большого числа диазокарбонильных соединений, полученных из самых разнообразных аминофенолов ароматического и гетероциклического рядов и описанных ранее в патентной литературе, в современных фоторезистных композициях используют эфир 5-сульфокислоты 2-диазо-1-нафталинона и следующих фенолов: 2,3,4-тригидроксибензофенона, 2,4-дигидроксибензофенона,
|
|
|
С6Н |
|
СН3 C6H4OR-/7 |
|
|
|
|
ди(2-гидрокси-1-нафтил) метана и др. [например, пат. ФРГ 2626473]
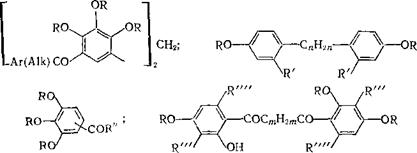
Судя по патентной литературе, до сих пор ведутся работы пб усовершенствованию этих основных светочувствительных компонентов Очень популярен триэфир 2,3,4-тригидроксибеизофенона, однако он ограниченно растворим в органических растворителях, особенно в таких широко применяемых, как монометиловый эфир этиленгликоля и сложные эфиры спиртов. Поэтому вместо него в жидкие композиции для получения офсетных печатных форм и в пленочные резисты рекомендуется вводить эфиры или кетоны следующей общей формулы:
|
|
|
■OR |
|
OR |
|
О
SO. '2 |
R' = Aik С4 —■ С!7 или Alkoxyl С4—Ci?, иногда с
атомом кислорода в цепи; R" = Aik Ci — С3, Н. С1, Вг
в количестве 7—35 % от массы композиции без растворителя [пат. ФРГ 3040157; см. также пат. ФРГ 3040156, европ пат. 0050806, 0092444].
|
|
|
Н'СбН4— 1-нафтил, 2-антрахинонил |
|
О |
|
SO. |
|
R' = 2-С1; 4-СНэ. 4-OR. Н 4-СНзО; вместо |
|
также растворимы в органических растворителях, совмещаются с НС и могут давать хорошие копировальные слои в композициях с НС и без НС; эти слои пригодны для создания форм плоской, глубокой печати. Сложные алкиловые и ариловые эфиры галловой кислоты этерифицируют по гидроксигруппам 5-сульфохлоридом диазонаф - талинона и получают в смеси с крезольным новолаком высокосветочувствительный резист; рельеф хорошо сохраняет размеры и устойчив к травлению [пат. США 4174222]. |
Неполные эфиры тригидроксибензофенонов [пат. ФРГ 1422474, 3220816; пат. Великобритании 1154749], например
|
|
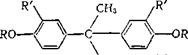
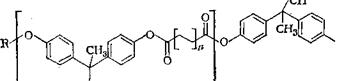
Эфиры бисфенола А давно патентуются как светочувствительные компоненты; в пат. ФРГ 2828037 описаны их структурные аналоги — производные эфиров 3,3-дифенилбутанкарбоновой кислоты и других кислот с более длинной углеродной цепью:
|
[CH2CH2I„COOAIk |
|
|
|
О |
|
R = N: |
|
SO; |
R' = Н, СНз, Br; Aik С, — С4, Alkoxyalk [СН2СН2ОСН3,
СН2СН2ОС2Н5, (СН2СН20)зСН3 и т. д.]; п = 1 - f-4.
Они лучше растворимы в органических растворителях, дают хорошие копировальные слои.
|
О
т — 2 - ь Ю. SO; |
К этим эфирам близко примыкают по структуре более сложные вещества, образованные в результате этерификации хлорангидри - дом 5-сульфокислоты 2-диазо-1-нафталинона (или сульфокислот других диазидов) динатриевых солей продуктов конденсации адипиновой (или другой дикарбоновой) кислоты с бисфенолом As
|
|
|
сн3 |
|
•OR |
|
СН3 |
|
т |
а также остатки других хинондиазидов; п = 2 — 8,
Эти полиэфиры создают как без всяких полимерных добавок, так и в смеси с НС хорошие гомогенные светочувствительные слои, образующие устойчивые печатающие элементы печатных форм [пат. Великобритании 1490284].
Недавно рекомендованы в композициях с крезольным новолаком эфиры 5-сульфокислоты 2-диазо-1-нафталинона и 2,2', 4,4'-тет - рагидроксидифенилсульфида, конденсата 2,3,4-тригидроксибензо - фенона с формальдегидом и др. [европ. пат. 0055814], ацилирован - ных полигидроксифенилметанов (пат. ФРГ 3043967; европ. пат.
0052788], ю, и/-ди(4-гидроксифенил)алканов (последние образуют слои, устойчивые к травлению щелочами) [пат. ФРГ 3124936; европ. пат. 0068346], ш,(о/-(гидроксиароил)алканов (европ. пат. 0056092), кетонов или сложных эфиров с длинными алифатическими радикалами (С10—C2s) — производных пирогаллола [европ. пат. 0051185]:
|
|
|
R' = Н, Aik С, — С4; R" = Aik С,0 — С или |
|
|
|
О |
|
S02 |
Alkoxyl Сю — C25j R'", R"" = Н, Hal, AlkC1 — C4; т = 2 4- 18; п = 6 - ь 18.
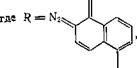
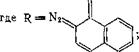
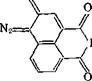
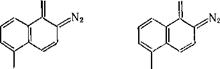
Эфиры 5- и 4-сульфокислот 2-диазо-1-нафталинона почти не поглощают свет с длиной волны более 450 нм. Для смещения адсорбции хинондиазида в области эмиссии лазеров, используемых для высокоразрешенной записи информации и голографии, в особенности ионного аргонового (эмиссия 488 нм) и гелиево-кадмиевого лазера (441,6 нм), синтезированы хинондиазиды — производные N-замещенных амидов 1,8-нафталиндикарбоновой кислоты. Они поглощают свет при 400—550 нм [пат. США 4207107]; для создания резистных слоев их совмещают с крезоло-формальдегид - ным новолаком:
|
|
|
О |
|
N—R |
где R = Aik, Alkoxyl, Аг (замещенный фенил, нафтил, антрил и др.), остатки полимеров.
С другой стороны, для повышения светочувствительности композиции в области среднего УФ-света (300—335 нм) используют эфиры 5-сульфокислоты 2-диазо-1-нафталинона и несимм-алицик- лических диолов, например 4,8-бис(гидроксиметил)трицикло[5,2, 1,02»6] декана, преимущество которых заключается и в более вы
сокой растворимости хинондиазида в НС и в поли-п-гидроксисти - роле [пат. США 4397937].
Слои низкомолекулярных светочувствительных соединений часто кристаллизуются; рельефы из эфиров сульфокислот о-наф - тохинондиазидов и гидроксикетонов ароматического ряда неустойчивы при травлении и поэтому мало пригодны для создания форм глубокой и высокой печати; в формах плоской печати они обладают ограниченной тиражеустойчивостью. Для устранения указанных недостатков составляют композицию из большего количества смолы (~ 85 %) и хинондиазида (~ 15%), поэтому диазид должен хорошо совмещаться со смолой и при комнатной температуре растворяться в органическом растворителе. В качестве полимерного компонента применяют полигидроксистирол, по - ЛИбромгидроксистирол [пат. ФРГ 267922], сополимер этилакрилата, стирола и метакриловой кислоты, взятых в мольном соотношении 10:5:2 [ пат. США 3637384]; для создания адгезионно активного и механически прочного печатного слоя рекомендуется сополимер метилметакрилата, стирола, метакриловой кислоты и 1,3-бутадиена, взятых в мольном соотношении 37,8:11,2:15,5:35,5 [пат. ФРГ 3107526]. Наконец, предлагаются смеси двух полимеров: 1) полимеризованных сложных эфиров винилбензилового спирта и полигидроксикарбоновых кислот и 2) акрилатных или стирольных полимеров; композиции на основе этих смесей отличает возможность широкого варьирования условий проявления [пат. ФРГ 3317919].
В подавляющем большинстве хинондиазидных фоторезистных композиций полимерным компонентом служат НС [41]. Они кислотостойки, растворяются в щелочах, гидрофобны. У новолаков, получаемых из смеси крезолов и используемых в композициях фоторезистов, Мп~ 500 - г - 900, Mw/Mn да 40 — 70, температура размягчения около 120°С, массовая доля групп ОН примерно 14 %. Полученные в результате экспонирования и проявления слоев композиций рельефы хорошо разрешены — до 1000 линий на 1 мм, поскольку малы размеры образующих рельефы молекул. Они надежно предохраняют от растравливания защищенные места подложки при травлении кислотами открытых мест. Рельеф воспринимает гидрофобную печатную краску, что позволяет служить ему в офсетных формах печатающим элементом. Все это наряду с хорошей светочувствительностью хинондиазидов и доступностью компонентов системы привело к широкому использованию хинондиазидных новолачных композиций в микроэлектронике и полиграфии.
В композиции полимерный и светочувствительный компоненты растворены в апротонном органическом растворителе (применяются практически все растворители, исключая предельные углеводороды и малолетучие вещества), обычно суммарная концентрация компонентов в растворе не превышает 10%. Композиции, по-видимому, отличаются от истинных растворов; в больших объемах они неоднородны, расслаиваются на различающиеся по свойствам области [41]. В слоях хинондиазид, вероятно, агрегирован} для них вопреки некоторым рекомендациям [42] не соблюдается закон Ламберта-Бугера-Бера в области поглощения хинондиазида и отмечается ряд других аномалий [42]. Слои на основе НС далеко не совершенны — они отличаются низкой абразивной стойкостью и обладают рядом других недостатков. Усилия исследователей направлены на устранение этих недостатков и улучшение других свойств композиций.
При обработке и хранении композиций резистов НС окисляются. Образующиеся гидропероксиды каталитически разлагаются следами ионов металлов, возникающие при этом радикалы сшивают близлежащие молекулы смолы. В таких участках ММ емолы выше исходной, смола хуже растворяется в щелочном проявителе. В результате рельеф содержит иепроявленные микрозоны, что приводит к браку в производстве интегральных микросхем, ухудшает качество записи аудио - и видеоинформации [пат. США 3842217]. Чтобы уменьшить число и размеры непроявленных микрозон в пат. США 4059449 рекомендуется вводить в слой до 7,5 % от массы НС дисульфидов (AlkOOCCH2CH2)2S, Aik (или Alkenyl) С12—С1в. Они известны как антиоксиданты, способные разлагать пероксиды. Для усиления их действия к 3,5 % дисульфида добавляют столько же ионола (ди-трет-бутилкрезола) или топанола СА [1,1,3-трис(2-метил-4-гидрокси-5-грег-бутилфенил) бутана]. Если в композицию вводить летучие алифатические карбоновые кислоты (уксусную, пропионовую и др.), то, судя по выделению азота, она лучше сохраняется; летучая кислота может быть удалена из слоя перед экспонированием [пат. Великобритании 1546633; пат. ФРГ 2623790].
Сроки хранения фоторезистных композиций часто невелики, вероятно, из-за осаждения кристаллов компонентов или их ассо - циатов; для предотвращения этого рекомендуется использовать смесь диазидов [а. с. СССР 948320]. Ниже приведен оптимальный состав фоторезистной композиции, % t
TOC o "1-5" h z Диэфир 5-еульфокислоты о-нафтохинонди - 10,2
азида и 2,4,4'-тригидроксибензофенона Эфир 5-сульфокислоты о-нафтохинондиаэи - 1,8
ца и гидроксибензальдегида
ЙС 18
Метиловый эфир метилцелдозольва 60
Метилцеллозольв ацетат 20
Она проявляет высокую контрастность, почти не дает проколов, хранится вдвое дольше, чем не содержащая эфира гидроксибензальдегида.
II. 1.1.3. Модификация полимерного компонента резистов
НС из смеси м - и п-крезолов (1:1) и формальдегида с ММ от 1200 до 1800 синтезирована специально фирмой Agfa (ФРГ) для композиций фоторезистов [пат. ФРГ 2616992]. Фирмой Bell
(США) [пат. США 4173470] НС с ММ от 2000 до 15 000 получена конденсацией формальдегида с крезолом и трет - бутил фенолом в присутствии щавелевой кислоты. Она лучше смешивается с неполярными компонентами. Фоторезисты на ее основе обладают повышенной светочувствительностью, легче удаляются с подложки ацетоном.
Предлагается модифицировать НС моноизоцианатами в присутствии дилаурата дибутилолова при кипячении в инертном растворителе [пат. Великобритании 1546971; пат. США 4189320; франц. пат. 2309896]. Использование такой смолы в позитивном резисте вместо немодифицированной уменьшает вымывание проявителем полимерного компонента из нефотолизованных участков слоя, улучшает адгезию к подложке, механические свойства слоя. В случае же необходимых термообработок готового рельефа существенно уменьшается число проколов и других дефектов. Этой же цели достигает использование галогенировэнной в фенольном ядре НС [а. с. СССР 213576; европ. пат. 0059250]; растворимость ингибируют не только нафтохинондиазидом, но и системой из аце - таля или производного ортокарбоновой кислоты и вещества, генерирующего кислоту при действии света [пат. ФРГ 3107109 (см. раздел II. 2. 1).
Чтобы достичь хорошей механической прочности слоя на основе
о-хинондиазидов, приходится увеличивать его толщину, что приводит к возрастанию абсолютного количества о-хинондиазида на подложке, а это понижает светочувствительность системы. Для уменьшения толщины слоев рекомендуется вводить в композиции различные упрочняющие полимеры, а также модифицировать их для придания слоям гибкости и эластичности.
Фирма ЗМ (США) вводит в композицию позитивного резиста с целью улучшения механических свойств слоя смесь НС и акри - латного полимера (например, сополимера 35 % стирола, 59 % этилакрилата и 6 % метакриловой кислоты), модифицированных полиизоцианатами в присутствии триэтилендиамина [пат. Великобритании 1474073]. С этой же целью составляют композицию фоторезиста из светочувствительного хинондиазида, НС, резола и добавок — эпоксифенольного лака и бутилированного стиромаля; после обычных операций и обработок получают высокотираже - устойчивую печатную форму [а. с. СССР 889486].
В резистный слой из нафтохинондиазида и НС дополнительно вводят примерно 0,04 от массы НС какой-либо полимер, например канифоль или ее производные [пат. ФРГ 2622799]. Канифоль придает печатной форме на анодированном алюминии стойкость к истиранию, улучшает и другие свойства резистных слоев [см. также пат. Великобритании 1586586; пат. США 4148664; пат. ФРГ 1622301].
Введение частично фторированного поверхностно-активного полимера в композицию делает гораздо более ровным слой резиста на подложке, улучшает его светочувствительность и повышает механические свойства резистного рельефа [пат. ФРГ 2914558].
Слои высокой прочности, дающие тцражеустойчивые печатные формы, отличающиеся хорошим разрешением и чистотой пробельных элементов, получены путем введения в композицию резиста продукта конденсации новолака и акрилонитрил-бутадиен-сти - рольного сополимера с ММ менее 160000 [франц. пат. 2382024; пат. США 4102686].
Для повышения устойчивости слоя резиста на германии или кремнии к жестким воздействиям таких травителей, как НЫ0ЗКонц, HF + СН3СООН, Н2О2, в композицию вводят наряду с идитолом и резолом примерно 0,3 % от их массы фторопласта - 32J1B [а. с. СССР 547712].
НС и дополнительно вводимые другие полимеры этерифици - руют сульфокислотами нафтохинондиазидов; молярное соотношение хинондиазид: полимер от 1 : 25 до 1 : 5. Эти эфиры давно патентуются в литературе в качестве основных компонентов фоторезистов, поскольку композиции из смесей хинондиазида и полимера теряют при щелочном проявлении часть полимера, кроме того при работе с ними необходимо строго соблюдать режимы проявления и состав проявителей. Однако этерифицированные смолы из-за уменьшения числа гидроксильных групп менее активны в щелочном проявлении, у них понижена адгезия к подложке (в частности, к алюминию), что уменьшает стойкость к любым обработкам, хотя и повышена гидрофобность, а следовательно, сродство к гидрофобным краскам. В поисках оптимальных вариантов таких эфиров полимеров патентуются разнообразные смолы и условия их этерификации. Так, чешские исследователи используют в композиции смесь кре- золо-формальдегидной смолы, этерифицированной фталевой, янтарной или другой кислотой, и НС, этерифицированной 5-сульфокислотой диазонафталинона; получают резист, пригодный для создания печатных форм [пат. ЧССР 180405]. Тот же светочувствительный компонент в смеси с неполным ацетатом целлюлозы и крезольным новолаком создает резистный слой, стойкий к различным травителям и в гальванических ваннах [пат. ЧССР 164710].
Авторы [пат. США 3635709] синтезировали НС конденсацией пирогаллола и ацетона и получали ее эфир с 5-сульфокислотой
1- диазо-2-нафталинона. Эфир оказался хорошей основой для фоторезистов и рекомендуется во многих последующих патентах. Как дальнейшее развитие этой работы можно рассматривать синтез этерифицированных 4- или 5-сульфо-2-диазо-1-нафталиноном или
4- сульфо-2-диазо-1-бензолоном смол из метил - или 2-этилрезор - цина, ацетальдегида или ацетона с ММ 800—4000 [пат. США 4306011], а также из резорцина или 5-метилрезорцина и бензаль - дегида, 4-метилбензальдегида, ацетофенона или бензофенона [пат. США 4306010]; последние смолы получали соконденсацией компонентов с крезолом и формальдегидом. Фоторезисты на такой основе, наряду с высокими показателями формного и печатного процессов, отличаются стойкостью к различным воздействиям, в частности, они теряют значительно меньше массы при обработке органическими растворителями, что обеспечивают высокую тира-
жеустойчивость, в 2 раза большую, чем у системы на основе кре - золо-формальдегидных смол [см. также европ. пнт. 0054258].
Конденсаты фенола, л-грег-бутилфенола и формальдегида (например, с молярным соотношением 2,3 : 2,4 : 3,3) этерифицируют на 20—60% 5-или 4-сульфокислотами либо 5-или 4-карбоновыми кислотами диазонафталинона. Эти смолы дают очень хорошую дифференциацию экспонированных и неэкспонированных участков по отношению к щелочному проявителю благодаря стойкости исходного слоя к действию оснований. Рельеф обладает стойкостью к действию кислотных травителей и отличается механической прочностью [пат. США 4308386].
С целью укрепления гидрофобного слоя полимера на анодированном алюминии составляют композицию фоторезиста из НС, 10% гидроксилов которой этерифицированы 5-сульфокислотой
2- диазо-1-нафталинона, и добавки нерастворимого в щелочи полимера: 10% от массы НС низкомолекулярного Г1ВА - или 16 % частично гидролизованного сополимера винилацетата с винилхлори - дом с ММ порядка 8000, либо 16 % последнего сополимера и сополимера винилхлорида, винилацетата и малеиновой кислоты [заявка Великобритании 2075700]. При больших количествах добавки после проявления на подложке остается вуаль.
Вместо НС рекомендуют этерифицировать сульфонафтохинон - диазидом полигидроксистирол (ММ « 5000) или полигидрокси - стирол, алкилированный фенилглицидиловым эфиром; продукт совмещают с НС и получают слой с улучшенной светочувствительностью, который хорошо проявляется [пат. США 4139384; пат. Великобритании 1494043]. Наряду с этим неполностью этерифицируют 5-сульфокислотой 2-диазо-1-нафталинона сополимеры алкилакрилата (75—87 %), гидроксиалкилакрилата, акрилоилгид - роксиалкилкарбоксилата. Эти эфиры совмещают с крезоло-фор - мальдегидной смолой, вводят также другие добавки [пат. ФРГ 2364178]. Резистные композиции получают и на основе полимери - затов п-и ж-гидроксиариламидов метакриловой кислоты; используют амиды различных аминофенолов и аминонафтолов. За счет части фенольных групп этих полимеров получают эфиры 4- или
5- сульфокислот 2-диазо-1-нафталинона [пат. ФРГ 2352139].
|
О О
ArOS02 ArNS02 |
|
I R |
В пат. США 3984250 рекомендуется вводить в композиции для получения позитивных копировальных слоев светочувствительные азидоариловые эфиры (I) или азидофениловые амиды (И) 5-суль - фокислоты 2-диазидо-1 - нафталинона:
I: Ar = 2-N3C6H4, 3-N3C6H4, 4-N3C6H4, 5-N3C10H6-a и др.
II: Ar = 4-N3C6H4, R = H, CH3; ArNR = 2-азидо-1-бензимидазолил
Образующийся при фотолизе иа воздухе нитрен «пришивает» остаток инденкарбоновой кислоты к специально вводимому в композицию гидрофобному и нерастворимому в основаниях полимеру— смеси эфира полиола и ненасыщенных кислот [канад. пат. 824096] и полимера с боковыми пептидными цепями [канад. пат. 837083]. Благодаря этому экспонированные участки полностью растворяются в основаниях, проявление не сопровождается потерей массы рельефа.
Не всегда укрепляющий слой добавочный полимер хорошо совмещается со светочувствительной композицией, поэтому в ряде работ его вводят в виде отдельной фазы (слоя). Например, на подложку анодированного алюминия наносят резист, затем на него найлон и сверху снова резист. Во время фотолиза засвечиваются оба слоя с хинондиазидом; при проявлении в этих местах вместе с новолаком удаляется и промежуточный найлоновый слой [пат. Великобритании 1478333]. Это усложнение технологии дает возможность при небольшой суммарной толщине слоя повысить светочувствительность при меньшем расходе хинондиазида, а также тиражеустойчивость печатной формы. Укрепляющий полимер можно наносить или на слой резиста, или под него, используя растворители, избирательно растворяющие только компоненты слоя, наносимого последующим [пат. США 4207106].
С целью повышения сродства укрепляющего слоя найлона к нижнему светочувствительному слою рекомендуется вводить в найлон силаны, например (RO)3SiX, где X = Aik С]—С9, ш-амино - алкил Ci—Cis, арил, винил, ш-алкоксисилапропил [пат. Великобритании 1488350]. Добавки кремнийорганических соединений увеличивают олеофильность рельефа. Верхний слой может состоять из частично алкилированного сополимера стирола и малеинового ангидрида (мол. соотношение 7:3) с ММ 100000, шеллака. Рекомендуются и трехслойные системы: хинондиазид — найлон — хинондиазид [пат. США 4217407; пат. Великобритании 1478334].
Для микроэлектроники запатентована двухслойная система, нижний слой которой состоит из смеси ПВС и меламиновой смолы, термоотверждаемой в присутствии катализатора, а верхний представляет собой позитивный резист; после литографии нижний слой травят до подложки (медн) 25 %-ной H2SO4. Это обеспечивает создание высокоразрешенного рельефа, стойкого к травлению [пат. Великобритании 1493834].

 Опубликовано в
Опубликовано в