ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
 20 марта, 2013
20 марта, 2013  admin
admin При макрофизическом подходе к явлениям природы мы встречаемся со специфическими свойствами теплоты. Повседневный опыт дает основание утверждать, что невозможно возвращение какой-либо термодинамической системы (или рабочего тела) в первоначальное состояние без каких-либо изменений в окружающей ее среде. Первый закон термодинамики, утверждая взаимопревращаемость теплоты и работы, не ставит каких-либо ограничений в осуществлении этого процесса. Между тем повседневный опыт учит нас, что если превращение работы в теплоту не связано с какими-либо ограничениями, то обратный процесс — превращение теплоты в работу — требует для своего осуществления определенных условий. Первому закону термодинамики не противоречит существование вечного двигателя второго рода, т. е. такой машины, в которой внутренняя энергия, переданная рабочему телу в форме теплоты, полностью превращалась бы в работу. Такой двигатель позволил бы практически неограниченное количество внутренней энергии окружающей нас атмосферы, водных бассейнов и земной коры превратить в работу. Однако создание такого двигателя невозможно не только практически, но и теоретически. Эти особенности теплоты, не противоречащие первому закону термодинамики, должны быть постулированы отдельно. Широкое обобщение особенностей теплоты как формы передачи внутренней энергии от одного объекта к другому, обнаруживаемых при макрофизическом подходе к явлениям природы, и составляет содержание второго закона термодинамики.
Необратимость процессов является одним из вопросов, рассматриваемых при анализе второго закона термодинамики. Результаты термодинамических расчетов, без учета необратимости реально протекающих процессов, не согласуются с опытом, и поэтому, чтобы полнее вскрыть содержание второго закона термодинамики, необходимо обсудить вопрос о необратимости термодинамических процессов.
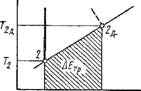
Необратимость термодинамических процессов. Рассмотрим термодинамическую систему, состоящую из рабочего тела и окружающей среды. Из определения обратимого процесса (см. с. 8) следует, что в обратимом процессе при возвращении рабочего тела в первоначальное состояние оно должно проходить через те же промежуточные термодинамические состояния, которые оно проходило в прямом процессе. Если, например, при расширении газа в цилиндре от состояния 1 до 2 (рис. 1.32) он проходил промежуточные термодинамические состояния е и /, то при сжатии от состояния 2 до 1 он должен проходить те же промежуточные состояния, но в обратной последовательности, т. е. / и <?. Это возможно только в том случае, если процессы 1-2 и 2-1 обратимые. Однако в природе обратимых процессов не существует и для того чтобы рабочее тело перешло из одного равновесного состояния в другое, необходимо нарушить это состояние; в этом случае в рабочем теле возникнут возмущения в виде градиентов Ар/р, Ар/р и А Т/Т, на компенсацию которых будет затрачена часть энергии. В результате осуществления такого реального процесса в прямом и обратном направлениях рабочее тело придет в первоначальное состояние, но в системе произойдут изменения: часть энергии будет безвозвратно потеряна на компенсацию,, указанных возмущений или, как говорят, на компенсацию потерь энергии на необратимость. В самом деле, в обратимом процессе расширения газа на участке 1-2 работа расширения /Сг. равна работе сжатия Цв на участке 2-1, т. е. /g6 = пл. Ief2341 = пл. 2fel432 — Lco5 и, следовательно, в системе никаких изменений не произошло. В необратимом же процессе работа расширения газа на участке 1-2 lfip — пл. Idc2341 Меньше /gб иа величину АР = PoG - /БР = пл.leficdl, которая является потерей энергии на необратимость. В последующем процессе возвращения газа в первоначальное состояние затрачиваемая работа сжатия 1спр = = пл. 2bal 432 больше 1соб на величину А/с = /?,р - = wi.2balef2. Таким образом, при возвращении рабочего тела в первоначальное состояние в системе произошло изменение: в ней обнаружились потери энергии на необратимость иа величину fHp = АР + А/с = пл./Ablcd 1. Другими
|
& 5 As Рис. 1.33. Графическое толкование необратимости процесса в координатах Т, S |
|
S |
Р
|
|
|
,2 |
3 If
Рис. 1.32. Графическое толкование необратимости процесса в координатах р, V
Словами, в ней бесполезно передана газу энергия 1нр = Qlw, вследствие чего его энтропия возросла на
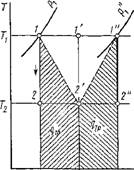
По этой же причине необратимый адиабатный процесс не может быть изоэнтропийным, что наглядно изображено на рис. 1.33. В конце необратимого адиабатного расширения от 7І до Т2 рабочее тело характеризуется состоянием 2', а не 2, так как в результате этого процесса вследствие потерь на необратимость возрастает энтропия. Если теперь осуществить необратимый процесс адиабатного сжатия до первоначальной температуры, то и в этом случае по той же причине рабочее тело будет характеризоваться не точкой Г, а точкой 1", при этом работоспособность рабочего тела уменьшится, поскольку при температуре Ті давление уже будет р'{ < рл. Таким образом, при протекании в термодинамической системе необратимого процесса неизменно возрастает энтропия и тем в большей степени, чем больше необратимость; следовательно, изменение энтропии является мерой необратимости тер - модинамических процессов.
Процесс теплообмена, т. е. передачи внутренней энергии в форме теплоты от тела с температурой Ті к телу с температурой Т2<Ти Также является процессом необратимым и протекает с возрастанием энтропии в системе. В самом деле, в этом процессе энтропия горячего тела уменьшается на величину Bq/Ti, а холодного, наоборот, увеличивается на величину 5Q/T2 и, следовательно, энтропия системы dsc = = dsi + ds, = -Bq/Tx + Bq/T2 = Bq{L/T2 - L/Ti) > 0, т. е. возрастает.
Все реальные процессы являются процессами необратимыми и все они протекают с потерей энергии на необратимость, т. е. с понижением работоспособности и возрастанием энтропии системы. Необратимость реальных процессов связана с потерей энергии на компенсацию градиентов параметров, характерных для данного процесса. Так необратимость гидродинамических процессов (движение вязкой жидкости и газа по каналам, смешение и перемешивание этих рабочих тел и т. д.) связана с потерей энергии на компенсацию градиента давления; необратимость массообменных процессов связана с потерей энергии на компенсацию градиента концентрации и т. д.
В термодинамике принято внутренней называть необратимость, обусловленную потерей энергии на компенсацию градиентов параметров в рабочем теле (Ар/р, А р/р, Д Т/Т), а также на трение потока о стенки канала. Все потери энергии на необратимость называют потерей на трение, выражают их в форме теплоты или работы и обозначают Qrp и /тр. Внешней называют необратимость, обусловленную конечной разностью температур в процессе теплообмена.
Из приведенного выше анализа следует, что любой реальный самопроизвольный процесс является необратимым. Этот логический вывод из анализа протекания реальных процессов является наиболее общей формулировкой второго закона термодинамики.
Действительный процесс истечения. Рассмотрим действительный процесс истечения, т. е. с учетом внутренней необратимости. Считаем по-
прежнему процесс истечения адиабатным, однако вследствие необратимости процесса энтропия потока увеличивается. В этом случае, как это показано на рис. 1.34, процесс истечения рабочего тела при изменении давления Or Pi до р2 изобразится условной кривоЙ 1-2д. ТАк как /і2Д > H2, То действительная Скорость иСтечения сд = ]/2(Hi — H2N) будет меньше теоретической с = ]/2 (Hi — H2) и поэтому можно написать, что
Сд = <рс, (1.179)
Где ф — так называемый скоростной коэффициент, значение которого меньше единицы. Экспериментально установлено, что для шлифованных и спрофилированных сопл ф = 0,95 ...0,98, а для цилиндрических совершенно необработанных насадок ~0,9.
Потеря энергии потока Д£ф на необратимость может быть выражена
Как
Д£тр = їЬІР£ї)1= СІЄ-ф2) (U80)
Величина (1 — ф2) называется коэффициентом потери энергии и обозначается греческой буквой С другой стороны,
|
СІ (1 - ф2) = H2Jl - H2, (1.182) |
- £Ц£к - IviF^R (1Ш)
Совмещая уравнения (1.180) и (1.181) между собой, получим 2
Откуда
H2д = H2 + (1 - Ф2) й- = H2 + (1.183)
Аналогично графику H, S на рис. 1.35 в координатах Т, S теоретический процесс адиабатного истечения изобразится прямой 1-2, а действительный — условной кривой 1 -2д. Из этого графика видно, что площадь под кривой процесса 1-2д представляет собой теплоту с/гр, усваиваемую рабочим телом, вследствие чего его температура в конце процесса истечения Т2я будет больше температуры в конце обратимого процесса истечения Т2. Площадь под отрезком изобары 2-2д изображает потерю кинетической энергии потока АЕтр из-за трения.
Найдем действительную температуру газа в конце адиабатного истечения Т2д. Так как /г2д - H2 = Qp - Cpm (Т2д — Т2), то, подставляя это выражение в уравнение (1.182), получим
(1-<р2) = срт(Т2л-Т2),
2
|
Л .2} |
Откуда
Ъ+ -^-(1 - ф2). (1.184)
|
T
|
|
H |
|
|
|
Рис. 1.34. Процессы обратимого и необратимого расширения пара в сопле в координатах Л, S |
|
І Ь
4 3 s Рис. 1.35. Процессы обратимого и необратимого расширения газа в сопле |
|
S |
В координатах Т, S
Величина игд найдется для газов, подчиняющихся уравнению Менделеева—Клапейрона, как ЯТщ/рг', для остальных газов и паров — по соответствующим таблицам для значений р2 и /ігд. Для водяных паров значение Via проще всего найти из /is-дйаграммы в точке р2, /ізД-
Действительный процесс в диффузоре. В необратимом процессе адиабатного сжатия рабочего тела в диффузоре от рХ до р2 процесс будет Происходить С ПОДВОДОМ К этому телу теплоты <2тр, вследствие чего энтропия его возрастает до значения S2Jx (рис. 1.36). В этом случае затрата работы в диффузоре на сжатие рабочего тела будет равна 'лиф = /дпф + <?тР + Ш1.122Ы. Дополнительная затрата работы, равная пл.122д1, как это видно из рис. 1.36 и 1.37, обусловлена тем, что вследствие Tin > 72 действительный удельный объем в конце сжатия 1>2д больше теоретического V2 и поэтому действительная кривая сжатия 1-2д в координатах р, V круче обратимой адиабаты 1-2. Таким образом, потеря энергии в диффузоре больше работы трения.
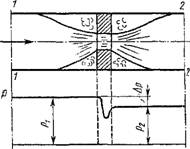
Дросселирование газов и паров. Если на пути потока имеется местное сопротивление в виде резкого сужения проходного сечения (рис. 1.38), то при прохождении этого сечения давление рабочего тела понижается на величину Ар = Pi — р2. Процесс, в котором рабочее тело в результате прохождения местного сопротивления понижает свое давление без совершения работы или отвода теплоты, называется дросселированием. Это типичный необратимый процесс, и, следовательно, всегда сопровождается возрастанием энтропии. Рассматривая процесс дросселирования без подвода теплоты извне в соответствии с рис. 1.38 и формулой (1.147), можно написать, что (с2 - Cj)/2 = Hx - H2. Обычно изменение скорости потока до и после местного сопротивления ничтожно мало, и им можно пренебречь. Очевидно, в этом случае H2 = Hx, т. е. в результате дросселирования энтальпия рабочего тела не изменяется.
Для идеального газа H2 — Hx = ср (Т2 - Тх) — 0, это означает, что для него Т2 = Тх, т. е. в результате дросселирования идеального газа его
температура не изменяется. У реальных газов и паров наблюдаются следующие три случая: dT= 0; dT< 0 и dT> 0. Так как при дросселировании во всех случаях dp < 0, то в общей зависимости
Dr=adp (1.185)
Значение dТ зависит от значения а — так называемого коэффициента адиабатного дросселирования, или дифференциального дроссель-эффекта. Явление изменения температуры при адиабатном дросселировании называют эффектом Джоуля — Томсона. Значение а найдем следующим образом. Подставляя в формулу (1.42) значение
|
С1 V дТ |
|
Dp, |
Б Q = cpdT-
Получим
|
Dp, |
|
(1.186) |
Dh = c„dT +
Рис. 1.36. Процессы обратимого и необратимого сжатия газа в диффузоре в координатах Т, S
|
H |
Рг |
|
|
І і |
||
|
T |
Я |
Pi |
|
1 |
||
|
В |
|
Г |
И |
||||
|
>1 |
|||||
|
( |
1 |
|
V2 % U Рис. 1.37. К анализу действительного процесса сжатия газа в диффузоре |
|
Srs2 |
|
Рис. 1.38. Изображение процесса дросселирования рабочего тела |
Которое для случая дросселирования, т. е. при Dh — 0, можно переписать в виде
DT= v Jp----------------- dp. (1.187)
CP
Сравнивая формулы (1.185) и (1.187) между собой, получим
А = ----------------------------- . (U88)
Из формул (1.187) и (1.188) следует, что при T(dv/dT)p > v dT < 0, т. е. при дросселировании рабочее тело охлаждается; это явление называют положительным эффектом Джоуля — Томсона; при T(dv/dT)p < v dТ> О, т. е. при дросселировании рабочее тело нагревается (отрицательный эффект Джоуля — Томсона); и наконец, при T(dv/dT)p = v dT — 0, т. е. в результате дросселирования рабочее тело не меняет своей температуры; эта температура называется температурой инверсии и обозначается Тинв. Следовательно,
Tum = v{dT/dv)p. (1.189)
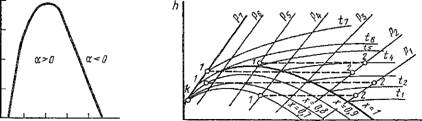
Геометрическое место точек температур инверсии на рТ-диаграмме дает инверсионную кривую. Так как точки кривой инверсии удовлетворяются уравнением (1.189), то, используя его и уравнение состояния данного рабочего тела, можно построить для него инверсионную кривую. В качестве примера на рис. 1.39 приведена инверсионная кривая для азота. Во всей области, заключенной внутри инверсионной кривой, а > 0 и, следовательно, в ней при дросселировании азот будет охлаждаться. Вне этой области а < 0 и поэтому здесь при дросселировании азот будет нагреваться. Таким образом, дросселирование газообразного азота при всех значениях начальной температуры Т< Tlim будет сопровождаться его охлаждением, а при Т> ТШІВ, наоборот, нагреванием. Поскольку для других рабочих тел кривые инверсии имеют аналогичный характер, можно утверждать, что для всех веществ, находящихся в газообразном состоянии, при Т< Тшв дросселирование сопровождается охлаждением, а при Т> Тпп„ — нагреванием вещества. Если для данного рабочего тела справедливо уравнение Ван дер Ваальса, то, как показывают соответствующие расчеты, в точке максимума инверсионной кривой итах = ук, Ртах = 9рк и Ттах = 37І-. Кривая инверсии при давлении р = 0 пересекается с осью температур в двух точках: слева — при Год = 0,75 Тк и справа — при Тол = 6,75 Тк. Значения Т0,2 для реальных газов хорошо согласуются с величиной 6,75 Тк при атмосферном давлении.
У водяного пара Тк = 647 К, и поэтому температура инверсии его должна быть равна примерно 4400 К. При этой температуре водяной пар полностью диссоциирован, и поэтому дросселирование водяного пара всегда сопровождается понижением его температуры. На рис. 1.40 представлены процессы дросселирования водяного пара различного состояния в координатах H, S. Эти процессы, как необратимые, проведены
P-10sПа
|
Т |
|
|
|
200 |
|
100 |
|
113 213 т 473 J73 Т, К |
|
Рис. 1.39. Кривая инверсии в координатах р, Т |
|
W |
|
0 |
Рис. 1.40. Графическое изображение процесса дросселирования водяного пара в координатах h, s
Условно пунктирными линиями. Из рисунка видно, что: 1) во всех случаях в результате дросселирования температура пара понижается; 2) влажные пары невысокого давления при дросселировании подсушиваются и становятся перегретыми; 3) перегретые пары высокого давления остаются перегретыми после дросселирования; 4) влажные пары высокого давления при дросселировании сначала увлажняются, а затем подсушиваются, становясь перегретыми; 5) перегретые пары высокого давления и невысокой температуры перегрева при дросселировании сначала превращаются в сухой насыщенный пар, далее увлажняются, затем подсушиваются и снова становятся перегретыми, но низкого давления и температуры.
Теория циклов. Исторически второй закон термодинамики возник как рабочая гипотеза тепловой машины, устанавливающая условия превращения теплоты в работу с точки зрения максимума этого превращения, т. е. получения максимального значения коэффициента полезного действия тепловой машины. Анализ второго закона термодинамики показывает, что малая величина этого коэффициента является следствием не технического несовершенства тепловых машин, а особенностью теплоты, которая ставит определенные ограничения в отношении величины его. Теоретически тепловые машины работают по круговым термодинамическим процессам, или циклам. Поэтому для того, чтобы шире раскрыть содержание второго закона термодинамики и провести детальный анализ его, необходимо исследовать эти круговые процессы.
Процесс, в котором рабочее тело, выйдя из некоторого начального состояния и претерпев ряд изменений, возвращается в то же состояние, называется круговым процессом или циклом.
Для осуществления цикла необходимо наличие трех элементов: нагревателя или геплоприемника со средней температурой Ті, холодильника со средней температурой Т2 <Т и рабочего тела, которое, последовательно вступая в теплообмен с нагревателем (или тепло - приемником) и холодильником, передает энергию от одного к другому. Как будет показано ниже, циклы бывают прямые и обратные, обратимые и необратимые.
Из определения цикла следует, что во всех без исключения циклах изменение в нем внутренней энергии, энтальпии и энтропии равно нулю. Отсюда следует, что первый закон термодинамики для циклов математически представляется в виде
«ц = /ц, (1.190)
Где Qn и U — алгебраическая сумма соответственно теплот и работ всех термодинамических процессов, из которых состоит цикл.
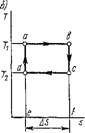
Прямой цикл есть цикл тепловой машины, в котором осуществляется превращение теплоты в работу. В координатах р, v этот процесс протекает в такой последовательности (рис. 1.41, а). На участке АБС рабочее тело, получая внутреннюю энергию в форме теплоты от нагревателя, совершает работу расширения H = Un.ABCEFA. После этого путем сжатия на участке CDA оно возвращается в первоначальное состояние, причем часть полученной от нагревателя внутренней энергии в форме теплоты рабочее тело передает холодильнику. Работа сжатия 12 = пЛ-CDAFEC и, следовательно, работа цикла = H — 12 = — Wi.ABCDA > 0, поскольку по абсолютной величине положительная работа расширения рабочего тела h больше отрицательной работы сжатия 12. В координатах Т, S этот процесс протекает следующим образом (рис. 1.41, б). На участке Abc к рабочему телу подводится теплота из нагревателя qi = пл.Abcefa. Однако только часть этой теплоты превращается в работу, так как невозможно возвращение рабочего тела в первоначальное состояние без отвода от него в холодильнике в процессе сжатия части теплоты Q2, равной пл. Cdafea. Таким образом, количество теплоты, превращенной в цикле в работу (или, иначе, теплота цикла), будет
Qll = qx — q2 — пл. abcda > 0,
Поскольку количество теплоты <ji, подведенной к рабочему телу, больше количества теплоты Q2, отведенной от него.
Таким образом, при анализе прямого цикла обнаруживается новое специфическое свойство теплоты: в круговом процессе теплота нагревателя не может быть полностью превращена в работу. Эта формулировка второго закона термодинамики принадлежит С. Карно.
В прямом цикле мы заинтересованы в том, чтобы максимум подведенной к рабочему телу теплоты превратить в работу. Поэтому эффективность прямого цикла оценивается отношением работы цикла /ц к количеству теплоты Qu подведенной к рабочему телу. Это отношение называют термическим коэффициентом полезного действия (к. п. д.) цикла и обозначают буквой г|,. Следовательно, термический к. п. д. прямого цикла
^-A.^-iL^-i-Ii.. (1.191)
4і Яі Яі Чх
Из рис. 1.41 и формулы (1.191) следует: невозможно создать тепловую машину, термический к. п. д. которой был бы равен единице. Этот вывод является другой формулировкой второго закона термодинамики, предложенной С. Карно.
|
|
|
|
|
А, |
Г8 |
|
|
1 -(-/X 'tf Ч 2 |
||
|
F |
£ |
|
А ( |
К |
G |
|
N |
||
|
В |
/ |
Рис. 1.4.1. Графическое изображение прямого цикла в координатах /?, V И Т, S
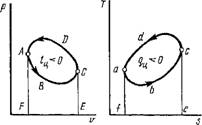
Рис. 1.42. Графическое изображение прямого цикла Карно в координатах р, V и Т, S
Идеальным циклом тепловой машины является прямой обратимый цикл Карно. Процесс в цикле Карно течет в такой последовательности (рис. 1.42). На участке Ab к рабочему телу подводится теплота Qx = ш. аЬ/еа = AsTi (рис, 1.42, б) из нагревателя при постоянной температуре Ті, вследствие чего газ совершает на этом участке работу изотермического расширения It = пл. Abfea (рис. 1.42, а). На участке Be происходит дальнейшее расширение газа, но уже адиабатно, за счет его внутренней энергии. В последующем сжатии газа на участке Cd рабочее тело входит в соприкосновение с холодильником, куда от него отводится при постоянной температуре Т2 теплота Q2 = Im.Cdefc = AsT2 (рис. 1.42, Б). На участке Da происходит дальнейшее адиабатное сжатие газа, в результате чего рабочее тело возвращается в первоначальное состояние. В соответствии с первым законом термодинамики работа цикла Карно:
'ц — h — h — Qi — ch — пл - abeda = (Tj — Т2) As.
Подставляя выражения работы цикла и теплоты Q2 в формулу (1.191), получим
IiL_ M- _ 7 - Т2 ^ _ Т^
|
Тх |
|
Tj As |
Т'
(1.193)
Ч
Из формулы (1.193) следует, что термический к. п. д. цикла Карно для газа не зависит от его природы и однозначно определяется температурами нагревателя и холодильника. Нетрудно показать, что термический к. п. д. цикла Карно для вещества в любом физическом состоянии не зависит от его природы и определяется формулой (1.193). На рис. 1.43 в координатах Т, S изображены циклы Карно для двухфазной системы «твердое тело + жидкость», влажного и перегретого паров. Из этого рисунка видно, что для каждого из этих трех циклов работа цикла определяется формулой (1.192) и, следовательно, термический к. п. д. - формулой (1.193).
|
(1.192) |
|
Лк = |
Необходимо иметь в виду, что выведенный нами термический к. п. д. цикла Карно относится к обратимому круговому процессу, состоящему из обратимых термодинамических процессов. Необратимость процесса связана с потерей работы, и поэтому термический к. п. д. необрати-
мого цикла Карно г)" всегда меньше обратимого т}", определяемого формулой (1.193). На рис. 1.44 условно изображен необратимый цикл ABCDA, в котором участки ВС и DA представляют соответственно необратимые адиабаты расширения и сжатия, протекающие с возрастанием энтропии. Рабочее тело получает от нагревателя теплоту qi = = пл.АВМКА и отдает холодильнику теплоту q'{ = пл.CDNHC. В обратимом цикле Карно Q° = пл.FEKMF < q" и поэтому
|
|
(1.194)
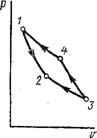
Докажем далее, что в заданном интервале температур 7 и Т2 обратимый цикл Карно обладает максимальным термическим к. п. д. по сравнению с любым произвольно взятым циклом. Для этого в заданном интервале температур 7 и Т2 рассмотрим два цикла (рис. 1.45): произвольный цикл ABCDA и цикл Карно Abcda. Оба цикла - прямые и обратимые. Проведя ряд адиабат, расположенных друг от друга на бесконечно малых расстояниях, разобьем цикл ABCDA на бесконечно болышое число элементарных циклов, состоящих каждый из двух адиабат и двух элементарных отрезков контура цикла ABCDA. Пренебрегая бесконечно малыми величинами высшего порядка, эти отрезки можно считать изотермами, и тогда эти элементарные циклы будут циклами Карно. Совокупное действие этих циклов одинаково с циклом ABCDA. Для всех элементарных циклов Карно Tu < Ті, а Т2І > Т2, и, следовательно, к. п. д. каждого элементарного цикла т^ = 1 — (Т^/Тн) будет меньше к. п. д. цикла Карно Abcda, равного г]к = 1 - (Тг/Тх). К. п. д. произвольного цикла ABCDA равен среднему значению элементарных циклов Карно, к. п. д. которых каждого меньше к. п. д. цикла Карно Abcda. Следовательно, цикл Карно будет иметь больший к. п. д., нежели к. п. д. произвольного цикла ABCDA.
|
Рис. 1.44. Условное графическое изображение прямого необратимого цикла Карно в координатах Т, S |
|
Рис. 1.43. Графическое изображение цикла Карно рабочего тела различных физических состояний в координатах Т, S |
В заключение отметим три признака прямых циклов: 1) направление термодинамических процессов, из которых состоит цикл, в координатах р, v И Т, s — по часовой стрелке; 2) линия расширения в координатах
|
Рис. 1.46. Графическое изображение обратного цикла в координатах р, V И Т. S |
Р, V и линия процесса подвода теплоты в координатах Т, S должны быть выше линии сжатия и линии отвода теплоты в соответствующих координатах; 3) алгебраическая сумма работ и теплот цикла больше нуля.
Обратный цикл есть круговой процесс холодильной машины и теплового насоса, в котором затрачивается работа извне для того, чтобы теплоту Q2 передать из холодильника в теплоприемник. Процесс осуществляется в такой последовательности. При расширении рабочего тела по линии ABC (рис. 1.46) к нему подводится количество теплоты Q2 от холодильника со средней температурой Т2. При последующем сжатии рабочего тела по линии CD А от него отводится в теплоприемник со средней температурой Тх > Т2 количество теплоты Qx, большее Q2. Таким образом, в обратном цикле теплота цикла Qlx = Qx — Q2 < О и работа цикла /ц = 1Х — 12 <0. Другими словами, в обратном цикле линия расширения ABC в координатах р, V и линия процесса подвода теплоты Abc в координатах Т, s лежат ниже линии CD А сжатия и Cda отвода теплоты. Другими признаками обратного цикла являются: 1) направление процессов в цикле против часовой стрелки; 2) алгебраическая сумма работ и теплот цикла должна быть меньше нуля.
В обратном цикле, так же как и в прямом, Аи = 0 и, следовательно, для него первый закон термодинамики напишется так: — <?і = —/ц, где Q2, Qx и /„ — абсолютные величины. Отсюда следует, что
Qx=q2 + hb (1-195)
Т. е. отводимая рабочим телом в теплоприемник теплота равна сумме теплоты, полученной им из холодильника, и теплоты, эквивалентной работе, затраченной на осуществление цикла.
|
Рис. 1.45. К доказательству теоремы Карно |
В машинах, работающих по обратному циклу, мы заинтересованы в минимальной затрате работы извне для передачи теплоты от менее нагретого тела к более нагретому. Поэтому эффективность обратного цикла оценивается отношением Q2 к /ц. Это отношение называют холодильным коэффициентом и обозначают буквой є:
|
Чг In |
|
Чг <?I - Чг |
|
(1.196) |
Итак, осуществление обратного цикла без затраты работы извне невозможно. Эта особенность теплоты является одной из формулировок второго закона термодинамики, которая гласит: теплота не может переходить от холодного тела к более нагретому сама собой даровым процессом (без компенсации). Эта формулировка принадлежит Ю. Клау - зиусу (1850). Одновременно с ним У. Томсон дал иную формулировку второго закона, идентичную по содержанию, но отличную по форме: теплота наиболее холодного тела в данной системе не может служить источником работы.
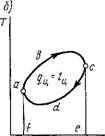
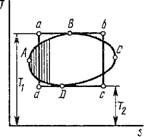
Идеальным циклом холодильной машины и теплового насоса является обратный обратимый цикл Карно, изображенный на рис. 1.47. Рабочее тело, которое в холодильной технике называется хладагентом, от начального состояния 1 расширяется адиабатно на участке 1-2, причем температура его падает от Г до Тх. Далее, по изотерме 2-3 оно расширяется, получая из холодильника с постоянной температурой Тх количество теплоты Q2. Затем на участке 3-4 происходит адиабатное сжатие хладагента, при котором температура его повышается от Тх до первоначальной температуры Т. На участке 4-1 происходит дальнейшее сжатие хладагента, но уже при постоянной температуре Т, вследствие чего он отдает тепло - приемнику с постоянной температурой Т количество теплоты Qx. В результате осуществления цикла на него была затрачена работа извне 1п = пл.12341, при этом от холодильника с температурой Тх получена теплота Q2, а теплоприемнику с температурой Т передана теплота Q{. Для цикла Карно холодильный коэффициент определится следующим образом (рис. 1.47):
_ Д2 _ Пл.23562__________________ AsTx __ Тх
S ~ Ш ~ Чг ~ Ші.41654 - пл.23562 ~ AST- AsTx ~ Т^7У
(1.197)
Аналитическое выражение второго закона термодинамики. Дадим аналитическое выражение второго закона термодинамики для обратимых и необратимых процессов.
Для обратимого цикла Карно можно написать, что - qK = 1 — Q2/Qi — = 1 - T2/Ti, откуда Q2/Qt = T2/Ti или Q2/T2 = QJT. Так как Q2 есть отводимое количество теплоты и, следовательно, его алгебраическое значение по смыслу отрицательно, то вместо Q2/T2 напишем { — Q2/T2). Тогда
I(g/T) = 0, (1.198)
|
|
|
Рис. 1.47. Графическое изображение обратного обратимого цикла Карно в координатах р, V и Т, S |
Т. е. для обратимого цикла Карно алгебраическая сумма частных,
Полученных делением количества теплоты на абсолютную температуру, при которой эта теплота подводится или отводится, равна нулю.
Покажем, что это утверждение справедливо для любого обратимого кругового процесса. Как было показано выше, любой произвольно взятый цикл можно представить как сумму бесконечно большого числа элементарных циклов Карно. Для каждого такого цикла J^(Bq/T) — О и, следовательно, для всего цикла ABCD А (см. рис. 1.45):
Ф (1.199)
J abcdЛ 1
Где §Abcda — интеграл, взятый по замкнутому контуру ABCD А.
Уравнение (1.199) называется интегралом Клаузиуса. Следовательно, для любого обратимого цикла интеграл Клаузиуса равен нулю.
Введем для подынтегральной функции интеграла Клаузиуса следующее обозначение: Bq/T = ds. Тогда уравнение (1.199) можно написать так:
§abcda DS = 0.
Из математики известно, что если криволинейный интеграл равен нулю, то дифференциал подынтегральной функции есть полный дифференциал. Следовательно, ds есть полный интеграл некоторой функции S. С термодинамической точки зрения функция S, изменение которой не зависит от процесса, а только от начального и конечного состояний, есть параметр термодинамического состояния вещества и, как уже было показано выше, была названа Клаузиусом Энтропией.
Таким образом, для любого обратимого цикла можно написать, что
Іавспа = §авспа Ds = 0, (1.200)
Или
5 Q = Tds. (1.201)
Уравнения (1.200) и (1.201) представляют собой аналитическое выражение второго закона термодинамики для обратимых процессов.
Для необратимого цикла Карно т]" = 1 — Q2/Qi < г|® = 1 — Т2/Ти Откуда следует, что — Q2/Qx < — Т2/Ти или Qz/T2> Qi/Tlt или
Ai- JLL. < о, т. е. Tt Т2
Любой произвольно взятый необратимый процесс ABCDA можно представить как сумму бесконечно большого числа элементарных необратимых циклов Карно, для каждого из которых ^(бд/Г) < 0, и поэтому для необратимого цикла ABCDA
Цг< 0. (1.202)
|
65 |
Abcda 1
З А. В. Чечеткин, Н. А. Заиемонец
Но для рабочего тела, совершающего цикл, <j>/1BaM ds = О и, следовательно,
5 Q
<ф ds = 0. (1.203)
Abcda * jabcda
Отсюда можно написать, что 8Q/T < ds, или необратимость процесса связана с увеличением энтропии по сравнению с обратимым.
Отсюда следует, что
8Q < Т ds. (1.204)
Уравнения (1.203) и (1.204) представляют собой аналитическое выражение второго закона термодинамики для необратимых процессов.
Свойство изолированной термодинамической системы. Физический смысл энтропии. Толкование второго закона термодинамики. Рассмотрим изолированную термодинамическую систему, состоящую из источника теплоты с температурой Ти холодильника с температурой Т2 < Тх И рабочего тела, которое совершает обратимый цикл Карно между источником теплоты и холодильником. В этом случае максимальная работоспособность системы равна
Ьі = біЛк = Qi (1 — Тг/Ті).
Количество теплоты, которое будет передано в холодильник рабочим телом,
Qz = Qi - Li = бі - Qi [1 - т2/т^ = Q, (Т2/Тх).
Изменение энтропии рассматриваемой системы будет равно алгебраической сумме уменьшения энтропии источника теплоты ASi = —QxjTx и увеличения энтропии холодильника As2 = Q2/T2, т. е.
AS = AS1 + AS2= --Q+-+ -
12 Тх т2 Тг Тх Т2
Теперь представим, что Qt источника теплоты сначала передается промежуточному телу, имеющему температуру Т < Тх. Тогда энтропия источника теплоты уменьшится на величину As І = — Qx/Tx, а энтропия промежуточного тела увеличится на As2 = Qi/T. В этом случае энтропия рассматриваемой системы вследствие протекания в ней необратимого процесса теплообмена между источником теплоты и промежуточным телом возрастает на величину
AsIieo6p = As! + AS2 = — ~~ + (1.205)
После этого теплообмена источником теплоты в рассматриваемой системе будет промежуточное тело с температурой Т. Если теперь осуществить обратимый цикл Карно между этим телом и холодильником, то получим максимальную работоспособность системы
Тг
L2 = QX4K = Q1[ 1
Уменьшение работоспособности системы AL вследствие протекания в ней необратимого процесса теплообмена составит
AL= L, - L2. а, (і - _ е, (t _ = fil І-) г2.
(1.206)
Сопоставляя между собой выражения (1.205) и (1.206), можно написать:
AL = Т2 As,.собр. (1.207)
Это уравнение называется уравнением Ги — Стодолы. Таким образом, Уменьшение работоспособности изолированной термодинамической системы (вследствие протекания в ней необратимых процессов), т. е. деградация энергии в этой системе, пропорционально увеличению в ней энтропии. Другими словами, энтропия является мерой деградации энергии в изолированных термодинамических системах. Энергия системы, оставаясь неизменной количественно (в вышерассмотреииом случае Qt = Const), ухудшается качественно, переходя в теплоту низкого температурного потенциала.
Второй закон термодинамики по существу является статическим законом, характеризующим необратимость процессов, протекающих в конечных изолированных системах, и определяющим преобладающее направление макроскопических процессов, т. е. процессов, протекающих в системах с весьма большим числом молекул.
Этот закон неприменим к отдельным молекулам или к малому числу их. Нельзя сказать, что в этом случае он неверен, так какой вообще ничего не говорит по поводу поведения отдельной молекулы или малого числа их, ничего не утверждает по той причине, что к отдельной молекуле неприменимо понятие теплоты, ибо понятие это, равно как понятия температуры и энтропии, имеет смысл только по отношению к весьма большому количеству молекул. Это вытекает из феноменологического метода, который положен в основу термодинамики. Феноменологический метод заключается в том, что рабочее тело рассматривают не как дискретное физическое тело, состоящее из отдельных молекул, а как некоторый континуум, т. е. как сплошную среду, физические параметры которой непрерывны и изменяются на бесконечно малую величину при переходе от одной точки пространства к другой. Это дает возможность изучать совокупность действия молекул, проявляющуюся в том, что нами названо параметрами состояния рабочего тела. Так, совокупность импульсов всех молекул газа дает параметр давления; совокупность кинетических энергий молекул — внутреннюю энергию газа, совокупность объемов, занимаемых молекулами в их движении, — удельный объем газа. Статистический метод является лишь дополнением к феноменологическому методу и дает свои поправки в тех случаях, когда возможно судить о закономерности поведения отдельных молекул. Примером таких поправок является уравнение состояния реального газа.
|
67 |
Феноменологический метод применим только к системам, состоящим из большого числа молекул.
3*

 Опубликовано в
Опубликовано в