Возникновение двойного электрического слоя
 8 января, 2013
8 января, 2013  admin
admin Для возникновения двойного электрического слоя на границе раздела жидкость — твердое тело необходимо присутствие ионных пар на его поверхности [97]. В зависимости от химического состава взаимодействующих фаз ионные пары могут образовываться в трех случаях; во-первых, при адсорбции, если один компонент ионной пары из раствора обладает более прочной связью; во - вторых, в результате диссоциации поверхностных молекул твердого тела с образованием в растворе ионов определенного знака, и в-третьих, вследствие самопроизвольного распределения ионов, когда граница раздела химически не активна и не обнаруживает диссоциации. Ионные пары составляют диполи, ориентированные на поверхности определенным образом; число ионных групп, приходящихся на единицу поверхности, и составляют его заряд.
В общем случае двойной электрический слой образуется в результате перераспределения электрического заряда, обусловливающего переход заряженных частиц (ионов, электронов) из одной фазы в другую. Это приводит к возникновению заряда на поверхности одной фазы (твердого тела) и равного по величине, но противоположного по знаку, заряда в другой фазе (в воде- растворителе) . Так, например, если кристаллическое тело (какую-либо соль) поместить в воду, то поверхностные ионы (потенциалоопределяющие) кристаллической решетки окажутся гидратированными и перейдут в раствор (воду), и на поверхности кристалла останутся избыточные электроны. Благодаря силам электроста' тического притяжения в зоне, соприкасающейся с отрицательно заряженной поверхностью твердого тела, концентрируются компенсирующие положительные заряды— катионы из раствора. В результате возникает равновесный в целом электронейтральный двойной электрический слой.
Другими словами, механизм образования двойного электрического слоя на поверхности раздела твердое тело — жидкость обусловливается в основном существованием некомпенсированных систем на границе между двумя фазами, а именно: адсорбцией на поверхности ионов из раствора (диполей воды) при одновременном переходе противоионов в раствор, и наоборот.
В первом приближении предполагалось, что ионы внешней части слоя прочно и жестко связаны с твердым телом и не принимают участия в диффузионных процессах. Такая интерпретация так называемого плотного (жесткого) двойного электрического слоя принадлежит Гельмгольцу. Отсюда и название гельмгольцевский слой. Изменение электрического потенциала в плоском плотном слое между твердой фазой и жидкостью от некоторого его значения до нуля носит линейный характер.
Теория двойного электрического слоя в виде плоского конденсатора с наружной обкладкой из ионов, расположенных в одной плоскости, с неизменным расстоянием, между обкладками получила дальнейшее свое развитие в работах Гуи и Чэмпмена.
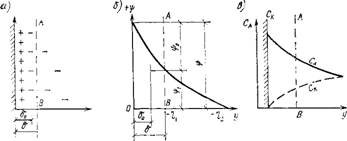
Согласно их представлениям о диффузном двойном слое, распределение ионов в растворе около поверхности твердой фазы происходит под влиянием молекулярного теплового( броуновского) движения ионов и электростатических сил, возникающих на поверхности твердой фазы. В результате этого она как бы притягивает противоположно заряженные и отталкивает одноименно заряженные ионы. Избыток противоположно заряженных ионов (находящихся непосредственно на поверхности) по мере увеличения расстояния от границы раздела в глубь раствора уменьшается по закону, открытому Гуи:
|
|
|
^сДе 2RT - е 2RT J. (1.1) |
I FB %.u VVn
Где R — газовая постоянная; Т — абсолютная температура; Ск — концентрация ионов в молях на 1 см3; F0— заряд 1 г эквивалента; *фоп—полная разность потенциалов между твердым телом и раствором.
Из формулы (1.1) следует, что расстояние, на котором еще сказывается влияние поверхности, тем меньше, чем больше концентрация раствора. По данным Гуи, среднее расстояние б между центрами тяжести зарядов в диффузном слое для водных растворов электролитов с одновалентными ионами составляет: для 0,1 н. раствора— 0,00096 мкм; для 0,001 н. раствора — 0,0096 мкм и для чистой воды — 0,01 мкм. Следовательно, в слабо ионизированных жидкостях, заряд распространяется на довольно-таки значительный слой.
При помощи теории Больцмана Гуи и Чэмпмен определили концентрацию положительных и отрицательных ионов в каждой точке потенциала. Исходя из этого Гуи получил зависимость, по которой можно вычислить толщину двойного электрического слоя:
|
Где Fa — число Фарадея; га и ZK — валентности анионов и катионов. |
|
(1.2) |
Согласно формуле (1.2), толщина двойного слоя обратно пропорциональна концентрации ионного раствора; с ее уменьшением число б возрастает.
Теоретические представления Руи и Чэмпмена справедливы при диффузном строении двойного электричес-
|
Рис. 1.8. Строение штерновского двойного электрического слоя А — распределение зарядов (пунктирная линия АВ условная граница раздела между обеими частями двойного слоя); б— изменение потенциала; в — выравнивание эквивалентных концентраций катионов С^ и анионов Сд с увеличением расстояния от поверхности твердой фазы |
|
-у |
Кого слоя для сильно разбавленных растворов и неприемлемы при высоких значениях потенциала и больших концентрациях растворов электролитов. Главный недостаток этой теории состоит в том, что ионы рассматриваются как точечные заряды без учета их объемов и адсорбционных свойств. При этом теория Гуи и Чэмпмена не может быть использована для объяснения различия между термодинамическим ет. д и электрокинетическим ^-потенциалами.
Для устранения указанных недостатков Штерн выдвинул теорию, являющуюся как бы синтезом представления Гельмгольца и Гуи. Согласно общей теории двойного электролитического слоя, ионы имеют вполне определенные конечные размеры, и центры их не могут подойти к поверхности ближе, чем на расстояние ионного радиуса. Часть ионов удерживается поверхностью на указанном расстоянии, образуя гельмгольцевский плоский конденсатор, а остальные ионы составляют диффузную часть двойного слоя, в которой они распределяются согласно законам, открытым Гуи.
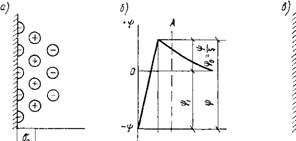
По теории Штерна, внутренняя часть двойного слоя состоит из двух рядов близко расположенных один к другому ионов. Первый из них (рис. 1.8,а) прочно связан с поверхностью твердого тела и определяет его заряд (потенциалоопределяющие ионы). Второй ряд противоположно заряженных ионов плотно прилегает к первому, испытывая действия электростатических сил при-
а — распределение зарядов в двойном электрическом слое; б — изменение потенциала о|э; в— внедрение полярных молекул воды в двойной слой между твердой фазой и ионами жидкой обкладки
Тяжения и избирательной адсорбции со стороны поверхности твердой фазы. Эта внутренняя часть общего двойного слоя (штерновского адсорбционного слоя) во всех отношениях, за исключением того, что он не является в целом электронейтральным (количество ионов второго ряда не совпадает с числом ионов первого ряда "из-за специфичности адсорбции анионов и катионов), сходна с гельмгольцевским слоем. Недостающее количество зарядов для компенсации потенциалоопределя - ющих ионов располагается по внешней (диффузной) части всего двойного слоя, которая, в соответствии с теорией Гуи, связана в большей степени с жидкой фазой. Условная граница раздела между обеими частями двойного слоя показана на рис. 1.8,а пунктирной линией АВ.
|
|
|
4 в |
|
-О0 |
|
-О0 |
|
О0. (£3 © |
|
Рис. 1.9. Схема процесса зарождения полимерных молекул воды |
|
-(£30 |
|
-еэ © |
Из теории двойного слоя следует, что движение (скольжение) жидкости происходит не по твердой поверхности, а за пределами неподвижного адсорбционного слоя в плоскости АВ. Это участие ионов в движении жидкости сопровождается уменьшением потенциала в зоне диффузного слоя. Разность потенциалов между диффузным и адсорбционным слоями двойного слоя называется электрокинетическим потенциалом, или дзета-потенциалом В разбавленных растворах g-потенциал близок к значению потенциала диффузного слоя, поскольку граница скольжения жидкости в этом случае совпадает с границей раздела АВ между внут
ренней и внешней частью двойного слоя. В концентрированных растворах, когда потенциалы резко изменяются с расстоянием, указанное равновесие не соблюдается.
Жидкую обкладку двойного слоя могут составлять ионы различного типа, т. е. на твердой поверхности могут адсорбироваться не только потенциалоопределяю - щие ионы, но и присутствующие в растворе различные ионы, в том числе—полярные молекулы растворителя (например, воды). Этот случай соответствует зарождению модифицированной структуры молекул воды непосредственно у поверхности минеральной частицы. Диполи молекул воды могут внедряться между твердой фазой и ионами жидкой обкладки двойного слоя; под влиянием электростатических и адсорбционных сил притяжения возможно ориентационное упорядочение структуры воды в виде пакетов из ассоциации ее возбужденных молекул линейной формы (рис. 1.9,в).
Водородные ионы, ионы высшей валентности, как, например, А1+++, Fe+++, Са++ и многие другие, не только способны весьма сильно понизить величину g-потен - циала, но и вызвать уже при незначительной концентрации ионов перемену его знака. Объясняется это тем, что отдельные ионы обладают по отношению к поверхности твердой фазы не только электрическим, но и адсорбционным потенциалом, выражающимся работой, затрачиваемой на перевод одного моля катионов или анионов из глубины раствора в мономолекулярный слой на границе раздела двух фаз.
Благодаря высокой активности многовалентные ионы проявляют сильную адсорбционную способность по отношению к твердой фазе, легче, чем другие ионы, проникают в состав штерновского слоя и замещают там потенциалоопределяющие ионы, придавая поверхности твердой фазы другой заряд.
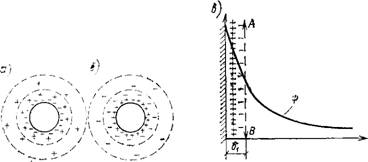
Двойной электрический слой образуется в тонких капиллярах, на поверхности коллоидных и высокодисперсных частиц, за счет адсорбции на твердой поверхности ионов из окружающего раствора. Поэтому частица, взаимодействующая с раствором, представляет собой сложное новообразование, в котором высокодисперсная твердая фаза (ядро) связана с окружающей средой (раствором) через стабилизирующий двойной электрический слой ионов, а в отдельных случаях через
|
Рис. 1.10. Строение мицеллы А — с отрицательно заряженной частицей; б — с положительно заряженной частицей; в — распределение зарядов и потенциала в мицелле |
«прочную» сольватную оболочку из молекул растворителя. Такой структурно-неоднородный комплекс разнородных веществ называется мицеллой (макромолекулой); она способна к самостоятельному существованию в виде обособленного целого и определяет все основные свойства коллоидной и дисперсионной систем. В состав мицеллы входят: ядро—кристаллической структуры или аморфного строения, двойной электрический слой из сольватированных ионов и диффузная часть двойного слоя из противоионов, толщина которого в зависимости от концентрации электролитов может изменяться в широких пределах (рис. 1.10).
На границе адсорбционной и диффузной частей двойного электрического слоя (правее линии АВ на рис. 1.10, в) при движении жидкости относительно поверхности ядра обнаруживается g-потенциал. Он играет важную роль при формировании коагуляционной структуры цементного геля, определяет сущность электрокинетических явлений (связанных с поверхностной проводимостью цементных частиц) и физико-химических процессов, обусловливающих возникновение крис- таллогидратной структуры цементного камня [11].

 Опубликовано в
Опубликовано в