Структура и силы связи в кристаллах
 6 декабря, 2012
6 декабря, 2012  admin
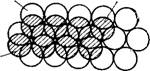
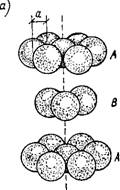
admin У многих материалов кристаллические структуры сравнительно просты и некоторые из них могут быть построены в виде стопки из двухмерных плотно упакованных гексагональных систем [82, 131]. Они могут быть образованы при складывании в простой последовательности плотноупакованных плоскостей, попарно соприкасающихся одна с другой таким образом, чтобы каждый атом одной плоскости помещался в углублении между тремя атомами соседней плоскости. Геометрия двух таких плоскостей показана на рис. 1.1, а. Здесь светлые кружки изображают атомы в одной плотноупакованной плоскости А прилегающая к ней плоскость В помечена заштрихованными кружками.
Плоскость В можно расположить либо как это показано на рисунке или же так, чтобы атомы помещались в углублениях С. При любом способе укладки каждый атом второй плоскости соприкасается с тремя атомами первой плоскости, и наоборот. Относительное расположение атомов в кристалле с гексагонально плотной упаковкой их показано на рис. 1.1,3 (схема выполнена таким образом, чтобы передние атомы не закрывали расположенные позади них). Атомы в такой структуре расположены наиболее компактно в пространстве, при этом каждый из них окружен 12-ю ближайшими соседними атомами: 6 — находятся в той же плоскости и по 3 атома— в верхней и нижней плоскостях (рис. 1,2,а). Расстояние а между центрами соседних атомов определяет атомный диаметр.
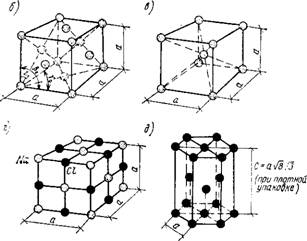
Подобная кристаллическая структура получается, если первые две плотноупакованные плоскости располагаются в последовательности АВ, третья смещена по отношению к двум другим А и В в положение С, а четвертая плоскость занимает положение А. В элементарной ячейке этой кристаллической-структуры атомы занимают все вершины куба и центр каждой грани (рис. 1.1, б), поэтому такое расположение называется гранецентрирован - ной кубической структурой; она также является плотно - упакованной, поскольку каждый атом имеет 12 ближайших соседей, соприкасающихся один с другим вдоль диагоналей граней (рис. 1.2,6).
Методы укладки, приводящие к образованию гексагональных плотноупакованных и гранецентрированных кубических структур исчерпывают все простейшие способы построения структур кристаллов. Если бы межатомные силы действовали только между ближайшими соседями, то рассмотренные две конфигурации кристаллических решеток были равнозначны. Однако взаимодействие соседей, следующих за ближайшими, отличает
|
|
|
Рис. 1.1. Наиболее часто встречающиеся элементарные ячейки кристаллов |
А — укладка плотноупакованных плоскостей для получения кристаллической структуры типа гексогональной плотноупакованной; б —гранецентрированная кубическая; в — объемно-центрированная кубическая; г — решетка NaCl; Д — Гексагональная плотноупакованная
Гранецентрированную кубическую от гексагональной плотно - упакованной структуры. В связи с этим первая имеет четыре семейства плотноупакованных плоскостей, а вторая — только одно семейство, что обусловливает дополнительную возможность для проявления пластической деформации.
В природе встречается немало элементов, структуры которых не образуются из плотноупакованных плоскостей. К числу таких относится объемно-центрированная кубическая структура, в которой элементарная ячейка имеет вид куба с атомами в каждой вершине и центре куба. Такая структура не имеет плотной упаковки, так как каждый атом окружен только семью соседями, и соприкасаются они вдоль диагоналей куба (рис. 1.1,б). Обычно ряд элементов и все химические соединения, в том числе и клинкерные минералы, имеют структуры, отличающиеся от приведенных, и некоторые из них представляют собой комбинации или составные части одной из основных кубических структур. В таких комбинированных структурах одна решетка помещается внутри другой. Примером комбинированной структуры может служить структура кристалла каменной соли NaCl, по типу которой кристаллизуются СаО и MgO (рис. 1.1,г).
В обоих случаях элементарная ячейка состоит из двух гранецентрированных кубических подрешеток со
|
|
|
Рис. 1.2. Расположение плоскостей из плотноупакованных шаров |
|
А — при укладке атомов непосредственно друг над другом; б —когда соблюдается последовательность АВСАВСА (гранецентриро - ванная кубическая структура) |
Стороной 4,797 А для СаО и 4,203 А для MgO. Каждый атом Са и Mg окружен шестью атомами кислорода, сгруппированными в правильный октаэдр. Атомы кислорода (белые кружки) соприкасаются, а атомы магния располагаются в промежутках между ними. Ионный радиус атома кальция значительно больше, чем радиус ю
атома магния, и в решетке СаО атомы кислорода отодвинуты один от другого, поэтому структура СаО значительно менее устойчива, чем структура MgO, что в свою очередь объясняет различную скорость гидратации обоих окислов в сильно обожженном состоянии. Классификация кристаллов по виду структур дает представление об их геометрическом строении, при этом не затрагивается вопрос о природе сил, удерживающих атомы (ионы или молекулы) в элементарных ячейках кристаллической решетки.
Если в углах кристаллической решетки ионы расположены так, что силы кулоновского притяжения одного знака больше, чем силы отталкивания, кристаллы называются ионными. Такая связь (ее еще называют полярной, электровалентной, гетерополярной) обусловлена в основном электростатическим взаимодействием противоположно заряженных ионов. Большинство диэлектриков относится к классу ионных кристаллов; это главным образом неорганические соединения, поэтому для них характерна вполне определенная химическая формула. Любой ионный кристалл по своей структуре представляет собой систему с правильно чередующимся расположением положительных и отрицательных ионов, между которыми действуют силы притяжения и отталкивания. Равновесие этих сил определяет фактически существующие в кристалле межионные расстояния. Силы притяжения между ионами — это кулоновские силы, а силы, не позволяющие кристаллу превратиться в комок из слипшихся ионов, — это силы отталкивания, действующие между электронными оболочками.
Типичными ионными кристаллами являются NaCl, СаО и MgO. Атомы Na, Са и Mg несут положительный, а атомы С1 и кислорода — отрицательный заряды. Каждый ион натрия окружен шестью ионами хлора, а каждый ион хлора окружают шесть ионов натрия. В свою очередь ионы кальция и магния окружены шестью ионами кислорода, а каждый ион кислорода окружен в соответствующих соединениях шестью ионами кальция и магния. Следовательно, каждый из этих элементов оттолкнул своих соседей и притянул к себе ионы другого элемента, т. е. проявилось действие известного закона: разноименные электрические заряды притягиваются, а одноименные — отталкиваются. Следовательно, кристаллы NaCl, СаО, MgO «держатся» электрическими силами притяжения между положительно и отрицательно заряженными ионами.
Кристаллы многих веществ, особенно тех, которые называются «солями», скрепляются такими же ионными связями, как поваренная соль и соединения СаО и MgO, поэтому все они относятся к ионным кристаллам. Ионные связи обнаруживают лишь в кристаллах, содержащих атомы по крайней мере двух различных элементов, которые способны образовать противоположно заряженные ионы. Количество ионов противоположного знака, составляющих ближайшее окружение данного иона в кристалле, определяет координационное число, значение которого вычисляется по отношению радиусов ионов противоположного знака. Чем ближе это отношение к единице, тем больше координационное число Ко [38].
О о
Например, для NaCl: rNa+=0,98 А г =1,81 А ,
RNa+
------ =0,54 и
ГС1~
В таком кристалле не представляется вероятным выделить какую-либо пару ионов (молекулу), более тесно взаимосвязанных, чем с другими соседями, поэтому в кристаллах такого типа (например, NaCl) не существует изолированной пары ионов, которую можно отождествить с молекулой данного соединения (молекулой NaCl). Следовательно, весь монокристалл ионного соединения можно рассматривать как гигантскую молекулу, в которой каждый ион испытывает значительное воздействие со стороны всех остальных ионов. При растворении в воде такой кристалл диссоциирует на ионы, а при испарении воды — на молекулы.
При низких температурах ионные кристаллы характеризуются малой электропроводностью, а при высоких температурах — хорошей ионной проводимостью и сильным инфракрасным поглощением. Чем больше валентность (способность атома соединяться с точно определенным числом атомов других элементов) и меньше сумма радиусов ионов, тем значительнее в ионных кристаллах одинаковой структуры силы взаимодействия между противоположно заряженными ионами. В прямой связи с этим находятся твердость, температура плавления и растворимость кристалла.
При возникновении ионных связей образуются двухполюсные молекулы, так называемые диполи. Этот вид связи характерен для соединений металлов с неметаллами, металлов с ОН или с кислотными остатками, в которых атомы металлов становятся положительно заряженными катионами.
В атомных кристаллах атомы в углах кристаллической решетки взаимодействуют со своими ближайшими соседями посредством ковалентной (гомеополярной) химической связи, которая возникает между одинаковыми атомами при образовании общей пары валентных электронов по одному от каждого атома (например, в молекулах Н2, N2, 02 и т. п.).
В основе ковалентной связи лежит обменное взаимодействие, возникающее, например, между протонами или между нейтронами при сближении их до расстояния, когда в атомном ядре может происходить существенное перекрытие волновых функций этих элементарных частиц. Ковалентная связь может быть не только между одинаковыми атомами, но и между атомами различных элементов. Как правило, атомы элементов I и VII группы периодической системы Д. И. Менделеева имеют тенденцию к ионной связи, а атомы из средних групп (С, Si, Ge) проявляют большую склонность к ковалентной связи.
При разрушении ковалентной связи (плавление или растворение атомного кристалла) никогда не возникают ионы; в расплаве или растворе обнаруживаются электрически нейтральные атомы или молекулы. В этом заключается коренное отличие ионного кристалла от атомного. Ковалентная (химическая) связь очень прочна, поэтому атомные кристаллы характеризуются большой твердостью, высокой температурой плавления и малой летучестью (например, графит, алмаз и т. п.).
Молекулярные кристаллы представляют собой достаточно сложную систему из взаимодействующих, плотно - упакованных, устойчивых молекул, расположенных в узлах кристаллической решетки. В таких кристаллах молекулы сохраняют свою индивидуальность в газообразной, жидкой и твердой фазах (Н2, N2, С12, Вг2, СаО, Н20 и т. п.) и удерживаются в узлах решетки сравнительно слабыми ван-дер-ваальсовыми силами, возникающими при взаимодействии между молекулярными диполями (см. поляризационные силы). Различают три вида взаи-
Модействия молекул, связанных с силами Ван-дер-Ваальса.
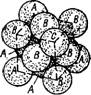
А. Молекулы данного вещества являются электрическими жесткими диполями, когда силы электростатического взаимодействия между диполями стремятся расположить молекулу так, чтобы достигалась минимальная потенциальная энергия системы (рис. 1.3, а). Этому случаю соответствует ориентационный тип взаимодействия полярных молекул. При тепловом движении молекул нарушается их упорядоченное взаиморасположение, а поэтому энергия ориентационного взаимодействия снижается с повышением температуры.
Б. При высокой поляризации неполярных молекул у них может возникать индуцированный электрический момент под влиянием внешнего электрического поля. В связи с этим при сближений такие диполи взаимодействуют друг с другом так же, как и жесткие диполи. Этот вид взаимодействия называется поляризационным и энергия его не зависит от изменения температуры.
|
Ооо ооо ООО |
|
Рис. 1.3. Схемы взаимодействия электрических диполей |
|
А — ориентационное расположение полярных молекул; б — расположение при притяжении; в — расположение при отталкивании |
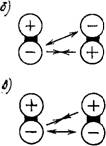
В. Третий вид связи между нейтральными молекулами может создаваться при возникновении так называемых дисперсионных сил. Этот вид взаимодействия возможен, когда два однородных атома находятся достаточно близко друг к другу и расстояние между ними значительно больше того, при котором перекрываются электронные облака и возникают ощутимые силы обменного взаимодействия. Рассмотрим это на примере двух атомов водорода. Известно, что в атоме водорода система протон—электрон в отдельные моменты обладает мгновенным (флуктуирующим) дипольным моментом, равным произведению заряда электрона на радиус его орбиты. Если в двух близко расположенных атомах водорода (рис. 1.3, а) электроны движутся синхронно и мгновенные значения дипольных моментов
совпадают по направлению, то между этими электрически нейтральными атомами возникает сила притяжения (рис. 1.3,6). Если же мгновенные дипольные моменты атома противоположны — произойдет их отталкивание (рис. 1.3,б). Энергетически более положительной является ситуация, соответствующая возникновению сил притяжения.
В молекулярных кристаллах могут одновременно проявляться все три вида взаимодействия, однако большая доля энергии приходится на ориентационный и дисперсионный эффекты и меньшая — на индукционный. Сила Ван-дер-Ваальса определяет наиболее универсальную связь — она возникает между частицами твердых тел и является более короткодействующей, чем кулоновская сила, пропорциональная г~2, в то время, как первая пропорциональна г-7. Действие сил Ван-дер - Ваальса как бы «маскируется» на фоне других сил, в том числе и ионных, поэтому молекулярные связи четко проявляются лишь в тех случаях, когда они возникают между нейтральными атомами и молекулами. Эти связи легко разрушаются тепловым движением и механическим воздействием. Молекулярные кристаллы легкоплавки при очень низких температурах.
Каждый из рассмотренных видов связи только в редких случаях встречается в чистом виде; обычно связь атомов в твердом теле представляет собой комбинацию различных типов связи. Например, в межатомном протяжении почти всегда какое-то влияние оказывают силы Ван-дер;-Ваальса. Только во взаимодействии атомов водорода, не имеющих внутренних электронов, силы притяжения Ван-дер-Ваальса отсутствуют; в этом случае силы притяжения создаются флуктуирующими ди - польными моментами молекулы водорода, которые при низких температурах связывают их как в жидком, так и в твердом состоянии (сухой лед).
Гораздо более важное значение, чем ван-дер^-вааль - сово притяжение, имеют ионные и ковалентные взаимодействия. При ковалентной связи между атомами двух различных элементов электроны могут находиться большую часть времени ближе к одному атому, чем к другому, привнося тем самым «ионный вклад» в ковалент - ную связь. Переход от ионной к ковалентной связи между атомами ряда элементов периодической таблицы может происходить при наличии электростатических сил.

 Опубликовано в
Опубликовано в