СТРОЕНИЕ ВЕЩЕСТВА Как устроен атом
 4 марта, 2013
4 марта, 2013  admin
admin Цтобы понять работу газоразрядного ионизационного ^счетчика, необходимо познакомиться со строением вещества.
Всякое вещество, будь то газообразное, жидкое или твердое, состоит из мельчайших материальных частиц — атомов, долгое время считавшихся неделимыми[1]). Размеры и вес атомов чрезвычайно малы. Так, например, атом железа весит 0,000 ООО ООО ООО ООО ООО ООО 093 128 грамма, а его радиус составляет всего лишь 0,000 000 0127 см. Но несмотря на свою ничтожную величину, атом имеет сложное устройство.
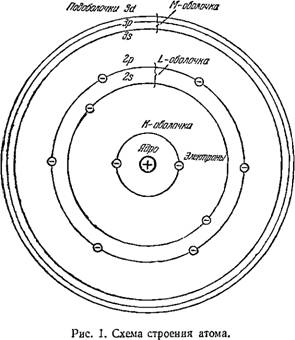
По современным представлениям в центре атома расположено атомное ядро. Размер ядра примерно в 100 000 раз меньше размера самого атома, но основной вес последнего сосредоточен именно в этом ядре. Плотность всех ядер приблизительно одинакова и выражается она огромнейшим числом порядка 100 000 000 000 000 гсмг (граммов в кубическом сантиметре), т. е. один кубический сантиметр ядерного вещества должен был бы весить около 100 миллионов тонн. Ядро в свою очередь не является элементарной, неделимой частицей, а состоит из электрически незаряженных (нейтральных) частиц — нейтронов — и положительно заряженных частиц — протонов. В целом электрический заряд ядра положителен.
Вокруг ядра на огромных по сравнению с его размерами расстояниях движутся с большими скоростями, около 2000 километров в секунду, материальные частицы — электроны. Масса электрона в 1835 раз меньше массы атома самого легкого химического элемента— водорода. Электроны заряжены отрицательным электричеством. Заряд их равен 0,000 000000 000 000 000 16 кулона или 0,000 000 000 48 абсолютных электростатических единиц[2]). Насколько эта величина мала, можно судить по тому, что для создания тока силой в 1 ампер по проводнику должно в каждую секунду протекать 6 250 000 000 000 000 000 электронов.
Число электронов в каждом атоме равно числу положительных зарядов в ядре, то есть числу протонов. Таким образом, атом в целом — электрически нейтральная частица.
Известно, что две частицы, заряженные разноименным электричеством, притягиваются. Тем не менее отрицательные электроны, притягиваемые положительным ядром, не падают на него. Это происходит потому, что, обладая огромными круговыми скоростями, они стремятся оторваться от ядра и тем самым уравновешивают силу притяжения.
В 1869 году русским ученым Д. И. Менделеевым был открыт один из важнейших законов природы — закон периодичности свойств химических элементов. Вы, вероятно, уже читали, что Менделеев расположил все элементы в таблице в строгом порядке, определяемом их химическими свойствами. Так вот, теперь мы знаем, что число электронов в атоме равно порядковому номеру элемента в этой таблице. Например, на первом месте таблицы расположен химический элемент водород. Это значит, что атом водорода состоит из ядра, вокруг которого движется один электрон. Химический элемент аргон занимает восемнадцатое место, у него 18 электронов; неон имеет порядковый номер 10; значит, атом неона содержит 10 электронов.
Электроны вокруг ядра располагаются слоями, которые называют оболочками. Эти оболочки обозначены буквами латинского алфавита, начиная с буквы /(, которой обозначена ближайшая к ядру оболочка (рис. 1). За ней идет L-оболочка, далее М-оболочка и т. д. Каждая оболочка в свою очередь состоит из подоболочек. /(-оболочка состоит из одной s-подоболочки, L-Оболочка — из двух: 2S и 2р-под - оболочек; TW-оболочка— из трех: 3s-, Зр- и &/-подоболочек; iV-оболочка — из четырех: 4S-, 4р-, 4D- и ^/-подоболочек, О-оболочка — также из четырех: 5s-, 5р-, 5D- и 5/-подобо - лочек. На каждой оболочке может располагаться строго определенное число электронов. Так, на /(-оболочке у атома любого элемента может быть расположено не более двух электронов, на L-оболочке — не более восьми, на М-оболочке — не более восемнадцати и т. д. Внутри оболочек на подоболочках может располагаться также строго определенное число электронов.
Электроны, движущиеся вокруг ядра по орбитам, определяемым соответствующими подоболочками, обладают определенным запасом энергии. Чем ближе к ядру располагается электрон, тем меньше запас его энергии и тем прочнее он связан с ядром; и наоборот, чем дальше от ядра находится электрон, тем больше запас его энергии и тем слабее он удерживается положительным зарядом ядра. Следовательно, каждой оболочке соответствует определенный запас энергии, соответствующий как бы определенному уровню, на котором может находиться электрон в спокойном, т. е. нормальном, состоянии. Поэтому подоболочки принято называть энергетическими уровнями.
Если число электронов в атоме таково, что оно не может образовать законченную наружную оболочку, то атом такого элемента является химически активным, т. е. он может вступать в реакцию с атомами других элементов, имеющих также незаконченную (неукомплектованную) наружную оболочку. Например, водород имеет один электрон,
|
|
Расположенный на /(-оболочке. А законченная /(-оболочка должна содержать два электрона. Поэтому водород может вступать во взаимодействие с другим элементом и образовать устойчивую заполненную двухэлектронную К-оболочку.
Атомы, имеющие внешнюю оболочку, полностью укомплектованную полагающимся числом электронов, являются химически нейтральными, или, как их называют, инертными, так как они не могут ни принять электрон, ни отдать его другому атому. К таким элементам относятся инертные (или, как их иногда называют, благородные) газы: гелий (порядковый номер 2) с заполненной /(-оболочкой, неон (порядковый номер 10) с заполненными К и L-оболоч - ками, аргон (порядковый номер 18), криптон (порядковый номер 36) и т. д. Устойчивыми оболочками являются только те, которые содержат либо два (как у гелия), либо восемь (как у неона, аргона, криптона, ксенона и радона). У всех этих элементов полностью заполнены s - и р-подоболочки.
Электроны, расположенные на внешней оболочке, принято в химии называть валентными, так как они определяют взаимодействие с другими атомами, а в физике — оптическими. Последний термин станет ясным из дальнейшего изложения.

 Опубликовано в
Опубликовано в