Система Zn ½ KOH ½ MnO2
 6 мая, 2013
6 мая, 2013  admin
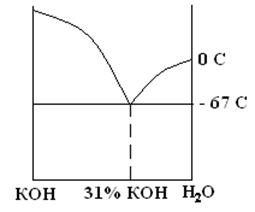
admin В других электрохимических системах с Zn анодом используется щелочной электролит. Это, как правило, концентрированный раствор КОН (25 – 40 масс. % КОН или 6 – 10 моль/л). Реже – 25% раствор NaOH (6 моль/л). В ХИТ всегда применяются высококонцентрированные или насыщенные растворы. Причины: 1) исходя из общих химических принципов, скорость процессов растет с ростом концентрации; 2) более прозаическая – расширение температурного диапазона в сторону низких температур требует незамерзающего электролита, поэтому лучше использовать эвтектические смеси. Для системы КОН – Н2О эвтектика приходится на 31 масс.% КОН (см. рисунок) и имеет tзам. = –670С. Максимум электропроводности приходится на 25 – 35 масс.% КОН в зависимости от температуры.
Сейчас Zn - MnO2 элементы всё больше выпускаются со щелочным электролитом (паста 30% КОН + загуститель). Их удельные характеристики ~ в 1.5 раза выше (80 – 125 Вт×ч/кг и 180 – 330 Вт×ч/л), чем солевых. Другие преимущества щелочных элементов: нет такого сильного падения емкости с током разряда и с температурой. В результате они могут быть лучше в 5 раз при разряде повышенным током. Сохранность заряда также лучше, чем у элементов Лакланше. Кроме того, щелочные элементы допускают повторный заряд после неглубокого разряда (не более 1/4 номинальной емкости).
|
|
При их изготовлении используется другая технология и более качественные и дорогие материалы, поэтому они дороже. На корпусе изделия указано, как правило, щелочная или солевая система используется. Реакция анодного растворения цинка в щелочном растворе связана с расходом щелочи, которая не компенсируется в катодном процессе на другом электроде. Zn + 4OH - = ZnO22- + 2H2O + 2e 2MnO2 + 2H2O + 2e = 2MnOOH + 2OH - После насыщения раствора цинкатом, идет вторичный процесс с образованием нерастворимого гидроксида или оксида Zn + 2OH - = Zn(OH)2¯ + 2e (или ZnO¯ + H2O + 2e) В этом случае в суммарном процессе щелочь уже не расходуется. |
Существует также Воздушно-цинковые элементы Zn½ NaOH ½O2 (на углеродном электроде с нанесенным катализатором восстановления кислорода) с ЭДС » 1.4 В (например, элемент «Крона») и суммарным токообразующим процессом
Zn + NaOH + 1/2O2 = NaHZnO2
Или
Zn + 2NaOH + 1/2O2 = Na2ZnO2 + H2O

 Опубликовано в
Опубликовано в