РЕДОКС-ИОНИТЫ (ЭЛЕКТРОНООБМЕННЫЕ СМОЛЫ)
 24 мая, 2013
24 мая, 2013  admin
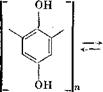
admin Фенольные смолы могут применяться в качестве электронообменных, или окислительно-восстановительных смол. Такие смолы называют редокс-ионитами [31]. Редокс-иониты представляют собой нерастворимые и ограниченно набухающие высокомолекулярные соединения, которые содержат обратимую окислительно-восстано - лвительную систему. В такой системе возможно обратимое превращение хинонов в гидрохиноны и наоборот. Процессы окисления и восстановления протекают с высокой скоростью. Редокс-иониты отличаются высокими химической стойкостью и механической прочностью.
Фенольные смолы, содержащие гидрохиноновые группировки, получают совместной поликонденсацией фенола, гидрохинона ж формальдегида в присутствии щелочного катализатора [32]. Гидрофильные продукты образуются при взаимодействии гидрохинона, тг-фенолсульфокислоты и формальдегида в мольном отношении 1 : 0,5 : 1,5. Кроме того, в качестве исходных продуктов для получения электронообменных смол было предложено использовать полиоксинафталин, нафтолсульфокислоту, пирокатехин и др. [33]. Однако в щелочной среде под действием сильных окислителей эти смолы окисляются необратимо. Только 2-оксиантр&- хинон или ализарин с фенолом или фенолсульфокислотой и формальдегидом образуют стабильные редокс-полимеры, которые можно восстанавливать дитионитом натрия ^а28204) [34].
Совместную поликонденсацию пирогаллола, гидрохинона, пирокатехина с формальдегидом проводят в присутствии фенола, служащего одновременно дополнительным сшивающим агентом ж разбавителем. В случае использования пирогаллола добавление - фенола необходимо для облегчения сшивания. При этом образуются продукты следующего строения [35]:
В присутствии окислителя гидрохинон, отдавая электроны и протоны, окисляется до хинона:
|
О |
![]() ОН О
ОН О
+ 2е - + 2Н+
ОН о
 Если раствор, содержащий вещество, подлежащее восстано - вленйю, контактирует с редокс-ионитом, содержащим гидрохино - новые группы, то последний при полном окислении отдает 2тг электронов и 2п протонов:
Если раствор, содержащий вещество, подлежащее восстано - вленйю, контактирует с редокс-ионитом, содержащим гидрохино - новые группы, то последний при полном окислении отдает 2тг электронов и 2п протонов:
![]() О
О
--2ne~-- 2пН+
О
При этом восстанавливаемое вещество принимает электроны.
Наилучшим методом исследования окислительно-восстановительных систем является потенциометрическое титрование.
С помощью окислительно-восстановительных смол, полученных поликонденсацией гидрохинона, фенола и формальдегида
ОН ОН ОН
Удаляют кислород, растворенный в водных растворах или в воде [36].
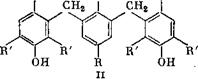
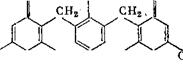
Для систематических исследований были синтезированы поли - мергомологические многоядерные соединения, представляющие собой бензилзамещенные окислительно-восстановительные системы [37]:
 ОН ОН ОН
ОН ОН ОН
|
И" . |
Соединения типа I получали из оксиметилфенолов и гидрохинона в присутствии НС1 в качестве катализатора. Для получения «соединений типа II использовали способ удвоения Керна и Тома [38]. Эти соединения окислением с помощью К2Сг207 превращали в соответствующие хиноны, чтобы их можно было использовать лри восстановительном титровании:
О v ОН О
|
|
Н3С I СН3 Н3С | СН3
О СН3 О
Авторы работы [39] исследовали систему лейкометиленовый голубой—метиленовый голубой, обладающую относительно низким окислительно-восстановительным потенциалом и интенсивно изменяющую цвет. Метиленовый голубой, .представляющий собой четвертичное аммониевое основайие, при всех значениях pH является одновалентным катионом:
Г(СН3)2К Б 4 ЗЧ(СН3)21+
|
N |
Систему получают совместной поликонденсацией метиленового голубого, резорцина и формальдегида.
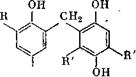
В качестве окислительно-восстановительных систем могут применяться также гидрохйнонсульфоны, которые были синтезированы Манеке и Вером [40]. Общая формула этих соединений - следующая:
ОН ОН
TOC o "1-5" h z Соеди - R
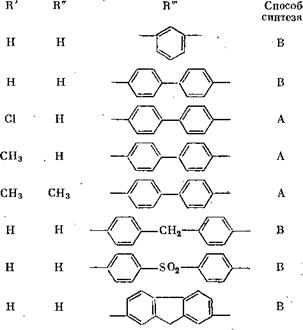 Нение
Нение
I Н
II Н
III С1
IV СН3
V СН3
VI Н
VII Н
VIII Н
Эти соединения были получены по реакции Гинсберга (способ А) и реакции Борше и Франка (способ В). Соединения III, IV, V были получены из дифенил-4,4'-дисульфояовой кислоты и соответственно 2,3-дихлоргидро^инона, 2,3-диметилгидрохинона и три- метилгидрохинона. Соединения I, II, VI, VII, VIII получали из соответствующих бифункциональных гидразидов сульфокислот и тг-бензогидрохинона. Окисление соединений проводили обычным образом с помощью хромовой кислоты.

 Опубликовано в
Опубликовано в