РАЗДЕЛЕНИЕ АРЕНОВ С8
 3 августа, 2013
3 августа, 2013  admin
admin Для разделения изомерных ксилолов и этилбензола разработано большое число процессов, применявшихся ранее, применяющихся в промышленности до настоящего времени и перспективных [8,9]:
Сверхчеткая ректификация - для выделения о-ксилола, а также (на некоторых установках) этилбензола;
Адсорбция на цеолитах, получившая наиболее широкое применение для выделения п-ксилола;
Кристаллизация - для выделения п-ксилола; диффузия через мембраны - для выделения л-ксилола; процессы с использованием клатратных соединений; экстракция борфтористоводородной кислотой - для выделения ж-ксилола;
Сульфирование и ступенчатый гидролиз сульфокислот; экстрактивная кристаллизация; экстрактивная ректификация; азеотропная ректификация.
Состав аренов С8 в зависимости от метода получения пред - •авлен в табл. 29 [31,305].
Независимо от происхождения аренов С8 в их составе в наи - олыпем количестве по сравнению с другими изомерами присутствует ж-ксилол, пользующийся наименьшим спросом. Поэтому часто процессы разделения комбинируют с процессом изомеризации ксилолов, при котором ж-ксилол изомеризуется в п - и о-ксилолы, находящие более широкое практическое применение.
|
Состав аренов С8, получаемых при различных процессах, % (мае.)
|
Для разделения аренов С8 используются различия в их температурах кипения и плавления, форме молекул, электронодо - норной способности, дипольных моментах. Некоторые физикохимические свойства, существенные для разделения аренов С8, приведены в табл. 30.
Для выделения самого высококипящего изомера - о-ксилола наиболее широкое применение получил процесс ректификации. Коэффициент относительной летучести ключевой, наиболее трудно разделяемой пары компонентов ж-ксилол - о-ксилол при нормальном давлении составляет а= 1.147 [306], при снижении давления до 26.66 кПа он увеличивается до 1.196, а при Р = 6.66 кПа - до 1.225 [307].
Выделение о-ксилола из смеси аренов С8 ректификацией осуществляют в трехколонной системе. Сначала в двух последовательно соединенных колоннах с общим числом тарелок 150- 160 при кратности орошения (5-8): 1 отгоняют все сравнительно низкокипящие изомеры, затем в третьей колонне получают товарный о-ксилол, очищенный от примесей высококипящих аренов [306].
На некоторых нефтеперерабатывающих заводах, например Новополоцком НПЗ, сверхчеткая ректификация используется и
|
ТАБЛИЦА 30 Физико-химические свойства аренов С8
|
Для выделения этилбензола. Предварительное выделение этил- бензола упрощает разделение и изомеризацию ксилолов. Однако из-за низкого коэффициента относительной летучести ключевой пары компонентов этилбензол - /г-ксилол, равного при атмосферном давлении 1.058, общее число практических тарелок ректификационной системы достигает 350-400 при флегмовых числах 25-50.
На Новополоцком НПЗ для выделения этилбензола из технического ксилола использовались три последовательные колонны диаметром 5 м, содержащие по 130 клапанных прямоточных тарелок. Флегмовое число равнялось 120. При производительности установки по сырью 10.5 т/ч отбор этилбензола чистотой 99.66 % (мае.) составлял 1.42 т/ч, или 76 % от потенциального содержания в сырье [308,309]. Однако в настоящее время выделение этилбензола ректификацией технического ксилола считается неэкономичным, и большая часть этилбензола получается алкилированием бензола этиленом.
Разделение смеси п- и ж-ксилолов с коэффициентом относительной летучести а= 1.019 ректификацией практически невозможно: даже при бесконечно большом флегмовом числе понадобилась бы система колонн с числом тарелок более 1000 [310].
Наиболее эффективный метод выделения гс-ксилола из смесей с другими аренами С8 - адсорбция на цеолитах. п-Ксилол имеет наименьшее поперечное сечение молекул, соответствующее диаметру входных окон некоторых цеолитов. В качестве цеолитов для селективного выделения п-ксилола предложены цеолиты типа X состава (0.9 ± 0.2)М2/„0 • А1203 ■ со8Ю2 • хН20, где М = Ъп, 1л, Со, Сс1 и (или) М£, п - валентность металла М, (0= 1-3, х = 0-9 [311]. Могут использоваться также цеолиты типа Ь состава (1 ±0.1)М2/П0 • А1203 • со8Ю2- .хН20, где М - щелочной, щелочноземельный металл или Т1, со =6.4 ±0.5, х = 0-7 [311, 312]. Запатентованы для адсорбции /г-ксилола цеолиты типа X или У, содержащие катион Т1+ [313], цеолиты КУ [314], цеолиты типа X или У, в которые методом ионного обмена введены катионы К, Ва или их смесь [315], а также двухступенчатая адсорбция на цеолите типа У, который подвергают ионному обмену сВаиЫ [316].
В качестве десорбентов возможно использование толуола или п-диэтилбензола [317], тетралина или его алкилпроизводных [318], /г-цимола [310], отдельных изомеров диэтилтолуола или их смесей [320], дифенилметана [321].
Фирмой «иОР» разработан процесс выделения /г-ксилола адсорбцией на неподвижном слое' цеолита в жидкой фазе при 120-180 °С. Принципиальная технологическая схема процесса,
Включающая адсорбер, десорберы, распределительный клапан, рассмотрена в монографии [322].
Описан также процесс «Aromax» - выделение /i-ксилола в адсорбере с движущимся слоем адсорбента [323].
Фирма «CECA SA» запатентовала усовершенствованный способ выделения д-ксилола из ароматической фракции С8 адсорбцией в псевдопротивоточном режиме на гранулированном цеолите, содержащем агломерированный фауязит X, подвергнутый обмену с ионами Ва2+. Цеолит содержит не менее 80 % (мае.) фауязита с модулем Si/Al = 1—1.5, в котором Ва занимает не менее 90 % обменной емкости [324].
Степень извлечения n-ксилола чистотой 99.5 % (мае.) адсорбцией на цеолитах достигает 98.4 %, что существенно выше по сравнению с другими используемыми методами.
«Institut Franзais du Petrole» запатентовал комбинированный способ выделения д-ксилола, включающий адсорбцию в колонне с цеолитом при 140-185 °С с впрыскиванием воды в исходную смесь ксилолов, в десорбент и/или в рецикл в количестве
1- 200 ppm. Обогащенную /г-ксилолом фракцию перегоняют для отделения десорбента, и д-ксилол очищают экстрактивной кристаллизацией с метанолом [317].
Фирма «UOP» предложила интегрированный процесс селективной адсорбции с получением фракции, обогащенной д-ксило - лом, и выделением последнего простой кристаллизацией. Фракцию, обедненную д-ксилол ом, изомеризуют и вновь пропускают через зону адсорбции [325].
Адсорбцией на различных цеолитах возможно выделение и других аренов С8 из их смеси. Так, по отношению к этилбензолу селективен цеолит Rb-Y, к ж-ксилолу - Ca-Y и Sr-Y, к о-ксилолу - Na-Y [284].
Этилбензол может быть сконцентрирован адсорбцией на цеолите типа 13Х, обмененном с раствором RbCl (сорбент имеет 53Rb+ и 33Na+ на элементарную ячейку). Коэффициенты селективности ос оценивались по формуле:
А = 1(тэб)цт/(тзб)ис] [(ткс)нс / (ткс)цт]
Где (тэб)цт и (тэб)нс - количество этилбензола в цеолите и неадсорбиро - ванном слое; (ткс)„с и (тт)ц, - количество ксилола в неадсорбированном слое и в цеолите.
Для систем этилбензол - д-, м- или о-ксилол значения а равнялись 2.4, 3.2 и 2.2 соответственно. Для системы этилбензол - десорбент (д-бутилбензол) а = 3.4 [326].
Жидкофазной адсорбцией при 100-150 °С на цеолите типа Y, в который входят Si и А1 в соотношении 4 : 6, а также катионы 70
Иа+ и 1.5-2.5 % (мае.) воды, возможно выделение м-ксилола из смеси с другими аренами С8. В качестве десорбента предложено использовать толуол или индан [327].
Высоким коэффициентом разделения по бинарной смеси м - и о-ксилолов обладает цеолит СаХ [328].
Одним из промышленных методов выделения п-ксилола остается низкотемпературная кристаллизация смеси аренов С8, полученной после ректификационного удаления о-ксилола. Применяется как одно-, так и двухступенчатая кристаллизация п-ксилола. Диаграммы плавкости систем, включающих /г-ксилол и другие арены С8, - эвтектического типа. Так, температура застывания эвтектической смеси /г-ксилол - ж-ксилол, содержащей около 86 % (мае.) п-ксилола, равна -52.7 °С. Присутствие в сырье других аренов С8 приводит к снижению температуры кристаллизации эвтектической смеси до -101 °С и уменьшению содержания в ней п-ксилола.
При двухступенчатой кристаллизации температура на первой стадии процесса около -70 °С, на второй стадии очистка п-ксилола проводится кристаллизацией при температуре около -18 °С [306]. Кристаллы п-ксилола отделяют от маточного раствора на вращающемся вакуум-фильтре. После повторной кристаллизации п-ксилол выделяется центрифугированием. Принципиальная технологическая схема процесса двухстадийной кристаллизации п-ксилола приведена в монографии [322].
Имеются установки одностадийной кристаллизации п-ксило - ла в интервале температур -(50 70) °С, с меньшими энергоза
Тратами, чем при двухстадийном процессе [329].
Фирма «ВЕРБ Ргокет» усовершенствовала одностадийный способ очистки п-ксилола. Сырье с содержанием п-ксилола 78 % охлаждают в течение 2 ч до -14 °С в кристаллизаторе, после чего отделенные от жидкой фазы кристаллы п-ксилола промывают очищенным продуктом. Это позволяет ускорить очистку п-кси- лола, довести его чистоту до 99.95 % и снизить капитальные затраты на 35-40 % [330].
Запатентован также способ очистки п-ксилола кристаллизацией при относительно высокой температуре (от 10 до -25 °С) и частичным плавлением кристаллов [331].
Предложен способ выделения п-ксилола, заключающийся в его кристаллизации при прямом контакте с хладагентом, например с этиленом. Смесь аренов С8 и этилена поступает в нижнюю часть кристаллизационной колонны, где за счет испарения этилена температура снижается до -73 °С. Температура потока при подъеме со скоростью 3-6 мм/с в колонне высотой 30-60 м постепенно понижается до -80 °С со скоростью падения температуры в пределах 0.01-1 °С/мин. Происходит медленный рост кристаллов п-ксилола. В верхней части колонны хладагент в паровой фазе отделяется от сырья, из которого выделяют кристаллы /г-ксилола [332].
Фирма «Phillips» разработала процесс выделения тг-ксилола зонной плавкой [333].
Фирма «Imperial Smelting Corp.»предложила выделение тг-кси - лола экстрактивной кристаллизацией с гексафторбензолом, образующим комплексы с ж-ксилолом. Однако из-за высокой стоимости гексафторбензола использование этого метода экономично лишь при степени регенерации растворителя свыше 99 % [334].
Исследовано также разделение ксилолов и этилбензола экстрактивной кристаллизацией в метанольных растворах с тиомо - чевиной в присутствии индукторов, например СС14. Тенденция к образованию аддукта изменяется в ряду: этилбензол > о-ксилол > > тг-ксилол > ж-ксилол. Таким образом, этим методом легче всего разделяются смеси этилбензол - ж-ксилол и плохо разделяются системы этилбензол - о-ксилол и тг-ксилол - ж-ксилол [335].
Французским институтом нефти разработан процесс «ELUXYL» - выделение п-ксилола из смесей с другими аренами С8 диффузией через полу непроницаемые мембраны. Процесс используется в промышленности с 1994 г. фирмой «Chevron» [336].
Скорость диффузии тг-ксилола через полимерные мембраны выше, чем других аренов С8, вследствие наименьшего поперечного сечения молекул п-ксилола. Принципиальная возможность выделения тг-ксилола диффузией через полимерные пленки установлена давно [337,338]. Так, при использовании мембраны из полиэтилена высокой плотности смесь тг-ксилол - ж-ксилол, содержащая по 50 % (мае.) каждого изомера, разделяется за 8 стадий с получением тг-ксилола чистотой 99 % (мае.) [339].
Имеются и патенты на процесс выделения тг-ксилола диффузией через мембраны, например [340].
Перспективно использование экстрактивной или азеотроп - ной ректификации для разделения аренов С8. Недостаток выделения о-ксилола простой ректификацией - низкая степень извлечения, составляющая около 70 % от потенциального содержания его в сырье [341].
Как установлено в результате обследования установки о-, п - ксилолов ПО «Киришинефтеоргсинтез», потери о-ксилола при ректификационном выделении достигают 42.7%, в том числе
41.2 % - в погоне с другими аренами С8. Попадание большого количества о-ксилола (около 9.7 % (мае.)) в смесь более летучих аренов С8 осложняет выделение w-ксилола, приводит к излишним потерям ксилолов на стадии их изомеризации.
|
Коэффициенты относительной летучести (ар) аренов С8 по отношению к о-ксилолу при 80 °С в присутствии селективных растворителей (при Хр —► 1)
|
В табл. 31 приведены рассчитанные из данных работы [293] коэффициенты относительной летучести аренов С8 по отношению к о-ксилолу при 80 °С и бесконечном разбавлении в различных растворителях, а также селективность этих растворителей к ключевой системе ж-ксилол - о-ксилол.
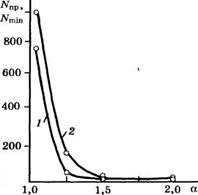
Даже небольшое повышение коэффициента относительной летучести с 1.14 до 1.25 приводит к существенному улучшению результатов выделения о-ксилола. В табл. 32 приведены результаты расчетов Л. Берга [310] с использованием уравнения Фенске минимального числа теоретических тарелок (А/^) при различных коэффициентах относительной летучести разделяемых компонентов с получением веществ со степенью чистоты 99.9 % (мол.). Для выделения о-ксилола такой чистоты требуется система колонн при простой ректификации с 7Ут1п = 330 (рис. 5). Число практических тарелок при КПД = 0.75 и бесконечно большом флегмовом числе А^пр= 440, а при реальных флегмовых числах 7Упр еще выше. При переходе от простой ректификации к экстрактивной, как следует из табл. 32, 7Ут1п и 7Упрснижаются в 3.3 раза.
Таким образом, использование экстрактивной ректификации для выделения о-ксилола позволит решить одну из следующих задач:
- резкое снижение числа тарелок при ректификации, гидравлического сопротивления, температуры в нижнем сечении, капитальных затрат;
Й - 28-4 73
Рис. 5. Зависимость минимального числа теоретических тарелок Nmin (/) и соответствующего числа практических тарелок ректификационной колонны Л^р (2) от коэффициента относительной летучести разделяемых компонентов а
-  Повышение качества товарного о-ксилола;
Повышение качества товарного о-ксилола;
— повышение степени извлечения о-ксилола.
При необходимости возможно одновременное улучшение всех перечисленных показателей разделения.
При использовании экстрактивной ректификации с 14-метил- пирролидоном для удаления аренов С8 из смеси с о-ксилолом степень извлечения последнего по сравнению с простой ректификацией может быть повышена на 20 %.
В табл. 33 представлены значения предельных коэффициентов активности аренов С8 в различных растворителях, определенные методами газо-жидкостной или жидкость-жидкостной хроматографии [78]. По значениям 7° рассчитаны селективность растворителей по отношению к системам этилбензол - п-ксилол, п-ксилол — ж-ксилол и ж-ксилол — о-ксилол. Как следует из табл. 33, универсального растворителя, селективного по отношению ко всем трем системам, что необходимо для выделения не только о-, но и /г-ксилола, среди исследованных соединений нет.
ТАБЛИЦА 32
|
Минимальное (Мтт) и соответствующее число практических тарелок (Мпр при КПД = 0.75) для ректификационного разделения веществ в зависимости от коэффициентов относительной летучести (степень чистоты выделенных веществ 99.9 % (мол.))
|
По отношению к системе ж-/о-ксилол достаточно высокую селективность помимо отмеченных выше растворителей проявляет также триэтиленгликоль. По отношению к наиболее трудно разделяемой системе п-/ж-ксилол селективен диметиловый эфир тетра - этиленгликоля. При разделении системы этилбензол/п-ксилол наиболее селективны высокополярный растворитель Р, Р'-оксидипропио - нитрил, а также высококипящие « алканы - гексадекан, тетракозан.
Патентная информация, касающаяся разделения аренов С8 экстрактивной и азеотропной ректификацией за последние 15- 20 лет, представлена в табл. 34. Большинство патентов принадлежит Л. Бергу из США и его фирме. Запатентован ряд растворителей, значительно более селективных по сравнению с представленными в табл. 34. Однако патентная информация нуждается в дополнительной проверке, некоторые результаты представляются сомнительными. Так, необычно высокую селективность при разделении наиболее близкокипящих ж - и п-ксилолов проявляют алифатические и циклоалифатические спирты, повышающие коэффициент относительной летучести 0Ср до 1.73 при невысоком содержании растворителей в системе - около 36 %.
Для выделения о-ксилола из смеси с другими аренами С8 наибольший интерес представляет, по-видимому, диметилфталат - доступный, термически стабильный растворитель: для выделения о-ксилола чистотой 99.9 % (мае.) достаточно А^т1п = 65 или около 100 практических тарелок в колонне при приемлемых флегмовых числах.
Перспективно выделение п-ксилола азеотропной ректификацией с метилвалератом - судя по величине афъ /м ) = 1.38, для получения п-ксилола чистотой 99.9 % (мае.) достаточно Лгт1п= 50 или около 80 практических тарелок.
Возможно, один из растворителей, предложенных для разделения конкретной пары изомерных аренов С8, окажется достаточно универсальным для выделения как о-, так и п-ксилола.
Поиск универсального растворителя для разделения всех аренов С8 методом экстрактивной ректификации - перспективное направление исследований. Для того чтобы этот поиск не был чисто эмпирическим, параллельно необходима разработка теории разделения изомерных аренов с использованием селективных растворителей.
В Японии с 1968 г. для выделения ж-ксилола применяется промышленный процесс экстракции борфтористоводородной кислотой [364]. Процесс основан на высокой основности ж-ксилола по сравнению с другими ксилолами и эти л бензолом, которая обусловлена согласованным ориентирующим влиянием обеих метильных групп в молекуле ж-ксилола.
|
Предельные коэффициенты активности аренов С8 и селективность растворителей [78]
|
|
Дифенилсульфоксид |
90.1 |
1.92 |
2.02 |
1.97 |
1.80 |
0.950 |
1.025 |
1.094 |
|
Дифениламин |
60 |
1.52 |
1.57 |
1.57 |
1.44 |
0.968 |
1.0 |
1.090 |
|
Дибутиловый эфир диэтиленгликоля |
30 |
- |
0.76 |
0.76 |
0.75 |
- |
1.0 |
1.013 |
|
Трибутилфосфат |
50 |
0.71 |
0.74 |
0.73 |
0.77 |
0.959 |
1.014 |
0.948 |
|
Бензофенон |
60 |
1.35 |
1.40 |
1.35 |
1.27 |
0.964 |
1.037 |
1.063 |
|
Г^Ы-Дифенилформамид |
80.1 |
1.86 |
1.88 |
1.93 |
1.75 |
0.989 |
0.974 |
1.103 |
|
9,10-Дигидрофенантрен |
65.7 |
1.06 |
1.09 |
1.07 |
1.02 |
0.972 |
1.019 |
1.049 |
|
1,2-Дифенилэтан |
55.5 |
1.02 |
1.01 |
1.01 |
0.98 |
1.01 |
1.0 |
1.03 |
|
Н-Гексадекан |
50 |
1.15 |
1.06 |
1.11 |
1.09 |
1.085 |
0.955 |
1.018 |
|
Бензилбифенил |
90.1 |
1.15 |
1.14 |
1.13 |
1.07 |
1.009 |
1.009 |
1.056 |
|
Н-Тетракозан |
80 |
0.69 |
0.64 |
- |
- |
1.078 |
- |
- |
|
Динонилфталат |
60 |
0.65 |
0.64 |
0.64 |
0.62 |
1.016 |
1.0 |
1.032 |
|
N-Формилморфолин |
40.1 |
3.88 |
4.07 |
4.10 |
3.53 |
0.953 |
0.993 |
1.161 |
|
59.5 |
3.60 |
3.84 |
3.81 |
3.35 |
0.938 |
1.008 |
1.137 |
|
|
79.3 |
2.59 |
3.71 |
3.68 |
3.23 |
0.968 |
1.008 |
1.139 |
|
|
100.2 |
3.44 |
3.56 |
3.34 |
2.98 |
0.966 |
1.066 |
1.121 |
|
Патентная информация по разделению аренов С8 экстрактивной и азеотропной ректификацией
|
|
Том, диизобутилкарбинолом (И) |
|
ЭР ЭР ЭР АР ЭР |
![]()
|
АР ЭР ЭР ЭР АР ЭР ЭР ЭР |
![]()
|
[351] [352] [353] [354] [355] |
![]()
|
[356] [357] [358] [359] [360] [361] [362] [363] |
![]()
М-/0-
Эб/ксилолы
П-/м-;
М-/о-
П-/м-
М-/о-
П-/м-
П-/о-;
М-/о-
Л^/о-
М-/о-
Эб/о-
Эб/л-; эб/м - эб/л - п-/м-
П-/0-; м-/о-
Диэтилмалонат (I), диэтилмалеат,
2 - этилгексилацетат Сульфонаты Си(1), например л-доде - цилбензолсульфонат Си(1) З-Этилфенол, 1,1,2-трихлорэтан, 2-бут- оксиэтилацетат, 1,1,1 - трихлорэтан Тетраэтилортосиликат
Крезолы, 3-этилфенол, 2,4-диметилфе - нол, 2,6-диметилфенол, 2- и 4-нитро - фенолы, изопропилпальмитат, 3-мето - ксиэтилцианоацетат, метилсалицилат, бутилцианоацетат, 2-бутоксиэтилаце - тат, 1,1,1-трихлорэтан
3- Метил-1-бутанол (I), метилпропио - нат (II), 3-пентанон (III)
Метилбензоат, л-дифенилфталат, ди- пропиленгликольдибензоат, метил-2-ги - дроксибензоат
Смеси диметилформамида с этилен - гликолем, 1,4-бутандиолом, 1,5-пентан - диолом, ДЭГ, ТЭГ, адипонитрилом, ди - гексилфталатом, гидрохиноном, м - и л-крезолами
Нитробензол, нитротолуолы, фенол и его гомологи, циклододеканол, доде - циловый и тридециловый спирты н-Бутанол, метилформиат, циклопен - танол
5-Метил-2-гексанон
Тетрахлорметан
О-Крезол, дихлоруксусная кислота, метилсалицилат, 1 - тетрадеканол
Ор= 1.246 в присутствии I
Ор= 1.16 в присутствии I при содержании эб в сырье 21 % (мае.) ап(л-/ж-) = 1.3 в 3-этилфеноле; сфг-/м-) = 1.4 в 1,1,2-трихлорэтане сйп-/м-) = 1.5-1.6 а^(п-/м-) =
= 1.3-1.8
0Ср=1.3 при мае. соотношении 3- этилфенола к сырью 2 : 1
0Ср(м-/о-) = 1.4 (I и II); 1.35 (III)
Последние два растворителя более эффективны
В качестве сильного электроноакцепторного экстрагента для выделения ж-ксилола может использоваться также СР3803Н. Запатентован процесс разделения аренов С8, в котором о-ксилол отделяют ректификацией, затем ж-ксилол экстрагируют СГ3803Н, и на второй ступени тем же экстрагентом выделяют п-ксилол из смеси с этилбензолом. Температура процессов экстракции 5-30 °С [365].
На более высокой основности ж-ксилола по сравнению с другими аренами С8 был основан также применявшийся в промышленности процесс селективного сульфирования и ступенчатого гидролиза сульфокислот: ж-ксилол сульфируется с наибольшей скоростью, а образующаяся ж-ксилолсульфокислота гидролизуется легче, чем сульфокислоты других аренов С8 [366].
Выделение п-ксилола осуществлялось в промышленности также методом клатратообразования с комплексами Вернера, в частности с тетра(4-метилпиридин)никель(И)-дитиоцианатом
|
|
Так, из фракции аренов С8 с содержанием п-ксилола около 20 % (мае.) посредством жидкостной клатрации в водном растворе моноэтаноламина может быть выделен п-ксилол чистотой 90-95 % (мае.) [367].
В качестве органического лиганда при выделении п-ксилола вместо 4-метилпиридина может использоваться бензиламин. При применении тетра(4-метилпиридин)никель(П)-диформиата или ди(4,4'-дипиридил)никель(И)-дитиоцианата из смеси аренов С8 можно селективно выделять о-ксилол. Использование тетра(4- ацетилпиридин)никель(11)-дитиоцианата позволяет выделять этил - бензол. Однако широкого промышленного применения для разделения аренов С8 клатратообразование не получило из-за больших расходов комплексов Вернера, коррозии оборудования, токсичности солей никеля и производных пиридина [368].

 Опубликовано в
Опубликовано в