ПРИМЕНЕНИЕ АНИЛИНА
 12 августа, 2013
12 августа, 2013  admin
admin С начала промышленного производства анилин использовали главным образом для получения красителей, после второй мировой войны - в основном в производстве ускорителей вулканизации резины, а начиная с 70-х годов - в производстве изоцианатов и полиуретанов на их основе [467].
Взаимодействием анилина с формальдегидом или его производными в водной среде в присутствии НС1 получают 4,4'-ди- аминодифенилметан.
Считается, что конденсация анилина с формальдегидом протекает в две стадии [502]:
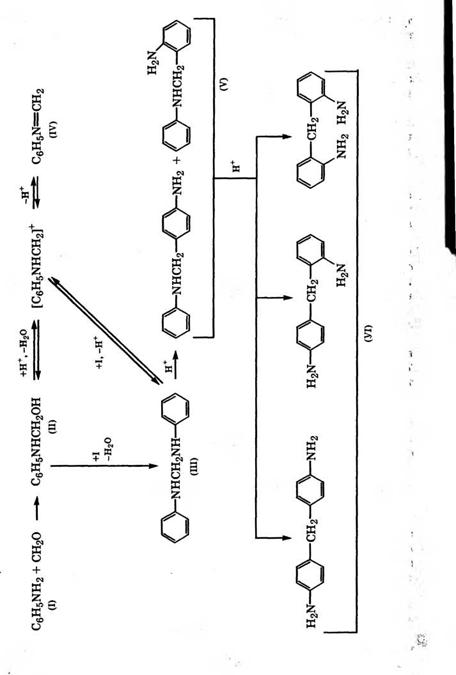
Сначала образуется метилольное производное (II), которое в зависимости от условий реакции превращается в аминаль (III) или метиленанилин (IV). Аминаль превращается в бензиламины (V) под действием катализаторов - неорганических кислот или гидрохлорида анилина.
Образующийся реакционноспособный метиленанилин поли - меризуется с образованием полимера линейного (VII) или циклического строения (VIII), а также взаимодействует с бензилами - нами (V):
|
*С6Н5 |
|
С6Н5, |
|
‘Ы N К } N С6н5 (VIII) |
|
+ |
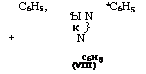 |
|
|
|
|
С6Н5К=СН2 (IV) |
![]()
|
+у |
![]() С6Н5КНСН2—^^-МНСН2— СН2ГШС6Н5
С6Н5КНСН2—^^-МНСН2— СН2ГШС6Н5
С6Н5КНСН2—^^-ынсн2—
НоЫ
На стадии образования предконденсата вторичного амина рекомендуется соблюдать оптимальное соотношение реагентов и избегать повышения температуры при хорошем перемешивании, что благоприятствует образованию соединений (III) и (V) и не способствует образованию полимеров (VII) и (VIII). Эта первая стадия проводится при 20-30 °С.
Вторая стадия процесса - изомеризация вторичных аминов в первичные (VI) - проводится при более высокой температуре и завершается при 95-105 °С при времени пребывания в реакторе около 4 ч. Затем реакционную смесь нейтрализуют при 90-100 °С для перевода полиаминов в жидкое состояние, смесь диаминов отделяют и разгоняют под вакуумом. Выход 4,4'-диаминодифе- нилметана составляет 78-79 %. Повышению выхода целевого продукта способствует оптимальное соотношение реагентов - анилин : формальдегид = (4-5): 1 и анилин : НС1 = 1 : (0.5-0.7).
Далее обычно в среде хлорбензола в одном реакторе под давлением или чаще в каскаде реакторов ведут сначала «холодное» фосгенирование полученного диамина при 0-30 °С
CH2(C6H4NH2)2 + СОС12 —► НС1 • H2NC6H4CH2C6H4NHCOCl а затем «горячее» фосгенирование при 70-125°С:
НС1 - H2NC6H4CH2C6H4NHCOCl + СОС12 —► OCNC6H4CH2C6H4NCO + ’*
; ■%
+ 4НС1 s
Образующийся НС1 поглощают водой с получением 30-36 % - й соляной кислоты или используют для гидрохлорирования.
4,4/-Дифенилметандиизоцианат (МДИ) выпускается в виде двух основных модификаций: смесь МДИ с полифениленмети- ленполиизоцианатами, содержащая 40-70 % (мае.) 4,4'-МДИ и называемая полиизоцианатом, полимерным МДИ или сырым МДИ; чистый 4,4'-МДИ, получаемый отгонкой из полимерного МДИ. Полимерный МДИ используется в основном (около 80 %) для получения жестких пенополиуретанов, а чистый 4,4'-МДИ - для производства непенистых полимерных материалов [503].
Образование уретанов (карбаматов) происходит при взаимо* действии изоцианатов со спиртами [504]:
/
R—N=C=0 + R'0H —► R—NH—С
OR'
Предложены различные бесфосгенные способы получения изоцианатов прямым карбонилированием нитросоединений или карбонилированием в присутствии спиртов с получением карбаматов, конденсацией карбаматов с альдегидами и пиролизом продуктов: ц
-2С02 nCH20
TOC o "1-5" h z C6H5N02 + ЗСО + ROH --------- ► C6H5NHCOOR ~ » I»
Г ')
-(п + l)ROH
-► R0C(0)NHC6H4(CH2C6H3NHC00R)nH ------------------------ ►
»
К -► OCNC6H4(CH2C6H3NCO)„H д
! t
Получение МДИ бесфосгенным методом перспективно: сырьевые затраты на 20%, а энергозатраты на 13-15% ниже по сравнению с методом, основанным на фосгенировании [503]. По - видимому, сложность реализации бесфосгенных методов состоит в создании катализатора карбонилирования, вклад которого в себестоимость продукции был бы невелик.
Получение бесфосгенным способом предшественника МДИ - дифенилметанбис(диалкилмочевины) запатентовано, в частности, фирмой «Агсо Chemical Technology» в среде нитрометана в присутствии протонной кислоты, например CF3SO3H, при бО - ЮСГС [505, 506].
Стадию термического разложения метилендифенилуретана предлагается проводить в среде органического растворителя, например диметилфталата, в присутствии H2S04, бензолсульфо - кислоты или n-толуолсульфокислоты, взятых в количестве 1- 4 % (мае.) от метилендифенилуретана [507].
Находят применение и модифицированные изоцианаты. Так, при взаимодействии МДИ со сложным полиэфиром и блокирующим агентом в органическом растворителе образуется блокированный олигомер - компонент клея, применяющегося при изготовлении электроизоляционного пленкосинтокартона. Взаимодействием кристаллического или жидкого МДИ с капролактамом в массе получают блокированные изоцианаты - компоненты порошковых лакокрасочных материалов [508].
Каталитической обработкой 4,4'-МДИ при нагревании получают жидкий продукт, содержащий карбодиимид [509]:
|
|
Полученный модифицированный продукт можно использовать для изготовления деталей автомобилей из интегрального пластичного пенополиуретана, полиграфического оборудования.
Частичную карбодиимидизацию МДИ предложено проводить в токе инертного газа при содержании 02 около 0.5 %, температуре 190-230 °С в присутствии трибутилфосфата. В результате модификации получается жидкий полиизоцианат, содержащий около 29-30 % изоцианатных остатков, использующийся в полимерных производствах [510].
Жидкий стабильный форполимер на основе МДИ получают взаимодействием его с алифатическим спиртом С1~С36 при 60- 1Ю°С в присутствии катализатора - ацетилацетоната Zn и ингибитора - бензилхлорида [511].
Взаимодействием анилина с сероуглеродом и серой при 250°С и давлении 3.2 МПа получают каптакс (2-меркаптобензотиазол) [467]:
|
|
Каптакс получается также реакцией о-хлорнитробензола с КаБЫ с последующей обработкой о-меркаптоанилина сероуглеродом:
|
|
|
При окислении каптакса (в виде натриевой соли) нитритом натрия в присутствии Н2804 получается альтакс [467]: |
![]()
![]()
![]()
|
В |
![]()
|
ЫН |
![]() При конденсации анилина с сероуглеродом в присутствии ЫаОН и бисульфита N3 образуется тиокарбанилид, при действии на который аммиака в присутствии сульфида свинца получают 1^,]М'-дифенилгуанидин:
При конденсации анилина с сероуглеродом в присутствии ЫаОН и бисульфита N3 образуется тиокарбанилид, при действии на который аммиака в присутствии сульфида свинца получают 1^,]М'-дифенилгуанидин:
Каптакс является ускорителем серной вулканизации, придает резинам стойкость к старению. Обычно он используется совместно с альтаксом или с дифенилгуанидином. Применяется также в синтезе цианиновых красителей.
Конденсацией анилина с 2-нафтолом производится неозон Д (М-фенил-2-нафтиламин), широко применяющийся в качестве антиоксиданта резины.
Тиокарбанилид (или М, М'-дифенилтиомочевина) также используется в качестве ускорителя вулканизации для каучуков, вулканизируемых серой, и хлоропреновых латексов, как стабилизатор поливинилхлорида и флотореагент.
Одним из важнейших направлений применения анилина остается производство красителей. Свыше 160 красителей получено на основе анилина и еще большее количество - из его производных [467]. Важнейшие красители, получаемые из анилина: азокрасители (анилиновый желтый, хризоидин, хризои - дин Р, жирорастворимый оранжевый, пигмент коричневый;
Кислотные - ярко-оранжевый, оранжевый светопрочный, прочный фуксиновый Б, ярко-красный, желтый светопрочный, си- не-черный, синий 3; прямой красный, прямой алый, прямой черный 3, прямой черный К); трифенилметановые (парафуксин, фуксин); сафранины (сафранин, метиленовый фиолетовый БН); хинониминовые (индулин ЗБ, нигрозин жирорастворимый); антрахиноновые (кислотный сине-черный антрахиноновый); индиго.
Так, индиго - древнейший органический краситель
|
О Н II I
|
Ранее получали из природного сырья, а после освоения промышленного производства анилина взаимодействием последнего с монохлоруксусной кислотой при 100 °С в присутствии Ге(ОН)2, плавлением образовавшегося К-фенилглицина (в виде К-соли) в смеси ЫаОН, КОН и КаГ»Ш2 при 200 °С с последующим окислением кислородом воздуха. Индиго применяется как синий кубовый краситель для текстильных материалов, для изготовления чернил и красок.
Фуксин - ярко-красный трифенилметановый краситель, получаемый совместным окислением анилина, о - и п-толуидинов нитробензолом в присутствии ЕеС13при 100-175 °С
|
МН2 |
Окраски фуксина и других красителей этой группы отличаются яркостью, но невысокой устойчивостью, особенно к действию света. Поэтому фуксин используется главным образом для окрашивания нетекстильных материалов, приготовления красных чернил и карандашей.
В производстве красителей широко применяются и алкил - или фенилпроизводные анилина.
М-Метиланилин может быть получен жидкофазным или парофазным N-алкилированием анилина метанолом. Жидкофазный процесс проводится при 180-200 °С и давлении до 3 МПа при мольном соотношении анилин : метанол : Н2804= 1 : 1.6 : 0.1. Парофазный процесс осуществляется в присутствии гетерогенного катализатора, цикл работы которого составляет до 250 ч. Недостатки этих процессов — периодичность, невысокие выход и качество Ы-метиланилина, большое количество отходов, малый срок службы катализатора, низкие экологические и экономические показатели.
В 1995 г. в ОАО «Волжский оргсинтез» (г. Волжский) реализован непрерывный процесс парофазного N-гидроалкилирования анилина в присутствии Н2 и гидрирующего-дегидрирующего катализатора [512]:
+н2
С6Н51Ш2 + СН3ОН ----- ^ С6Н5КНСН3 + Н20
Механизм процесса может быть представлен следующей схемой:
СН3ОН —► СН20 + Н2 СН20 + С6Н51Ш2 — С6Н5Ы=СН2 + Н20 С6Н5К=СН2 + Н2 — С6Н5КНСНз
Катализатор - меднохромовый контакт НТК-4 непрерывно работал без регенерации 2 года. Степень конверсии анилина составляет 96-99%, селективность образования М-метиланилина 95-98.5 %, выход побочного К, К-диметиланилина 2.5-3 %.
Разделение реакционной смеси осуществляется в четырех ректификационных колоннах, в которых отгоняются последовательно метанол, азеотропная смесь анилин - 1Ч, К[-диметилани - лин, возвращаемые в реактор, М-метиланилин первого и высшего сорта (содержание основного вещества 95.3 и 98 % (мае.) соответственно). Расходные коэффициенты на 1 т N-метиланилина составляют: анилин - 0.91 т, метанол - 0.49 т, Н2 - 0.095 т, катализатор - 3.4 кг.
1Ч-Метиланилин можно получать совместно с анилином каталитическим гидрированием нитробензола в присутствии Си-Сг-ка- тализатора и избытка метанола (до 5 моль на 1 моль нитробензола) при 180-220°С [513].
1Ч-Метиланилин используется для синтеза красителей, медицинских препаратов, стабилизаторов пироксилиновых порохов. Нитрованием К-метиланилина нитрующей смесью получают тетрил - бризантное взрывчатое вещество для капсюлей-дето - наторов и промежуточных детонаторов:
М,. , Г ПК»,*5
Однако наибольшее количество 1Ч-метиланилина применяется в качестве беззольной антидетонационной добавки к бензинам [514, 515]. Эта добавка уступает по антидетонационной активности высокотоксичному тетраэтилсвинцу, но в 10-15 раз превосходит метил-трет-бутиловый эфир и другие кислородсодержащие добавки, содержание которых в реформулированном бензине достигает 15 % (мае.).
Так, добавление 1 % (мае.) ]Ч-метиланилина к бензину АИ-92 позволяет производить неэтилированный бензин АИ-95. Из неэтилированного бензина А-76 при добавлении 2.5-3 % (об.) ]Ч-ме - тиланилина получается бензин АИ-92. Добавка 1-1.3 % (мае.) 1Ч-метиланилина к бензину с октановым числом 69 по моторному методу дает бензин А-76 [512].
1^-Метиланилин может быть получен взаимодействием анилина с диметилкарбонатом в присутствии цеолита типа К-У при 180°С. Конверсия анилина 99.6%, селективность образования К-метиланилина 93.5 % [516].
Алкилирование анилина метанолом исследовано в присутствии цеолитов типа У и X, модифицированных катионами 1л+, Ма+, К+, Ш)+, Сб+ при 400°С. Установлено, что активность и селективность цеолита сильно зависят от его кислотно-основных свойств: на более основных катализаторах, содержащих К+, КЬ ', Св+, в основном образуется 1Ч-мети л анилин, а на более кислых цеолитах - п - и о-толуидины [517].
Аналогично могут быть получены и другие ]Ч-алкилани - лины. Так, взаимодействием анилина с избытком этанола при мольном соотношении 1 : 3 в присутствии катализатора, содержащего 20 % (мае.) Си и 2 % (мае.) Сг на 8Ю2, при 250°С получен ]Ч-этиланилин со степенью чистоты 99 % (мае.) с примесью 0.5 % М,1Ч-диэтиланилина при конверсии анилина 99.5 % [518].
Активность и селективность цеолитов Н-Х, Н-У, Н-7вМ-5 и Н-морденита при парофазном алкилировании анилина этанолом повышается при модифицировании цеолитов У205 [519].
1Ч-Этиланилин используется в синтезе ускорителей вулканизации и инсектицидов.
Алкилированием анилина на металлосиликатах, в которых металлы внедрены в решетку и которые имеют большое число средних по силе кислотных центров, получают с высокой селек
тивностью N, N-диметиланилин [520]. М,1Ч-Диметиланилин применяется в качестве ускорителя отверждения полиэфирных смол, проявителя для цветной фотографии и как промежуточный продукт в производстве красителей - фиолетового кристаллического и малахитового зеленого.
Нитрозированием 1Ч,]М-диметиланилина получают гидрохлорид гс-нитрозодиметиланилина хиноидного строения, из которого при действии щелочи может быть выделено свободное основание [521]: }
<снз)^-<3 [(сн3)2й=^^=шн]сг ■*
__
— (СНз)2К-^^“КО
П-Нитрозодиметиланилин - промежуточный продукт при получении хинониминовых красителей, например нафтолового синего, а также оксазиновых и диазиновых красителей.
N-Изопропиланилин и М-втор-бутиланилин получают в промышленности восстановительным алкилированием нитробензола или алкилированием анилина соответственно ацетоном или метилэтилкетоном при 100-120 °С в присутствии платиновых или палладиевых катализаторов.
Возможно также получение К-алкиланилинов из нитробензола и альдегидов в присутствии в качестве катализаторов N1 Ренея или Рс1 с конверсией нитробензола свыше 90 % [522].
При алкилировании анилина спиртами в присутствии цеолитов типа У и г8М-5 получается смесь К - и С-алкилпроизводных [523]. При увеличении времени контакта и температуры повышается селективность образования С-алкилпроизводных анилина с преобладанием о-изомера. Так, при использовании цеолита Се-У и скорости подачи реагентов 10 мл - ч-1 при 300 °С образование продуктов алкилирования анилина 2-пропанолом происходит со следующей селективностью, %: 1Ч-изопропиланилин - 23.5, о-, п - и диизопропиланилины - 63, 11.2 и 2 соответственно. В аналогичных условиях при снижении температуры до 200 °С М-изопропиланилин и о-изомер получают с селективностью 74.4 и 25.6 % соответственно, однако конверсия анилина при этом снижается с 17 до 4.3 % [524].
Запатентован способ получения п-изопропиланилина парофазным алкилированием анилина 2-пропанолом или пропиленом в присутствии пентасилов типа гБМ-5 или гвМ-Н при мольном соотношении 8Ю/А1203 не более 300. Так, при 300 °С в присутствии цеолита гвМ-5 конверсия анилина и селективность образования д-изопропиланилина составляют 20.5 и 55.1 % соответственно [525]. д-Изопропиланилин является промежуточным продуктом синтеза химикатов для сельского хозяйства.
Взаимодействием эквимолярных количеств анилина и гидрохлорида анилина в присутствии катализаторов (НС1, А1С13, NH4BF4) при 300 °С в промышленности получают с выходом 50- 60 % дифениламин [467].
Дифениламин получают также каталитической конверсией анилина в присутствии у-А1203, промотированного НС1 и Н3В03 [526]:
2C6H5NH2 ^ (C6H5)2NH + NH3
Процесс проводится при 370-460 °С и давлении 10-50.7 кПа. При использовании непромотированного катализатора начальная селективность образования дифениламина составляет 50 %, причем через 2 ч она снижается до 21.7%. Пропитка у-А1203 только НС1 не повышает стабильность катализатора, а промоти- рование Н3В03 или 7 % (мае.) Н3В03 и 7 % (мае.) НС1 снижает скорость дезактивации катализатора - селективность образования дифениламина через 2 ч составляет 97 %. Предложенный катализатор регенерируют через 4-5 ч работы при 500-550°С в токе сухого воздуха и используют вновь.
Запатентовано использование алюмофосфатных катализаторов при получении дифениламина парофазной конденсацией анилина при 430-470°С [527, 528], а также фторборатного катализатора, приготовленного смешением Н3В03 и NH4HF2 при соотношении F : В = 3; в последнем случае температура реакции может быть снижена до 340 °С [529].
Разработан новый процесс производства дифениламина конденсацией анилина с фенолом в мольном соотношении 2 : 1 при 360 °С при пропускании азота в присутствии 8 % (мае.) арилфос - фата в качестве катализатора. Выход дифениламина составляет 55 % [530].
Фирма «Bayer AG» запатентовала способ получения дифе - ниламинов взаимодействием анилина с циклогексаноном или их производных в присутствии Rh или Rh-Pt, нанесенных на А1203, обработанный солями Сг и Мп, а также 1-12 % (мае.) сульфатов или гидроксидов щелочных металлов [452]. Так, при массовом соотношении анилин : циклогексанон = 4:1 и температуре реакции 290 °С получена реакционная смесь следующего состава, % (мае.): дифениламин - 36.4, N-циклогексиланилин - 0.15, фенол - 0.4, анилин - 62.9.
Дифениламин применяют в производстве антиоксидантов для полимеров. Нагреванием дифениламина с серой или хлори-
Фенотиазин используется в качестве антиоксиданта смазоч: ных масел, инсектицида, антигельминта, его производные - как красители (например, метиленовый голубой), лекарственные средства (аминазин, диэтазин, прометазин, этопропазин), ингибиторы полимеризации.
|
Дами серы при 180-250 °С в высококипящих растворителях в присутствии 12 или А1С13 получают фенотиазин (дибензо-1,4-тит азин) [531]: |
![]()
|
Н I |
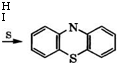 Дифениламин применяется также в качестве стабилизатора термо - и атмосферостойкости нитратов целлюлозы, в том числе пироксилиновых порохов, как промежуточный продукт в синтезе триарилметановых и азокрасителей, как ингибитор коррозии.
Дифениламин применяется также в качестве стабилизатора термо - и атмосферостойкости нитратов целлюлозы, в том числе пироксилиновых порохов, как промежуточный продукт в синтезе триарилметановых и азокрасителей, как ингибитор коррозии.
Нитрозированием дифениламина получают КГ-нитрозодифе- ниламин, который при взаимодействии с НС1 в метаноле перегруппировывается в 4-нитрозо дифениламин:
^імо2 неї //
(С6Н5)2МН —с-Г^ (С6Н5)2К-КО ----------------------------
ГЯ-Нитрозо дифенил амин применяется в качестве замедлителя вулканизации каучуков, вулканизуемых серой. 4-Нитрозоди - фениламин используется в производстве антиоксидантов для каучуков.
При получении дифениламина различными способами возможно образование канцерогенной примеси - 4-аминодифенила. Предложены различные методы очистки дифениламина: обработкой нитрозосоединениями с разрушением 4-аминодифенила
[532] , обработкой моно - или поликарбоновыми кислотами или их производными, например фталевым ангидридом при 250 °С
[533] , бензальдегидом в токе N2 при 150 °С [534], окислением 4-ами - нодифенила воздухом при 2 50 °С или соединениями, выделяющими 02[535], адсорбцией 4-аминодифенила сульфокатионитом, например сульфированным сополимером стирола с дивинилбен - золом [536]. Очищенный дифениламин может использоваться даже в качестве консерванта фруктов.
Взаимодействием анилина и циклогексанола в паровой фазе в присутствии Н2 при 190-250 °С на катализаторе, содержащем 8-30 % (мае.) СиО и 92-70 % (мае.) ZnO, получается КГ-цикло - гексиланилин с селективностью 92.4 % и выходом 81.2 % [537].
Конденсацией Ульмана - взаимодействием анилина и гало - генбензола в присутствии комплексов Си с трет-ампн&мн при 120-150 °С получают триариламины [538]. Конденсация может проводиться в присутствии органического растворителя, гидроксида щелочного металла и медного катализатора, лиганд которого является монодентатным 1-амином или бидентатным трет - амином [539].
Взаимодействием анилина с кислотами, ангидридами или галогенангидридами кислот получают анилиды - 1Ч-ацилзаме - щенные производные анилина. Так, ацетанилид образуется при ацетилировании анилина уксусной кислотой или уксусным ангидридом при 120 °С. Ацетанилид применяется для синтеза промежуточных продуктов в производстве красителей - п-нит - роацетанилида, /г-нитроанилина, /г-фенилендиамина, а также лекарственных средств, например сульфамидных препаратов. Ацетанилид используется также как стабилизатор Н202 и пластификатор нитратов целлюлозы.
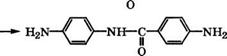
/г-Фенилендиамин - краситель черного цвета для окрашивания меховых изделий - производится восстановлением /г-нитроанилина чугунными стружками в присутствии НС1 при 75-80 °С [540]:
|
|
Конверсия п-нитроанилина составляет 70-75%, реакционная смесь содержит 10-15 % смол. п-Фенилендиамин выделяют фильтрацией от шлама и последующей кристаллизацией.
Взаимодействием анилина с бензойной кислотой при 180- 225°С в промышленности производится бензанилид, использующийся в качестве промежуточного продукта в синтезе красителей. Производное бензанилида - 4,4'-диаминобензанилид получают ацилированием /г-нитроанилина /г-нитробензоилхлоридом в среде ксилола при 140 °С с последующим восстановлением 4,4'- динитробензанилида железом [467]:
^0-ко2
С1
|
|
Низкотемпературной полимеризацией анилина в присутствии протонной кислоты, соли и агента полимеризации получают полианилины [541]. Так, полианилины с высокой молярной массой можно получить при -40 °С в НС1, содержащей достаточное количество 1лС1, чтобы система оставалась жидкой при температуре процесса. В качестве окислителя использовали персульфат аммония в мольном отношении к анилину 0.25 : 1 [542]. Окислительная полимеризация анилина исследована также на цир - конийфосфатсульфофенилфосфонате [543].
Поликонденсацией анилина и формалина в мольном соотношении 1 : 1.5 в водной среде с катализатором - НС1 получают термореактивные анилино-формальдегидные смолы. Смолы выделяют из реакционной смеси, добавляя 25 %-й водный раствор ЫаОН. Отверждение термореактивной смолы сопровождается образованием сетчатых структур типа [544]:
—кн— с6н4— сн2—кн-с6н3-сн2— г1
СН2 »
Термопластичные анилино-формальдегидные смолы получают взаимодействием эквимолярных количеств анилина и формальдегида в нейтральной или слабокислой среде. Образующийся ангидроформальдегиданилин далее нагревают при 130-180 °С с минеральными или органическими кислотами:
/С6Н5
|
—N—СН2- С6н5 |
![]() /СН2-КЧ пС6Н5^ /СН2
/СН2-КЧ пС6Н5^ /СН2
СН2—N.
Термореактивные анилино-формальдегидные смолы используются в основном в качестве отвердителей эпоксидных смол. Феноло-анилино-формальдегидные смолы применяются как связующие в электротехнических изделиях.
Модифицированные термопластичные смолы, полученные взаимодействием ангидроформальдегиданилина с фракцией 250- 270 °С растительных масел или с фракцией 230-240 °С жирных кислот, применяются как пленкообразователи электроизоляционных лаков.
Окислением анилина пиролюзитом (Мп02) в Н2804 получают д-бензохинон, последующим восстановлением которого желез
ным порошком производится гидрохинон [545]. Окисление анилина пиролюзитом проводится при 3-10 °С, возможно в качестве окислителя использовать также Ма2Сг207 в Н2в04 при 20 °С. Выход гидрохинона в промышленном процессе составляет 60-70 % на анилин, причем основные потери сырья приходятся на стадии синтеза и выделения д-бензохинона. Для снижения выхода олигомеров /г-бензохинона предложено снизить продолжительность процесса до 3-4 ч, прекращая его после достижения концентрации гс-бензохинона в реакционной смеси 3.5-4 %.
/г-Бензохинон применяется также в производстве красителей и как дубящее вещество.
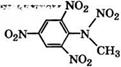
Взаимодействием анилина с 2,4-динитрохлорбензолом в спиртовой или водной среде получают динитродифениламин и нитрованием последнего - бризантное взрывчатое вещество гек - сил(2,2',4,4',6,б'-гексанитро дифениламин) [350].
Изомеризацией анилина в присутствии цеолитов типа гвМ-5 или Оа-МП в присутствии МН3 при 400 °С и оптимальном давлении 2-2.5 МПа получают а-пиколин, причем более активен цеолит Оа-МЕ1. Установлено, что цеолит В-МИ обладает слишком слабой кислотностью для проведения перегруппировки, а цеолит Ее-МИ нестабилен в присутствии 1ЧН3 [546]. а-Пиколин применяется для получения а-винилпиридина и пестицидов.
Из анилина и этиленгликоля в присутствии бинарных катализаторов Сс1Вг2-КВг и РЫ2-К1 получается индол, причем катализатор на основе С<1 отличается большим сроком службы [547].
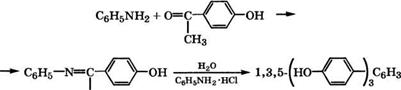
Взаимодействием анилина с 4-гидроксиацетофеноном через анил при нагревании с водой и катализатором (солью анилина или нафтиламина) при 190-200°С может быть получен 1,3,5- трис(4-гидроксифенил)бензол [548]:
|
СН3 |
Конденсацией выделенного продукта с формальдегидом, ангидридами кислот или эпихлоргидрином получают смолы.
Цианэтилированием анилина или его производных акрило - нитрилом при 80-200 °С в присутствии отбеливающих земель (монтмориллонита, бентонита) как катализаторов получают мо- но-М-(Р-цианэтил)анилины [549].
Анилин может быть получен одностадийным синтезом окислительным аминированием бензола с использованием молекулярного кислорода как окислителя. Катализатором служит металл (V, Nb, Си, Pd, Ni, Ag), нанесенный на подложку - оксиды металлов, молекулярные сита, глины. В качестве промотора можно использовать моно - или биядерные лиганды, содержащие нитро - или нитрозогруппы и, возможно, амидную группу. Катализатор может также включать соединения бария. Процесс ведут при температуре 250-320 °С и давлении 3.5-6.3 МПа [550].
•

 Опубликовано в
Опубликовано в