Превращения В алюмоферритных системах
 4 ноября, 2011
4 ноября, 2011  admin
admin При исследовании системы СаО—А1203—Fe20:i в 1928 году Хансеном, Браунмиллером и Боггом был впервые получен четы - рехкальциевый алюмоферрит, или браунмиллерит, который в течение длительного времени рассматривался как соединение определенного состава 4СаО • А1203 • Fe2G3, плавящееся при температуре 1450°С [181]. Торопов с сотрудниками [178] при изучении частной системы C4AF — С5А3 установили образование в ней твердого раствора с предельным содержанием 30 мол. % С6А3, состав которого отвечает формуле 48СаО • • 16А1203 • 7Fe203. В последующем в качестве предельных указывались следующие составы: Q, в7А2,33F[182]; C6A2F [183]; C8A3F [184]; [185]; [186];
^6^35^175^ [187].
Образование твердых растворов алюмоферритов обычно рассматривают как процесс замещения в решетке C2F ионов Fe3+ ионами А13+. При замещении Fe3+ на А13+ происходит сжатие решетки, поскольку ион А13+ имеет меньший радиус по сравнению с ионом Fe3+, 0,51 и 0,64 А соответственно [188]. Структура двухкальциевого феррита является орторомбической [189], и твердые растворы алюмоферритов кальция сохраняют эту сингонию. В решетке C2F наблюдается чередование слоев октаэдров Fe06 со слоями тетраэдров Fe04. Если представить составы алюмоферритов кальция в виде C4ApF,.p, где р изменяется от 0 до 0,7, то по данным [190] А1 замещает Fe сначала в тетраэдрических позициях до р = 0,33, а затем равномерно в тетраэдрической и октаэдрической позициях. Авторы работы [191] получили, что при 0,25 < р < 0,66 распределение Fe3 + имеет одинаковый характер.
Мальквори и Чирилли [І92] указывали на то, что в кристаллической решетке твердых растворов типа 2CaO(Fe, А1)03 может вероятнее всего наблюдаться тетраэдрическая координация алюминия. Авторы считают, что т. к. во всей области твердых растворов постоянные решетки являются линейными функциями количества замещенных атомов Fe, замещение последних атомами алюминия происходит не избирательно, а статистически. Бойкова и др. [193] «изучавшие распределение трехвалентного железа в твердьи^Щтворах алюмоферритов методом ЯГР - спектроскопии, пришли к выводу, что до 18 масс.% Fe203 наблюдается равШмерное распределение Fe3+ по октаэдрической и тетраэдрм|рс» позициям.
79
До настоящего времени остаехдд JMinirr спорным вопрос относительно того, существуют л^Нщи приведенных выше составов алюмоферритов кальция индавидуальные соединения, или все они являются лишь членами в непрерывном ряду твердых растворов. Так, М. Швейзе [194] в результате изучения тройной системы СаО—А1203 — Fe203 указывает, что «высокотемпературные точки плавления на пограничной кривой между полями С3А и железистой фазы находятся там, где двойные точки С3А—C6A2F и С3А—C4AF пересекают эту кривую. Точки на пограничной кривой между этими пересечениями имеют несколько более низкие конечные температуры плавления. С этой точки зрения C6A2F и C4AF являются скорее индивидуальными соединениями, чем простыми членами ряда твердых растворов».
Однако Мальквори и Чирилли [192] опровергают эти доводы М. Швейзе, основываясь на том, что если бы C4AF был индивидуальным химическим соединением, то все атомы А1 и Fe в нем обладали бы четко выраженной координацией, но при образовании твердых растворов промежуточных составов они могут сменить октаэдрические позиции на тетраэдрические.
Вопросам изучения состава алюмоферритной фазы в клинкере посвящено значительное количество работ [195—208]. Поданным Миджлей [209], алюмоферритная фаза в различных клинкерах может иметь переменный состав от C6A2F до C6AF2. Авторы [210] пришли к выводу, что состав алюмоферритной фазы в клинкере приближается в среднем к C4AF. В [211] указывается на то, что не только меняется отношение A:F в алюмоферрите, но оно непостоянно по всей массе кристалла. Волконский и Жмодикова [212], исследовав промежуточную фазу ряда промышленных и синтезированных клинкеров методом ИКС, пришли к выводу, что состав алюмоферритов кальция находится в пределах C4AF—C6AF2, приближаясь, однако, к C4AF. Хорнен [213], проведя анализ ферритной фазы 10 промышленных клинкеров с помощью микрозонда, установил, что отношение A/F в алюмоферритах кальция промышленных клинкеров колеблется около величины 1,5±0,2 при A/F молярных клинкера выше 3. По данным С. И. Иващенко и др. [197, 196], алюмоферритная фаза бездобавочного клинкера приближается к составу C5A,,5F.
В работах [214, 195—197] указывается на то, что состав алюмоферритной фазы в клинкере может изменяться в зависимости от температуры. С. И. Иващенко и др. [195—197] связывают также изменения в составе алюмоферритов кальция
80
С перестройкой «структуры» жидкой фазы, которая может происходить под действием температурного или концентрационного факторов в соответствии с кислотно-основным равновесием в расплаве. При введении в расплав добавок, проявляющих кислотные свойства, возрастает число октаэдрически координированных ионов А1 nFe, в результате при резком охлаждении из расплава выкристаллизовываются обогащенные оксидом а л ю м и н и я а л ю м о ф е р р и т ы к а л ь ц и я. Медленно е о х л а ж д е н и е клинкера или ввод в сырьевую смесь добавок, проявляющих основные свойства, приведет, по мнению этих авторов, к повышению концентрации в расплаве тетраэдрических группировок А104 и ГеОэ4~ и кристаллизации обедненных оксидом алюминия алюмоферритов кальция.
Однако Астреева [215] отмечает, что медленная скорость охлаждения клинкера в интервале температур 1450—1250°С способствует образованию алюмоферритов кальция состава
QA2F.
Авторы [216, 217] при закалке расплава от 1450° зафиксировали C4AF, а при медленном охлаждении состав алюмоферритной фазы изменялся в широких пределах от C6A2F до C6AF2.
Температура и характер плавления и кристаллизации алюмоферритов кальция в равновесных и неравновесных условиях представляют определенный интерес для технологии производства портландцемента, а также глиноземистого и железистых цементов. Как отмечалось выше, предельный состав алюмоферритов кальция до настоящего времени остается спорным. В связи с этим [170, 171, 174] сделана попытка в определении предельной концентрации иона А13+ в твердом растворе CaL)Fe?(1 . Alov05 расчетным путем, исходя из магнитных свойств данного антиферромагнетика при разбавлении его диамагнитным ионом. При этом принималось, что структура твердого раствора алюмоферрита кальция остается неизменной и соответствует Ca2Fe205 до тех пор, пока сохраняется вероятность протекания по связям Fe—О—Fe. При полном разрыве указанных связей, вследствие внедрения диамагнитного иона АІ3+ уже не в состоянии сохраниться матричная структура Ca2Fe205, произойдет выделение новой избыточной алюминат - ной фазы.
Известно, что двухкальциевый феррит имеет орторомби - ческую структуру с постоянными решетки а = 5,32 А; в = = 14,6 А; с = 5,58 А; X — 4 [218]. Структурная формула Ca2[Fe] (Fe)Os. Особенность структуры феррита состоит в наличии двух неэквивалентных позиций для ионов Fe3 +—октаэдри-
81
Ческих и тетраэдрических. Вдоль оси слои октаэдров чередуются со слоями тетраэдров. В результате магнитных, нейтроно - графических и ядерногаммарезоиансных исследований установлена магнитная структура двухкальциевого феррита [162, 219, 482]. Показано, что в слоях октаэдров и тетраэдров спины ионов Fe3+ антиферромагнитно упорядочены, между слоями взаимодействие также антиферромагнитно.
При определении вероятности протекания по связям Fe— О—Fe распределение железа по тетраэдрическим и октаэдри - ческим позициям в твердых растворах алюмоферритов кальция рассчитывали из эмпирического выражения Fe,. / (Fe, + - fFe0)=0,5—0,35х, полученного А. И. Бойковой, С. П. Екимо - вым, Л. В. Грищенко, где х—концентрация диамагнитного иона А13+ [193].
Вероятность протекания для решетки Ca2Fe205 находили численным моделированием диамагнитного разбавления на блоке, состоящем из 10X10X10 узлов, заполняя случайным образом октаэдрические и тетраэдрические позиции ионами Fe3+ с концентрацией F^ и Fe,. соответственно. С увеличением х вероятность выхода ионов Fe3+ на границу блоков уменьшалась, кроме того, внутри блока могли не выполняться условия протекания. Поэтому вероятность протекания определяли из соотношения P = Nmax / N(x), где Nmax—число связанных ионов Fe3+, имеющих выход на грани, N(x) —общее число всех ионов Fe3i~. Полученные зависимости вероятности протекания по связям Fe — О — Fe от концентрации диамагнитного иона А13+ показали (рис. 37), что в интервале 0 < х ^ 0,5 почти все ионы Fe3+ образуют связанную систему. Резкое уменьшение вероятности протекания начинается для концентрации х>>0,6, достигая нулевого значения при х = 0,68 ± 0,02, которая и является критической для магнитного концентрационного фазового перехода в решетке двухкальциевого феррита. Если принять значение х = 0,7, то предельный состав твердого раствора алюмоферрита кальция будет Q67A223F, что хорошо согласуется с данными исследователей [182, 186].
Для исследований свойств, процессов плавления и кристаллизации алюмоферритов кальция синтезировались твердые растворы следующих составов: C8A3F; C7A25F; C6A2F; C5A15F; C4AF; C5AF15; C6AF2; C2F.
Смеси готовились из карбоната кальция и оксида железа марок «осч» и спектрально чистого оксида алюминия. Алю - моферриты получали плавлением смеси в платиновых тиглях,
82
|
|
№
О, в
0,6
Рис. 37. Зависимость вероятности протекания Р(х) от концентрации диамагнитного иона х для решетки двухкальциевого феррита.
--- 1-- 1-- а-- 1------ 1—ОІА
О 0,2 0,4 0,6 X
Предназначенных для ДТА. Для обеспечения однородности состава и получения воспроизводимых результатов каждый образец в процессе термического анализа подвергался 3—4- кратному нагреванию и охлаждению в интервале температур 1200—1500°С (рис. 38). Результаты считались достоверными при совпадении двух последовательных кривых ДТА.
В процессе циклического нагрева и охлаждения вещества каждый раз при плавлении масса образца несколько уменьшалась, а при кристаллизации — вновь восстанавливалась. Указанная зависимость в большей степени проявлялась у обо - гащенных оксидом железа фаз. Это дает основание предполагать, что при плавлении часть оксида железа (около 2%) переходит в закисную форму, а при кристаллизации — вновь в окисную.
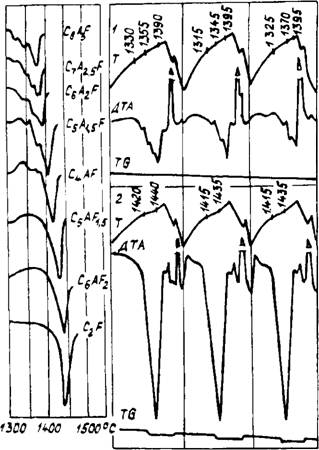
Полученные нами кривые ДТА алюмоферритов кальци^ ряда C8AsF—C2F представлены на рис. 38, Установлено, ^ что температура плавления в ряду СвА3г—C2F возрастает с увеличением содержания оксида железа в смеси от 1375 до 1440°С, что согласуется с данными М. Швейзе 1183]. Процесс плавления обогащенных оксидом алюминия составов сопровождается наличием 3—4 эффектов, особенно четко повторяющихся при температурах около 1345 и 1375°С. Наличие нескольких повторяющихся эндотермических эффектов при плавлении алюмоферритов кальция может быть обусловлено неравномерным распределением оксида алюминия в структуре двухкальциевого феррита, на возможность такого распределения указывали авторы [211]. Проведенные нами с помощью ЯГР-спектро - скопии исследования, подтверждают наличие в составе алюмоферритов кальция областей, обогащенных и обедненных оксидом железа (рис. 39, а). Действительно, значительная ве-
Рис. 38, Результаты термического анализа алюмоферритов кальция (а) и C, A_>F (1) и C()AFl» (2), полученных в режиме последовательного нагрева и охлаждения (б)
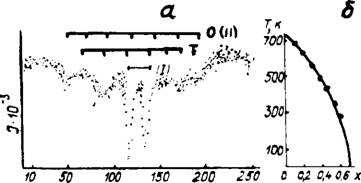
Личина дуплета (1) свидетельствует, что часть алюмоферритов кальция при комнатной температуре перешла из антиферромагнитного в парамагнитное состояние. Состав твердых растворов алюмоферритов кальция контролировался по изменению температуры Нееля от концентрации диамагнитного иона д|3+ [174^ 219]. Как показывают расчетные данные, точка Нееля для комнатной температуры в 290 ± 10 К соответствует составу C4,88Ab44F (рис. 39, б). Точками показаны экспериментальные данные при Ft = 1,4. Таким образом, характер ЯГР-спектра свистельствует, что при валовом составе C4AF часть алюмоферритов кальция имеет состав с содержанием ионов железа меньше, чем в C4f88A|44Ff основная же масса содержит Fe3+ несколько более, чем в C4AF.
|
|
|
Рис. 39. ЯГР-спектр CiAF (а) и зависимость температуры Нееля от концентрации х диамагнитного иона алюминия (б) I— область, обогащенная оксидом алюминия; II— область, обогащенная оксидом железа. |
Кристаллизация расплавов алюмоферритов кальция проходит с переохлаждением на 40—60°С и сопровождается саморазогревом смеси на 10—Э0°С. В связи с тем, что процессы плавления и кристаллизации алюмоферритов кальция при обжиге клинкера протекают одновременно с процессом образования гранул, указанные особенности могут существенно усложнить ход процесса агрегирования.
В реальных промышленных условиях имеются не предварительно синтезированные фазы, а сырьевые компоненты, при нагревании которых вследствие неравновесности процессов могут изменяться состав фаз и температура их плавления. Кроме того, существенное влияние на характер процессов плавления и кристаллизации алюмоферритов кальция могут оказывать щелоче - и серосодержащие примеси, которые входят в состав жидкой фазы.
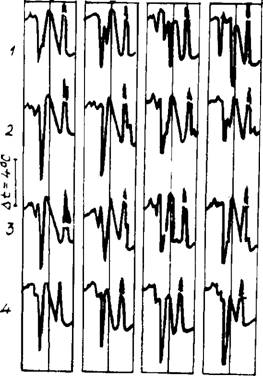
В связи с этим исследовались плавление и кристаллизация смесей, рассчитанных на получение алюмоферритов кальция, без добавок и с добавками в количестве 3% Na20, К20 и S03, которые вводили в виде карбонатов щелочей и сульфата кальция. На термограммах смесей (рис. 40) при температурах выше 1000°С наблюдаются экзоэффекты, соответствующие образованию низкоосновных алюминатов и ферритов кальция в твердой фазе. На кривых ДТА составов C8A;iF и C6A2F имеется по два четко выраженных экзоэффекта, а у составов CjAF и C(iAF2 - по одному.
Процесс плавления проходит в несколько стадий, но при переходе от высокоалюминатных составов C8A3F и CeA2F к высокожелезистым C4AF и CeAF2 количество эндоэффектов плавления возрастает. На дериватограммах CgA3F и CeA3F,
85
|
|
|
CiAif C$AaF CSAFI |
|
Рис. 40. Превращения алюмофер - ритных смесей различного состава При нагревании и охлаждении. I—без добавки; 2, 3, 4—с добавками 3% Na2Of К20 и SO3 |
1Ю0 1500 W0 11001500 Н00 Ш (SDC Н001Ю0 #00 1100
Кроме конечного эндоэффекта, соответствующего полному плавлению указанных составов, появляется дополнительный эффект плавления в интервале 1330—1340°С, что, по данным Дайала и Глассера [215], соответствует плавлению эвтектики в системе С12А7 — СА — C2F и, следовательно, свидетельствует об образовании этих фаз до указанной температуры. При нагреве высокожелезистых составов первый эффект плавления появлялся в области 1200°С, что соответствует эвтектике в системе СА—CF—C2F. Для богатых алюминием составов температура начала плавления сырьевых смесей фактически совпадала с температурой эффектов, наблюдаемых при нагреве предварительно синтезированных фаз, и находилась в области температур несколько выше 1300°С. С повышением содержания оксида железа в смеси начальные эффекты плавления появлялись в области 1200°С, т. е. при значительно более низких температурах по сравнению с плавлением предварительно синтезированных высокожелезистых фаз и даже ниже температур плавления высокоалюминатных составов.
Таким образом, если система находится в равновесии, температура плавления алюмоферритов кальция возрастает с
86
Повышением в их составе оксида железа. В том случае, когда нагреванию подвергаются сырьевые смеси, с увеличением содержания оксида железа в смеси в результате твердофазных реакций и образования ферритов кальция, а, следовательно, неравновесности системы, происходит не повышение, а понижение температуры плавления расплава. Этим явлением отчасти могут быть объяснены противоречивые мнения относительно температур плавления алюмоферритов кальция. У всех составов наблюдалось переохлаждение расплавов и интенсивная кристаллизация, что может приводить к термическим напряжениям, оказывающим влияние на структуру алюмоферритов кальция и в конечном итоге клинкерной гранулы.
Добавки щелочных оксидов и серного ангидрида изменяют температуру и характер плавления алюмоферритов кальция (рис. 40). В присутствии Na20 температура плавления снижалась в среднем на 30—50°С.
Как и у бездобавочных алюмоферритов, в присутствии добавок температура начальных эффектов плавления снижалась по мере обогащения системы оксидом железа, а полное плавление составов, напротив, происходило при более высоких температурах. При добавлении щелочных оксидов к высоко - алюМинатным составам наблюдались два эндоэффекта плавления, однако изменилось их соотношение. Если у бездобавочных смесей болыцим по величине был первый эффект, то в присутствии добавок он уменьшался. Это свидетельствует о раннем образовании и плавлении в присутствии щелочей более обогащенных оксидом железа алюмоферритов кальция.
Добавка К30 снижала температуру плавления на меньшую величину, чем Na20. Это объясняется более интенсивным взаимодействием в смеси, что подтверждается большей величиной эндотермических эффектов в области температур 1350°С. Следовательно, при введении К20 система ближе находится к состоянию равновесия, в результате чего температура плавления повышалась. При введении щелочных оксидов в высокожелезистые составы количество эндоэффектов плавления увеличивается.
Добавка серного ангидрида в меньшей степени снижала температуру плавления алюмоферритов кальция. При этом наблюдалась существенная возгонка S03, степень которой возрастала у богатых оксидом железа составов. Расчеты, сделанные по кривым потери массы, показали, что из расплава C4AF возгонялось 1,8% S03; CeA2F — 1,2% hC8A3F — 1% S03. Приведенные цифры свидетельствуют о предрасположенности и
87
Более легком взаимодействии серного ангидрида с алюминатной фазой.
Б процессе кристаллизации алюмоферритов с добавкой оксида натрия наблюдались два эффекта, причем величина второго эффекта существенно снижалась при переходе от высоко - алюминатных составов C8A3F и C6A2F к обогащенным оксидом железа C4AF и CeAF2. Это связано с образованием щелоче - содержащей фазы NC8A3, количество которой снижалось с уменьшением содержания оксида алюминия в смеси. При кристаллизации расплавов с добавкой К20 у обогащенных оксидом алюминия составов наблюдалось также по два эффекта, что, вероятно, связано с образованием калийсодержаїцей алюминатной фазы.
Анализ фазового состава смесей на получение алюмоферритов кальция с добавками, нагретых до температур, превышающих температуры эндоэффектов плавления, показал, что в образцах с добавками щелочных оксидов присутствуют в значительном количестве неусвоенный оксид кальция и более обогащенные оксидом железа алюмоферриты. Например, в образце смеси состава C8A3F с добавкой Na20, нагретого до температуры 1300°С, присутствовал алиомоферрит кальция состава, близкого к C6AF2 (1,933 и 2,652 А). При нагреве указанной смеси до температуры 1350°С, превышающей температуру полного плавления, в спеках появлялся трехкальциевый алюминат, количество СаОсв уменьшалось, алюмофероит кальция по составу приближался к C6A2F (1,916 и 2,637 А). Идентичные превращения наблюдались в смеси с добавкой К20.
В присутствии серного ангидрида также происходило образование более обогащенных оксидом железа алюмоферритов кальция вследствие вовлечения части А1203 в соединение 3(СА) - CaS04.
Выполненные нами исследования скорости движения материала по длине промышленных вращающихся печей показали, что в зависимости от режима обжига может существенно изменяться время пребывания обжигаемого материала в отдельных зонах. Так, в зоне спекания печи длиной 185 м длительность пребывания клинкера при оптимальной грануляции и клинкерном пылении изменяется, от 25 до 75 мин, т. е. наблюдается различная скорость охлаждения в области температур кристаллизации расплава. Поэтому исследовано влияние режима охлаждения в интервале температур 1450—1100°С на фазовый состав и свойства алюмоферритов кальция.
Смеси, рассчитанные на получение алюмоферритов кальция
88
Ряда C8A3F— C6A2F—C4AF—C6AF2—C2F, нагревали в платиновых кюветах в лабораторной силитовой печи до температуры 1450°С. Полученные расплавы подвергали охлаждению по трем режимам: 1) от температуры 1450 до 1100°С равномерно в течение 75 мин в печи, затем на воздухе; 2) в том же интервале температур в течение 25 мин в печи, затем на воздухе; 3) закалка в воде со льдом от температуры 1450°С.
При резком охлаждении расплавов в воде со льдом образцы составов C8A3F, C6A2F и C4AF получены в стеклообразном состоянии. На рентгенограммах образцов 75-минутного режима охлаждения (рис. 41) с увеличением содержания оксида железа н а б л ю д а л ось смещение отра жен ни в сторон у б о л ь ш! і х значений межплоскостных расстояний от 1,910 и 2,622 А у С8А3Р до 1,944 и 2,675 А у C2F. Кроме того, на рентгенограммах возрастала высота фона, что обусловлено увеличением относительного содержания оксида железа в ряду C8A3F—С2Р. Значительные различия в высоте фона наблюдались также на рентгенограммах каждого состава в зависимости от режима охлаждения.
Минимальной высотой фона характеризовались рентгенограммы образцов, подвергнутых 75-минутному режиму охлаждения. По мере увеличения скорости охлаждения расплава высота фона также возрастала.
Как известно, высота фона на рентгенограммах зависит от
Св^ CЂAzF CtAF
89
Содержания оксида железа и рентгеноаморфного стекла. Поэтому при анализе рентгенограмм образцов одного состава, подвергнутых различной скорости охлаждения, можно сделать вывод о том, что наблюдаемые отличия в высоте фона связаны с различным содержанием стекловидной фазы, что было подтверждено дополнительными опытами. В зависимости от скорости охлаждения менялось не только соотношение количества стекловидной и кристаллической фаз, но и состав последней. На рентгенограммах образцов, подвергнутых 25-минутному охлаждению, наблюдалось смещение дифракционных максимумов в сторону больших значений межплоскостных расстояний (рис. 41). Это может быть объяснено тем, что при образовании непрерывного ряда твердых растворов кристаллы содержат по сравнению с жидкостью в большем количестве тот компонент, добавление которого повышает температуру плавления твердой фазы. Применительно к нашим составам, если рассмотреть диаграмму состояния частной системы СаО—С5А3— C2F, изученной Швейзе [183], твердая фаза обогащается железосодержащим компонентом, повышающим температуру плавления алюмоферритов кальция в ряду тведдых растворов. В условиях замедленной скорости охлаждения, когда создаются условия для постепенной полной кристаллизации жидкой фазы, образующаяся кристаллическая фаза имеет тот же состав, что и исходная жидкая фаза. При более быстрой скорости охлаждения, когда не вся жидкая фаза выкристаллизовывается, а часть ее остается в стеклообразном состоянии, образующаяся кристаллическая фаза в соответствии с диаграммой состояния будет обогащена оксидом железа, а стекловидная — оксидом алюминия.
Добавки щелочных оксидов разлагают алюмоферритную фазу с образованием щелочесодержащей алюминатной фазы и алюмоферритов кальция, обогащенных оксидом железа. В фазовом составе образцов, полученных из смесей с повышенным содержанием оксида алюминия, в наибольшем количестве присутствовала щелочесодержащая фаза NC8A3. Наряду с выделением соединения NCeA3 алюмоферритная фаза приобретала зональное строение с наличием в структуре участков, характеризующихся различным соотношением A/F. Это подтверждается исследованиями структуры алюмоферритов кальция методом ЯГР-спектроскопии, которые показали наличие отдельных областей, отличающихся отношением A/F и различным количеством тетраэдрических и октаэдрических комплексов Fe3 +
90
В присутствии добавок щелочных оксидов, понижающих температуру плавления, все составы алюмоферритов кальция при резком охлаждении в воде со льдом получены в стеклообразном состоянии. На рентгенограммах образцов, подвергнутых охлаждению по 1-му и 2-му режимам, наблюдались отличия в высоте фона: для высокожелезистых составов наблюдается та же зависимость высоты фона на рентгенограммах от режима охлаждения, что и у бездобавочных образцов. На рентгенограммах алюмоферритов кальция составов C8A3F и C6A2F высота фона наоборот больше у образцов 75-минутного режима охлаждения. Это может быть объяснено тем, что в условиях 75- минутного режима охлаждения щелочесодержащая фаза NC8A3 образуется в большем количестве, и при этом выкристаллизовывается соответственно более обогащенная оксидом железа алюмоферритная фаза. Так, например, при 75-минутном охлаждении состава C8A3F с добавкой Na20 выкристаллизовываются алюмоферриты кальция, близкие по составу к C4AF (2,640 и 1,920 А), а при 25-минутном охлаждении — близкие к составу C6A2F (2,637 и 1,916 А).
Установленные изменения в фазовом составе, происходящие в зависимости от режима охлаждения и наличия примесей, могут оказать существенное влияние на физические свойства алюмоферритов кальция и промежуточной фазы клинкера. Поэтому определялись плотность, макроструктура и прочность полученных образцов.
Плотность алюмоферритов кальция рассчитывали по данным рентгеноструктурного анализа [220]. Константы решеток, рассчитанные по РФА и определенные гидростатическим взвешиванием значения плотности, приведены в табл. 18, 19.
|
Т а б л и ц и 18 Константы решетки и плотность алюмоферритов кальция
|
91
|
Влияние режима охлаждения на плотность алюмоферритов кальция Таблица 19
|
|
Резкое 3,04 3,12 3,10 3,09 3,18 3,19 3,71 3,16 3,30 3,81 3,19 3,50 |
Если сравнить расчетные и экспериментальные значения плотности, то только лишь для соединения CpF они имеют близкие значения, различающиеся на 0,01 г/см Плотности алюмоферритов C8A3F и C6A2F меньше расчетных значений. При этом следует отметить, что как экспериментальные, так и расчетные плотности указанных составов имеют близкие величины 3,41 и 3,42 г/см3; 3,53 и 3,57 г/см3 соответственно.
При переходе к более обогащенным оксидом железа составам наблюдалось изменение плотности, причем для алюмоферритов C4AF и C6AF2 фактические значения плотности оказались выше расчетных.
Анализируя изменение плотности алюмоферритов кальция в заі|йсимости от режима охлаждения (табл. 18), следует отметить,4 что разница в плотности кристаллических и стекловидных составов C8A3F и C6A2F выше, чем у образцов C4AF и C6AF2. Например, плотность кристаллического C6A2F на 8,5% выше плотности в стеклообразном состоянии, а для состава C4AF эта разница составляет лишь 0,2%. Отсюда следует, что кристалл и* зация обогащенных оксидом алюминия составов сопровождается существенным изменением объема и может приводить к разрыхлению структуры клинкерных зерен.
Величина плотности образцов 25-минутного режима охлаждения занимает промежуточное положение между значениями плотности образцов 1-го и 3-го режимов охлаждения, что подтверждает наличие в них некоторого количества стекловидной фазы.
Добавки щелочных оксидов приводят к снижению плотности образцов 75- и 25-минутного режимов охлаждения, причем К20 — в большей степени, чем Na20. Плотность стекловидных образцов C8A3F и C6A2F с добавками выше плотности бездобавочных составов, а плотность же стекловидных C4AF и C6AF2 в присутствии добавок снижалась. Наблюдаемое влияние добавок может быть объяснено следующим образом. Щелочные оксиды, как было установлено, разлагают алюмоферритную фазу с выделением из неё алюминатной составляющей, которая, как известно [39], характеризуется значительно более низкими значениями плотности 3,0—3,04 г/см3. Ионы Na+ и К+, имеющие ионные радиусы 0,97 и 1,33 А соответственно, могут частично входить в виде твердого раствора в решетку алюмоферритов кальция, способствуя её расширению. Кроме того, указанные добавки, как было установлено методом ДТА, существенно снижали температуру плавления алюмоферритов каль-
C, ASF CtA, F C4AF C,&Ft
|
Рис. 42. Макроструктура спеков алюмоферритов кальция без добавки (1); с добавкой 3% NaO (2); 3% SO( в C,,AFj (3), при кристаллизации расплава C4AF толщиной слоя 5 мм и CeAFu—1 мм (3) |
Ция, что облегчает получение стеклофазы в созданных условиях охлаждения.
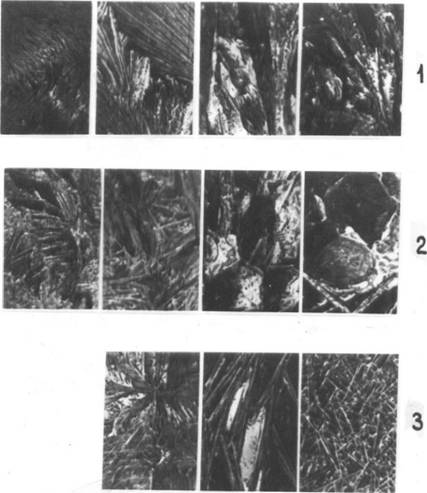
Установленное резкое изменение в фазовом составе и плотности алюмоферритов кальция, наблюдаемое в различных условиях охлаждения или в присутствии примесей при переходе от обогащенных оксидом алюминия составов C8A3F и C6A2F к обогащенным оксидом железа C4AF и C6AF2, подтверждают особенности макроструктуры кристаллических алюмоферритов кальция указанного ряда. На фотографиях (рис. 42) видно,
94
Что расплавы алюмоферритов кальция кристаллизуются в виде игл и волокон, при этом в массе образца возникают пустоты и полости. Характер кристаллизации составов CgA3F и C6A2F отличается от характера кристаллизации C4AF и C6AF2. Вы - сокоалюминатные составы характеризуются тонковолокнистой структурой кристаллов. Составы C4AF и C6AF2 представлены крупными волокнистыми кристаллами. Добавки Na20, К20 и S03 приводят к существенному изменению структуры образцов.
Кроме того, важную роль играет количество кристаллизующегося расплава. Так, при кристаллизации расплава состава QAF2, покрывающего слоем толщиной около I мм платиновую подложку, структура образца имела вид переплетенных тонких кристаллов. Для сравнения показана структура четырехкаль - циевого алюмоферрита при кристаллизации расплава толщиной 5 мм. Если учесть тот факт, что кристаллизация расплавов алюмоферритов кальция в присутствии щелочных добавок проходит в несколько этапов, о чем свидетельствует наличие 2—3 экзоэффектов на кривых ДТА при охлаждении (рис. 40), то можно предположить, что в клинкерах может иметь место существенное изменение структуры алюмоферритов кальция в зависимости от режима охлаждения и количества остаточной жидкой фазы, что окажет влияние на прочностные свойства клинкерных гранул.
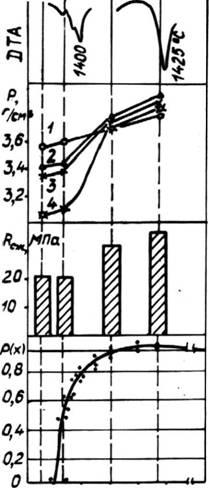
Определение прочности на сжатие спеков алюмоферритов кальция C8A3F, C6A2F, C4AF, C6AF2 показало, что она также в значительной степени зависит от состава, причем при переходе к обогащенным оксидом железа фазам прочность возрастала от 21,5 МПа до 32,5 и 37,5 МПа у составов C4AF и C6AF2 соответственно (рис. 43).
Изменения, наблюдаемые в структуре и свойствах алюмоферритов кальция при переходе от состава C6A2F к C4AF, можно объяснить, исходя из структуры элементарных ячеек указанных твердых растворов. В соответствии с данными [190], при образовании твердых растворов алюмоферритов кальция, выражаемых общей формулой C2ApF,_p, алюминий замещает ионы железа вначале в тетраэдральных слоях до р = 0,33, а затем распределяется равномерно между тетраэдрами и октаэдрами. В составе C4AF 1/4 атомов железа заменены атомами алюминия в октаэдрической координации и 3/4 — в тетраэдрической. Так как и в дальнейшем алюминий будет заметать железо равномерно в обеих координациях, то при достижении состава C6A2F все атомы железа в тетраэдрической координации будут замещены
95
|
|
|
|
|
Рис. 43. Изменение макроструктуры, ДТА, плотности, рассчитанной по РФА (1) и определенной пикнометрически (2—4), прочности спеков алюмоферритов кальция и вероятности протекания Р(х) по связям Fe—О—Fe. Скорость охлаждения от 1450°С 5°С/мин (2), 15°С/мин (3) и в воде со льдом (4). |
|
И 0,7 0,6 0,5 о, и аз, о Концентрация uohod At |
Атомами алюминия, и последующее внедрение атомов алюминия в решетку твердого раствора будет происходить только по октаэдрическим позициям. Кроме того, структурные изменения алюмоферритов при переходе от C4AF к C6A2F могут быть также связаны с тем, что при комнатной температуре указанный переход сопровождается переходом антиферромагнетика в парамагнитное состояние.
Этим структурным фактором обуславливается, по нашему мнению, не только резкое изменение свойств в ряду бездобавочных алюмоферритов кальция, но и изменения в структуре и
96
Свойствах композиций, происходящие под влиянием добавок. В зависимости от смещения кислотно-основного равновесия в расплаве, вызываемого свойствами введенных добавок, возможно образование алюмоферритов кальция одинакового состава с различным соотношением тетраэдрических и октаэдрических комплексов AI и Fe.



 Опубликовано в
Опубликовано в