ПОВЕРХНОСТНЫЕ ЭЛЕКТРОХИМИЧЕСКИЕ СВОЙСТВА ДРЕВЕСНОЙ ЦЕЛЛЮЛОЗЫ И ДРУГИХ ЦЕЛЛЮЛОЗНЫХ МАТЕРИАЛОВ
 22 марта, 2013
22 марта, 2013  admin
admin Поверхностные свойства целлюлозы имеют большое практическое и теоретическое значение. При размоле и проклейке бумажной массы, наполнении и образовании листа на бумажной машине, отбелке, крашении, обезвоживании и сушке целлюлозы адсорбционные и электрокинетические свойства волокон играют большую роль. Активная кислотность (рН) целлюлозных волокнистых материалов, вопросы долговечности бумаги, скорость делигнификации целлюлозы при варке, сольватация целлюлозы — всей это связано с электрохимическими свойствами поверхности волокон. Изучение коллоидоэлектрохимических свойств целлюлозы имеет значение и для развития самой коллоидной химии.
Целлюлозные волокнистые материалы обладают очень развитой удельной поверхностью, составляющей величину порядка миллиона квадратных сантиметров на грамм целлюлозы в набухшем состоянии. Подобно большинству твердых веществ при ^соприкосновении с водою, водными и неводными растворами поверхность целлюлозных волокон получает электрический заряд. Возникновение его является следствием преимущественной (специфической) адсорбции катионов или анионов или результатом диссоциации поверхностных электролитически активных групп, входящих в состав целлюлозных материалов, или, наконец, результатом ориентации диполей, входящих в состав жидкой фазы.
При соприкосновении целлюлозы с водой и разбавленными водными растворами электролитов она заряжается отрицательно. Отрицательный заряд поверхности целлюлозных волокон в этих случаях может быть, по-видимому, объяснен кислотными свойствами целлюлозных материалов. Целлюлоза никогда не встречается в природе в химически чистом виде, она всегда находится в весьма трудно разделимых сочетаниях с примесями (спутниками). Даже в наиболее чистых препаратах, полученных в лабораторных условиях (стандартная хлопковая целлюлоза), всегда можно обнаружить, хотя и в небольших количествах остатки глюкуроновой кислоты, являющейся продуктом окисления первичной спиртовой группы при шестом атоме углерода. В наиболее чистых препаратах хлопковой целлюлозы количество карбоксильных групп составляет примерно 0.03—0.04°/о. Многие исследователи пытались определить силу «целлюлозной кислоты» и пришли к выводу, что она примерно равна силе уксусной кислоты. Наличие такого сравнительно небольшого количества карбоксильных групп в чистой целлюлозе оказывается достаточным, чтобы
Объяснить плотность заряда в пределах, наблюдаемых при электрохимических явлениях на целлюлозной поверхности. Технические сорта целлюлозы всегда в большей или меньшей степени загрязнены сопутствующими веществами, имеющими кислотный характер, и поэтому количество кислотных групп в технической целлюлозе значительно возрастает и определяется условиями производственного процесса. Так, например, сульфитная целлюлоза практически всегда содержит лигносульфоновый комплекс, имеющий сильно кислый характер.
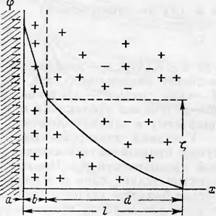
При соприкосновении твердой поверхности (например, целлюлозы) с жидкой фазой на границе раздела твердое тело—жидкость возникает особое распределение электрических зарядов, которое получило название двойного электрического слоя. Как известно из курса коллоидной химии I1], строение двойного электрического слоя может быть изобраишно следующей схемой (рис. 49). На осп ординат откладывается потенциал <р, а на оси абсцисс — расстояние от твердой поверхности в глубь раствора (х). Двойной электрический слой состоит из внутренней (а) и наружной (Z) обкладок. Ионы, входящие в состав твердой фазы, образуют внутреннюю обкладку и обусловливают заряд поверхности. Наружная же обкладка распространена в глубь жидкой фазы и состоит из двух частей. Одна часть (Ь) представляет собой слой ионов, тесно связанных с внутренней обкладкой (а) и при движении жидкой фазы не увлекается последней (адсорбционный слой внешней обкладки). Другая часть наружной обкладки (D) получила название «диффузной» и состоит из относительно подвижных ионов, распределение которых зависит от соотношения электростатического притяжения и теплового движения. Суммарный заряд наружной обкладки (Z) является противоположным по знаку и полностью компенсирует заряд внутренней обкладки (а). Диффузная часть (D) наружной обкладки может перемещаться при относительном движении фаз и благодаря этому возникают электрокинетические явления, количественной мерой которых является так называемый ^-потенциал.
|
Рис. 49.' Двойной электрической слой. |
Электрокинетический потенциал представляет собою скачок потенциала между началом диффузного слоя и свободным раствором и является мерой «свободного» заряда поверхности. Под «свободным» зарядом поверхности понимается та часть заряда, которая компенсируется противоположным зарядом диффузной части двойного электрического слоя. С увеличением концентрации электролита во внешнем растворе толщина диффузной части (D) уменьшается, что вызывает соответствующее уменьшение электрокинетического потенциала (^-потенциала). При введении во внешний раствор ионов, обладающих специфическими адсорбционными свойствами по отношению к данной поверхности может произойти не только снижение ^-потенциала до нуля, но и сама поверхность может переменить знак заряда (перезарядка); при этом совершается соответствующая перестройка всего двойного слоя.
При количественном определении ^-потенциала волокнистых целлюлозных материалов используется главным образом либо потенциал протекания, либо электроосмос.[15] При продавливании жидкости через целлюлозную диафрагму, по обе стороны от которой помещены электроды, на последних возникает разность потенциалов, получившая название потенциала протекания (Е). При электроосмосе, наоборот, при наложении разности потенциалов, через целлюлозную диафрагму переносится определенный объем жидкости (У), который и определяется на опыте.
Вычисление электрокинетического потенциала производят по следующим формулам. В случае потенциала протекания
4LtT;H.N
(f)
А в случае электроосмоса
T = ~nfv, (2)
Где тг = 3.1416; t— коэффициент вязкости; х0—-удельная электропроводность диафрагмы (*0 = *г - f-*4); D — диэлектрическая проницаемость; 1—-сила тока; Р — давление, под которым продавливается жидкость; Е — потенциал протекания и V—объем жидкости, перенесенной через диафрагму в единицу времени.
Удельная электропроводность диафрагмы представляет собою сумму проводимости жидкости в свободном объеме (у.,,) и поверхностной проводимости (V.S). Последняя обусловливается наличием двойного электрического слоя и в случае целлюлозных поверхностей имеет весьма большое значение (табл. 31). Определение элеюгрокинетического потенциала методом потенциала протекания обладает рядом преимуществ по сравнению с методом электроосмоса [4], и поэтому первый метод наиболее часто применяется для исследования целлюлозных диафрагм I5-9]. К сожалению, измерения потенциала протекания_(£) ограничиваются только областью разбавленных растворов электролитов, примерно до 0.001—0.005/7 концентрации.
В экспериментальном отношении электрокинетические свойства целлюлозных волокнистых материалов изучены еще недостаточно. Имевшиеся до недавнего времени литературные данные [10] относились главным образом к хлопку, высококачественной фильтровальной бумаге и в меньшей степени к древесным целлюлозам. В частности, совершенно отсутствовали сведения об электрохимических свойствах сульфатной целлюлозы и древесной массы. В течение ряда лет в лаборатории кафедры физической и коллоидной химии, Лесотехнической академии им. С. М. Кирова проводятся систематические исследования по изучению электрохимических свойств разнообразных технических сортов сульфитной и сульфатной целлюлозы отечественного производства, а также ряда производных целлюлозы. В результате исследований сотрудников этой лаборатории Юрьева и Позина Is] было установлено, что ^-потенциал целлюлозных материалов, определенный с учетом поверхностной проводимости, не зависит от плотности диафрагмы и практически является постоянной величиной, характеризующей состояние поверхности цел
люлозных волокон, ^-потенциал технических небеленых целлюлоз имеет более низкое значение, чем у беленых и хлопка. Наибольший £ - и ге циа по отношению к чистой воде обнаружен у стандартного хлопка (—21.4 мв), а наименьший у сульфитной (—4.0 мв) и сульфатной (—4.3 мв) небеленыз технических целлюлоз. Наличие обменно-адсорбционной зольности в целлюлозе уменьшает отрицательное значение электрокинетического потенциала. В табл. 31 приведены значения ^-потенциала для исследованных указанными авторами образцов целлюлозы и некоторых ее производных. Сравнивая величины ^-потенциала для различных сортов целлюлозы можно сделать заключение, что на величину электрокинетического потенциала при равных условиях измерения, оказы вает сильное влияние степень чистоты целлюлозного материала, содержание в нем инкрустирующих веществ (степень про вара технических целлюлоз ["]), золы и продуктов распада целлюлозы. Например, с ростом содержания карбоксильных групп (см. образцы монокарбоксилцеллюлозы) отрицательная величина ^-потенциала имеет тенденцию к уменьшению. Эта же тенденция имеет место и у кислых эфиров целлюлозы (см. образцы фталата и малеата целлюлозы). На рис. 50 иллюстрируется ход изменения ^-потенциала с увеличением концентрации соответствующих хлористых солей для высококачественной немецкой фильтровальной бумаги №589 [Б].
|
*0 |
|
0 0ч - 0.8 1.2 1.6 Концентрация (5 м зкР) Рис. 50. С-иотеыциал фильтровальной бумаги в растворах хло~ ридсв, по Бриггсу. |
Впервые поверхностную проводимость целлюлозы количественно изучил Бриггс [12]. Он исследовал действие различных катионов на поверхностную проводимость фильтровальной бумаги. Юрьев и Позин [9] изучили поверхностную проводимость как древесной и хлопковой целлюлозы, так и некоторых ее производных по отношению к чистой воде и растворам хлористого калия. Эти авторы установили, что доля участия поверхностной проводимости (•/.„) в общей проводимости (х0) целлюлозной диафрагмы растет с увеличением плотности диафрагм и может достигать значительных величин. Например, для диафрагм плотностью около 0.32 г/см[16] в случае чистой воды были получены следующие данные:
Сульфитная небеления Вискозная а-Ц1 ллюлоза Стандартный хлопок 93—95% 88—910/0 86о/0 68.5о/0
Для дистиллированной воды и очень разбавленных растворов электролитов поверхностная проводимость играет преобладающую роль в общей'проводимости плотных диафрагм.1 По мере увеличения концентрации
Таблица SI
Электрокинетический потенциал н поверхностная проводимость некоторых целлюлозных материалов для дистиллированной воды (по Юрьеву и Позину) [■']
|
|
|
Плотность диафрагмы Г/см3 |
|
С-потенциал MB |
|
Целлюлозный материал |
Стандартный небеленый хлопок......................................
Беленый текстильный хлопок..........................................
Вата гигроскопическая....................................................
Техническая вискозная целлюлоза...................................
Обеззоленная вискозная целлюлоза..................................
Обеззоленная беленая сульфитная целлюлоза Техническая небеленая сульфитная целлюлоза Обеззоленная небеленая сульфитная целлюлоза
Техническая небеленая сульфатная целлюлоза Обеззоленная небеленая сульфатная целлюлоза
А-целлюлоза (из вискозной целлюлозы) ....
Древесная масса из ели....................................................
Монокарбоксилцеллюлоза из ваты
А) с 0.35% СООН-групп.................................................
Б) с 4.45% СООН-групп.................................................
В) с 7.76% СООН-групп.................................................
Монокарбоксилцеллюлоза из сульфитной вискозной целлюлозы
А) с 1.16% СООН-групп.................................................
Б) с 2.52% СООН-групп.................................................
В) с 4.36% СООН-групп.................................................
|
-21.4 -15.7 -14.0 - 7.5 -12.4 - 9.0 - 4.0 - 6.5 - 4.3 - 8.2 -10.5 - 6.6 -13.6 -14.8 -10.0 |
|
0.335 0.352 0.360 0.329 0.323 0.330 0.330 0.336 0.338 0.319 0.329 0.360 0.360 0.360 0.360 0.360 0.360 0.360 0.360 0.360 |
|
-11.7 - 7.7 - 7.5 -12.5 - 8.6 |
Кислый фталат целлюлозы с 8.9% СООН-групп Кислый малеат целлюлозы с 6.6% СООН-групп
Электролита роль поверхностной проводимости падает и, например, для 0.01 н-раствора КС1 для очищенных целлюлоз она составляет всего от 2 до 13%, а для небеленых сортов от 18 до 28% от общей проводимости. Как общий вывод из этих исследований (табл. 31) вытекает, что небеленые сорта древесных целлюлоз имеют большую поверхностную проводимость, чем беленые; еще меньшим значением обладает а-целлюлоза и особенно хлопковая целлюлоза; Таким образом, при одинаковой плотности диафрагм, чем чище целлюлозный материал, тем меньше поверхностная проводимость. Следует также отметить, что с ростом содержания карбоксильных групп (см. образцы монокарбоксилцеллюлозы и кислых эфиров целлюлозы) значительно увеличивается поверхностная проводимость по сравнению с исходным образцом целлюлозы.
Проводимость целлюлозных диафрагм в целом будет больше проводимости равного им по толщине и площади слоя равновесного с ними раствора. Это явление получило название капиллярной сверхпроводимости Г13]. Капиллярная сверхпроводимость возрастает с уменьшением концентрации раствора электролита, достигая максимального значения для дистиллированной воды. Поэтому явление капиллярной сверхпроводимости необходимо учитывать во всех случаях, когда имеют дело с проводимостью целлюлозных систем в чистой воде или в разбавленных растворах электролитов.
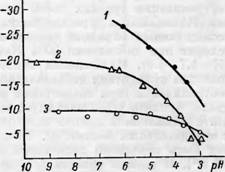
Эпектрокинетический потенциал целлюлозных материалов с увеличением рН равновесного раствора, при постоянной ионной силе, сначала возрастает, а затем приблизительно с рН=5—6 остается практически постоянным (рис. 51). При высокой кислотности (рН=3) ^-потенциал хлопка и сульфитной беленой целлюлозы практически одинаков.
Степень провара (жесткость) сульфитной небеленой целлюлозы заметно влияет на ее электрокинетические свойства. С возрастанием жесткости сульфитной целлюлозы отрицательная величина ^-потенциала уменьшается, а поверхностная проводимость (xs) увеличивается. Это, по-види - мому, находится в связи с относительно более высоким содержанием твердой лигносульфоновой кислоты, обладающей сильно кислотным характером, в более жестких целлюлозах ("1-
|
•е. |
|
Рис. 51. ^-потенциал целлюлозных материалов в зависимости от рН при постоянной ионной силе р= 0.001 в системе: НС1—NaCl—NaOH. |
|
1 ■— ацетат целлюлозы [34]; 2 — хлопок Р1]; 3 — сульфитная беленая целлюлоза [зь]. |
Изучение влияния размола на электрокинетические свойства древесной и хлопковой целлюлозы показало [14-1в], что с увеличением градуса размола ^-потенциал уменьшается, а поверхностная проводимость имеет тенденцию к возрастанию. Такое поведение целлюлозы в процессе размола можно объяснить увеличением электронейтральной гидратации. [17] При размоле происходит разрыв водородных связей между макромолекулами целлюлозы и увеличивается общая поверхность размолотых волокон, что и влечет за собою возрастание электронейтральной гидратации, которая обусловливает соответствующий эффект в измерении потенциала протекания.
Взаимодействие солей алюминия с древесной целлюлозой, главным образом сульфата алюминия, играет весьма существенную роль в процессе смоляной проклейки и наполнении бумаги. В связи с этим представляет большой теоретический и практический интерес изучение изменения электрокинетнческих свойств целлюлозы при взаимодействии ее с алюминиевыми солями. В последнее время [17_18] было установлено, что электрокинетический потенциал целлюлозы меняется в процессе проклейки бумаги. В лаборатории коллоидной химии Лесотехнической академии [19] было изучено электрокинетическое поведение основных сортов древесной целлюлозы при взаимодействии их с солями алюминия.
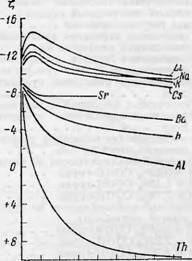
Отрицательное значение ^-потенциала у беленой и небеленой сульфитной и у небеленой сульфатной целлюлозы с ростом концентрации средних солей алюминия уменьшается, но перезарядка поверхности волокон ни в растворах хлорида, ни в растворах сульфата алюминия вплоть до 0.001 н-концентрации не происходит. Поверхностная проводимость с ростом концентрации средних солей алюминия уменьшается, переходя при определенных концентрациях к отрицательным значениям. Это показывает, что общая проводимость целлюлозной диафрагмы (х0) становится при этих концентрациях меньше, чем электропроводность раствора в свободном объеме (у.,). Таким образом, в этих случаях ярко проявляется тормозящая роль целлюлозного скелета диафрагмы, насыщенной алюминием, на общую проводимость системы. По мере увеличения степени нейтрализации средних солей алюминия едким натром (при возрастании рН) целлюлоза перезаряжается, получая положительный заряд. Для исследованных образцов древесной целлюлозы такая перезарядка происходит при добавлении 20% NaOH по отношению к алюминию (при рН = 4.7—4.9). Наибольший положительный заряд при этих условиях показала сульфитная небеленая целлюлоза. По мере увеличения степени нейтрализации (при возрастании рН), положительная величина ^-потенциала, проходя через максимум, вновь уменьшается, и при высоком проценте добавляемой щелочи электрокинетический потенциал возвращается к отрицательным значениям. Такое поведение целлюлозных волокон ьщ - жет быть объяснено состоянием алюминия в растворе при изменении рН [20]. В кислой области рН, по-видимому, перезарядка целлюлозной поверхности объясняется адсорбцией положительно заряженных мицелл гидрата окиси алюминия, а в щелочной области волокна вновь получают отрицательный заряд, что можно отнести за счет некоторого уменьшения при этих рН (нейтральная и слабощелочная реакция) сорбируемости соединений алюминия и их возможной перестройкой в отрицательно заряженные мицеллы гидрата окиси алюминия.
Целлюлозные волокнистые материалы (хлопковая, древесная целлюлоза и некоторые ее производные), обладая кислым характером, проявляют свойства катионообменника. Еще в 1834 г. отмечалось, что хлопковая целлюлоза способна к поглощению катионов из солевых растворов. С тех пор появился ряд исследований, посвященных ионному обмену на различных целлюлозных материалах, но все же этот вопрос является сравнительно еще мало изученным. В качестве примера опишем некоторые результаты, полученные в лаборатории коллоидной химии Лесотехнической академии им. С. М. Кирова, где в последние годы проводится систематическое изучение ионообменных свойств целлюлозных материалов. Юрьев, Позин и Скурихина [21_22] изучили влияние рН равновесного раствора на величину обменно-адсорбционной способности [18] различных технических целлюлоз отечественного производства. Оказалось, что обменнот Адсорбционная способность целлюлозных материалов при постоянной концентрации обменивающегося катиона металла находится в прямолинейной зависимости от рН равновесного раствора. Интервал рН, в котором сохраняется определенный характер этого прямолинейного соотношения, т. е. наклон прямой и начальная ордината, может изменяться в зависимости от кислотности раствора, сорта целлюлозы, природы адсор-
|
Таблица 32 Ионообменная способность обеззоленных целлюлоз в отношении ионов кальция и двухвалентной меди из 0.1 н-раствора в зависимости от рН равновесного раствора (по Юрьеву, Позину, Скурихпной) [21,22]
|
Бируемых катионов и их концентрации. В результате исследования, проведенного этими авторами, было установлено (табл. 32), что чем чище целлюлозный материал, т. е. чем меньше в нем инкрустирующих веществ, гемицеллюлоз и продуктов деструктивного распада, тем меньше его об - менно-адсорбционная способность по отношению к катионам металла.
Допуская электрохимическую природу обмена катионов на волокнистых целлюлозных материалах, можно ориентировочно оценить их внутреннюю поверхность, используя следующее соотношение:
S = 84 • 104Й (3) v
Где S—внутренняя удельная поверхность в см 2/г; Ъ — угловой коэффициент прямой в координатах: обменная способность—рН равновесного раствора. Юрьев и Скурихина [22] применили это соотношение для вычисления внутренней поверхности для ряда целлюлозных материалов. Они получили, например, для гигроскопической ваты, вискозной сульфитной. сульфатной беленой, сульфитной небеленой и сульфатной небеленой целлюлозы соотвественно 0.28-10е, 1.29-106, 1.51 • 106, 1.76 ■ 10е и 2.26 • 10е см2/г.
В 1959 г. Мищенко, Талмуд и Якимова [23] определили удельную поверхность некоторых целлюлоз методами низкотемпературной адсорбции паров азота и ионообменным. Эти авторы подтвердили вышеприведенные данные Юрьева и Скурихиной. Порядок величин для внутренней удельной поверхности целлюлозных материалов, полученный по ионообменному методу согласуется с данными других авторов [24], полученных иными методами. Результаты подобных вычислений, однако, могут вызвать возражения той части, что обменно-адсорбционная способность различных целлюлозных материалов зависит не только от величины внутренней поверхности, но и от химических свойств последней, т. е. от характера соответствующих функциональных групп.
Степень провара (жесткость) сульфитной небеленой целлюлозы значительно влияет на ее обменно-адсорбционные свойства. С увеличением жесткости, т. е. количества твердой лигносульфоновой кислоты, возрастает и количество адсорбируемых катионов металла. В кислой области растворов обменно-адсорбцнонная способность волокнистых целлюлозных материалов определяется, с одной стороны, содержанием остаточного лигносульфонового комплекса (древесные небеленые сорта сульфитной целлюлозы), а с другой — количеством карбоксильных групп (табл. 33111]).
|
Таблица 33 Влияние жесткости небеленой сульфитной целлюлозы на ее ионообменную способность в отношении ионов кальция (по Юрьеву, Позину и Скурихиной) [п]
|
Гейман и Рабинов, изучившие катионный обмен хлопковой целлюлозы с различными солями, пришли к заключению, что кислотность целлюлозы определяется преимущественно карбоксильными группами, а не гидрок - сильными [25].
В процессе массного размола целлюлозы (до 85° ШР) обменно-адсорб - ционная способность в отношении катионов металла не изменяется, так как при размоле практически остается неизмененным количество кислых функциональных групп, считая на весовую единицу целлюлозы [1в].
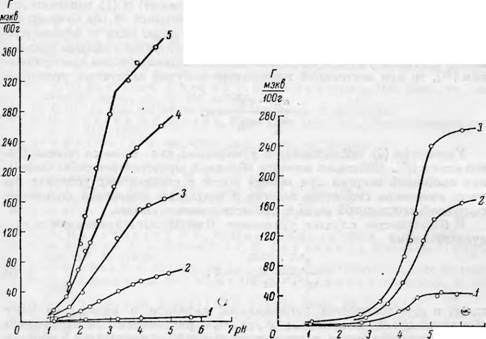
Изучение ионообменной способности препаратов моно- и 5м-карбок - силцеллюлозы, полученных окислением сульфитной беленой целлюлозы или хлопка, показало, что обменная адсорбция по отношению катионов металла сильно возрастает (в десятки и даже сотни раз) с увеличением содержания карбоксильных групп и является пропорциональной их количеству в целлюлозном препарате [2°-28]. На рис. 52 представлены кривые, иллюстрирующие влияние содержания карбоксильных групп в препаратах монокарбоксилцеллюлозы на обменно-адсорбционную активность в зависимости от рН равновесного раствора.
Юрьев и Скурихина изучили ионообменную способность кислых эфиров целлюлозы. В частности, были исследованы кислые фталаты и и малеаты целлюлозы. Данные для фталатов представлены на рис. 53. Кислые малеаты дают аналогичные кривые [36].
Особый интерес для бумажного производства представляет адсорбция алюминия на древесной целлюлозе. Этот вопрос изучался многими исследователями как у нас, так и за границей. Исследованиями последнего времени [19' 29] было показано, что изотерма адсорбции алюминия на сульфитной и сульфатной целлюлозе проходит через максимум при рН=5.0—5.5. Примерно до рН=3.5 алюминий главным образом адсорбируется обменно в форме трехвалентного иона; при более высоких рН начинают поглощаться и основные соли алюминия. Адсорбция основных солей алюминия на целлюлозе происходит специфически, а не по ионообменному механизму, т. е. поглощенные основные соли алюминия не вытесняются с поверхности целлюлозных волокон другими катионами металлов, например, ионами калия или кальция. На процесс ионного обмена на целлюлозных материалах влияет ряд факторов, связанных как со
J Кислотный миллиэквивалент серы в лигносульфоновом комплексе принят За 0.032, а миллиэквивалент карбоксильной группы за 0.045.
■свойствами жидкой водной среды, так и со свойствами самой твердой фазы (целлюлозы). В настоящее время общей теории, охватывающей все случаи ионного обмена пока еще не существует. В ряде работ предлагаются разнообразные уравнения для количественного описания обменной
Способности ионитов.
Рассмотрим процесс ионного обмена на целлюлозе с термодинамической точки зрения. Обмен двух катионов М и М2 на цел-
Рис. 53. Влияние содержания —СООН групп в кислых фталатах целлюлозы на ионообменную способность по отношению ионов Са+2 из 0.1 н.-раствора в зависимости от рН [36].
1 — с 3.0% —СООН групп; 2-е 8.9% —СООН групп; 3 — с 15.6% —COOH групп.
1 — исходная беленая сульфитная целлюлоза;
|
Рис. 52. Влияние содержания карбоксильных (—СООН) групп в монокарбоксилцел - .люлозе на ионообменную способность по отношению ионов Си+2 из 0.1 н.-рас- твора в зависимости от рН[28]. |
|
6 рЛ |
2 — с 2.8% —СООН групп; 3 — с 6.26% —СООН трупп; 4 — с 9.26% —СООН групп; 5 — с 17.42%
|
•люлозных материалах уравнением 1 _ 1 |
—СООН групп.
Можно в общем виде представить следующим
Целл. Л72+ Y Mi + ^HaO). (4)
Где Zx и Z2 — заряды (валентности) соответствующих катионов; М и Л/2 — ионы в поглощенном состоянии, а М1 и Ма — эти же ионы в свободном растворе. (Н20) и (Н20) — обозначают соответствующие молекулы воды (растворителя) в связанном состоянии, т. е. в двойном электрическом ■слое (ионная сольватация), и в свободном растворе; п — число милли - молей воды, перенесенных из двойного слоя в свободный раствор при обмене одного миллиэквивалента ионов. Применяя термодинамическое уравнение изотермы реакции к процессу обмена катионов [80], получаем
-^Г" Целл. Л/1 + Мг + п (Н20) =
|
Ам2 |
|
Ж, |
|
RT In |
|
(5) |
|
А15 М. |
|
П1 |
= К + п(У. н2о —Стад),
Где К — разность стандартных изобарных потенциалов для данной пары обменивающихся ионов; (щ — активности катионов в двойном электрическом слое на поверхности целлюлозы; ам — активность катионов в равновесном растворе; рн2о и рн^) — химические потенциалы воды в свободном растворе и в двойном электрическом слое; R — газовая постоянная и Т — абсолютная температура. Уравнения (4) и (5) написаны для случая, когда процесс обмена поглощенных катионов МЛ на катионы М2 Сопровождается освобождением п миллимолей воды. Если в первом приближении пренебречь изменением количества связанной воды при процессе ионного обмена (п=0) и сделать небольшие математические преобразования [31], то при постоянно!! температуре получим следующее уравнение
. „1 /г2
El* ■ а1'*' (6}
Уравнение (6) тождественно с уравнением для ионного обмена Никольского [32]. Константа ионного обмена К представляет собой изменения свободной энергии при обмене ионов в стандартных условиях без учета изменения свободной энергии в результате изменения количества связанной целлюлозой воды в процессе ионного обмена. ч
В большинстве случаев уравнение _ Никольского применяют в следующей форме
GX/г, . CI,Z2
1/^2 . Г,
■ С1
Где G1 и G2 — количества поглощенных катионов в мг-экв. на 100 г абсолютно-сухой целлюлозы; Сх и С2 — равновесные концентрации соответствующих ионов в г-экв./л раствора; К' — кажущаяся константа обмена ионов.
Юрьев и Скурихина f31-33] исследовали применимость уравнения Никольского к целлюлозным материалам и показали, что в случае обмена катионов одинаковой валентности это уравнение применимо с достаточной точностью ( + 2—5%)- При обмене же разновалентных катионов отклонения достигают 20—33°/0.
Эти же авторы провели исследование по выяснению обратимости процесса обменной адсорбции катионов на целлюлозных волокнистых материалах [31]. Изучались равновесия, достигаемые с разных сторон. Например, для ионов кальция и натрия эти равновесия могут быть представлены следующими химическими уравнениями
1 1
2 Целл. Са + Na+ = Целл. Na + у Са++.
1 1 Целл. Na-f у Са++= у Целл. Са + Na+.
Полученные данные показали, что равновесное состояние получается одинаковым, независимо от того, каким катионом был предварительно насыщен данный образец целлюлозного материала. Константы прямого и обратного процесса очень хорошо совпали. Таким образом „ эти исследования показали, что при обмене катионов металлов на волокнистых целлюлозных материалах устанавливается истинно/в равновесие.

 Опубликовано в
Опубликовано в