Получение водорода из гидридов металлов
 27 декабря, 2016
27 декабря, 2016  Mihail Maikl
Mihail Maikl Гидриды щелочных и щелочноземельных металлов являются одним из перспективных разовых источников водорода для автономных энергоустановок, изготовляемых на основе ЭХГ. Основные характеристики наиболее распространенных гидридов представлены в табл. 8.4.
|
Таблица 8.4
|
Перечисленные гидриды удобны и безопасны в хранении при условии отсутствия влаги, поэтому хранятся они в герметичной таре, исключающей попадание воды.
У большинства гидридов температура разложения выше 100 °С. При температурах ниже температуры разложения гидриды могут храниться в течение нескольких лет, практически не теряя своих ■свойств.
Выделение водорода из гидридов металлов может происходить двумя способами:
1) в процессе термического разложения;
2) в процессе гидролиза жидкой водой или паром.
Термическому разложению подвержены все перечисленные гидриды, однако далеко не все могут быть использованы в качестве источников водорода для работы автономных ЭУ. Это вызвано тем, что в процессе термического разложения требуются довольно высокие температуры для обеспечения необходимого расхода водорода. Наиболее приемлемым гидридом, который может быть использован в качестве источника водорода, является гидрид магния. Разложение его протекает по следующему уравнению
Давление и расход водорода сильно зависят от температуры. На рис. 8.19 приводится график зависимости давления водорода, выделяемого из MgH2, от температуры [8.6].
Вообще для большинства гидридов металлов характерны высокие температуры и небольшие давления водорода. Так, для достижения давления водорода, равного 105 Па, для некоторых гидридов необходимы следующие температуры:
Гидрид..................................................... LiH NaH КН MgH2
Температура, °С...................................... 865 430 420 200
Как уже было сказано выше, наиболее пригодным является гидрид магния, так как после выделения водорода оставшийся активный порошок магния может быть вторично превращен в гидрид путем прямого синтеза с водородом.
В основе получения водорода из гидридов путем гидролиза лежит необратимая реакция взаимодействия перечисленных гидридов металлов с водой. Гидриды бурно реагируют с водой с выделением водорода и теплоты. Гидролиз простых (бинарных) гидридов, щелочных и щелочноземельных металлов протекает по следующему общему уравнению:
MeH„-f пН20—)-Ме (ОН) n-fnH2.
Гидролиз комплексных гидридов протекает по более сложной схеме. Так, при избытке воды NaAlH4 реагирует по следующей схеме:
NaAlH4+4H20—э-NaOH+Al (ОН)3-(-4Н2.
При недостатке воды реакция протекает с образованием алюмината или окиси алюминия
N а А1Н4+2Н20—*-NaA102-f 4Н2 или
6NaAlH4-fl5H20—>6Na0H+3Ab03-f24H2.
Однако, как показывает практика, реакция гидролиза проходит до конца только при избытке воды. Поэтому при определении массо-габаритных характеристик СХП водорода необходимо учитывать это увеличение потребного количества воды. Так, для полного завершения гидролиза ЦН требуется 10—15-кратное увеличение воды против рассчитанного по стехиометрии, для NaAlH4 и NaH — соответственно 3—3,5-кратное увеличение. Это влечет за собой и увеличение массы материала емкости, где должен храниться запас воды. Для уменьшения запаса воды можно использовать воду, образовавшуюся в процессе электрохимической реакции в ЭХГ.
Общий запас водорода, необходимого для выработки заданного количества электричества, может быть определен по следующей простой зависимости:
Р
V = 0,415/гст = 0,415 - у—т,
' ЭЛ '
где V —объем водорода, л; / — нагрузка на ЭХГ, А; т —время работы ЭХГ, ч; п — количество ТЭ в ЭХГ; Р — .мощность ЭХГ, Вт; Uэл — напряжение на ТЭ, В.
Так как потребное количество гидрида прямо пропорционально количеству водорода, для каждого гидрида может быть вычислен свой коэффициент пропорциональности К, используемый в ниже приведенной зависимости
р ■ , ■
G,. = К 1пх = К, ту—т,
и эл -
где Gr — масса гидрида.
Коэффициенты К дта некоторых гидридов:
Гидриды......................... UH NaH СаН2 MgH2 NaAlH4 LiAIH4 NjBH, LiBH,
К............. . . 0,147 0,445 0,39 0,243 0,25 0,176 0.175 0.1
В процессе работы происходит заполнение электродных камер инертными газообразными примесями водорода, которые, постепенно накапливаясь, начинают блокировать подвод водорода к активной поверхности электрода, снижая тем самым энергетические характеристики ЭХГ. Для удаления накопившихся примесей производится продувка водородных электродов, в процессе которой происходит потеря определенного количества водорода. Опыт эксплуатации показал, что указанные потери могут достигать 5—6% количества водорода, вступившего в электрохимическую реакцию. Поэтому необходимо пропорционально потерям увеличить массу гидридного запаса.
Наряду с гидридами в качестве источников водорода можно применять многие металлы и элементы, активно взаимодействующие с водой с выделением водорода.
Наиболее дешевыми и широкораспространенными являются магний и алюминий. Реакция гидролиза с водой протекает по следу-
2А1-і-6Н20—>2А1 (ОН) з+ЗН2
![]() или
или
Mg+2H20-*-Mg (ОН) 2+Н2.
 |
 |
В чистом виде эти металлы реагируют с водой очень медленно, однако небольшие добавки ртутя (амальгамы), лития, индия могут резко увеличить их активность.
В процессе гидролиза гидридов наряду с водородом образуется водяной пар ввиду больших теплот реакции и щелочной аэрозоль, который в случае применения в ЭХГ кислого электролита может уменьшить его энергетические характеристики. Поэтому перед входом в ЭХГ должен быть установлен противоаэрозольный фильтр.
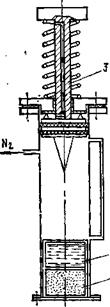
Непосредственно генерация водорода из гидридов происходит в водородном газогенераторе. В настоящее время имеются разнообразные конструкции генераторов водорода в зависимости от их назначения. Для питания ЭХГ небольших мощностей (до 1000 Вт) очень удобным является использование водородного газогенератора, основанного на принципе аппарата Киппа. Схема этой системы представлена на рис. 8.20.
В генератор I подается вода. В зоне реакции происходит взаимодействие гидрида 2 с водой и образование водорода, который очищается от аэрозоля в фильтре 3 и подается в ЭХГ.
Данная конструкция работает наиболее четко при использовании гидридов, имеющих растворимые продукты реакции (это гидриды LiH, NaH, NaAlH4 и др.). В этом случае система является саморегулируемой и простой в эксплуатации. Другим примером
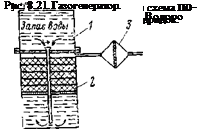
может быть система, предназначенная для долгого хранения и быстрой взводимости, представленная на рис. 8.21.
 |
В этом случае хранение реагентов производится в закрытых капсулах с гидридом 1 и водой или кислотой 2. В случае необходимости усилием на шток 3 производится разбивка капсул, и гидрид вступает во взаимодействие с водой или кислотой. Водород заполняет объем генератора, достигает определенного давления и через систему редуцирования подается в ЭХГ. В этом случае генератор газа работает как баллон высокого давления с той разницей, что хранение водорода производится не в компремированном виде, а в химически связанном состоянии.
Кроме вышеперечисленных систем хранения водорода могут быть использованы некоторые металлы или сплавы, хорошо поглощающие водород и при нагревании выделяющие его. К таким металлам могут быть отнесены титан, магний и ряд других металлов. Эти системы обладают обратимостью процессов (гидрирование-дегидрирование) и могут многократно использоваться для хранения водорода в отличие от разовых источников водорода, к которым относится вышеописанный гидролиз гидридов металлов. Основным недостатком многих аккумуляторов водорода является то, что для их дегидрирования требуется достаточно высокая температура. Так, для выделения водорода из титана требуется 900— 1100°С. Другим примером может служить система с использованием гидрида магния, который тоже может многократно поглощать и выделять водород. Данные по парциальному давлению водорода от температуры представлены на графике (см. рис. 8.19).
Более хорошая кинетика выделения водорода имеется в сплаве MgjNi.
До I960 г. гидрид магния считался наиболее подходящим материалом для использования в качестве аккумулятора водорода, однако в настоящее время был синтезирован ряд интерметаллических соединений, которые обладают лучшими качествами как аккумуляторы водорода, т. е. не требуют таких высоких температур для дегидрирования. Общая формула указанных соединений АВ5, где А — редкоземельный элемент; В — Ni, Со, Си, Fe.
Ниже приведен ряд представителей этих интерметаллических соединений, а также среднее равновесное давление водорода при температуре около 25 °С [8.3].
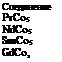
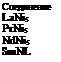
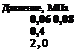 |
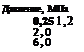 |
Наиболее широкое применение в качестве аккумуляторов водорода нашло соединение LaNis, молекула которого может присоединять до 6—7 атомов водорода. Кроме этого соединения большое распространение получило соединение FeTi.
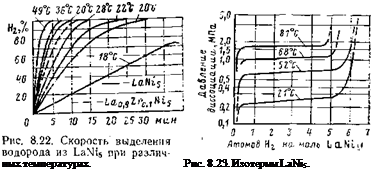
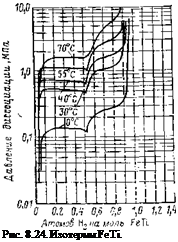
Скорость выделения зависит от температуры. На рис.
8.22—8.24 представлены соответственно скорость выделения водорода из LaNis и изотермы LaNis и FeTi. При поглощении водорода выделяется около 30 кДж/моль Н2. Для поддержания постоянства выделения водорода такое же количество теплоты должно подводиться к соединению. На основании исследований было выявлено, что LaNis обладает избирательной способностью адсорбции. Из смеси газов (Н2+
ДСОг-1-CO-j-CH. i) поглощается только водород. Благодаря этому выделяемый газ не содержит посторонних примесей.
При использовании этих соединений в качестве источников водорода объем системы хранения и подачи топлива уменьшается в 3 раза.
Большие работы по созданию систем хранения на основе указанных интерметаллических соединений проводятся за рубежом, особенно в США.

 Опубликовано в
Опубликовано в