ПЕРЕРАБОТКА ФТОРСОДЕРЖАЩИХ ПОЛИМЕРОВ
 4 мая, 2013
4 мая, 2013  admin
admin ПОЛИТЕТРАФТОРЭТИЛЕН
Суспензионный политетрафторэтилен
Высокая вязкость расплава ПТФЭ [1010 Па-с(10пП) при 380 °С] исключает переработку этого полимера обычными для термопластов способами. Для получения готовых изделий или полуфабрикатов разработаны специальные приемы переработки, которые в какой-то степени используются и в порошковой металлургии. Все известные способы переработки суспензионного ПТФЭ, несмотря на их различие, имеют сходство, сводящееся к существованию двух стадий: предварительное формование заготовки на холоду и последующее ее спекание при 365—385 °С. •
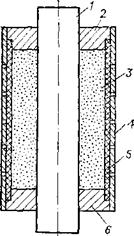
Компрессионное прессование. Обычно прессование осуществляется на гидравлических прессах, рассчитанных на давление 35 МПа (350 кгс/см2). Для крупногабаритных заготовок используются пресса с усилием до 5 МП (500 тс.). Качественные заготовки средних и особенно больших размеров можно получить на прессах с двусторонним прессованием (рис. VII.1). В отличие от одностороннего при двустороннем прессовании матрицу формы устанавливают на нижней плите на распорке которую удаляют после первой стадии уплотнения порошка. На второй стадии уплотнения происходит не только продвижение верхнего пуансона, но и некоторое опускание матрицы. Прессование на второй стадии доуплотняет нижние слои полимера и позволяет получать блоки с большей однородностью.
В зависимости от насыпной плотности ПТФЭ высота формы должна быть в 3,5—7 раз больше высоты отпрессованной заготовки. Поэтому иногда используют специальные наставки к матрице. Радиальный зазор между матрицей и пуансоном колеблется в пределах 0,13—0,25 мкм [1, с. 3]. Пресс-формы можно изготовлять из обычных малоуглеродистых сталей, поверхность формы необходимо отполировать и отхромировать. При повышенных температурах формования целесообразно использовать формы из нержавеющих сталей.
Различные марки ПТФЭ должны прессоваться при различных давлении, скоростях формования и выдержках полимера
Под давлением. Обычно для чистого полимера давление составляет 25—42 МПа (250—420 кгс/см2) и для композиций — 35— 100 МПа (350—1000 кгс/см2). Большое значение для качества изделий имеет равномерное распределение порошка в форме. Температура прессования заготовки должна быть не менее
21 °С (т. е. выше температуры перехода при 19 °С) и не выше 28 °С. Влияние давления прессования на свойства ПТФЭ показано на рис. VII. 2 [1, с. 17]. Скорость смыкания формы не должна быть слишком большой (оптимально 10—120 мм/мин) для обеспечения удаления воздуха. Время выдержки под давлением зависит от массы и формы заготовки и составляет
2-
J-
4~
5-
|
9-1 |
Рис. VII. 1. Схема формования заготовки двусторонним прессованием (с «плавающей» матрицей):
/ — верхняя плита; 2 — толкатель; 3— верхний пуансон; 4— порошок П ГФЭ; 5 — матрица; 7 —ннжний пуансон; 7 — упор; 8 — подставки; 9 — ннжняя плита
5— 30 мин. Поскольку порошок ПТФЭ легко электризуется и притягивает пыль из воздуха, помещение для прессования ПТФЭ отделяется от других стадий переработки и снабжается чистым отфильтрованным воздухом.
При свободном спекании отформованную заготовку осторожно извлекают из формы и помещают в печь для спекания. Спекание проводится при 370—385 °С, продолжительность спекания зависит от массы заготовки и для крупных заготовок составляет несколько суток. При спекании заготовок при температурах выше 385°С снижается механическая прочность изделия, а ниже 370 °С продолжительность спекания увеличивается. При спекании протекают два основных процесса. Вначале при 342°С (для исходного порошкообразного полимера) происходит плавление кристаллитов и полимер расширяется на 25%, затем при более высокой температуре частицы полимера сплавляются, и получается монолитный блок. Параметры спекания, как и прессования, зависят от свойств полимера и габаритов
I
Изделия. Режимы формования и спекания заготовок, а также другие способы переработки - фторполимеров обобщены в обзоре [2].
Для свободного спекания, как правило, используются электропечи с рабочей температурой до 450°С, с рециркуляцией воздуха и выносными электронагревателями. Печи имеют местную вентиляцию и автоматически выключаются при достижении температуры в печи 420 °С. Температура печи поддерживается с точностью ±5°С и, как правило, регулируется автоматически по заданной программе. Размещение заготовок в печи обеспечивает максимальную турбулентность движения воздуха.
|
Рис. VII. 2. Зависимость свойств ПТФЭ от давления прессования: / — разрушающее напряжение при растяжении; 2—относительное удлинение при разрыве; в — электрическая прочность. |
/ — пористые образцы; //—образцы хорошего качества (рекомендуемые давления); /// —образцы с видимыми мнкротрещинами.
Температура, при которой заготовки помещают в печь, не должна превышать 90°С (за исключением тонких изделий). При этой температуре заготовки выдерживают в течение часа. Затем температура повышается медленно (10—25°С/ч) или ступенчато (с выдержкой при постоянной температуре в диапазоне 288—349 °С). Выдержка в печи на 1 мм толщины изделия при максимальной температуре составляет примерно 5— 10 мин для тонких и около 5 мин для толстостенных изделий. Максимальная температура спекания не должна превышать 382 °С, что особенно важно соблюдать при спекании крупных заготовок. Оптимальные режимы спекания для конкретных марок и изделий обычно уточняют опытным путем.
Качество изделий зависит от структуры полимера, которая определяется как молекулярной массой, так и режимами охлаждения и закалки (рис. VII. 3) [1, с. 46]. При снижении степени кристалличности ПТФЭ, достигаемом закалкой, улучшаются многие свойства, кроме жесткости и проницаемости. Однако закалка используется нечасто, так как форсирование режима охлаждения, особенно для крупногабаритных блоков, приводит к растрескиванию изделий. Рекомендуемая скорость охлаждения от 8 до 14°С/ч при охлаждении расплава до200°С и 50°С/ч— при температурах ниже 200°С. Извлекать заготовки из печи можно при температуре не выше 90 °С.
Богатый ассортимент марок ПТФЭ позволяет в большинстве случаев использовать свободное спекание отформованных заготовок, избегая спекания или (и) охлаждения под давлением. В некоторых случаях для получения изделий с минимальной пористостью, особенно из наполненных композиций, применяют охлаждение изделий под давлением (в прессе). Этот
|
|
|
Рис. VI. 3. Зависимость степени кристалличности от молекулярной массы при различных скоростях охлаждения (а) и от температуры закалки (б). Скорость охлаждения г>1<я2<аз- |
|
Молекулярная масса |
|
280-288°С |
|
Температура закалки?88°С 310-324*С |
Способ рекомендуется для получения ровных (без коробления) листов. Снижение пористости изделий может быть достигнуто спеканием в инертной среде (азот; аргон), что также улучшает другие свойства и позволяет уменьшить давление прессования [3].
Компрессионным формованием с последующим спеканием изготовляют как непосредственно готовые изделия, так и блоки для дальнейшей механической переработки. ПТФЭ хорошо обрабатывается на всех металлообрабатывающих станках, и этим способом могут быть изготовлены самые сложные детали. Однако при механической обработке требуются значительные затраты труда и, как правило, при этом образуются большие отходы полимера. В связи с этим в последнее время создан ряд новых процессов переработки (и оборудование), свободных от указанных недостатков. Все же механическая обработка широко используется при переработке ПТФЭ. Этим способом изготовляют листы и пленки из ПТФЭ, применяемые в электротехнической, химической и других отраслях промышленности. Для электроизоляционных назначений используют блоки высотою до 300 мм и толщиною стенок 75—110 мм. Листы и пленки для химической промышленности строгают из заготовок высотою 1200 мм и толщиною стенок до 175 мм, масса таких заготовок может достигать 400 кг.
Любая токарная обработка ПТФЭ требует учета особенностей полимера. В этом полимере сочетаются пластичность и упругость, для него характерны низкая электропроводность, высокие коэффициенты термического расширения и др. Важна выбрать правильные скорости обработки. Так, оптимальная скорость обработки составляет 60—150 м/мин, а скорость подачи инструмента — 0,13—2,3 мм на оборот. При большей скорости обработки следует применять хладагент. Инструмент, особенно для получения широких пленок и листов, должен иметь специальную конструкцию. Электроизоляционную пленку можно подвергать прокатке для повышения электрической прочности. Строжкой блоков можно получать тонкие конденсаторные пленки (толщиной меньше 10 мкм).
Изостатическое прессование. Способ формования порошкообразного ПТФЭ с помощью воздушного или гидравлического давления через эластичную мембрану позволяет изготовлять полые изделия, в том числе сложной конфигурации (рис. VII. 4). Резиновая или другая эластичная мембрана может служить либо пуансоном, либо матрицей, при этом второй элемент матрицы выполняется жестким из металла. Порошок ПТФЭ засыпается в зазор между матрицей и пуансоном, после чего под давлением он уплотняется и формуется в заготовку для спекания. Спекание заготовки проводится по описанному ранее режиму.
Изостатическое прессование приобрело особое значение после создания свободносыпучих марок суспензионного ПТФЭ. Эти марки позволяют получать тонкие изделия (до 1 мм) и упрощать трудоемкую операцию заполнения формы порошком. Изостатическое прессование применяется для получения малых и больших сосудов, труб большего диаметра, трубной арматуры и фасонных изделий сложной формы. В конце 1960-х начале 1970-х гг. созданы новые установки для изостатического прессования, которые позволили существенно улучшить этот процесс и повысить его экономические показатели. Для ряда изделий производительность изостатического прессования значительно превышает этот показатель для других способов переработки. Давление прессования для чистого ПТФЭ составляет 28—42 МПа (280—420 кгс/см2) и до 70 МПа (700 кгс/см2) для наполненных композиций [4].
Затруднительным моментом изостатического прессования является удаление воздуха при прессовании (особенно при изготовлении толстостенных блоков), который заключен в частицах и между частицами порошка ПТФЭ. В отличие от компрессионного прессования при изостатическом процессе формование происходит по цилиндрической поверхности, а не по горизонтальной плоскости, что создает другую ориентацию частиц
полимера и приводит к существенному изменению свойств изделий. Так, строганая пленка, при изготовлении которой срезание идет параллельно поверхности прессования, имеет физикомеханические характеристики, в несколько раз превышающие аналогичные показатели для пленки, полученной с помощью компрессионного прессования.
 Автоматическое прессование. Создание свободносыпучих марок ПТФЭ разрешило проблему дозирования порошка и открыло возможности разработки автоматических методов получения изделий из ПТФЭ. Этот метод наиболее выгоден при
Автоматическое прессование. Создание свободносыпучих марок ПТФЭ разрешило проблему дозирования порошка и открыло возможности разработки автоматических методов получения изделий из ПТФЭ. Этот метод наиболее выгоден при
|
|
Рис. VII. 4. Схема изостатического прессования заготовки из ПТФЭ:
/ — металлический стержень; 2,6 — крышки; 3 —порошок ПТФЭ; 4—жесткая форма; 5—эластичная форма.
Рис. VII. 5. Схема плунжерного экструдера:
/ — бункер; 2 — вибропитатель; 3 —нагреватели; 4 —термопары; 5 —камера спекания;
6 — экструдат; 7—поршень; 8 — цилиндр.
Производстве большого числа некрупных изделий достаточно простой формы (кольца, втулки, подшипники, прокладки).
Автоматические пресса используются как механические, так и гидравлические мощностью до 150 кН (15 тс). Дозирующие устройства оборудуют вибропитателями. Давление, как правило, повышенное [до 100 МПа (1000 кгс/см2)] по сравнению с компрессионным прессованием, что необходимо для достижения высокой производительности.
Установки для автоматического прессования укомплектованы печами для спекания, которые могут: работать в периодическом
или непрерывном режиме (печи туннельного типа). На этих установках часто перерабатывают наполненные марки ПТФЭ. Большим достоинством этого метода является отсутствие отходов ПТФЭ, что объясняется изготовлением непосредственно готового изделия и точным дозированием порошка.
Плунжерная экструзия. Плунжерная экструзия (рамэкстру - зия) — это непрерывный процесс получения труб, стержней, различных профильных изделий из ПТФЭ и его наполненных композиций. Плунжерный экструдер (рис. VII. 5) работает в автоматическом режиме. Для плунжерной экструзии используются марки ПТФЭ, которые имеют хорошую сыпучесть. Они изготовляются либо гранулированием порошка путем перемешивания в воде, либо спеканием ПТФЭ при 380—390 °С в течение 90 мин и последующим измельчением до частиц с размерами 0,75—1 мм [5]. Процесс экструзии осуществляется следующим образом.
Порошок ПТФЭ из бункера подается на лоток вибропитателя, с которого ПТФЭ поступает на питательную тарелку с распределительной планкой. Вращением распределительной планки порошок засыпается в верхнюю часть камеры спекания. Затем порошок движением плунжера уплотняется и проталкивается в зону спекания. Плунжер отходит в верхнее положение, и в освободившуюся зону камеры спекания вновь засыпается порошок. В зоне спекания ПТФЭ нагревается выше температуры плавления и спекается.
Камера спекания состоит из нагревательных блоков, максимальная температура которых.400°С. Давление, возникающее в результате расширения порошка (примерно на 25%) при нагревании и особенно при плавлении полимера, способствует сплавлению частиц в монолитный блок. Величина давления определяется соотношением поверхности трения к сечению экструдера. При изготовлении труб давление экструзии наиболее высокое, что может приводить к расслоению экструдата по плоскости разделения дозировочных порций. Давление может быть изменено как за счет длины камеры спекания, так и за счет применения дорна с переменным сечением. Отношение длины к диаметру камеры спекания при изготовлении труб 40, а стержней — 80. Давление экструзии может быть снижено также использованием подвижного дорна. При производстве стержней давление экструзии может быть недостаточным для полного спекания экструдата. В этих случаях используется специальное приспособление, устанавливаемое после камеры спекания. Оно представляет собой втулку с внутренним диаметром меньше диаметра цилиндра камеры спекания. Скорость экструзии зависит от толщины или диаметра экструдата и обычно составляет I—20 м/ч. При изготовлении тонких стержней используется многоканальная оснастка.
Плунжерной экструзией получают стержни диаметром до 80 мм, трубы диаметром до 200—300 мм и различные профильные изделия. Чаще всего эти изделия используются в электро* технической промышленности.
В промышленности применяются экструдеры в основном вертикального типа; изделия большой длины производят на горизонтальных экструдерах. Элементы экструдера, соприкасающиеся с расплавом ПТФЭ, либо хромируют, либо выполняют из хромоникелевых сплавов (ЭИ-437Б). Чистота обработки рабочей поверхности оснастки V 9 — V 10.
Плунжерная экструзия по сравнению с компрессионным прессованием имеет следующие преимущества:
1) получение изделий с большой размерной точностью, что упрощает дальнейшую обработку и снижает количество отходов;
2) изготовление изделий большой длины, ограничение которой диктуется только возможностями приемки изделия;
3) возможность получения изделий из отходов ПТФЭ.
Способ плунжерной экструзии особенно предпочтителен при
Изготовлений мелких и средних по величине изделий.
Другие способы. Кроме вышеуказанных способов переработки суспензионного ПТФЭ могут использоваться и другие, в том числе вторичная обработка заготовок. К ним следует отнести горячее штампование листов, получение пористых изделий, изготовление армированных пластин. Штампование проводится при 300—350 °С и давлении 15—40 МПа (150—400 кгс/см2) [6]. Недостатком изделий, полученных горячим штампованием, является потеря формы при температуре эксплуатации выше 150°С. Специальные режимы тепловой обработки позволяют поднять эту температуру до 260°С. Получение пористых изделий чаще всего основано на введении наполнителя, который при спекании или после удаляется растворением, возгонкой или химической обработкой [7, с. 5]. Другой способ основан на применении предварительно термообработанного и измельченного порошка. Прессуют такие порошки при давлении 45—85 МПа (450—850 кгс/см2). Пористые изделия (пористость 5—15%) можно получать из обычных порошков при пониженном давлении прессования 2,0—4,0 МПа (20—40 кгс/см2). Производство армированных пластин, употребляемых для изготовления фоль - гированных диэлектриков, основано на горячем прессовании стеклотканей и пленок из ПТФЭ, уложенных в чередующемся порядке. Для лучшей адгезии ПТФЭ к стеклоткани и фольге применяются пленки из термопластичных фторполимеров (например, фторопласта-4МБ). Охлаждение под давлением позволяет получать армированные пластины с ровной поверхностью.
Дисперсионный политетрафторэтилен
При переработке дисперсионного ПТФЭ, полученного эмульсионной полимеризацией, используется способность этого порошка при смешении с органическими жидкостями ориентироваться
Под действием деформации сдвига. Паста, полученная из дисперсионного порошка и жидких углеводородов (С8—С^), обладает удовлетворительной текучестью, а полученный экстру - дат имеет достаточную прочность для дальнейшей обработки. Такой экструдат, высушенный при повышенных температурах и нагретый до 360—370 °С, дает сплошные прочные изделия, форма которых подобна форме неспеченного экструдата. На этих свойствах основано получение из дисперсионного ПТФЭ труб и тонких трубок, неспеченных уплотнительных жгутов различного профиля и размеров, уплотнительной ленты и наложение изоляции при изготовлении проводов.
Дисперсионный порошок в смесителе, работающем на принципе пересыпания порошка, смешивается с бензином (легкая фракция) или другой органической жидкостью и выдерживается двое суток для обеспечения проникновения жидкости в поры порошка. Пасту, содержащую 18—22% (масс.) смазки, прессуют в таблетки при давлении 1,5—3,0 МПа (15—30 кгс/см2) [8]. Продавливание пасты через насадку приводит к получению экструдата необходимого профиля.
Экструдат имеет волокнистую структуру, легко разделяется на волокна, прочность его вдоль оси экструзии до 10 МПа (100 кгс/см2). Экструзия осуществляется под давлением около 10 МПа ^и0 кгс/см2) при коэффициенте сжатия (отношение сечения таблетки к сечению экструдата) 80—120 и до 120 МПа (1200 кгс/см2) при коэффициенте сжатия 2000—3000. Для высоких коэффициентов сжатия должен использоваться ПТФЭ, модифицированный небольшим количеством гексафторпропи- лена.
Для экструзии пасты используются пресса специальной конструкции [9, с. 63—71], состоящие из механического или гидравлического привода, экструзионного цилиндра, пуансона, дорна (для труб и трубок) и набора съемных мундштуков. Набор мундштуков и дорнов позволяет получать изделия различной формы.
При изготовлении труб экструдат высушивается горячим воздухом '■•••. 100—120°С и подается в печь спекания с температурой 370—390 °С. Аппараты для сушки и спекания могут входить в единую линию для производства изделий или быть выполнены отдельно. Как правило, для труб большего диаметр? операции сушки и спекания осуществляются в отдельных аппаратах. При получении тонких трубок и при наложении изоляции все операции выполняются в одном агрегате непрерывно. Спекание труб большого диаметра проводится в стальных оправах; используются горизонтальные печи длиною до 15 м.
Неспеченный уплотнительный жгут изготовляют с использованием в качестве смазки вазелинового масла [13—17% (масс.)]. Экструзия аналогична экструзии пасты при изготовлении труб. Для особо агрессивных сред в качестве смазки могут применяться перфорированные масла (типа УПИ), а также бензин «Галоша» [17—19% (масс.)], который после экструзии удаляется сушкой при 80—120 °С. Жгут имеет волокнистую структуру и является отличным уплотнительным материалом, стойким к большинству агрессивных сред; может применяться до температуры 150°С. Для уплотнительных устройств жгуты круглого или прямоугольного сечения раздавливаются в прокладку толщиною до 0,1 мм.
Сырая каландрированная лента представляет собой двуосно- ориентированную пленку из дисперсионного ПТФЭ. Ее получают путем каландрования неспеченного жгута, изготовленного, как описано выше, и содержащего в качестве смазки 20% вазелинового масла. Жгут раскатывается на валках диаметром 400 мм при 60—70 °С [9, с. 72—75] в пленку шириною до 150 мм и толщиною 45—120 мкм. Вазелиновое масло экстрагируется перхлорэтиленом или трихлорэтиленом при 80—90°С, растворитель удаляется сушкой при 80—90°С. Сырая каландрированная лента используется в качестве электроизоляционного материала для проводов и кабелей. Нанесение изоляции осуществляется путем намотки ленты на жилу и последующего спекания при 370±5°С. Таким способом можно получать самую тонкостенную изоляцию. Лента может использоваться также и для уплотнения резьбовых соединений труб. Чаще всего уплотнительную ленту получают без удаления смазки. Гьо. вые сырая каландрированная и уплотнительная ленты поставляются в виде катушек шириной от 4 до 20 мм.
Активация поверхности изделий из политетрафторэтилена
Известно несколько методов активации поверхности изделий из ПТФЭ, из которых наибольшее значение имеют химическая обработка [10, с. 124] и обработка электрическим разрядом [11, 12]. Предпочтителен метод обработки ПТФЭ растворами натрия в аммиаке или тетрагидрофуране или дисперсией натрия в органическом растворителе. Химический ме, тод обеспечивает наиболее высокую адгезию к фторопласту ибычно применяемых адгезивов и широко используется в техник*..
Однако химический метод из-за применения металлического натрия представляет большую опасность и требует особой осторожности. Хорошую адгезию к адгезивам обеспечивает метод активации пленок из ПТФЭ тлеющим разрядом [13, с. 21—29]. Метод основан на деструкции ПТФЭ на поверхности изделия в результате бомбардировки электронами с образованием свободных радикалов, которые в дальнейшем переходят в присутствии воздуха в устойчивые перекисные радикалы, придающие поверхности ПТФЭ хорошую адгезию к адгезивам [14, 15].
В отличие от химической обработки при действии тлеющего разряда практически не образуется двойных сопряженных связей, и полимер не приобретает коричневую окраску. Глубина обработки меньше 1 мкм. Обработка материала происходит в момент прохождения его между двумя параллельными электродами, на которые подается переменное напряжение частотою 50 Гц. Оптимальное остаточное давление воздуха в вакуумной камере, где происходит обработка, 19,95 Па (0,15 мм рт. ст.).' Разрядный ток и напряжение зависят от остаточного давления и обычно составляют 0,4—0,6 А и примерно 1000 В соответственно. Продолжительность обработки 20 с обеспечивает адгезию 20—40 кН/м. Адгезионные свойства пленок^ обработанных тлеющим разрядом, сохраняются неизменными в течение 7 лет при хранении в комнатных условиях. Адгезия снижается в два раза при прогреве материала при 200°С в течение 200 сут.
Для активации тлеющим разрядом разработаны установки, позволяющие обрабатывать пленки и другие рулонные материалы из фторопластов шириною до 800 мм.
Сварка политетрафторэтилена
Основным методом сварки ПТФЭ является контактно-теп - ловая сварка прессованием. Это обусловлено высокой вязкостью расплава ПТФЭ и приводит к серьезным затруднениям при необходимости сварки сложных изделий. Пленки толщиной 40— 200 мкм обычно сваривают при 370—380 °С и избыточном давлении 0,02—0,04 МПа, время выдержки сварного шва под давлением 5—10 мин [17, с. 83]. Прочность сварного шва при расслаивании составляет около 70—80% прочности основного материала, по прочности на сдвиг сварные швы равноценны не - сваренной пленке.
Сварка листов, пластин и подобных изделий должна выполняться в сварочном приспособлении, обеспечивающем нагрев, сварку и охлаждение под давлением. Особое значение для сварки толстых изделий имеет качество подготовки поверхности под сварку. Необходимо также обеспечить тесный контакт по всей площади сваривания. Известны способы сваривания ПТФЭ с применением теплостойких пленок из термопластичных фторопластов, которые при нагревании плавятся и обеспечивают адгезию между свариваемыми элементами на уровне 80—90% от когезионной прочности ПТФЭ. В качестве таких полимеров используются сополимеры ТФЭ — ГФП (фторопласт-4МБ) и ТФЭ — ПФ(ПВ)Эф (тефлон-РИА).
Переработка отходов ПТФЭ
Многие способы переработки ПТФЭ связаны с получением значительных количеств отходов. Так, механическая обработка на станках может приводить к получению отходов (в количестве до 40% от перерабатываемого ПТФЭ) в виде стружки, лент: остатков заготовок. Основные методы переработки отходов ПТФЭ заключаются в измельчении их до частиц с размерами
Менее 1000 мкм и последующем спекании под давлением. При спекании в замкнутой форме или под давлением могут быть использованы частицы размером 500—1000 мкм. Качество таких изделий значительно ниже качества изделий из исходного (первичного) ПТФЭ, например механические показатели в 2—3 раза ниже. Для получения из отходов изделий высокого качества необходимо проводить измельчение до частиц размерами 100 мкм и менее.
Измельчение отходов обычно осуществляют в две стадии. Вначале на грубых ножевых мельницах получают гранулы размером 2—5 мм, затем на мельницах типа ИПР измельчают до порошка с размером частиц 500—1000 мкм или на специальных мельницах (вихревые, струйные) получают порошок с размером частиц 20—100 мкм. ПТФЭ очень трудно поддается тонкому измельчению, поэтому необходимо проводить процесс при температуре около 0 °С и ниже и эффективно отводить тепло, выделяющееся при помоле. В работе [15] описан следующий способ измельчения отходов ПТФЭ. Регенерируемый материал подается потоком воздуха при давлении до 7 МПа (70 кгс/см2) и сверхзвуковой скоростью в камеру с мишенью ил карбида вольфрама. В результате адиабатического расширения воздуха ПТФЭ охлаждается и дробится на частицы неправильной формы размером около 20 мкм. Этим способом можно перерабатывать отходы чистого и наполненного ПТФЭ. Измельчение при низких температурах также дает возможность получить порошок с частицами размером 30 мкм [16].
ТЕРМОПЛАСТИЧНЫЕ ФТОРСОДЕРЖАЩИЕ ПОЛИМЕРЫ
Все промышленные фторсодержащие полимеры, за исключением ПТФЭ, являются термопластичными полимерами и относятся к числу так называемых «плавких» фторопластов. Вязкость расплава при температуре переработки термопластичных фторсодержащих полимеров (ТФП) находится в пределах 103 ч - 105 Па-с (104—10® П) (табл. VII. 1), что позволяет перерабатывать их всеми общепринятыми для обычных термопластов способами. Однако при переработке ТФП необходимо учитывать ряд факторов.
1. Температура плавления и перехода в вязкотекучее состояние у ТФП выше, чем у обычных термопластов, что обусловливает более высокую температуру переработки этих полимеров. , Температура переработки отдельных видов ТФП тем выше, чем выше их температура плавления (см. табл. VII. 1) и находится1 ' в пределах от 200—225°С для ПВДФ и до 380—430°С для со-' полимеров ТФЭ —ГФП и ТФЭ —ПФ (АВ)Эф.
2. Несмотря на высокую термостойкость ТФП, при температуре их переработки выделяются небольшие количества агрессивных летучих продуктов, основными компонентами которых являются газообразные HF и НС1 (для ПТФХЭ и его
|
О о о. о <М О Г-» 00 См со со 1 см |
|
О О Со |
|
О См См |
|
О Т?” См |
|
О См |
|
* «г : 2 н <У с5 |
|
<и о. О к о с с; с а - <у 8 КО 5 й) И я 0)0 о На. й^ ° |
|
»0.2 - | ЬЗ * Й 2 = ° !-=-3 |
|
О Со Со |
|
О о о — О См см со |
|
О о 00 оо со см |
|
||||
|
||||
|
||||
|
||||
|
||||
|
||||
|
|
|||
|
||||
|
||||
|
||||
 |
||||
|
||||
|
||||
|
||||
|
||||
|
||||
Сополимеров). Они вызывают коррозию оборудования в местах контакта ТФП с формующими частями, если они изготовлены из обычной стали.
3. 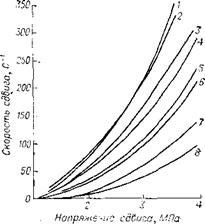 Вязкость расплава большинства ТФП с высокой температурой плавления выше вязкости расплава обычных промышленных термопластов и в ряде случаев может быть снижена только при температурах, граничащих с температурой разложения материала. Ньютоновский режим течения этих ТФП, т. е. пропорциональная зависимость между скоростью деформации сдвига V и напряжением сдвига т (рис. VII. 6) [18, с. 10], достигается только при определенных условиях формования. Критическая скорость сдвига у некоторых, особенно перфторированных, ТФП ниже, чем у обычных промышленных термопластов.
Вязкость расплава большинства ТФП с высокой температурой плавления выше вязкости расплава обычных промышленных термопластов и в ряде случаев может быть снижена только при температурах, граничащих с температурой разложения материала. Ньютоновский режим течения этих ТФП, т. е. пропорциональная зависимость между скоростью деформации сдвига V и напряжением сдвига т (рис. VII. 6) [18, с. 10], достигается только при определенных условиях формования. Критическая скорость сдвига у некоторых, особенно перфторированных, ТФП ниже, чем у обычных промышленных термопластов.
Рис. VII. 6. Кривые течения ТФП и других полимеров (снятые на экструзионном реометре):
/ — полипропилен (240 °С); 2—фторопласт*30 (260 °С); 3 —полиэтилен-высокой плотности (2°0 °С); 4—фторопласт-2М (220 °С); 5 — пентапласт (200 °С); 6— фторопласт-2 (220 °С);
7 —фторопласт-40 (280 °С); 8 — фторопласт-ЗМ (280 °С).
Температуры экструзии для кривых течения определены по установившимся значениям: расход экструдата — давление в головке.
1сходя из вышеперечисленных особенностей ТФП, при подборе оборудования для переработки и режимов их формования должны быть предусмотрены особые требования [9].
1. Формующие части оборудования, контактирующие с расплавами ТФП (червяки, цилиндры, головки, решетки, сопла, сетки и др.), должны быть изготовлены из коррозионностойких легированных сплавов типа ХН77ТЮР (ЭИ-437Б) или 47НХМ. За рубежом для этих целей используют сплавы хастеллой, дю - раникель, монель-400. Формы могут быть выполнены из стали с хромовым или никелевым покрытием. Следует отметить, что некоторые ТФП, легко формующиеся при относительно низких температурах (200—250 °С), например ПВДФ (фторопласт-2 и 2М), сополимер ТФХЭ — Э, могут перерабатываться и на обычном оборудовании, используемом для получения изделий из по - лиолефинов, поливинилхлорида и других термопластов, при условии недлительной эксплуатации оборудования. Для предотвращения коррозии в этом случае рабочие части оборудования
Должны быть изготовлены из стали с твердохромовым или никелевым покрытием или из нитрированной стали.
2. Для получения истинного гомогенного расплава машины для формования ТФП должны иметь несколько зон (три-четыре) пластикации с самостоятельным обогревом и охлаждением каждой зоны для точного регулирования температуры в узких пределах. Температура в зонах должна достигать 430 °С для переработки перфторированных ТФП.
3. В связи с выделением при переработке ТФП токсичных летучих продуктов оборудование должно быть обеспечено хорошо работающей вентиляцией.
4. Скорость сдвига расплава не должна превышать критического значения. При превышении критической скорости сдвига нарушается стабильность течения расплава и происходит «дробление» расплава, проявляющееся в шероховатости, шелушении, расслаивании поверхности изделия. Для исключения дробления расплава необходимо снизить скорость сдвига, уменьшив скорость движения червяка, скорость впрыска и, увеличив сечение литниковых каналов, или повысить критическую скорость сдвига, увеличив температуру расплава ТФП.
5. При переработке ТФП должны быть обеспечены форсированные режимы переработки, исключающие накопление частиц расплавленного фторопласта в рабочих зонах машин. Не допускаются перерывы или остановка машины в процессе получения изделий. После окончания работы на машине необходимо максимальное удаление из нее остатков материала. При чистке рабочих частей рекомендуется персоналу использовать шланговый противогаз марки ПШ, рабочее место для чистки отдельных частей оборудования должно быть оснащено хорошо работающей вентиляцией.
Способы переработки
Литье под давлением — это один из наиболее производительных способов для получения тонко - и толстостенных изделий с конфигурацией любой сложности. Для переработки литьем под давлением используют литьевые машины с червячной пластикацией, обеспечивающей возможность прогрева материала в зонах пластикации до 300—400 °С. Обычно используют литьевые машины серии КиАБУ (ГДР) с червячной пластикацией, отечественные литьевые машины с регулированием давления литья в широких пределах и с дополнительными устройствами для термостатирования литьевых форм, а также в отдельных случаях модернизированные стандартные литьевые машины. Основные технологические параметры литья под давлением приведены в табл. VII. 2 [18—20]. При получении изделий сложной конфигурации центральный и распределительный литники должны быть короткими, широкими, плоскими, с минимальной конусностью. В зависимости от условий литья, размеров и конфигу
Рации изделий литьевая усадка находится в пределах 1—2,5%. Для снижения усадки сложных изделий, например из фторо - пласта-42ЛД, подпитку продолжают и после впрыска, при этом форму с изделием охлаждают проточной водой под давлением. Удельное давление литья, как правило, составляет 90—150 МПа (900—1500 кгс/см2). Большое значение при литье под давлением имеет стабильность температуры формы, индивидуальной для каждого вида фторопласта.
Экструзия, так же как и литье под давлением, наиболее производительный и распространенный способ переработки ТФП. Для экструзии используют червячные экструдеры с отношением длины к диаметру червяка (20 - f - 25) : 1. В длинных цилиндрах создается большая площадь теплопередачи и нагревание полимера происходит равномерно. Отношение длины зоны питания, транспортирования и плавления к длине зоны гомогенизации и сжатия расплава до давления, достаточного для выдавливания его через мундшт^^к, составляет примерно 3:1. Решетка в головке экструдера способствует переводу вращательного движения расплава в прямолинейное. Необходимо регулирование частоты вращения червяка от 1 до 60 об/мин. Приспособления для приема изделий должны обеспечивать быстрое охлаждение и точную стабилизацию температуры.
Экструзией получают трубы с различным диаметром и толщиной стенок, профили, прутки, пленки, изоляцию проводов (первичную и оболочки), волокно и др. Основные технологические параметры экструзии труб из ТФП приведены в табл. VII 3 [18—20].
Экструзию пленки осуществляют через формующие головки двух типов: плоскощелевую для получения пленки в виде ленты и с кольцевым зазором для производства рукавной пленки [50, с. 16—21]. Скорость движения вытягивающих устройств должна регулироваться в широком диапазоне, при этом необходимо предусмотреть систему быстрого охлаждения с помощью охлаждающих валиков или водяной ванны. Для экструзии применяют ТФП с более высокой вязкостью расплава, чем при переработке литьем под давлением. Температура экструзии выше температуры литья под давлением.
Выдувное формование рекомендуется для получения особенно тонкостенных изделий и изделий с большой площадью из высоковязких ТФП. Заготовки для выдувного формования готовятся при тех же температурных режимах, с теми же мундштуками и дорнами, как и для производства трубок. Давление составляет 0,1—0,4 МПа (1—4 кгс/см2), температура и продолжительность замыкания формы должны контролироваться. Способом термоформования можно изготовлять изделия из пленок на основе ТФП.
Компрессионное прессование применяют при получении толстых изделий с большой площадью (плит, блоков-заготовок, брусьев, листов) и в производстве малосерийных изделий.
|
О о о о СО «? о ^ —' — см од. М М I < о о о о О •>*■ СП м |
|
С> о о о СО СО х*> Мм 1Л1ЛОО |
|
О о о о со о о о СМ СО «О 01 ММ О о о о <£> 00 •Х’ СО См см см —• |
|
О о со со I I оо о о |
|
О 1Л о о О О ■-Ч »— См см см — Мм 1-0 о о о 00 О — оо - МО) |
|
Мм Ююоо |
|
! I О О Со о |
 |
|
|
|
|
|
|
|
|
О 1/3 1Л о со со 'Л1 СМ 1-4 см *— |
|
0 0 0 1/30 1Л О —• СМ О — — О! см — И II I с Ооооо ■'З* со СГ> <— ю |
|
Ооооо _ го ^ о см 2 СМ С'Ч СО — ^ 1 М М см I ООООО 2 СМ СО СО СО 10 ^ СМ СМ СМ см |
|
0001Л0 Ю СО <Л — о см см •—• М м I О <~> О ОО СО оо — ^ |
|
О ю о о Щ1ПЙМ см см — |
|
ОЙСО Щ со М! М(М |
 |
|
|
|
|
|
|
|
|
|
|
С? о о - ■ч* Г"- со См с^с-, |
|
ООО оо _ О см 1_о г - см о См см см см —• игз ■'*■ М I М I I О О О О О СО о С~- *— СО 1/3 ю см — СМ см СМ |
|
|
|
|
|
ОЯ |
|
|
О о •*}* ю СМ со со — |
Ю ю |
|
Мм |
1 1 |
|
1Л (Л см СМ СМ СМ — |
|
I м I ЮЮОо |
|
О 1Л о ю о СМ СО СО со о СМ СМ СМ СМ *— 1/3 - М м Мс О 1-0 О О О СО г— см г-1 со ю см см см см |
|
Ооооо _ ^ со “ «*■ 1.0 <? Ем см со со — ^ I I I I I соХ Ооооо — ю а> о см с» см см со — |
|
Од О О о — СО СО ■«* / III О Ю О иэ |
|
■5 со ю со см С* СМ СО СО *— /ММ со оо о о — о о СМ со СО (Л о СМ СМ СО СО ~ |
|
К?? К % Я | , * а Т у ев 5 3 X И О с* щ О (-• ГГГ С Н Ш *£ Й О? |
|
!£ ч „ Ёж5а 15а8«Зоё|й“ , о а^«? I* к 2 « р о Ж X <у и 5 5 5 у Д •а* ^ а.« в О ^ >> со гг |
|
О О О о ь» с> см со см см го см 1)11 оо о о СО ^ а ю см см о —' |
|
И £ |
|
1 I о о см о |
|
Экструзия лент и пленок. Экструзия прутка диаметром 1,5 мм. |
|
>> 2 И га |
|
Йй |
|
А о ^ Г» <п _ м? в ь |
|
||
|
||
|
 |
|
|
||
Технологические параметры компрессионного прессования ТФП приведены в табл. VII. 4 [18, 20].-
ТА.6ЛИЦА VII, 4
|
Технологические параметры компрессионного прессования некоторых отечественных ТФП Фторопласт *
|
|
* Толшина 1—2 мм» ** На 1 мм толщины. |
Литьевое прессование ТФП используют для получения деталей значительной массы (5 кг и более) и габаритов, а также для футерования вентилей, трубной арматуры и других изделий. Формой служит футеруемая деталь. Расплав в нее может подаваться из тигля, экструдера или из литьевого агрегата. Охлаждение проводят под давлением. Для регулирования скорости кристаллизации применяют охлаждение воздухом или водой [21, 22].
Ротационным формованием получают изделия из сополимеров ТФЭ — Э и ТФХЭ — Э. Ротационное формование осуществляют в обычных формах, например, из алюминия со стальными вкладышами, но с радиусом изгибов более 12—-13 мм для получения равнотолщинных изделий с гладкой поверхностью.
Термоусадочные изделия из ТФП получают из экструзионных, выдувных или литьевых изделий (заголовок) растяжением или раздувом этих заготовок (на 50—100%) с последующей термической обработкой для восстановления первоначальных размеров и формы изделий. Для изготовления термоусадочных изделий применяют сополимер ТФЭ — ГФП (фторопласт-4МБ), сополимер ТФЭ —Э (фторопласт-40), ПВДФ (фторопласт-2 и 2М). Эти ТФП (за исключением фторопласта-4МБ) перед вытяжкой подвергают радиационному облучению, что увеличивает их способность к термоусадке и повышает прочность термоусадочных изделий [19].
Заслуживает внимания и непрерывный способ получения ламинатов с использованием ТФП. Тройной ламинат ПТФЭ — сополимер ТФЭ — ГФП — металл в виде рулонного материала
Получают сплавлением пленок ПТФЭ с металлом с использованием промежуточного слоя сополимера в качестве адгезива. Прочное сцепление сополимера с прочностью на сдвиг 12,6 МПа (126 кгс/см2) получают нагреванием при температуре 315— 370 °С при небольшом давлении.
Особенности переработки отдельных видов фторопластов
Сополимеры ТФЭ — ГФП и ТФЭ —ПФ(АВ)Эф вызывают наибольшие трудности при переработке из-за низких значений критической скорости сдвига (3—5 с~> для ТФЭ — ГФП). Для исключения явления дробления расплава сополимеры должны перерабатываться при низких скоростях впрыска при литье под давлением. Оборудование должно обеспечивать точность регулирования напряжения сдвига (давления впрыска) 0,3—0,4 МПа (3—4 кгс/см2), скорости сдвига (скорости впрыска) 0,05—2 с и температуры цилиндра и формы 1—2°С [18, 23]. Литье иод давлением сополимера ТФЭ — ПФ(АВ)Эф проводят при температуре расплава 340—430 °С и формы 200 °С, Экструзию этих сополимеров рекомендуют проводить при низком числе оборотов червяка [23], через широкую профилирующую щель с последующей вытяжкой до необходимых размеров экструдата. Для исключения дробления расплава можно дополнительно снижать вязкость расплава непосредственно в головке, повышая температуру в этой зоне для сополимера ТФЭ — ГФП до 405 °С.
ПТФХЭ перерабатывают при температурах, близких к температуре разложения. Поэтому необходим точный и строгий контроль за температурой и длительностью нагревания материала. При переработке должна быть исключена возможность попадания следов смазки и других органических загрязнений. » Для придания изделию желаемых свойств очень важен режим охлаждения. Лучшие свойства изделий достигаются при резком охлаждении материала для максимального содержания аморфной фазы, однако при большой толщине изделий это трудно достижимо. Наиболее распространенным методом переработки ПТФХЭ является компрессионное прессование, хотя не исключаются и методы экструзии и литья под давлением.
Сополимеры ТФЭ — Эи ТФХЭ — ВДФ (ф т о р о - п л а с т - ЗМ) по легкости переработки в изделия занимают промежуточное положение между ТФП типа сополимеров ТФЭ — ГФП, ТФЭ — ПФ(АВ)Эф и ПТФХЭ и остальными фторопластами (сополимером ТФХЭ — Э, ПВДФ). Критическая скорость сдвига сополимера ТФЭ — Э 500—1000 см~'. Его перерабатывают экструзией, литьем под давлением, литьевым прессованием, выдувным и ротационным формованием, компрессионным прессованием. Из фторопласта-ЗМ получают конструкционные изделия прессованием, пленку и трубы — экструзией.
Сополимер ТФХЭ — Э, ПВДФ (фторопласт-2 и 2М) легко перерабатывают всеми обычными для термопластов способами (литье под давлением, экструзия, выдувное и ротационное формование, прессование и др.) в любые изделия без особых ограничений. Их можно перерабатывать даже на обычном для термопластов оборудовании при условии недлительной его эксплуатации. Листовой сополимер ТФХЭ —Э особенно при" годен для изготовления изделий на вакуумных и пневматических формовочных машинах. Полые изделия (флаконы, лабораторная посуда) получают на экструзионно-выдувных автоматах при температуре формы 120—140°С и в формующей головке 240— 260 °С с последующим раздувом при избыточном давлении воз - духа 0,09—0,1 МПа (0,9—1 кгс/см2). Продолжительность цикла 25—40 с [20]. Для получения термоусадочных трубок из ПВДФ его гранулируют при 225°С и ‘экструдируют в трубки при 265°С. Для этой цели используют также смесь ПВДФ с 0,5—3% сшивающего агента, например триаллилцианурата. Полученные трубки облучают небольшой дозой ионизирующей радиации 0,025—0,1 МДж/кг (2,5—10 Мрад) для повышения термостойкости и разрушающего напряжения при растяжении.
Сополимер ТФЭ —ВДФ (ф т о р о п л а с т - 42) наиболее пригоден для производства конструкционных изделий и футерования арматуры литьем под давлением [21, с. 133]. При литье фторопласта-42 в чугунную арматуру ее предварительно нагревают до 200—250 °С, что позволяет применять давление литья не более 60 МПа (600 кгс/см2).
ПВФ занимает особое место в ряду ТФП при переработке. Температуры его переработки и разложения очень близки (см. табл. VI 1.1), и оказалось необходимым разработать специальные методы экструзии ПВФ в пленку. Для существенного снижения температуры экструзии в ПВФ вводят латентные растворители, например диметилфталат, дибутилсебацинат. Температура экструзии (120—175°С) должна быть ниже температуры кипения латентного растворителя во избежание образования пузырей в пленке. Растворитель удаляют в процессе экструзии и сушки пленки. Пленку ориентируют в продольном и поперечном направлениях. В отсутствие растворителя можно экструдировать только модифицированный ПВФ. Полимер должен иметь более низкую вязкость расплава и содержать смазку, например воск полиэтиленовый или полиэфирный [1,5—2% (масс.)], и термостабилизирующие добавки (обычно такие же, как при переработке ПВХ).
Механическая обработка, сварка и склеивание
Все ТФП легко подвергаются механической обработке: сверлению, распиливанию, фрезерованию, токарной обработке, нарезанию резьбы и др. Все они способны свариваться. Необходимую температуру сварки достигают подачей горячего воздуха или инертного газа. Пленки ТФП можно сваривать с помощью ультразвуковых и диэлектрических импульсов [24].
Для склеивания большинства ТФП с металлическими поверхностями требуется предварительная обработка поверхности полимера для последующего нанесения термостойкого клея. Для сополимеров ТФЭ — ГФП, ТФЭ —Э обработку поверхности изделия проводят теми же методами, которые применяются для ПТФЭ (см. стр. 193). Склеивание ПТФХЭ осуществляют с помощью ненасыщенных аминосоединений в комбинации с клеем, например аминоаллилметакрилатом [25, с. 257]. Пленки и листы фторопласта-ЗМ склеивают эпоксидными клеями без предварительной обработки поверхности.
Пигментирование
Для получения окрашенных в различные цвета изделий из ТФП применяют сухое смешение порошка полимера с термостойкими пигментами, например двуокисью титана, кадмием красным или желтым, хромом зеленым и другими, или с концентратом пигмента (порошок полимера, содержащий до 20% пигмента), а также введение пигмента в процессе формования изделий из гранул полимера.
Вторичная переработка
ТФП могут подвергаться вторичной многократной переработке с учетом чистоты получаемых материалов и их молекулярной массы после повторной переработки. Большинство ТФП за время короткого цикла переработки не успевает существенно изменить молекулярную массу в результате процессов сшивания или деструкции. Поэтому при переработке ТФП практически нет отходов производства.
При переработке ТФП необходимо строго руководствоваться всеми положениями, правилами техники безопасности и инструкциями для каждого конкретного вида ТФП и типа переработки.
СУСПЕНЗИИ И ЛАКИ. ПОРОШКИ ДЛЯ НАПЫЛЕНИЯ
Выдающаяся устойчивость к агрессивным средам, теплостойкость, высокие антиадгезионные и электрические свойства, низкий коэффициент трения предопределили широкое применение фторсодержащих полимеров в качестве покрытий. Так как вышеуказанные свойства в наибольшей степени присущи перфто - рированным полимерам, нерастворимым в обычных растворителях, были разработаны специальные способы получения покрытий из суспензий, представляющих собой тонкодисперсные взвеси порошка полимера в воде или органической жидкости. Основные вопросы теории и практики получения суспензий ПТФЭ и ПТФХЭ (первых промышленных суспензий фторполимеров), покрытий на их основе изложены в работах [25, с. 222—233, 247-256; 26, с. 153—180].
Водные суспензии фторсодержащих полимеров получают из дисперсионных марок ПТФЭ, сополимеров ТФЭ с ГФП, этиленом (фторопласт-4Д, 4МД, 40Д соответственно), имеющих шарообразную форму и небольшой размер частиц. Нестойкие водные дисперсии ПТФЭ с концентрацией около 20%, образующиеся в процессе полимеризации, сразу же после полимеризации стабилизируют введением неионогенных поверхностно-активных веществ (НПАВ), например ОП-7 [27], образующих на каждой частице полимера защитные оболочки.
Стабилизированную суспензию концентрируют до содержания сухого вещества 50—60%. Концентрирование (седиментацию) проводят в поле гравитационных сил при центрифугировании или электродекантацией. Центрифугирование осуществляют на специальных центрифугах с частотой вращения вала до 10 000 об/мин. Пептизацию (восстановление суспензии из осадка) осуществляют добавлением при перемешивании дистиллированной воды в количестве, необходимом для образования суспензии заданной концентрации. Полная пептизация осадка в концентрированную стабильную суспензию происходит при содержании ОП-7 в суспензии 5—6% (масс.) и концентрации осадка, не превышающей 76—80% дисперсной фазы. С целью придания способности смачивать спеченный полимер в суспензию добавляют дополнительное количество ПАВ до общего содержания &—12% от массы полимера [26, с. 175—177].
Получение суспензий электродекантацией осуществляют в сосудах (электродекантаторах), разделенных диафрагмами, помещенными между электродами. Частички полимера, несущие электроотрицательный заряд, осаждаются на стенках диафрагм (через которые проходит электрический ток) и постепенно опускаются на 'дно. Повышения концентрации суспензий достигают постоянным выводом дисперсионной среды из верхней части сосуда и концентрированной суспензии из нижней части [25, с. 222—223]. Коллоидные характеристики суспензии фторопла - ста-4Д описаны в работе [27].
Неводные суспензии ПТФХЭ, сополимера ТФЭ — Э (фторо - пласта-40Д) и других полимеров получают, измельчая полимер в дисперсионной среде на коллоидной, шаровой или других мельницах. В качестве дисперсионной среды применяют спирты или их смеси с другими органическими жидкостями. При размоле агрегаты полимерных частиц, имеющие обычно неправильную форму, разрушаются на мелкие, в основном шарообразные, частицы и агрегаты. Размол проводят до достижения определенных значений тонины помола и фракционного (по размеру частиц) состава, устанавливаемых опытным путем. Для получения качественных покрытий суспензия ПТФХЭ должна содержать 60—70% частиц размером до 0,5 мкм, остальное
Количество составляют агрегаты размером от 0,5 до 5—10 мкм. Суспензии на основе фторопласта-4Д и 40Д имеют размер частиц 0,06—0,4 мкм, фторопласта-4МД, 2-СД, 2М-СД — 0,2— 0,3 мкм. Важными характеристиками являются также концентрация и вязкость суспензии. При равной концентрации толщина однослойного покрытия тем выше, чем больше вязкость суспензии. Так как толстые слои легко растрескиваются — для каждой суспензии подбирают оптимальную вязкость.
Неводные суспензии фторсодержащих полимеров отличаются хорошей смачивающей способностью, применяются преимущественно без добавления ПАВ. Они более технологичны при получении покрытий окунанием, с помощью кисти или пульверизатора. Водные суспензии менее пожароопасны. Они также более удобны при получении покрытий и для пропитывания материалов машинным способом.
Суспензии ПТФЭ выпускают четырех марок:
4Д — для производства покрытий, свободных и армированных пленок, фольгированных диэлектриков, эмалированных проводов;
4ДВ — для получения волокна;
4ДП — для изготовления покрытий и пропитывания само - смазывающихся подшипников, набивочных шнуров;
4ДПУ — для пропитки углеграфита.
Основные марки суспензии фторопласта-3:
СК (спиртовая с добавкой ксилола) и СВ (спиртовая с добавкой воды и ПАВ) —для получения покрытий;
С. (спиртовая)—для изготовления пленок.
На основе фторопласта-40Д выпускают водную и неводную суспензии.
Методика нанесения покрытий из большинства суспензий в основном одинакова. Покрытия можно наносить на металлы и другие материалы, выдерживающие высокую температуру, необходимую для сплавления. Перед нанесением покрытия поверхность изделия тщательно очищают от ржавчины, пыли и других загрязнений, острые углы и края закругляют. Для улучшения адгезии поверхность изделия подвергают пескоструйной или дробеструйной обработке, фосфатированию или оксидированию, затем тщательно обезжиривают, промывая растворителем. Пескоструйная обработка увеличивает адгезию фторсодержащих полимеров примерно в 5 раз. Повышения адгезии (и тем самым долговечности) покрытия достигают также применением в качестве грунта суспензии, содержащей тонкоизмельчениую окись хрома (являющуюся одновременно и пигментом). В 30—40 раз повышает адгезию к стали добавление в суспензию ПТФЭ смеси хромовой и фосфорной кислот [20, с. 146].
У одних полимеров, например у ПТФХЭ, адгезионная прочность покрытия зависит от режима охлаждения изделия после термообработки, у других, например у фторопласта-40Д, не зависит.
Суспензию на поверхность изделия наносят методами окунания, полива или распыления с помощью пульверизатора (краскораспылителя типа КРУ-1, КРУ-Ю и др.). Покрытие, нанесенное одним из указанных методов, сушат на воздухе или в термостате, при этом в высохшем слое не должно быть затеков и трещин. Высохшее покрытие сплавляют в печи при температуре, определяемой температурами плавления и текучести полимера (табл. VII. 5). Для перекрывания дефектов и достижения необходимой толщины наносят несколько слоев суспензии последовательно, подсушивая и сплавляя каждый слой. После сплавления последнего слоя покрытие, в случае необходимости, подвергают термообработке, затем охлаждают на воздухе или подвергают закалке холодной водой, которая повышает эластичность и адгезию покрытия. Толщина покрытия определяется его назначением. Для получения антиадгезионного и антифрикционного покрытий из ПТФЭ достаточна толщина 20—30 мкм, для электроизоляционного—100 мкм. Для защиты от коррозии толщина покрытия должна быть не менее 100 мкм, а в случае сильно корродирующих сред 200—400 мкм.
Для получения толстослойных покрытий существуют ускоренные способы, позволяющие наносить слои толщиной 50— 125 мкм каждый [28]. Один из таких способов заключается в добавлении к суспензии ПТФХЭ небольших количеств фторуг - леродной жидкости № 12, оказывающей пластифицирующее действие на полимер. Введение 'этой жидкости предотвращает растрескивание при получении толстого слоя (40—55 мкм), способствует быстрому сплавлению частиц полимера в сплошную пленку. Однослойное без трещин покрытие из ПТФХЭ толщиной до 125 мкм можно получать применением в качестве дисперсионной среды вещества с температурой кипения, близкой к температуре плавления полимера, например хлорированного дифенила. При этом испарение растворителя и сплавление полимера происходят одновременно и полимер не проходит через порошкообразную стадию. Такое же однослойное покрытие можно получать и при применении дисперсионной среды, состоящей из смеси кетона, ароматического углеводорода и хлорированного дифенила.
Применение в качестве дисперсионной среды смеси летучего и высококипящего растворителей положено и в основу получения суспензий из фторопласта-2 и 2М (2-СД и 2М-СД соответственно). В данном случае дисперсионная среда состоит из смеси спирта и ДМФА [20, с. 196—197]. Методика нанесения покрытий из этих суспензий несколько отличается от обычной. Каждый слой суспензии подсушивают на воздухе до состояния влажного геля. Первый слой сплавляют при 250 ±20°С, последующие— при 85—90 °С, затем все покрытие прогревают при 250 ± 20 °С. Растворяющую смесь, состоящую из низко - и высо- кокипящих растворителей, применяют и в суспензии ПВФ.
|
Г ЕГ И ч <У к "Г н Пи ^ |
|
•е-ч |
|
О, Н |
|
Л Со |
|
О о См |
|
|
|
|
|
|
|
|
|
|
|
Н О* К И |
|
А « -1 о* ” Я И |
|
С* О СО |
|
2 к ч з Е) г* |
|
= 5 . а £ | * о о 5Чч8Н О О о И'б' ^ е( ч й о п я к К 0.0.0 ч сод с 5^; * * « * 2«" |§ О о |
|
Аи >? н * та * с,* 0> т |
|
О- К*-» |
|
Я С* |
|
О О А А я |
|
|
|
^ 5 ^3 Ч* £ |
|
Го О Со |
Со |
|
О из о Ю тР |
|
С> Л Та _, о ч З 5 со я |
|
О о Г-4 О |
|
<М СО С} |
|
О Ю <м |
|
|
О 2 та 5 * 3 £ I >>5 5 С{ 53 Ц |
|
СО О СО |
|
|
3 >, О Га |
|
О Я А >, Щ О Ю |
|
И |
|
К К Я Та О- |
|
X О 8 о ~ и та о а х н ч; Я ° р? о Н |
|
Я X О |
|
Режимы нанесения покрытий из суспензий |
|
О |
|
►. И |
 |
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
Покрытия на основе ПВФ получают также из пластизолей, представляющих собой дисперсии полимера в жидком нелетучем пластификаторе, растворяющем полимер при температуре выше 75 °С. Расслаивания полимера и пластификатора при охлаждении не происходит [20, с. 202].
В последние годы разработаны новые рецептуры и способы нанесения дисперсий фторопластов, позволившие значительно расширить области их применения. Способом электрофорезного осаждения можно получать из дисперсионного ПТФЭ свободные от трещин покрытия толщиной 127—635 мкм [29, с. 41—44] с адгезионной прочностью, превышающей 3,5 МПа (35 кгс/см2). Разработан способ нанесения суспензии ПТФЭ на поверхность, покрытую порошкообразной сталью.
Большое значение приобрели слоистые покрытия из тефлона-5 (фирма «Дюпон»), содержащего кроме ПТФЭ легколетучий растворитель и связующий полимерный компонент, благодаря которому улучшается адгезия к субстрату. Композицию наносят в один слой, без грунта, но с соответствующей обработкой поверхности. Покрытия, в отличие от покрытий из одного ПТФЭ, обладают хорошими противокоррозионными свойствами (благодаря меньшей микропористости), высокой износостойкостью и стойкостью к абразивным материалам [29, с. 43—44].
Разработана композиция на основе раствора ПТФХЭ, позволяющая наносить практически бездиффузионное двухслойное покрытие. При этом продолжительность нанесения и спекания покрытия сокращается на 70 и 60% соответственно [30].
Антифрикционные лаки на основе фторопласта-4Д марок ФБФ-48Д, ФБФ-74Д, ВАФ-31 получают из растворов полимерных связующих (типа клея БФ), наполненных тонкодисперсным фторопластом-4Д [20]. Лаки наносят в 2—3 слоя (общая толщина 15—30 мкм). Покрытия из ФБФ-48Д и ФБФ-74Д сушат в течение 2—2,5 ч при 20 °С или 1 —1,5 ч при 50—60 °С, отверждают при 150 °С. Покрытие из лака ВАФ-31 сушат и отверждают при комнатной температуре. Сравнительно низкая температура отверждения этих лаков позволяет наносить их не только на металлы, но и на дерево, пластмассы, ткань. По антифрикционным свойствам покрытия из лаков практически не уступают покрытиям из чистого ПТФЭ, но значительно превосходят их по адгезии и износостойкости (в 5—50 раз). Более высокой износостойкостью обладает покрытие ВАФ-31. Лаки ФБФ-48Д и ФБФ-74Д можно также применять для пропитки тканей и получения антифрикционных текстолитов.
*Лаки на основе растворимых фторсодержащих полимеров, пригодные для получения высокоэффективных защитных покрытий, изготовляют из фторопласта-42Л, 32Л, 23, 26 и 4Н. Для получения лаков применяют смесь активных растворителей (ке - тонов и сложных эфиров) с нерастворителями (спиртами, ароматическими углеводородами). Последниие вводят в количестве, не препятствующем достаточной когезии между высохшими
Слоями и не ухудшающем стабильности лака в течение нескольких месяцев [31]. Вязкость лаков увеличивается с повышением молекулярной массы и концентрации полимера, также с уменьшением
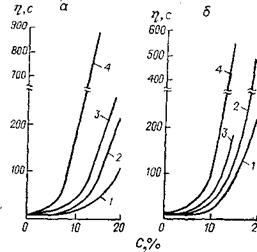 Рис. УТI. 7. Зависимость вязкости растворов фторопла - ста-42Л в различных растворителях от концентрации и молекулярной массы (т]отн) полимера. а: растворитель—ацетон; %тн— 2,1 (/); 2,5 (2); 3,0 (3) 4,2 (4); б: 'Потн==2,5; растворитель — ацетон {!), этил ацетат (2), амилацетат (3), гхиклогексанон (4).
Рис. УТI. 7. Зависимость вязкости растворов фторопла - ста-42Л в различных растворителях от концентрации и молекулярной массы (т]отн) полимера. а: растворитель—ацетон; %тн— 2,1 (/); 2,5 (2); 3,0 (3) 4,2 (4); б: 'Потн==2,5; растворитель — ацетон {!), этил ацетат (2), амилацетат (3), гхиклогексанон (4).
Активности растворителя (рис. VII. 7, VII. 8). Лаковые покрытия из фторопластов-42Л и 32Л сушат при 25—100 °С, из фторопластов-23 и 26 при температурах не выше 50 °С. Продолжитель-
|
Рис. VII. 8. Зависимость вязкости лаков фторопласта-32Л от концентрации и молекулярной массы (г)отн) полимера. А растворитель—■ ацетон : амилацетат : циклогексаион : толуол—25 : 40 ; 10 : 25 (по массе); ^отн — 1 *25 (/); 1,35 (£); 1,42 (5); 1,5 (4), 1,6 (5), {.71 (в); Б: т|оТН==1,35; растворитель — метилэтилкетои (,/); ацетон : этилацетат : бутилацетат : то - луол=20 : 15 г 50 г 15 (по массе) (2); ацетон : амилацетат : =иклогексаиои : толуол» = '.’5 : 40 : 10 : 25 (по массе) (3) |
Ность сушки одного слоя при 20—25 °С составляет 45—60 мин, при 50—100°С — от 30 до 45 мин. Продолжительность сушки- всего покрытия — не менее 6 ч при 100 °С и до 10—15 сут при
20—50 °С [32]. Свойства покрытий в значительной степени зависят от условий их получения (табл. VII. 6).
Для улучшения адгезии и в ряде случаев для снятия внутренних напряжений покрытие после нанесения первого и последнего слоев подвергают термообработке. Повышения адгезии достигают также пескоструйной обработкой покрываемой поверхности, фосфатированием или хромированием поверхности, использованием поливинилбутирально-фосфатирующих и эпоксидных грунтов. Лаки наносят поливом, кистью, пульверизатором или машинным способом с помощью валков. Наибольшее применение получили покрытия из фторопласта-42Л и особенно из фторопласта-32Л.
Лаки на основе ф т о р о п л а с т а-42Л (Ф-42Л)- дают покрытия с высокой прочностью, влаго - и морозостойкостью, антифрикционными свойствами, стойкостью к коррозии и условиям тропического климата. Оптимальная толщина покрытия из фторопласта-42Л для защиты от коррозии 200—250 мкм. Такие покрытия стойки при 50 °С к концентрированной серной и хлорноватой кислотам, ксилолу, бензолу, этиловому и бутиловому спиртам. Вследствие значительной диффузионной проницаемости они нестойки к действию «царской водки», концентрированной азотной и плавиковой кислот [33]. Получение многослойных покрытий излакаФ-42Л осложняется кристаллической структурой сополимера (различной скоростью набухания кристаллических участков с разной степенью дефектности) [31], приводящей к сморщиванию покрытия. Этот недостаток устраняют использованием в качестве растворителя смеси, состоящей из ацетона, этилацетата, амилацетата или бутилацетата, циклогексанона и этилцеллозольва (нерастворителя) в количествах 15, 30, 30, 10 и 15 ч. (масс.) соответственно.
Лак из ф т о р о п л а с т а-32Л (Ф-32Л), обладающего низкой степенью кристалличности, отличается хорошими технологическими свойствами. Для получения лака наиболее широко применяют смесь ацетона, бутилацетата, циклогексанона и толуола в количествах 25, 40, 10 и 25ч. (масс.). Лак Ф-32Л является одним из лучших влагозащитных лаков. Влагопроницае - мость покрытия из него равна 0,16-10-15 кг/(с-м• Па) [0,08 X X 10~9 г/(ч-см-мм рт. ст.)], т. е. в 30 раз меньше, чем влаго-
Проницаемость полиэтилена, в 40—60 раз меньше, чем влаго-
Проницаемость эпоксидных лаков. Покрытия из лака обладают также хорошими антикоррозионными, диэлектрическими и оптическими свойствами, атмосферостойкостью. Защитное действие пленки Ф-32Л (толщиной 100 мкм) от проникновения 98%-ной азотной кислоты в 300—1000 раз выше, чем у пленки
Из Ф-42Л (8—30 сут против 40 мин) [31]. Покрытие хорошо от
Мывается от радиоактивных загрязнений.
На основе фторопласта-32Л выпускают лаки марок: ЛФ-32ЛН-1, ЛФ-32ЛН-2, СП-ФЛ-1, ФП-525 и ряд других.
|
Концентрация лака |
Толщина одного |
Температура, °С |
|
|
(при условной вязкости по ВЗ 4 за 60 с), % |
Слоя, мкм |
Сушки |
Термообработки |
|
8-12 |
10-20 |
50-100 |
Фт о р О |
|
8-12 |
10-20 |
50—100 |
150-270 |
|
8-12 |
10-20 |
50-100 |
150-270 |
|
15-25 |
15-30 |
50-100 |
Ф т о р о |
|
15-25 |
15-30 |
50-100 |
150-220 |
|
15-25 |
15-30 |
50-100 |
150-220 |
|
5-20 |
10-25 |
50 |
Фт о р О |
|
8-15 |
10-25 |
50 |
220-250 |
|
,т |
|
* Различия обусловлены внутренними напряжениями, связанными с кристаллизацией по |
Ниже приведен технологический режим получения покрытия из лака СП-ФЛ-1 методом окунания [34]:
TOC o "1-5" h z Вязкость по ВЗ-4 при 18—23 °С, с...................................... 26
Число слоев........................................................................................................... 12—14
Общая толщина покрытия, мкм.................................................................. ' 200
Температура, °С
,, сушки......................................................................................................... 18—23
Обработки комплексного покрытия..................................... 270
Время, ч
Сушки каждого слоя.............................................................................. 1
Термообработки ..................................................................................... 1
Режим охлаждения............................................................................................ Медленное
В термошкафу
Покрытие, нанесенное по данному режиму, имеет адгезионную прочность 19,5 МПа (195 кгс/см2), коэффициент диффузии 10%-ного раствора НС) при 90 °С 4,3-10~10 см2/с. Покрытия, находящиеся в контакте с такими агрессивными средами, как «царская водка», азотная кислота (концентрацией 12; 3 и 1М), серная, соляная, уксусная и щавелевая кислоты (концентрацией 1 М), едкий натр (1 М) можно эксплуатировать в течение нескольких лет [34].
Описано получение концентрированных (до 60%) лаков в гексафторбензоле сополимеров ТФХЭ—ВДФ, нерастворимых в обычных промышленных растворителях. Лаки пригодны для получения сплошных покрытий и пленок [35].
|
ТАБЛИЦА VII. 6
|
|
Лимера на подложке. |
Лаки на основе ф т о р о п л а с т а-26Л и 23 изготовляют с использованием растворяющей смеси, состоящей'из ацетона, этилацетата, бутилацетата или амилацетата. Их можно наносить на металлы, ткани, асбест и другие материалы.
Лак из ф т о р о п л а с т а-4НА представляет интерес для получения покрытий, сохраняющих эластичность при низких температурах, вплоть до температуры жидкого водорода.
Фторопласто-эпоксидные композиции (ЛФЭ) представляют собой лаки на основе фторсодержащих полимеров, модифицированные эпоксидными олигомерами [32]. .Применение таких композиций позволяет сохранить основные, присущие фторопластам, свойства (влаго - и химическую стойкость, .эластичность, анти - адгезионные свойства, атмосферостойкость и др.) и в то же время значительно повышает адгезию покрытий. Адгезия к металлам возрастает в 4—6 раз и сохраняется при длительном воздействии (до 500 ч) кипящей воды. В значительно меньшей степени, чем у исходных фторопластов, снижаются прочностные характеристики при повышенных температурах, что обусловлено образованием, благодаря наличию эпоксидного компонента, жесткого сетчатого каркаса. Сравнительно невысокие температуры отверждения композиций позволяют наносить их не только на металлы, но и на различные другие материалы, в том числе на дерево, пластмассы, резины. Совмещение фторопластового и эпоксидного компонентов осуществляют в смесях сложных
Эфиров и кетонов, применяемых для приготовления обычных фторопластовых лаков. Эпоксидный компонент (ЭД-8, ЭХД) вводят в количестве 5—20%. Такие лаки горячей сушки (ЛФЭ-23г, ЛФЭ-32г, ЛФЭ-42г) непосредственно готовы к употреблению. Лаки холодной сушки (ЛФЭ-23х, ЛФЭ-26х, ЛФЭ-32х, ЛФЭ-42х) перед употреблением смешивают с растворенным в ацетоне от - вердителем аминного типа (АФ-2, диамет X). Режимы получения покрытий из ЛФЭ описаны в работе [32].
Порошковое напыление фторсодержащих полимеров, особенно интенсивно развивающееся в последние годы, позволяет получать однослойное покрытие толщиной до 300—600 мкм (в отдельных случаях до 800 мкм), что значительно повышает их надежность. Композиции наносят газопламенным напылением, в псевдоожиженном слое (вихревое и вибровихревое напыление), струйным и электростатическим методами. Эти методы более экономичны, не требуют применения растворителей. Для порошкового напыления применяют специальные марки ПТФХЭ, сополимеров ТФЭ—ГФП, ТФЭ—Э, ТФХЭ—Э, обладающие большим размером частиц, хорошей растекаемостью. Поверхности изделий подготовляют к покрытию такими же способами, как и при нанесен-ии суспензий и лаков.
Для получения покрытий из ПТФХЭ используют преимущественно различные варианты газопламенного напыления [36]. Смесь порошка с воздухом или инертным газом подают из распылителя через воздушно-ацетиленовое или водородно-кислородное пламя на изделие, нагретое до 250—800°С (в некоторых случаях с последующим прогревом его при 270 °С), и затем закаливают холодной водой. Во избежание разложения полимера распыление и закалку проводят с максимальной скоростью. ПТФХЭ, например марки волталеф 300-УФ, можно также напылять и на холодное изделие с последующим сплавлением в печи при 265°С, при этом толщина однослойного покрытия составляет 300—500 мкм.
Известен метод получения покрытия из ПТФХЭ в псевдоожиженном слое [21, с. 156—158]. Метод заключается в том, что нагретую деталь погружают во взвесь порошка в воздушной или газовой среде (псевдоожиженный раствор). При этом порошок налипает на нагретую деталь и сплавляется в сплошное покрытие. Метод псевдоожиженного (кипящего) слоя весьма прогрессивен, отличается высокой производительностью. Этим методом получают^ около 80% покрытий из сополимера ТФЭ— ГФП, например используют марку РЕР-160 с низкой вязкостью расплава и размерами гранул 250—350 мкм. Нагретую деталь погружают в слой ожиженного порошка, затем для полного расплавления и удаления пузырьков воздуха прогревают в печи при 330°С,[29, с. 45—46]. Дополнительный прогрев (при 270—280 °С) применяют и при получении покрытий из фторо- пласта-ЗМ.
|
Режимы получения покрытий в псевдоожиженном слое из некоторых полимеров приведены в табл. VII. 7. ТАБЛИЦА VII. 7 Режим получения покрытий в псевдоожиженном слое
|
Толщина конечного покрытия зависит от продолжительности и числа погружений изделия в псевдоожиженный слой.
Большой интерес представляет струйный метод нанесения покрытий по технологии УКРНИИхиммаш [37]. На предварительно нагретую поверхность находящегося в печи изделия (вращающегося со скоростью 0,5—1,0 м/с) подают с помощью механизма напыления и' распылительной форсунки порошковую смесь с необходимыми добавками — наполнителями, стабилизаторами и др. После нанесения первого слоя покрытие сплавляют до появления сплошного глянца, по окончании напыления— проводят дополнительный прогрев изделия в течение нескольких часов. Этим методом наносят покрытия из фто - ропласта-ЗОП, 40ДП, 4МП, ЗМ.
Режим нанесения покрытий из фторопласта-ЗОП приведен
Ниже:
Температура, °С.................................................................................................. 230—240
Время сплавления
TOC o "1-5" h z одного слоя, мин.................................................................................... 10—15
Всего покрытия, ч.................................................................................. 2,5—3,0
Толщина, мкм
Одного слоя.............................................................................................. 40—60
Всего пойрытия...................................................................................... 250—350
Число слоев............................................................................................................ 5—8
Охлаждение........................................................................................................... Воздушное
Режимы для других фторопластов отличаются - в основном температурой сплавления, которая на 5—10 °С превышает показатель ТПП полимера (для фторопласта-40ДП и 4МП составляет 270—280 и 270—300 °С соответственно).
Наряду со струйным применяют электростатическое напыление. Метод заключается в том, что наэлектризованные частицы полимера осаждаются на противоположно заряженном изделии. Этим методом удается получить покрытие из РЕР-532-5001 толщиной до 760 мкм [29, с. 46].
Известен метод плазменного напыления полимерных порошков. Этот метод позволяет напылять даже ПТФЭ. Порошок ПТФЭ при продувании через плазму с температурой 5500—
8000 °С расплавляется, получаемый расплав с большой силой ударяется о изделие при 315—370 °С. Метод очень экономичен, но не получил широкого распространения из-за образования токсичных продуктов и необходимости в применении специального оборудования [29, с. 42].
Покрытия из фторсодержащих полимеров широко применяют в различных отраслях народного хозяйства в качестве антикоррозионных, электроизоляционных, антифрикционных, антиад - гезионных, абразивостойких. Покрытия сохраняют, в основном, свойства, присущие исходным полимерам, в том числе стойкость к агрессивным средам. Однако следует учитывать, что защитное действие покрытий от агрессивных сред определяется не только химической стойкостью полимера, но и диффузионной проницаемостью и адгезией покрытия к субстрату. Назначения и некоторые характеристики основных типов покрытий из фторопластов приведены ниже:
Покрытия, полученные из суспензий и порошковым
|
Фторопласт-4Д Фторопласт-3 Фторопласт-ЗМ Фторопласт-2 Фторопласт-2М Фторопласт-1 Фторопласт-4М Фторопласт-40 Фторопласт-30 |
 Напылением Отличаются наилучшими электроизоляционными, антиадгезиоиньши и антифрикционными свойствами, наиболее высокой тепло - и морозостойкостью. Повышенная диффузионная проницаемость (из-за наличия микротрещии и пор) препятствует применению для защиты от сильных агрессивных сред
Напылением Отличаются наилучшими электроизоляционными, антиадгезиоиньши и антифрикционными свойствами, наиболее высокой тепло - и морозостойкостью. Повышенная диффузионная проницаемость (из-за наличия микротрещии и пор) препятствует применению для защиты от сильных агрессивных сред
По защитному действию от агрессивных сред превосходят другие антикоррозионные покрытия; практически бездиффузионны. Могут применяться и в качестве электроизоляционных, антиадгезионных, абразивостойких, атмосферостойких
То же, но вследствие меньшей кристаллизуемо- сти полимера могут применяться без потери эластичности при более высокой температуре (150 °С). Защитное действие несколько ниже
Атмосферостойкие с длительным сроком службы, электроизоляционные, антикоррозионные (для защиты от воздействия морской воды), антиадгезиониые, радиационностойкие
То же, но более эластичные Атмосферостопкие со сроком службы 25—30 лет, радиационностойкие, абразнвоустойчпвые
Относятся к лучшим теплостойким электроизоляционным, антикоррозионным и антифрикционным покрытиям. Имеют хорошую адгезию к металлу
Отличаются высокими электроизоляционными и антифрикционными свойствами, стойкостью к радиации, тепло - и морозостойкостью. Стойки к агрессивным средам, но наличие значительной диффузионной проницаемости ограничивает применение в качестве антикоррозионных
Обладают высокими антикоррозионными, электроизоляционными свойствами, радиационной стойкостью, абразивостойкостыо Покрытия из лаков на основе фторопласта-4Д ФБФ-48Д; ФБФ-74Д Антифрикционные с более высокой адгезией и
Износостойкостью по сравнению с покрытиями из ПТФЭ. Температура эксплуатации от —70 до 150 °С
ВАФ-31
ФК-33
Покрытия
Фторопласт-42Л
Фторопласт-32Л
Фторопласт-23 и 26Л
Фторопласт-4Н
Покрытия ЛФЭ-23х, 26х, 23г
ЛФЭ-32х, 32г
ЛФЭ-42х, 42г
Антифрикционные с износостойкостью, превышающей износостойкость чистого ПТФЭ в 50 раз, а покрытий из лаков ФБФ в 10—30 раз. Могут работать без смазки. Максимальная температура эксплуатации 150°С
Антифрикционные и антиадгезионные с интервалом рабочих температур от —260 до 260 °С (кратковременно до 400 °С)
Из лаков растворимых полимеров
Атмосферостойкие, антикоррозионные, антифрикционные, тропикостойкие
Влагозащитные, антикоррозионные, электроизоляционные, прозрачные к ИК - и УФ-лучам
Высокоэластичные атмосферостойкие, электроизоляционные, тропикостойкие, стойкие к радиации
Покрытия, сохраняющие эластичность при глубоком холоде
Из фторопласто-эпоксидных лаков
Химически стойкие, атмосферостойкне, аитиадге - зионные с высокой адгезией к субстрату
Влагозащитные, химически стойкие, электроизоляционные, атмосферостойкие
Антифрикционные, антиадгезионные, химически стойкие с высокой адгезией
НАПОЛНЕННЫЕ КОМПОЗИЦИИ
Композиции из ПТФЭ. Одним из основных достоинств ПТФЭ являются его прекрасные антифрикционные свойства, позволяющие использовать ПТФЭ в качестве подшипников без смазки. Однако ненаполненный ПТФЭ имеет низкую твердость, обладает ползучестью, имеет недостаточную износостойкость И обычно пригоден лишь для подшипников, работающих при малой скорости скольжения. Чистый ПТФЭ широко используется в качестве опорных подшипников для мостов и трубопроводов большого диаметра, где высокие нагрузки и малые скорости делают его предпочтительным перед наполненными сортами в связи с самым низким коэффициентом трения чистого ПТФЭ [38].
Введение в ПТФЭ таких наполнителей, как стекловолокно, графит, бронза, коксовая мука, дисульфид молибдена, углеродное волокно, силициды металлов, теплостойкие полимерные материалы, позволяет в 200—1000 раз снизить износ подшипников, в несколько раз увеличить теплопроводность, в 5—10 раз увеличить прочность при сжатии и твердость [39]. Количество вводимых наполнителей обычно составляет 10—40% (об.).
Наибольшее распространение в СССР имеют композиции ПТФЭ с 15% измельченного стекловолокна (Ф4С15), 20% коксовой муки (Ф4К20) и 15% коксовой муки и 5% Мо32 (Ф4К15М5) [16] (табл. VII. 8).
|
ТАБЛИЦА VII, 8
|
Влияние условий трения на значение коэффициента трения для композиции ПТФЭ с наполнителями приведено в табл. VII. 9 [40].
ТАБЛИЦА VII, 9
|
Коэффициент трения для наполненных композиций ПТФЭ
|
Смешение ПТФЭ с наполнителями проводят либо в сухом состоянии на скоростных смесителях, либо в воде с добавкой поверхностно-активных веществ.
Для получения оптимальных свойств композиций необходимо использовать тонкодисперсные марки ПТФЭ (размер частиц меньше 200 мкм, предпочтительно 20—50 мкм) и твердый наполнитель с размерами частиц менее 10 мкм. Для приготовления композиций с бронзой спекание необходимо проводи*^ в инертной атмосфере во избежание окисления бронзы. '
Большое внимание уделяется получению композиций с теплостойкими полимерами (полиимиды, полифениленсульфиды, поли- арилсульфиды). Композиция ПТФЭ со смолой эконол (США) имеет прочность при изгибе до 3,85 МПа и модуль упругости при изгибе 7-103 МПа, коэффициент трения 0,12 [41].
Для получения композиций используется в основном суспензионный ПТФЭ, но можно применять и дисперсионный. Такие композиции готовят в виде водных и органических дисперсий для получения антифрикционных покрытий [42], а также в виде густых паст.
Большой интерес представляют металлофторопластовые подшипники, состоящие из металлической основы с бронзовым металлокерамическим слоем, пропитанным либо суспензией дисперсионного ПТФЭ, либо, пастой ПФМ-75 [43]. Пасту ПФМ-75 изготовляют путем механической коагуляции полимера органическими растворителями в присутствии Мо32. Содержание ПТФЭ в пасте составляет 75% (об.), МоБ2 24—25%. Паста вкатывается в бронзовый пористый слой, нанесенный на стальную ленту, и затем спекается при 370—390 °С. Из ленты прессуют подшипники, способные работать без смазки в наиболее жестких условиях по нагрузке и скорости. Известен способ получения металлофторопластовых листов накатыванием композиции из ПТФЭ, графита и стекловолокна на металлическую (бронзовую) сетку [44]. Такой материал удобен для формования различных втулок, полусфер, используемых как элементы подшипников без смазки.
Подшипники из композиций ПТФЭ в виде лент, колец, шайб, втулок, пластин, тканей применяются в самых различных областях техники. Наиболее целесообразны подшипники из ПТФЭ там, где недопустима или трудноосуществима смазка, используются агрессивные среды, требуется равенство статического и динамического коэффициентов трения.
Композиции из ТФП. При модификации термопластичных фторсодержащих полимеров (ТФП) наполнителями получают материалы со специфическим комплексом свойств для конкретных применений с целью улучшения ряда свойств ТФП (ползучести, жесткости, теплостойкости, износостойкости, абразиво - стойкости и др.). Публикации по наполненным ТФП относятся главным образом к сополимерам ТФЭ—Э, ТФЭ—ГФП и к ПВДФ. Наполнители в сополимеры ТФЭ—Э и ТФЭ—ГФП вводят так же, как и в ПТФЭ, перемешиванием порошкообразных компонентов в сухом виде, а также в расплаве (при экструзии), вальцеванием и другими методами.
В наполненных композициях сополимера ТФЭ—Э со стекловолокном высокая прочность адгезионной связи между сополимером и порошком стекловолокна приводит к значительному повышению температуры термической деформации, прочности, твердости, модуля сдвига, стабильности размеров, сопротивления ползучести и деформации под долговременной нагрузкой, устойчивости к электрической дуге.
Ниже приведены свойства ненаполненного (I) и усиленного 25% (масс.) стекловолокна (II) сополимера ТФЭ—Э [45]:
I п
|
Температурный коэффициент |
||
|
Линейного расширения, °С-1 |
9-Ю5—1,4-Ю“ |
1,7 • 105—3,2 • К |
|
Разрушающее напряжение, МПа (кгс/см2) |
||
|
При растяжении.................................... |
45,5 (455) |
84 (840) |
|
При сжатии............................................. |
50 (500) |
70 (700) |
|
Относительное удлинение при |
||
|
Разрыве, %.................................................. |
200 |
8 |
|
Модуль упругости, МПа (кгс/см2) |
||
|
При растяжении.................................... |
840 (8 400) |
8 400 (84 000) |
|
При изгибе............................................... |
1 400 (14 000) |
6 650 (66 500) |
|
Твердость по Роквеллу. . . |
50 |
74 |
|
Температура деформации под |
||
|
Нагрузкой, °С |
104 |
|
|
0,46 МПа (4,6 кгс/см2) . . |
265 |
|
|
1,85 МПа (18,5 кгс/см2) . |
74 |
210 |
|
Диэлектрическая проницае |
||
|
Мость (60—10б Гц)................................... |
2,6 |
3,4 |
|
Удельное объемное электри |
Выше 10,в |
101в |
|
Ческое сопротивление, Ом-см |
||
|
Тангенс угла диэлектрических |
||
|
Потерь |
||
|
0,0008 |
0,002 |
|
|
При 10е Гц................................................ |
0,005 |
0,005 |
|
Электрическая прочность, |
||
|
МВ/м или кВ/мм......................................... |
16 |
13,2 |
|
Дугостойкость, с............................................. |
75 |
110 |
|
Водопоглощение, %....................................... |
0,029 |
0,022 |
|
Усадка, %.......................................................... |
1,5-2,0 |
0,2-0,3 |
Стеклоусиленный сополимер ТФЭ—Э применяют в условиях частых ударных нагрузок, особенно для изготовления различных конструкционных узлов, в подшипниках, работающих без смазки, при значениях Pv = 0,53. По данным [45], сополимер ТФЭ—Э даже с 50% стекловолокна перерабатывается литьем под давлением.
Получены антифрикционные коррозионностойкие композиции сополимера ТФЭ—Э (фторопласт-40П), наполненного графитом (Ф40Г20), дисульфидом молибдена (Ф40М30), ситаллом и молибденом (Ф40С15М1.5), бронзой (Ф40Б70), сухим смешением порошков сополимера и наполнителя [19, 20, 46]. При содержании 20—30% (масс.) наполнителей или их смесей прочностные свойства композиций мало отличаются от свойств чистого сополимера, коэффициент трения по стали и интенсивность массового износа, особенно со смазкой водой, снижаются (табл. VII. 10) [46], твердость несколько увеличивается, а ударная вязкость уменьшается.
ТАБЛИЦА VII, 10
|
Свойства наполненных композиций на основе фторопласта-40
|
|
Примечание. Испытания проводили при трении образцов по стали Х18Н10Т', в числителе—данные при сухом трении, в знаменателе—при смазке водой. |
Последние выполняют роль пластификаторов по отношению к ПВДФ, увеличивая гибкость экструзионных изделий из него, например рыболовной лески [48].
Наполненный сополимер ТФЭ—ГФГ1 обладает повышенной жесткостью и износостойкостью (табл. VII. 11) [49]. В качестве наполнителей используются, например, стекловолокно и графит.
ТАБЛИЦА VII. п
|
Свойства наполненного сополимера ТФЭ — ГФП
|
1. Проспект фирмы Du Pont. Teflon TFE-fluorocarbon resins. Molding techniques. Bull. No. X-7d. 66 p.
2. Кузьмин Ю. Г. Технология переработки ПТФЭ (по зарубежным данным).
Обзорная информация. Серия: полимеризационные пластмассы. М.,
НИИТЭХИМ, 1976. 73 с.
3. Technical Service Note Processing Filled Polymers (ICI) F-8. 2nd Ed. (Aug. 1969).
4. Проспект фирмы 1C1 «Isotactic Compaction of «Fluon» PTFE. Technical data aheet F. TD 128».
5. Варламов Б. Г., Пугачев A. K., Дуничев Ю. Ф. В кн.: Новое в переработке и применении фторопластов и пентапласга. Под ред. Ю. А. Паншина. Л., ОНПО «Пластполимер», 1976, с. 12—16.
6. Проспект фирмы Hoechst «Kunstoffe Hoechst. Hostaflon TF».
7. Горина A. A., Сыркус Т. Д., Уколова Л. C. Пористые фторопласты. Обзорная серия: пластические массы и синтетические смолы. М., НИИТЭХИМ»
1975. 80 с.
8. Пат. США 2868707.
9. Нестеренко А. П., Паншин Ю. А. и др. В кн.: Новое в переработке и применении фторопластов и пентапласта. Под ред. Ю. А. Паншина. Л„ ОНПО «Пластполимер», 1976, с. 63—80.
10. Кейгл Ч. Клеевые соединения. М., «Мир», 1971. 296 с.
И. Пат. США 3030290, 1958.
12. Tsunoda Т. е. a. J. Chem. Soc. Japan, Ind. Chem. Sect., 1968, v. 71, № 10, p. 1692—1696, A 106.
13. Евдокимова H. В. В кн.: Новое в переработке и применении фторопластов.
Под ред. Ю. А. Паишина. Л., ОНПО «Пластполимер», 1976, с. 21—29.
14. Стефанович H. Н., Виленский А. И., Вирлин Э. Э. и др. В кн.: «Мехаио-
Эмиссия и механохимия твердых тел». М., «Наука», 1974, с. 94—97.
15. Chem. Eng. News, 1967, v. 45, № 38, p. 36—37.
16. Chem. Eng., 1973, v. 80, № 20, p. 54—56.
17. Tростянская E. Б., Комаров Г. В., Шишкин В. А. Сварка пластмасс. М., «Машиностроение», 1967. 251 с.
18. Паншин Ю. А., Ярцев И. К., Малкевич С. Г. и др. Термопластичные фтор - лоны и их переработка. Л„ ЛДНТП, 1975. 20 с.
19. Ярцев И. К-, Паншин Ю. А., Виноградов В. Н. В ки.: Новое в переработке и применении фторопластов и пентапласта. Л., ОНПО «Пластполимер»,
1976, с. 5—12; 32—38.
ST 20. Справочник по пластическим массам. Изд. 2-е. Т. 1. Под ред. В. М. Катаева, В. А. Попова, Б. И. Сажина. М., «Химия», 1975. 447 с.; Фторугле - родные пластики. Каталог-справочник. Черкассы, отд. НИИТЭХИМ, 1974. 82 с.
21. Горяйнова А. В., Божков Г. К-, Тихонова М. С. Фторопласты в машиностроении. М., «Машиностроение», 1971. 232 с.
22. Авт. свид. СССР 187288, 1966; Plast. Mod. Elast., 1974, v. 26, № 8, p. 98—107.
23. Japan Plast., 1970, v. 21, № 2, p. 17—23; Малкин A. Я-, Радушкевич Б. В. В кн.: Переработка пластмасс. Труды Свердловского научно-технического совещания по переработке и применению пластмасс. М., «Химия», 1966, с. 45—53.
24. Мацюк J1. Н. Пласт, массы, 1976, № 3, с. 37—39; 45—46.
25. Лазар М., Радо Р., Климан Н. Фторопласты. Пер. со словацк. Под ред. С. А. Яманова. М. — Л., «Энергия», 1965. 304 с.
26. Чегодаев Д. Д., Наумова 3. К., Дунаевская Ц. С. Фторопласты. Л., Гос - химиздат, 1960. 192 с.
27. Явзина H. Е., Николаев А. Ф., Черешкевич Л. В. и др. ЖПХ, 1969, т. 42, вып. 3, с. 573—577.
28. Николаева Т. Курятиикова В. Г. Пласт, массы, 1960, № 1, с. 44—46; англ. пат. 743464, 1955; Chvatal A. Kaucuk a plast tmoty, 1962, № 7, s. 209—211.
29. Обзорная информация. Применение фторуглеродиых пластиков за рубежом. М., НИИТЭХИМ, 1974. 74 с.
30. Brit. Plast., 1971, v. 44, № 10, p. 8.
31. Бугоркова H. A., Чегодаев Д. Д., Черешкевич Л. В. Пласт, массы, 1970, № 5, с. 65—67.
32. Тризно В. Л., Бугоркова Н. А., Бляхман E. М. и др. Свойства и применение защитных покрытий на основе фторлонов и фторлоно-эпоксидных композиций. Л., ЛДНТП, 1975. 21 с.
33. Николаева Т. H., Лабецкая 3. М., Пласт, массы, 1962, № 3, с. 67—69.
34. Шигорина H. H., Егоров Б. Н. «Лакокрасочные материалы и их применение», 1970, № 6, с. 31—33; Шигорина H. H., Звягинцева Н. В., Егоров Б. Н. Там же, 1972, № 4, с. 39—40.
35. Англ. пат. 1031849, 1966.
36. Япон. пат. 180, 1958; Voltalef moulding powders. Prospect of Uqine Kuhl- mann (France).
37. Ефременко И. П., Колоколова Т. Г. «Технология и организация производства», 1967, № 5, с. 86.
38. Скуцкий В. И, «Вестник машиностроения», 1974, № 2, с. 51—52.
39. TOC o "1-5" h z Монэтани Ютака, Пурасутиккусу, Japan Plast., 1974, v. 25, № 9, р. 86---------------------------------- 91;
Kunstst.-Berat., 1973, Bd. 18, № 10, S. 756; Авт. свид. СССР 466251, 1 973.
40. Europ. Plast. News, 1976, v. 3, № 10.
41. Plast. World, 1973, v. 31, № 12, p. 78; пат. США 3879301, 1973.
42. Пат. ФРГ 1804409, 1968: япон. пат. 310969, 1968.
43. Паншин Ю. А и др. Пласт, массы, 1973, № 6, с. 63—64.
44. Пат. ЧССР 142547, 1969.
45. Ивасита А. Пурасутиккусу, Japan. Plast., 1973, v. 24, № 11, р. 74—79;
Europlast, 1972, v. 45, № 11, р. 14.
46. Воронков Б. Д., Киричек Б. И. Антифрикционные коррозиоииостойкие
Материалы иа основе фторопласта-40П. Л., ЛДНТП, 1968, 35 с.
47. Авт. свид. СССР 189571, 202516, 1967; 504377, 1975; Бланк Л. А., Ярцев И. К-, Паншин Ю. А. В кн.: Новое в переработке фторопластов и
Пентапласта. Л., ОНПО «Пластполимер», 1976, с. 55—63.
48. Англ. пат. 1339153, 1973; франц. пат. 2239501, 1975; пат. США 354 1039, 1970.
49. Encyclopedia of Polymer Science and Technology. V. 13. New York — London, 1970. 843 p.
50. Мясников Г. Д., Коханова E. A., Васильева Т. А. и др. В кн.: Новое в переработке и применении фторопластов и пентапласта. Л., ОНПО «Пластполимер», 1976, с. 16—21.
ГЛАВА VIII
НЕКОТОРЫЕ ВОПРОСЫ токсикологии И ТЕХНИКИ БЕЗОПАСНОСТИ
Мономеры, применяемые для получения основных фторсодержащих полимеров, токсичны, в смесях с воздухом при определенных соотношениях взрывоопасны (таблица) [1, с. 97; 2, с. 65—71].
|
Области воспламенения и предельно допустимые концентрации фторсодержащих мономеров в воздухе производственных помещений
|
Наименее токсичны винил - и винилиденфторид, наиболее токсичны гексафторпропилен и трифторхлорэтилен. Ниже приведены концентрации (в %) мономера в воздухе, при которых погибает 50% крыс после экспозиции в течение 4 ч [3]:
TOC o "1-5" h z Винилфторид..................................................................................................... 80
Винилиденфторид........................................................................................ 12,8
Тетрафторэтилен .......................................................................................... 4
Гексафторпропилен....................................................................................... 0,3
Перфторизобутилен........................................................................ 0,5 • 10 4
Вдыхание тетрафторэтилена в значительных количествах приводит к полнокровию органов, вызывает кровоизлияние в легких, селезенке, приводит к дистрофическим изменениям печени. Острое отравление трифторхлорэтиленом характеризуется выраженными сосудистыми нарушениями, вызывающими отек мозга, легких, дегенеративными изменениями почек, печени,
Миокарда. Воздействие гексафторпропилена на человека вызывает в легких случаях бронхоспазм, в тяжелых случаях после небольшого скрытого периода развивается отек легких, наблюдаются изменения в сердечной мышце и в почках. Картина интоксикации аналогична наблюдаемой при отравлении перфтор - изобутиленом, для которого предельно допустимая концентрация в воздухе 0,1 мг/м3 [2, с. 71].
Высокой токсичностью обладают продукты взаимодействия мономеров с кислородом воздуха (фтор - и фторхлорфосгены, фтористый и хлористый водород и др.). Токсичны и фторкарбо - новые кислоты, соли которых применяются в качестве эмульгаторов при полимеризации.
Описанные фторсодержащие полимеры сами по себе инертны, безвредны для организма. ПТФЭ применяют даже в качестве противоподгорающего покрытия кухонной посуды. Использование такой посуды допущено Министерством здравоохранения СССР [4, с. 520]. Пленка из фтороиласта-26 при выдержке в воде в течение 4 мес. не придает ей токсичных свойств. Однако при нагревании фторсодержащих полимеров выше 200— 250°С начинается термоокислительная деструкция, резко повышающаяся с возрастанием температуры выше 320°С (для ПТФЭ выше 400 °С). При прогреве суспензионного и дисперсионного ПТФЭ при 370 и 4Ц0°C первоначальные потери массы составляют 0,004—0,008 и 0,03—0,08%/ч соответственно, при 425°С — 0,15%/ч. О потерях массы другими фторсодержащими полимерами при температурах их переработки можно судить по введенному в технические условия показателю термостойкости.
Основные продукты термоокислительной деструкции некоторых фторсодержащих полимеров приведены ниже:
Политетрафторэтилен
Политрифторхлорэти-
Лен
Водородфторсодержа - щие полимеры и сополимеры
Тетрафторэтилен, гексафторпропилен, перфтор- изобутилен, перфторциклобутан, фторфосген (карбо - нилфторид), фтористый водород, окись и двуокись углерода, аэрозоль вторичной полимеризации тетра- фторэтилена [2, с. 12]
Низкомолекуляриые осколки полимерных цепей, трифторхлорэтилен, фторхлорпропилены, фтор - и фторхлорфосгены, фтористый и хлористый водоро - ды, двуокись углерода
Низкомолекулярные осколки полимерных цепей, фтор - и фторхлорфосгены, галогеповодороды, двуокись углерода, возможно мономеры
Образующиеся парогазовоздушные смеси обладают высокой токсичностью. Наиболее токсичными компонентами этих смесей являются: перфторизобутилен. фтористый водород (ПДК 0,5 мг/м3) [2, с. 7, 71], ГФП, ТФХЭ, фтор - и фторхлорфосгены. Для аэрозолей ПТФЭ и других фторполимеров установлено ПДК'МО мг/м3 [2, с. 7; 4, с. 520].
По данным [5], токсичность продуктов термической деструкции ПТФЭ при температуре до 450 °С обусловлена главным об-
Разом карбонилсодержащим веществом, точный состав которого не установлен. При 475 °С и выше основным, ответственным за токсичность, продуктом является перфторизобутилен. По другим данным [2, с. 12], образование последнего наблюдается уже при 390—400 °С.
Вдыхание летучих продуктов деструкции фторсодержащих полимеров и тонкодисперсных частиц полимеров вызывает явления, называемые условно «фторопластовой» или «полимерной» лихорадкой, напоминающей «металлическую» лихорадку. Основные ее признаки: озноб, высокая температура, раздражение верхних дыхательных путей с сухим кашлем, одышка, потоотделение. При этом могут наблюдаться диффузные поражения почек, печени, мозга [4, с. 520]. В связи с недостаточной осведомленностью врачей о возможном развитии полимерной лихорадки, такие заболевания иногда диагностируют как простудные.
Острое отравление продуктами разложения фторсодержащих полимеров может привести к смертельному исходу. Хроническое воздействие этих веществ в ряде случаев вызывает функциональные расстройства нервной системы, изменения сердечно-сосудистой деятельности [2, с. 155—162].
Полимеризацию описанных фторсодержащих мономеров осуществляют при повышенных давлениях, что также является источником опасности.
При получении и переработке фторсодержащих полимеров необходимо соблюдать следующие основные меры предосторожности.
Полимеризаторы следует размещать в кабинах с дистанционным управлением и перепадом давления воздуха между кабинами и коридором управления, создаваемым подачей приточного воздуха в коридор управления (что препятствует поступлению в него загрязненного воздуха из кабин). Перед разгрузкой целесообразно полимеризатор продуть азотом и от- вакуумировать для удаления мономеров, сорбированных полимером и маточным раствором [2, с. 9].
В производственных помещениях должна быть предусмотрена эффективная приточно-вытяжная вентиляция с кратностью обмена не менее 8—10. Необходима максимальная герметизация оборудования и коммуникаций. Места отбора технологических проб, люки, печи для спекания заготовок, пресса, экструдеры и другое оборудование для переработки полимеров (включая оборудование для механической обработки, при которой могут развиваться высокие температуры) следует снабжать местной вентиляцией. Хороший эффект дает местная встроенная вентиляция. Необходимо также наличие аварийной вентиляции.
Печи для спекания заготовок оснащаются приборами для автоматического регулирования температуры и автоматической сигнализации о наличии перегрева.
Так как применяемые мономеры и многие продукты разложения фторсодержащих полимеров не имеют запаха, — в производственных помещениях следует устанавливать постояннодействующие газоанализаторы и сигнализаторы. В качестве газосигнализаторов применяют газовые хроматографы и приборы типа галогенотечеискателей ГТИ-5 [2, с. 30].
Ремонт, сварку оборудования и коммуникаций необходимо проводить только после тщательной очистки их от остатков фторорганических веществ с применением изолирующих противогазов.
В производственных помещениях запрещается курение, так как пыль полимеров, попадая на папиросы, при их сгорании разлагается и летучие продукты разложения попадают в легкие курящего. Особую опасность представляют пожары в помещениях, где находятся фторсодержащие полимеры. При тушении пожаров необходимо применять изолирующие противогазы, а после ликвидации пожара тщательно проветривать помещение.
В качестве мер личной защиты от фторорганических веществ рекомендуют фильтрующий противогаз марки ФОС, а также шланговые противогазы с подачей воздуха из незагрязненных зон. Работающий в цехах персонал должен быть обеспечен спецодеждой.
Лицам, занятым производством фторсодержащих полимеров и их переработкой, выдаются нейтрализующие средства (молоко, спецпитание), для них установлены укороченный рабочий день, дополнительный отпуск, периодическое медицинское освидетельствование.
1. Пожарная опасность веществ и материалов, применяемых в химической промышленности. Справочник. М., «Химия», 1970. 336 с.
2. Корбакова А. И., Макулова И. Д., Марченко Е. Н. и др. Токсикология фторорганических соединений и гигиена труда в их производстве. М., «Медицина», 1975. 183 с.
3 Hamilton /. М. In: Stacey М. е. a. Advances in Fluorine Chemistry, 1963, № 3.
4. Справочник по пластическим массам. Т. 2. Под ред. В. М. Катаева, В. А. Попова, Б. И. Сажина. М., «Химия», 1975. 566 с.
5. Encyclopedia of Polymer Science and Technology. V. 13, New York —London, 1970. 843 p.: Teflon Fluorocarbon Resins — Safety in handling and use. Prospect of du Pont, 1970 (USA).
ОГЛАВЛЕНИЕ
TOC o "1-5" h z Предисловие........................................................................................................................................................................... 3
Тетрафторэтйлен.......................................................................................................................... 5
Трифторхлорэтилен..................................................................................................................... 9
Винилфторид................................................................................................................................... 10
Винилиденфторид......................................................................................................................... 13
Гексафторпропилен .................................................................................................................... 14
Политетрафторэтилен................................................................................................................ 27
Политрнфторхлорэтилен.......................................................................................................... 53
Поливинилфторид....................................................................................................................... 69
Поливинилиденфторид................................................................................... - .... 80
Литература.................................................... 91
Глава III. СОПОЛИМЕРЫ ТЕТРАФТОРЭТИЛЕНА...................................................................... 96
Сополимеры тетрафторэтилена с гексафторпропнленом. .105
Сополимеры тетрафторэтилена с этиленом................................................... 115
Сополимеры тетрафторэтилена с перфтор(алкилвиниловы-
Ми) эфирами..................................................................................................................................... 124
Сополимеры тетрафторэтилена с вшшлиденфторидом. . . 127
Сополимеры тетрафторэтилена с трифторэтиленом. . . .137.
Литература.................................................. 139
Глава IV. СОПОЛИМЕРЫ ТРИФТОРХЛОРЭГИЛЕНА............................................................... 142
Сополимеры трифторхлорэтилена с этиленом............................................................... 146
Сополимеры трифторхлорэтилена с тетрафторэтиленом. . 156
Сополимеры трифторхлорэтилена с трифторэтиленом. .157
Сополимеры трифторхлорэтилена с винилиденфторидом. . 158 Литература 168
Глава V. СОПОЛИМЕРЫ ВИНИЛИДЕНФТОРИДА..................................................................... 170
Сополимеры винилиденфторида с гексафторпропнленом. . 172
Сополимеры винилиденфторида с пентафторпропиленом. . 176'
Сополимеры винилиденфторида с перфтор(метилвинило-
Вым) эфиром.................................................................................................................................... 177
ЩИХ ПОЛИМЕРОВ............................................................................................................... 178
Глава VII. ПЕРЕРАБОТКА ФТОРСОДЕРЖАЩИХ ПОЛИМЕРОВ 184
Политетрафторэтилен........................................................................................................... 184
Термопластичные фторсодержащне полимеры..................................... 195
Суспензии и лаки. Порошки для напыления............................................................. .204^
Наполненные композиции.................................................................................................... 217
Глава VIII. НЕКОТОРЫЕ ВОПРОСЫ ТОКСИКОЛОГИИ И ТЕХНИКИ БЕЗОПАСНОСТИ.225
Литература................................................ 228
ЮРИЙ АЛЕКСАНДРОВИЧ ПАНШИН СОФЬЯ ГРИГОРЬЕВНА МАЛКЕВИЧ ЦИРА СЕМЕНОВНА ДУНАЕВСКАЯ
Редактор Э. Э. ЯРЦЕВА Техн. редактор 3. Е. МАРКОВА Обложка художника В. Д. БЕРТЕЛЬСА Корректор Л. С. АЛЕКСАНДРОВА
ИБ № 427
Сдано в наб. 16.11.77. Подп. к печ. 31.03.78. М-13362. Формат бумаги бОХЭО'Аа. Бум. тип. № 3. Литературная гарнитура. Высокая печать. Уел. печ. л. 14,5. Уч.-изд. л. 16,26. Тираж 5800 экз. Зак. 830. Изд. № 1167. Цена 80 коп.
Издательство «Химия». Ленинградское отделение 191186, г. Ленинград, Д-186. Невский пр., 28
Ордена Трудового Красного Знамени Ленинградская типография № 2 имени Евгении Соколовой Союзполиграфпрома при Государственном комитете Совета Министров СССР по делам издательств, полиграфии и книжной торговли. 198052.
Г. Ленинград. Л-52, Измайловский пр., 29.
ИЗДАТЕЛЬСТВО «ХИМИЯ» Имеется в продаже
РЕЙБМАН А. И. Защитные лакокрасочные покрытия. Изд.
4-е, перераб. Л., «Химия», 1978. 296 с. 1 р. 40 к.
В книге рассмотрены вопросы защиты аппаратуры и оборудования от воздействия агрессивных сред с помощью лакокрасочных покрытий. В 4-м издании (3-е изд.— 1973 г.) учтены достижения в области техники и технологии лакокрасочных покрытий; описаны новые лакокрасочные материалы иа основе алкидных, эпоксидных, полиуретановых, кремнийорга - нических и других смол; приведены составы для травления, обезжиривания и фосфатирования поверхности перед окраской: значительное внимание уделено покрытиям специального назначения (аитиадгезиониым, токопроводящим и др.), отражены вопросы контроля качества работ, техники безопасности и охраны труда
Книга предназначена для широкого круга инженерно-технических работников химической промышленности, занимающихся вопросами защитных покрытий, Она будет полезна и для работников производств иехими - ческого профиля.
Книги можно приобрести в магазинах, распространяющих научно-техническую литературу. В случае отсутствия книг в магазинах заказ можно направлять по адресам: 198147, Ленинград, Московский пр., 54, отдел «Книга — почтой» магазина № 21 «Книги по химии» или 103050, Москва, ул. Медведева, 1, отдел «Книга — почтой» магазина № 8 «Техническая книга». Заказ будет выслан наложенным платежом.
|
Стр. |
Строка |
Напечатано |
Должно быть |
|
13 |
11 сверху |
1,1-дифторэтаи |
1,1-фторхлорэтан |
|
28 |
7 » |
Катонная |
Катионная |
|
35 |
4 » |
1 червяков |
Прессов |
|
39 |
6 » |
СР2 |
~СР2 |
|
164 |
I графа, 1 строка |
Гс/см3 |
Г/см3 |
|
Г 66 |
16 снизу |
С. 166 |
Т. 166 |
|
220 |
15 сверху |
&. 105—1,4 • 10* 1,7- 105—3^2 • 105 |
9 • 10-5—1,4 • 10~б 1,7- 10_6—3,2. 10_6 |
|
За. к 830. |
|
|
|
|
ИЛ КН УНЯ Н Ц, А. В. ФОКИ н
ПОКОРЕНИЕ
НЕПРИСТУПНОГО
ЭЛЕМЕНТА
ДКАДЕМИЯ НАУК СССР НАУЧНО-ПОПУЛЯРНАЯ серия
Акад. И. Л. КНУНЯНЦ, проф. А. В. ФОКИН
ПОКОРЕНИЕ
НЕПРИСТУПНОГО
ЭЛЕМЕНТА
Издательство академии наук ссср
МОСКВА 1963
Фтор — это самый активный и самый агрессивный химический элемент в природе. Еще недавно разрушительные свойства делали невозможным использование его для нужд человечества. Но теперь химики одержали победу. Фтор побежден и поставлен на службу атомной и реактивной технике, авиации и космонавтике, науке и промышленности. Эта книга — рассказ об истории покорения фтора, полной неудач, трагических происшествий и побед, рассказ о его соединениях с неорганическими и органическими веществами и об их поистине необыкновенных свойствах.
ОТ АВТОРОВ
Пожалуй, ни с одним из химических элементов не связано столько своеобразных, подчас поэтических, а иногда странных названий. Фтор по праву называют самым активным и самым электроотрицательным элементом, элементом удивительных свойств и необыкновенной судьбы, неприступным, разрушительным и неукротимым, элементом неожиданных реакций и агрессивных свойств.
Не так давно упоминание о фторе и его соединениях вызывало представление о протравленном стекле, разрушающейся металлической аппаратуре, необыкновенной коррозии и о почти непреодолимых экспериментальных трудностях.
Теперь, когда говорят о новой химии, поставленной на службу атомной и реактивной технике, технике авиации и космических исследований, приходится вспоминать о фторе и грандиозном здании его соединений с углеродом и другими элементами.
Фтор не существует в природе в свободном состоянии. Техника прошлых столетий использовала только минеральные соединения фтора. Хотя со времени синтеза первого фторорганического соединения прошло более ста лет, химия фторорганических соединений стала развиваться только в последнюю четверть века. Работы отдельных исследователей —Свартса, Руфа, Бородина, построивших первый, но достаточно устойчивый мост между неорганическими и органическими фторидами, Долгое время не находили практического применения.
Длительная и волнующая история получения свободного фтора, полная неудач и трагических происшествий, закончилась победой химиков. Фтор был выделен из соединений с другими элементами, и это позволило обнаружить его поразительную реакционную способность. Сразу же начались попытки укрощения фтора, с разрушительной силой реагирующего почти со всеми элементами и соединениями. Эта работа полна интересных и значительных открытий, которые привели науку к созданию новых веществ, не имеющих аналогов в природе, веществ с удивительными свойствами, существование которых трудно было предсказать.
Укрощение самого активного элемента закончилось созданием фторуглеродов, которых за их химическую и термическую стойкость назвали веществами с алмазным сердцем и шкурой носорога.
В связи с возникшей в начале 40-х годов нашего столетия потребностью в материалах с новыми особыми свойствами внимание химиков сконцентрировалось на этом наиболее активном неметаллическом элементе. Мощный сдвиг в развитии химии фтора произошел во время второй мировой войны, когда необыкновенные свойства его были использованы для решения задач по овладению ядерной энергией. С помощью летучих фторидов урана удалось осуществить разделение его изотопов.
Оборудование для получения изотопов урана и обогащения природного урана нужным изотопом работает в среде таких агрессивных веществ, как шестифтористый уран и фтористый водород. В связи с этим потребовалось создать химически устойчивые прокладочные материалы, смазочные масла, покрытия и др. Это было достигнуто в результате успешных исследований в области фтор - органических соединений; впервые были широко рассмотрены и оценены уникальные свойства фтора, позволяющие создавать при его помощи очень стабильные материалы. Так были получены фторуглероды и другие вещества с высокой термической устойчивостью, обладающие наряду с большим молекулярным весом необыкновенно высокой летучестью, плотностью, низким показателем преломления и специфической растворимостью.
Первое знакомство со свойствами некоторых фторугле - родов позволило предугадать среди них соединения, могущие быть использованными в качестве взрывобезопасных невоспламеняемых материалов, пригодных для гидравлических систем, рефрежирантов, запорных жидкостей и смазочных материалов.
Использование физико-химических особенностей перфорированных соединений, хорошо иллюстрируемых на свойствах фторуглеродов, фтороксидов и фторнитридов, вызвало широкие исследования методов получения и свойств фторорганических веществ с различными функцио - нальными групп ами.
Блестящие работы по органическим соединениям фтора, имеющие общенаучное значение, в последнее десятилетие вылились в интереснейшую главу органической химии.
Накопившиеся к настоящему времени данные свидетельствуют о том, что химия соединений фтора становится обширным и важным разделом науки.
Огромные запасы фтора в земной коре и его особые свойства открывают все возрастающие перспективы использования этого элемента в различных областях науки и техники.
Химию фтора едва ли можно назвать новой областью. Многие неорганические соединения фтора: плавиковый шпат, криолит, фториды металлов, плавиковая кислота, трехфтористый бор уже длительное время применяются в промышленности. Применение многих других соединений фтора, обладающих интересными свойствами, ограничивалось малой доступностью элементарного фтора. Разработка новых способов введения фтора в органические соединения и сравнительно недавние усовершенствования конструкций электролизеров сделали органические соединения фтора широко доступными. С этого времени химия фтора прочно входит в народное хозяйство, в научную практику, в быт. Большое внимание привлекает применение фторидов в скоростной авиации и ракетной технике.
Фтор и его многочисленные соединения являются важными объектами для изучения ряда фундаментальных научных проблем (природа сил Ван-дер-Ваальса, водородные связи, теории растворов и др.).
Без преувеличения можно сказать, что в настоящее время создана новая химия — химия фторуглеродных соединений, теоретическое и практическое значение которой увеличивается с каждым днем.
•
Глава первая
ФТОР И ЕГО НЕКОТОРЫЕ НЕОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Распространение фтора в природе
Когда говорят о соединениях фтора, часто кажется, что это довольно редкие вещества и уже, конечно, более редкие, чем соединения хлора. В действительности же фтора в природе значительно больше, чем хлора. По подсчетам академика А. Е. Ферсмана, в земной коре имеется около 0,05—0,06 весовых процентов хлора, тогда как содержание фтора достигает 0,08%. Некоторые авторы увеличивают эту цифру до 0,10%. Это показывает, что в среднем на 1 т твердой породы приходится 800—1000 г фтора. Таким образом, фтор—широко распространенный элемент Земли. В ряду других элементов он должен быть поставлен на тринадцатое или четырнадцатое место.
Из-за своей высокой химической активности фтор встречается в природе исключительно в виде соединений с другими элементами, главным образом в виде солей фтористоводородной кислоты. Чрезвычайно малые количества свободного фтора обнаруживаются в некоторых образцах плавикового шпата; его присутствие там объясняется разложением фтористого кальция под влиянием радиоактивного излучения. Из элементов, наиболее распространенных в земной коре, особенно большое химическое сродство фтор проявляет к кальцию и алюминию и встречается главным образом в виде соединений с этими элементами.
Наиболее важным фтор содержащим минералом является плавиковый пшат, или флюорит, состоящий в основном из фтористого кальция СаРг; в этом соединении содержится до 49% фтора. Обычно плавиковый шпат встречается в виде больших бесцветных кристаллов; изве стны также окрашенные разновидности его (синяя, желтая, зеленая). Прозрачные кристаллы флюорита, имеющие большую ценность для оптической промышленности, встречаются редко. Некоторые образцы плавикового шпата флуоресцируют. Само слово флуоресценция произошло, по-видимому, от латинского названия плавикового шпата — флюорит.
Плавиковый шпат — сравнительно широко распространенный минерал. В Советском Союзе имеется несколько крупных месторождений его: в Забайкалье (Солнечное, Седловское, Абагатуевское, Калангуйское), в Ненецком национальном округе (Амдерминское), в Средней Азии (Такобское и Аураохматское). На реке Чаткал в предгорьях Тянь-Шаня также много плавикового шпата: местные жители называют его Санг-и-Сафет (белый камень).
Крупными месторождениями плавикового шпата располагают США и Англия. В США основные запасы плавикового шпата находятся в штатах Иллинойс и Кентукки. Здесь сосредоточено 85% промышленной добычи флюорита. По подсчетам, опубликованным Американским химическим обществом, запасов плавикового шпата при современном развитии фторной промышленности хватит в США на 30—40 лет. В 1957 г. мировое производство плавикового шпата достигало 1,7 млн. т, из них 0,787 млн. т приходилось на долю США. По сравнению с 1948 г., производство плавикового шпата в 1957 г. увеличилось в США вдвое.
В добываемых рудах содержится 20% и более фтористого кальция. Руды подвергают обогащению методами флотации, для чего используют тяжелые жидкости с удельным весом 2,6—3,1. В США вырабатывается несколько сортов плавикового шпата, например металлургический (содержащий 85% фтористого кальция) и керамический (до 95%). Наиболее богат по срдержанию фтористого кальция так называемый кислотный фторид; из него получают плавиковую кислоту.
Большая часть добываемого фторида кальция использовалась ранее в металлургии. Сейчас, в связи с успехами химии фтора, основным потребителем этого продукта стала химическая промышленность, где он используется главным образом для производства фтористого водорода.
Рост промышленной химии фтора можно иллюстри - овать данными об изменении потребления плавикового яшата в США. В 1948 г. металлургическая промышленность использовала 57% добываемого фтористого кальция, химическая — только 27%; в 1957 г. потребление его в химической промышленности возросло до 51 %, а в металлургической снизилось до 38%.
Среди минералов, содержащих фтор, большое значение имеют также апатиты и фосфориты — основное сырье для производства фосфорных удобрений. Главными составными частями этих ископаемых является фторапатит Са3(Р04)2 CaF2 и трикальцийфосфат Саз (Р04)2. Крупнейшие в мире месторождения апатита находятся в СССР, на Кольском полуострове. Основные залежи апатита в США расположены в штатах Теннеси, Флорида и севернее Скалистых гор. Годовая добыча США составляет 15 млн. пг апатита, содержащего более 400 тыс - т фтора. Крупные месторождения высококачественного апатита имеются также в Северной Африке.
В обогащенных фосфоритах в среднем содержится 2,5—3,2% фтора. Хотя по сравнению с содержанием фтора в плавиковом шпате это количество невелико, огромные запасы и широкие масштабы переработки апатитов и фосфоритов в искусственные удобрения позволяют считать их важнейшим источником получения фтора. В каждой тонне перерабатываемой руды содержится более 30 кг фтора. До недавнего времени фтористый кремний (SiF4), образующийся при разложении апатита серной кислотой, выбрасывался в атмосферу. В настоящее время, правда, пока еще небольшую часть его поглощают водой, превращая в кремнефтористоводородную кислоту. При нейтрализации кислоты хлоридами, окислами, карбонатами или сульфатами щелочных и щелочноземельных металлов получаются соответствующие кремнефториды.
Фтор встречается в природе и в виде комплексных солей. Наиболее важная из них —криолит NasAIFe, который образует сероватые, желтые, красные, иногда бесцветные призматические кристаллы. Наиболее значительные залежи криолита имеются в Гренландии; в меньших количествах он встречаема на Урале, в Колорадо (США) и других местах. В связи с большим потреблением криолита в алюминиевой промышленности в настоящее время производят синтетический криолит. Значительно реже встречаются фторалюминаты натрия (хиолит) и лития (криолитионит), а также минералы флиэллит и топаз, содержащие фтор в качестве основного компонента.
Простейшие из солей фтористоводородной кислоты — редко встречающиеся в природе фтористый натрий — вильяумит (он входит в состав некоторых нефелиновых пород) и фтористый магний — селляит, обнаруженный в вулканических породах. Там же найдены две соли кремнефтористоводородной кислоты (фторсиликаты) — хи - ратит и малладрит. Все эти минералы, а также большая группа редко встречающихся фторкарбонатов и фтор- сульфатов промышленного значения не имеют.
Среднее содержание связанного фтора в почвах русской равнины (0,02%) и почвах других стран приблизительно одинаково. В районах, прилегающих к вулканам и вблизи фосфатных залежей, содержание фтора в почве резко повышено. На 1 л морской воды приходится 0,3 мг фтора, причем с глубиной его концентрация возрастает. В раковинах устриц фтора в 20 раз больше, чем в морской воде. В коралловых рифах заключены миллионы тонн фторидов. В речных водах концентрация фтора колеблется в широких пределах. Меньше всего фторав реках известковых районов, так как фтор осаждается солями кальция. В водных источниках количество фтора может быть резко повышенным вследствие вымывания его соединений из минералов. Например, в воде французского источника Виши концентрация фтора достигает 6,3 мг/л. Исследование некоторых природных вод Казахстана показали, что наиболее обогащены фтором воды, вытекающие из гранитов, в первую очередь воды источников Тянь-Шаня; содержание фтора в них превышает 1% веса сухого остатка.
При пониженном содержании фтора в питьевых водах наблюдается снижение устойчивости зубной эмали к кислым веществам> входящим в состав пищи, что вызывает заболевание зубов (кариес). Оптимальным содержанием фтора в воде считается 1—1,5 мг/л, и в настоящее время исследуется вопрос о целесообразности искусственного введения фтора в питьевую воду. Однако слишком повышенная концентрация фтора в воде также неблагоприятно влияет на зубную эмаль, вызывая особое заболевание флюороз (пятнистая эмаль). Это заболевание встречается в районах, где население пользуется водой источников, вытекающих из пород, обогащенных фтором, например в районах фосфоритовых месторождений Туниса и Марокко. Естественно, что угроза заболевания флюорозом имеется и на производствах, перерабатывающих соединения фтора, например на суперфосфатных заводах, где сырьем служит фосфорит или апатит.
Некоторые авторы полагают, что фтор необходим для существования живой клетки и утверждают, что он находится вместе с фосфором во всех животных и растительных тканях.
Среднее содержание фтора в живых организмах приблизительно в 200 раз меньше, чем в земной коре. В органах и тканях, в которых протекают интенсивные физиологические процессы, например в мускулах, нервных тканях и железах, содержится фтора 0,5—8 мг на 100 г сухого вещества. В костях и сухожилиях его еще больше —80—100 мг. Особенно много фтора (100 — 180 мг) содержится в зубах, ногтях, волосяном покрове животных, а также в перьях птиц. В растениях фтор сосредоточен главным образом в листьях (3—14 мг); в коре, древесине (0,36—1,7 мг) и в плодах (3,9 мг) его уже меньше. Можно считать установленным, что фтор концентрируется в тех частях растений, которые наиболее богаты фосфором.
Первым известным соединением фтора был плавиковый шпат. По-видимому, он употреблялся еще в древние времена, но впервые под названием флюор был описан Б. Валентинусом в конце XV в. Автор упоминает о свойстве этого минерала снижать температуру плавления руды и шлака. Об этом же минерале упоминает немецкий ученый Агрикола в книге, изданной в Базеле в 1529 г. Здесь впервые используется название флюсс, приобретенное минералом благодаря его способности образовывать жидкие шлаки.
Для технологии восстановления руд и получения стекла, возникшей еще в древние времена, большое значение имели снижение температуры и повышение скорости реакций между тугоплавкими материалами. Поэтому можно себе представить, как важно было для металлургов того времени найти минерал, ускоряющий процесс выплавления металлов и делающий металлургический шлак более текучим; последнее обстоятельство особенно важно для более полного отделения шлака от металла. Неудивительно, что найденный минерал — плавиковый шпат был назван флюоритом от латинского слова флуоре — текучий. Позднее появилось немецкое название минер ал а — флюссшпат (текучий шпат), или глассшпат (стеклянный шпат). Все эти названия — синонимы и связаны с практическим применением минерала в качестве плавня или флюсса в металлургической промышленности.
В XVII в. плавиковый шпат получил новое применение, свидетельствующее о некотором познании его химических свойств. Нюренбергский художник Шван - хард открыл (1670) возможность наносить рисунки на стекло с помощью смеси плавикового шпата и серной кислоты. Эта смесь делает поверхность стекла матовой, и его можно употреблять для декоративных целей, делать на нем надписи и т. д. С того времени началось использование фторида кальция как средства для травления стекла в силикатной промышленности. В 1725 г. Паули получил жидкость для травления и гравировки стекла, смешав дымящую азотную кислоту с плавиковым шпатом.
Изучение реакции между плавиковым шпатом и серной кислотой началось с опытов Маргграфа, который в 1764 г., перегоняя смесь этих веществ из стеклянной реторты, обнаружил в сборнике продуктов реакции суспензию белого порошка в воде. Он пришел к заключению, что серная кислота выделяет из плавикового шпата «летучую землю», которая накапливается в сборнике.
Через несколько лет известный химик Шееле повторил опыты Маргграфа и установил, что серная кислота освобождает какую-то особую кислоту, которая соединена с известью, содержащейся в плавиковом шпате. Шееле назвал кислоту плавиковой, или фторной, кислотой, а плавиковый шпат — известью плавиковой кислоты. Ученому удалось показать, что для получения плавиковой кислоты вместо серной можно использовать соляную, азотную и фосфорную кислоты.
Взгляды Шееле, продолжавшего изыскания в области химии фторидов, разделяли далеко не все ученые того времени. Например, Буланже высказал предположение, что вещество, названное Шееле фторной кислотой, в действительности является соляной кислотой, соединенной с некоторыми «земляными» веществами. Другой исследователь, Моне, считал фторную кислоту летучим соединением серной кислоты и плавикового шпата. Шееле удалось опровергнуть оба возражения. В 1780 г. он писал: «Я надеюсь, что могу теперь продемонстрировать, что фторная кислота существует и является исключительно минеральной кислотой».
Для получения кислоты Шееле обычно использовал стеклянные реторты и, естественно, его всегда сбивало с толку появление в сборнике осадка кремневого соединения. Шееле думал, что новая кислота обладает свойством выделять при контакте с водой кремнезем и считал его составной частью кислоты. Несмотря на неточное представление Шееле о составе плавиковой кислоты, его трудами установлено, что в ней содержится новый активный элемент. Таким образом, честь открытия фтора принадлежит именно ему. Однако для получения открытого Шееле фтора в свободном состоянии потребовалось огромное количество исследований, продолжавшихся более ста лет.
Мейер и Виглеб установили, что источником кремнезема служит стекло реторты и что эта примесь не образуется, если вести перегонку в металлическом сосуде, а для растворения парообразной кислоты в воде использовать оловянный котел. Газ, получающийся в этих условиях, они сочли фтористоводородной кислотой, которая в присутствии стекла образует смесь с фтористоводороднокремневой кислотой.
В химической системе Лавуазье новая кислота была названа кислотой флуория, так как он считал ее соединением кислорода с неизвестным элементом флуорием. В 1779 г. Лавуазье пишет: «В настоящее время остается определить природу фторного радикала, но только эта кислота до сих пор не поддается разложению. По этой причине мы не имеем возможности создать какое-либо представление о самом радикале». Гей-Люссак и Тенар разделяли взгляд Лавуазье. В 1819 г. они пытались получить безводную плавиковую кислоту, и хотя им это не удалось (они получили только концентрированный раствор), все же их работа пролила свет на отношение кислоты к силикатам. Природа вещества оставалась невыясненной.
После опубликования работы Гэмфри Дэви (1810 г.) об электролитическом получении хлора возникла мысль об использовании электролиза для выделения элементарного фтора. В частности, Дэви получил два письма от Ампера, в которых были изложены оригинальные доводы в пользу аналогии между хлористоводородной и фтористоводородной кислотами. Отвечая Амперу, Дэви высказал твердое убеждение, что плавиковая кислота является водородной кислотой неизвестного еще элемента флюора. Ампер и Дэви предложили переменить название флюор на фтор (греческое—разрушительный). Новое название отражало свойства фтористоводородной кислоты, с которыми многие исследователи, особенно Дэви, успели познакомиться практически. Оно было принято в России, тогда как в других странах осталось прежнее название.
Теперь уже никто не сомневался в существовании нового неизвестного элемента фтора, хотя последний активно сопротивлялся любой попытке перенести его в мир известных явлений.
Уверенность в существовании фтора и возможности его выделения опиралась на многочисленные случаи аналогии его соединений с соединениями трех других элементов из группы галогенов — хлора, брома и йода. На основании этого было предпринято бесчисленное количество попыток выделить фтор в свободном состоянии. Однако получение элементарного фтора оказалось одной из самых трудных задач неорганической химии прошлого века. На разрешение ее потребовалось 70 лет.
В 1813 г. Дэви проделал опыт, который впоследствии стал классическим. Он попытался получить фтор электролизом дымящей плавиковой кислоты, но ее необычайные коррозионные свойства и токсичность заставили его прекратить исследования.
Так описывал Дэви свои неудачные попытки: «Я предпринял эксперимент по электролизу чистой фтористоводородной кислоты с большим интересом, так как он давал наиболее вероятную возможность убедиться в действительной природе фтора. Но при осуществлении процесса встретились значительные трудности. Жидкая фтористоводородная кислота немедленно разрушала стекло и все животные и растительные вещества. Она действует на все тела, содержащие окиси металлов. Я не знаю ни одного вещества, которое бы не растворялось в ней, за исключением некоторых металлов, древесного угля, фосфора, серы и некоторых соединений хлора».
Многие исследователи, в том числе и Дэви, пытались получить элементарный фтор по аналогии с известными реакциями получения хлора — термической диссоциацией фторидов ртути, серебра и других металлов, действием электрического разряда на фториды фосфора, кремния, бора. Все эти попытки не оправдали себя.
Дэви правильно объяснил неудачи при получении неизвестного элемента в свободном виде его высокой реакционной способностью. Он испытывал сосуды из кристаллической серы, угля, золота, серебра и платины, но среди них не нашел материала, который сопротивлялся бы действию нового элемента. Огромное сродство к другим элементам и высокая разрушающая способность заставили рассматривать фтор как один из видов алко- геста — универсального растворителя, который в давние времена упорно отыскивали алхимики.
Неудачи Дэви не остановили других исследователей. Наоборот, они, вероятно, явились стимулом для многих талантливых химиков в их стремлении получить элементарный фтор.
Братья Нокс (1836) пытались получить фтор из фторида серебра и хлора, используя для этого сосуд из плавикового шпата, но не добились никаких результатов, так же как и Фреми, выделявший фтор из фторида кальция действием кислорода при высокой температуре в платиновой трубке.
Позднее братья Нокс подвергли электролизу расплавленный фторид свинца, а Фреми — фториды кальция, калия и других металлов. Последний пользовался платиновым тиглем с платиновой проволокой в качестве анода. При этом он наблюдал сильную коррозию электрода и выделение газа, который он счел фтором, так как газ разлагал воду с образованием фтористоводородной кислоты и выделял йод из йодистого калия. На самом деле это был безводный фтористый водород, содержащий некоторое количество свободного фтора. Несмотря на эту ошибку большим достижением Фреми следует считать разработку способа получения фтористого водорода.
Многие исследователи пытались выделить фтор путем окисления фторсодержащих соединений. Например, фтористоводородную кислоту окисляли азотной, фторид кальция —перманганатом натрия, концентрированной серной кислотой, солями хлорноватистой и хлорной кислоты. Фторид калия пробовали окислить нитратом калия и двуокисью марганца. Естественно, что в результате опытов часто получали кислород и исходный фторид, так как фтор является более сильным окислителем. Исследования, проводимые без знания химической природы фтора, были заранее обречены на неуспех. Вытеснить фтор из фторидов действием других простых веществ невозможно.
Фарадей — ученик и последователь Дэви — в течение нескольких лет пытался получить фтор электролизом расплавленных фторидов олова, кальция, аммония и мышьяка. Все эксперименты оказались безрезультатными главным образом из-за плохой проводимости этих солей. Возможно, что при электролизе получалось небольшое количество фтора, но при высокой температуре опытов он реагировал с материалом анода или электролизной ванны.
В 1834 г. Фарадею показалось, что он наконец получил неуловимый газ, но вскоре ему пришлось признать свою ошибку: «Я не смог получить фтор,— заявил он.— Мои предположения, подвергаясь строгому анализу, отпадали одно за другим».
После Фарадея попытки получить элементарный фтор продолжались непрерывно в течение пятидесяти лет. Работы эти поистине можно назвать героическими. Они не только отличались большой трудоемкостью, но были опасны для жизни исследователей.
В 1883 г. учепик Фреми Муассан решил тщательно исследовать электролизный метод получения фтора из фтористоводородной кислоты, тот самый метод, который в 1810 г. был предложен Ампером и на котором потерпели неудачу сам Ампер, Дэви и многие другие исследователи. В первых опытах Муассан пытался подвергнуть электролизу безводную фтористоводородную кислоту, нов соответствии с наблюдениями Фарадея, нашел, что она не проводит электрический ток. Если в кислоте присутствует небольшое количество воды, последняя разлагается с образованием озона. По мере разложения воды кислота становится все менее проводимой; с исчезновением воды передача тока прекращается полностью. Муас - сан получил кислоту, настолько свободную от воды, что она почти не проводила тока.
Летом 1886 г. Муассану наконец удалось получить свободный фтор путем электролиза плавиковой кислоты, т. е. способом, на котором потерпели неудачу его многочисленные предшеств енники.
В начале Муассан был уверен, что полученный им фтор является продуктом электролиза безводного фтористого водорода, полученного при нагревании расплавленного бифторида калия (КНРг). Пропуская ток через электролизер, Муассан установил, что на катоде выделяется водород, а на аноде — очень реакционноспособное газообразное вещество. Впервые в истории исследования фтора ученый имел возможность собрать пузырьки газа, оказавшегося таинственным и неуловимым фтором.
Муассан заранее знал его агрессивные свойства и поэтому изготовил свой электролизер целиком из платины, за исключением двух электродов, сделанных из ирридиево-платинового сплава, и проводил опыты при —23°. Однако несмотря на эти предосторожности наблюдалась интенсивная коррозия аппаратуры.
После заявления Муассана о сделанном открытии Парижская Академия наук назначила комиссию для проверки его опытов. Чтобы быть уверенным в чистоте исходных продуктов, Муассан подверг фтористый водород вторичной перегонке. И это послужило причиной неудачи опыта —чистая кислота не проводила электрический ток. Лишь в последующих работах Муассану удалось показать, что только добавление нескольких кристалликов фтористого калия делало фтористый водород проводником тока и что первоначальный успех опытов объяснялся присутствием примеси соли.
Таким образом, способ получения элементарного фтора по Муассапу заключается в электролизе раствора бифторида калия в безводном фтористом водороде. В дальнейшем быстро разрушающийся платиновый сосуд Муассан заменил медным, сохранив и-образную форму сосуда и платиновый анод. Стоимость элементарного фтора была очень высока, так как при его получении этим способом происходило интенсивное разрушение анода: платина вступала в реакцию с фтором с образованием фтористой платины. На 1 г фтора расходовалось 5—6 г платины.
Как мы знаем теперь, главная трудность в получении свободного фтора заключается в необходимости отнять от иона фтора электрон, к которому атом фтора имеет исключительно большое сродство. Эта задача могла быть разрешена только при помощи электрического тока — универсального окислительно-восстановительного агента, которому можно придать любой «окислительный потенциал» путем изменения напряжения.
Способ Муассана требовал непрерывного охлаждения электролита, а выход фтора по току не превышал 30%. Кроме того, в нем содержалась трудно отделимая примесь кислорода. Небольшое количество получаемого газа позволило определить только его основные химические и физические свойства. Мысль о практическом применении фтора и его соединений никому не приходила в голову. В конце прошлого века Д. И. Менделеев в «Дополнениях к основам химии» писал: «Полезно и поучительно знать ныне, что и фтор как простое тело не успел укрыться от опыта и наблюдения, что попытки его уединения увенчались успехом, но совокупность общих химических сведений о фторе, как элементе, от этого выиграла немного».
Работы Муассана сыграли решающую роль в развитии химии фтора. Хотя его электролизер и условия получения элементарного фтора были мало пригодны даже для лабораторных исследований, до настоящего времени не найден метод, принципиально отличающийся от метода Муассана. С 1919 г. в качестве электролитов для получения фтора стали использовать расплавленные бифториды. Это освободило от необходимости охлаждать электролизер, повысило выход по току и чистоту газа. Были внесены изменения в конструкцию электролизера: вместо и-образного сосуда стали применять ванны с диафрагмами. Корпус электролизера изготавливается из меди, никеля, стали. Платиновый анод заменен никелевым, угольным или графитовым (рис. 1). Все это позволило перенести процесс получения фтора из лабораторных условий в промышленные.
В литературе описаны 32-анодные электролизеры на 4000—6000 ампер. Продолжительность службы таких
|
Рис. 1. Промышленный электролизер |
 1 — выходная трубка для фтора; 2 — электролит; 3 — анод; 4 — катод; 5 — экран Диафрагмы; 6— водяное охлаждение
1 — выходная трубка для фтора; 2 — электролит; 3 — анод; 4 — катод; 5 — экран Диафрагмы; 6— водяное охлаждение
Рис. 2. Лабораторный электролизер
1— корпус; 2 — анод; 3 — катод с диафрагмой
Аппаратов исчисляется Многймй месяцами, что значительно превышает срок службы менее мощных электролизеров.
Современный электролизер для получения элементарного фтора (рис. 2) подобен хлорному электролизеру. Он состоит из трех основных частей: емкости с электролитом, электродов и приемника выделяющегося фтора. Электролитом служит раствор фторида калия во фтористом водороде; в нем не должно содержаться воды и других веществ, окисляющихся легче ионов фтора. Материал анода также должен окисляться значительно медленнее, чем фтор-ионы. Поскольку в растворе присутствуют ионы Е~ и НЕ'2, реакцию, происходящую на электродах, можно записать следующим образом:
На аноде На катоде
2¥~->¥2 + 2е 2Н¥~2 +2е-*Н2 + Ь¥~
2И+ Н2 — 2е
Выход фтора по току в современных электролизерах достигает 95% при напряжении 8—10 вольт.
Во время второй мировой войны в ряде стран производство фтора достигло промышленных масштабов. Стоимость его неуклонно снижается. В США в конце 30-х годов один фунт фтора стоил 75 долл.; в 1957 г. эта цена уменьшилась до 25 центов, т. е. в 300 раз.
Газообразный фтор перевозят в стальных и никелевых баллонах емкостью от 1 до 20 кг под давлением 15 — 35 ат. Для перевозки фтора в жидком состоянии газ конденсируют при помощи жидкого азота. Контейнер с жидким фтором охлаждается в пути жидким азотом или кислородом. Транспортирование фтора —дорогая и сложная операция. Часто его предпочитают получать на месте использования. Например, на урановом заводе в Ок-Ридже производят и тут же используют большое количество элементарного фтора. Фтор получают на нескольких установках производительностью около 14 кг/час. Каждая установка состоит из пяти электролизеров. Аноды выполнены из угля, а катоды из стали. Продукт электролиза содержит 10—12% фтористого водорода; который отделяется и очищается пропусканием через колонну с фтористым калием и рефрежираторный конденсатор.
Очищенный газ, содержащий приблизительно 96% фтора, 2% фтористого водорода, 0,5% азота и 0,5% кислорода, собирают в емкости объемом 16 м3, покрытые монель-металлом (сплав никеля с медью). Газ хранится под давлением 5 ат.
Свойства и особенности элементарного фтора
Свободный фтор — бледно-желтый газ. В толстых слоях он приобретает зеленовато-желтую окраску. Запах фтора, резкий и раздражающий, напоминает одновременно запах хлора и озона. По запаху можно обнаружить присутствие одной части фтора в миллионе частей воздуха. Один литр газа при 0° и нормальном давлении весит 1,71 г.
При очень низкой температуре (—187°) фтор конденсируется в жидкость канареечно-желтого цвета. При обычной температуре, даже применяя высокое давление, фтор невозможно превратить в жидкость вследствие его низкой критической температуры (—129°). Поэтому для конденсации и хранения фтора непригодны способы, используемые для хлора. При —218° жидкий фтор замерзает в светло-желтое кристаллическое тело, которое ниже —252° становится бесцветным.
Жидкий фтор обладает высоким удельным весом, данные о котором исправлены только в последнем десятилетии. Ранее пользовались данными Муассана (удельный вес при температуре кипения 1,108); они приведены в советской «Технической энциклопедии» и в американской «Химической энциклопедии» Отмера. В более поздней литературе приводится исправленное значение плотности жидкого фтора 1,513. Однако до сих пор в некоторых учебниках ошибка повторяется. Например, в учебниках Н. Л. Глинки и А. Г. Кульмана приведена плотность фтора 1,11 г/см8,
В периодической системе Менделеева фтор занимает место во втором периоде и имеет атомный номер 9. Атомный вес фтора 19.
Фтор — первый член группы галогенов. По своим свойствам он во многом напоминает их, но подобно всем первым членам групп других элементов обнаруживает и значительные отличия. Атом фтора имеет всего два
|
.-•'V |
/V |
|
_ і 1 ,'9р' ^ ',1 )» •Л/'У/ |
/ / ' ' ^ • |
|
А |
6 |
|
Рис. 3. Схема перехода атома (а) фтора в ион (б) |
Электронных слоя (п = 2). Во внутреннем (К-слое) содержится два, а во внешнем (1/-слое) — семь электронов. Это сообщает фтору ярко выраженные электроотрицательные свойства. Благодаря нечетному числу электронов во внешнем слое фтор особенно легко присоединяет электрон, превращаясь в отрицательный одновалентный ион (рис. 3).
Число валентных электронов во внешнем электронном слое показывает, что отрицательная валентность фтора равна единице; в отличие от других галогенов фтор не может проявлять положительной валентности. Двухатомная молекула фтора образуется за счет ковалентной связи, возникающей в результате взаимодействия двух неспаренных электронов 1,-слоя двух атомов фтора.
Фтор обладает рядом особенностей, которые в известной степени объясняют своеобразные свойства его соединений. В первую очередь следует отметить малые размеры атома фтора. Так, его атомный радиус 0,64, тогда как радиус хлора равен 0,99, а радиус йода 1,33 А. Таким образом, объем атома фтора составляет только одну четвертую часть объема атома хлора и менее одной десятой атома йода. Приобретая один недостающий электрон, атом фтора превращается в анион, который также отличается минимальной величиной ионного радиуса 1,33 А; соответствующие радиусы хлора и брома — 1,81 и 2,20 А. Малые размеры атомов помогают фтору плотно располагаться или, как говорят, упаковываться вокруг атомов других элементов, в результате чего образуются соединения, богатые фтором и соответствующие высшим валентностям элементов, например ЗЕ6, 32Г1о, 11Г6, 1Е7, ОэЕв.
Фтор обладает наибольшей реакционной способностью среди неметаллических элементов, его окислительный потенциал выше потенциала озона. Высокая электроотрицательность фтора обусловлена максимальным сродством к электрону по сравнению с другими элементами и очень большим потенциалом ионизации. Нормальный электродный потенциал фтора 2,85 Ь, тогда как для хлора и кислорода эта величина составляет 1,36 и 1,22 Ъ. Если электроотрицательность фтора, выраженную в условных единицах, сравнить с электроотрицательностью других элементов, получается следующий ряд: фтор 4, кислород 3,5, азот и хлор 3,0, бром 2,8, углерод 2,5, литий 1.
Причиной большой реакционной способности атомов фтора является стремление завершить октет внешнего электронного слоя, и эта сила настолько велика, что фтор взаимодействует почти со всеми веществами за исключением инертных газов (имеются сведения, что в прошлом году получено даже соединение фтора с ксеноном). Все реакции с участием фтора отличаются очень высоким тепловым эффектом. Например, на 1 кг эквимолекулярной смеси лития и фтора выделяется 5650, бериллия и фтора 4830, углерода и фтора 1830 ккал. При взаимодействии фтора с водородом выделяется 128,4 ккал/молъ, тогда как присоединение водорода к кислороду сопровождается выделением только 57,8 ккал/молъ.
С кислородом фтор соединяется только в электрическом разряде, образуя сравнительно стабильное соединение — дифторид кислорода Г20. Поскольку фтор более электроотрицательный элемент, чем кислород, то в данном соединении последний заряжен положительно.
В этом заключается резкое отличие фтора от других галогенов, образующих с кислородом неустойчивые окислы с отрицательно заряженным кислородом. И вообще во всех соединениях с кислородом фтор имеет отрицательный заряд, поэтому нельзя ожидать образования кислородных кислот фтора, аналогичных кислотам хлора, например фторноватой (НГ03) или фторной (НГ04).
Реакция соединения кислорода и фтора эндотермична, т. е. идет с поглощением тепла. При взаимодействии фтора со всеми остальными элементами происходит выделение тепла. Такие элементы, как бром, йод, сера, фосфор, мышьяк, бор, сурьма, кремний соединяются со фтором с самовоспламенением даже при обычной температуре.
Хлор бурно взаимодействует с фтором после предварительного нагревания. Древесный уголь воспламеняется при соприкосновении с фтором. Графит загорается во фторе при темно-красном калении, алмаз — при еще более высокой температуре. Фтор реагирует со всеми окисляющимися элементами уже при комнатной температуре, часто вызывая воспламенение.
Азот непосредственно не реагирует со фтором даже при высокой температуре и может быть использован как инертный разбавитель при реакциях фтора в газовой фазе. Однако электролизом фтористого аммония получается вполне устойчивый трехфтористый азот ОТз с положительно заряженным атомом азота; в противоположность этому треххлористый азот представляет собой взрывчатое соединение с отрицательно заряженным атомом азота.
Некоторые из соединений фтора с металлоидами, например трехфтористый хлор, в свою очередь являются исключительно реакционноспособными веществами; другие, наоборот, более стабильны, чем соответствующие соединения других элементов. Многие соединения фтора обладают исключительной стабильностью, например гексафторид серы, трехфтористый азот, фторуглероды.
Вопреки распространенному мнению гомогенная реакция между фтором и водородом протекает медленйо, так как требует сравнительно высокой энергии активации (30—40 ккал) и начинается лишь при 150-250°. Взаимодействие этих элементов представляет собой радикальноцепной процесс, в котором цепи зарождаются на стенках сосуда и, следовательно, скорость реакции зависит от материала сосуда. Фтор энергично соединяется с водородом на поверхности кварца; в этом случае смесь взрывается даже при температуре жидкого воздуха. На поверхности серебра или платины фтор и водород соединяются медленно. В магниевых сосудах, покрытых слоем фтористого магния, реакция не наблюдается даже при комнатной температуре.
Большинство металлов взаимодействует с фтором при обычной температуре, но многие из них образуют стойкую защитную пленку фторида, которая препятствует дальнейшей реакции. Свинец, уран, ванадий реагируют с фтором на холоду. Натрий и кальций в этих условиях самовоспламеняются. При небольшом разогревании во фторе загораются титан, молибден и вольфрам. С фтором энергично взаимодействуют нагретые металлы платиновой группы. Так, осмий и рутений загораются в атмосфере фтора при 250°, а платина и палладий — при температуре темно-красного каления. Алюминий, железо, хром, никель при обычной температуре образуют защитную пленку фторида. Коррозионная устойчивость деталей из этих металлов снижается с увеличением содержания в них углерода, кремния, титана и других лигирующих добавок. Из стали можно изготовлять трубопроводы для фтора, используемые только при обычной температуре. Однако пленка фторида не всегда защищает эти металлы от фтора. При накаливании серебро и железо загораются во фторе при температуре около 500°, но никель, покрытый фтористым никелем, не реагирует с фтором даже при 600°.
Нагретая вода горит в струе фтора бледно-фиолетовым пламенем. При этом образуется фтористый водород и элементарный кислород
2Н20 + 2¥2 -* 4НГ + 02.
В этой реакции в отличие от обычных случаев горения кислород является не причиной, а продуктом горения.
Активность фтора в различного рода реакциях может быть уменьшена тщательным регулированием температуры, разбавлением его инертным газом и другими способами. При низких температурах фтор не действует на стекло и некоторые металлы.
|
Таблица 1
|
Перфторметан (четырехфтористый углерод) — единственное органическое вещество, которое при обычной температуре не взаимодействует с фтором. Фториды металлов, находящихся в состоянии высшей валентности, также противостоят фтору. Они менее летучи, чем соответствующие хлориды. Для неметаллов наблюдается обратная закономерность; это видно из данных табл. 1, где приведена температура плавления и кипения некоторых фторидов и хлоридов.
Фтор имеет только один устойчивый изотоп Г19. Известны радиоактивные изотопы фтора с массами 16, 17, 18, 20, 21, но они имеют настолько короткие периоды полураспада, что практическое применение их, например в качестве меченых атомов, весьма ограничено. При кратковременных опытах, вероятно, может применяться Г18 с периодом полураспада 105 мин.
•
Фтористый водород и другие неорганические фториды
Простейшим и вместе с тем одним из наиболее важных соединений фтора является соединение его с водородом — фтористый водород.
В промышленном масштабе фтористый водород начали получать в начале 30-х годов текущего столетия. Главные потребители фтористого водорода — нефтеперерабатывающие заводы, где его используют для получения высокосортных авиационных топлив, и заводы органического синтеза, производящие фреоны и другие фторуглероды. В последние двадцать лет выработка фтористого водорода непрерывно возрастает в связи с использованием его в атомноэнергетическох! промышленности.
Среди галоидоводородов фтористый водород занимает особое место. Его физические свойства скорее можно сравнить со свойствами аммиака и воды, чем галоидоводородов. Температура кипения безводного НГ (+19°) намного превышает температуру кипения хлористого водорода (—84°), так же как температура кипения воды выше температуры кипения сернистого водорода.
Жидкий фтористый водород — бесцветная, подвижная, легко испаряющаяся жидкость, обладающая мало'й вязкостью и чрезвычайно низким поверхностным натя -
Рением (10 дин/см при 0°). Температура плавления фтористого водорода минус 83°,а плотность при 0° 1,0015 г/см3. фтористый водород чрезвычайно прочное соединение, что видно из его энергии гемолитической диссоциации, равной 140 ккал/молъ, обладает высокой диэлектрической пос тоянной (83,6 при 0°) и высокой критической температурой (230°).
Физические свойства жидкого фтористого водорода свидетельствуют о своеобразном характере этой жидкости. Большая диэлектрическая постоянная и сравнительно высокая для такого молекулярного веса температура кипения указывают на то, что жидкий НЕ является ассоциированной жидкостью. Однако этому противоречат низкие значения поверхностного натяжения и вязкости фтористого водорода. Удовлетворительное объяснение столь противоположным свойствам еще не найдено.
С химической точки зрения фтористый водород — сильная кислота, являющаяся прекрасным ионизирующим растворителем. Вследствие своей специфической способности к комплексообразованию НЕ энергично реагирует не только с основными, но и с кислотными окислами, кислородными кислотами и их солями, образуя комплексные кислоты и соли.
Растворение многих неорганических веществ в жидком фтористом водороде поразительно напоминает растворение в воде. По отношению к НЕ фториды играют ту же роль, что окислы и гидроокиси по отношению к воде. Хлориды растворяются в фтористом водороде с образованием фторидов и хлористого водорода, который, будучи совершенно нерастворимым в НЕ, выделяется в виде газа. Бромистый и йодистый водород очень плохо растворимы в жидком НЕ. По-видимому, это объясняется тем, что жидкий фтористый водород — один из самых кислых растворителей, в то время как вода по отношению к столь кислым газам является основанием.
Свойства фтористого водорода во многом зависят от присутствия в^ нем воды. Совершенно сухой НЕ не реагирует с большинством металлов и их окислами. Однако достаточно ничтожной примеси воды, чтобы вызвать реакцию, которая идет с самоускорением, так как одним из продуктов реакции является та же вода. Подобным образом фтористый водород действует и на окислы неметаллов. Он легко реагирует, например с двуокисью кремния —составной частью стекла и глазури. Поэтому
НЕ нельзя получать и хранить в стеклянной посуде. Безводный фтористый водород очень медленно реагирует с кварцем и кварцевым стеклом. Хотя реакция имеет автокаталитический характер из-за постепенного накопления воды, скорость ее все же мала, и при непро - должительных лабораторных работах иногда можно пользоваться стеклянной посудой.
Безводный фтористый водород хранят в стальных баллонах или танках, а водный раствор, называемый плавиковой кислотой, — в свинцовых, парафиновых, полиэтиленовых сосудах, имеющих защитное покрытие из фторопластов. Во многих случаях реакция с фтористым водородом протекает только на поверхности металла, так как образуется слой нерастворимой соли, защищающий металл от дальнейшего действия кислоты; так ведет себя, в частности, свинец.
Получение фтористого водорода непосредственно из элементов сопровождается выделением тепла (128 ккал/молъ) и в присутствии пористых веществ протекает очень бурно даже в темноте и при сильном охлаждении. Эта реакция используется во «фтористоводородной горелке» (рис. 4) для резания металлов.
Промышленное получение фтористого водорода основано на разложении серной кислотой фтористого кальция
Са¥2 + Н2804 Са804 + 2Я¥
Или других фторидов, например солей кремнефтористоводородной кислоты. Образующийся фтористый водород очищают от примесей и поглощают водой; при этом образуется плавиковая кислота. Для выработки 1 т НР требуется 2,5 т плавикового шпата кислотного сорта.
Техническая плавиковая кислота, содержащая не менее 40% фтористого водорода, представляет собой бесцветную, дымящую на воздухе жидкость. Она действует разрушающим образом на стекло, бетон и некоторые металлы, особенно на сплавы, содержащие кремний, например чугун. Кислота разрушает также каучук, кожу и многие другие органические вещества. Фтористый водород сильно действует на слизистые оболочки, дыхательные пути, покровные ткани человека и животных, поэтому в производстве этих продуктов уделяется особое внимание технике безопасности.
|
Рис. 4. Фтористоводородная горелка |
Толчком к развитию производства фтористого водорода послужило то, что вся быстро растущая промышленность фторорганических веществ базируется на нем как на источнике фтора. Кроме того, НЕ очень активный и удобный катализатор многих реакций — ацилирования, циклизации, полимеризации, гидролиза и алкилирова - ния, используемого при получении высокоактивного авиационного топлива.
Преимущества НЕ как катализатора объясняются не только его химическими, но и физическими свойствами. Низкая температура кипения способствует легкому отделению его от продуктов реакции; низкая температура замерзания позволяет осуществлять реакцию при отрицательной температуре. Органические вещества, содержащие кислород, азот и серу, хорошо растворяются во фтористом водороде, который в свою очередь легко растворяется в этих веществах. Таким образом, катализатор может действовать в жидкой фазе. Фтористый водород не осмоляет и не разлагает углеводородов. Например, толуол, нагреваемый до 200° с НЕ в течение недели, не подвергается никаким' изменениям.
Фтористоводородная кислота (в незначительных количествах) обладает свойством усиливать дрожжевое брожение, может служить дезинфицирующим средством. Ее слабые растворы пригодны для удаления ржавых пятен с тканей; при этом образуется бесцветная комплексная соль фторида железа.
Фтористый водород служит исходным продуктом синтеза самых разнообразных фторорганических соединений в лабораторной практике и промышленности. С его помощью из ряда соединений вытесняют галоиды, заменяя их фтором. При взаимодействии HF с солями или окислами металлов образуются фториды металлов, которые используют для фторирования органических галогени - дов. При соединении HF с ненасыщенными углеводородами образуются фторсодержащие вещества.
Фтористый водород широко используется в электрохимических процессах фторирования органических веществ и служит основным материалом для получения элементарного фтора в электролизерах. Наконец, безводный HF играет важную роль в атомной промышленности, где его используют для получения четырехфтористого урана (после восстановления которого образуется металлический уран) и элементарного фтора (с помощью которого тетрафторид урана переводят в гексафторид).
В США в 1957 г. было произведено 135 тыс. т фтористого водорода; в 1963 г. ожидается увеличение его выработки до 215 тыс. т. Потребление фтористого водорода в США в 1957 г. и ожидаемое потребление в 1963 г. приведены в табл. 2.
Таблица 2
|
1957 г. |
1963 г. |
|||
|
Тыс. т |
% |
Тыс. т |
% |
|
|
Фтористый алюминий. . |
40 |
29,6 |
65 |
30,2 |
|
Фторуглероды......................... |
38,5 |
28,3 |
67 |
31,2 |
|
Производство урана. . . |
16 |
11,8 |
21 |
9,8 |
|
Синтетический криолит. |
13 |
— |
25 |
— |
|
Соли....................................... |
7,3 |
5,6 |
8,4 |
3,9 |
|
Травление стали........................ |
7 |
5,2 |
8,1 |
— |
|
Разное.................................... |
13,2 |
— |
20,5 |
— |
Важным фторсодержащим вспомогательным веществом является фторсульфоновая кислота (HFSO3), более силь -
Йая, чем серная, и более устойчивая к гидролизу, чем хлорсульфоновая. Фторсульфоновая кислота потребляется в производстве трехфтористого бора, сульфурилфто - рида, окиси фтора, широко применяется как катализатор этерификации, алкилирования и полимеризации монооле - финов, а также для получения сульфамидных препаратов. С ее помощью осуществляют присоединение фтористого водорода к ненасыщенным углеводородам и многие реакции конденсации (например, получение ДДТ и других органических производных).
Широкое признание завоевали трехфтористый бор (ВЕз) и его соединения как катализаторы полимеризации, алкилирования, конденсации; по каталитическому действию они близки к серной, фосфорной и фтористоводородной кислотам.
Трехфтористый бор был открыт Гей-Люссаком и Те - наром при попытке получить газообразный фтористый водород из плавикового шпата путем нагревания его с окисью бора в накаленной докрасна железной трубке. В настоящее время трехфтористый бор получают из щелочного фтор - бората, борного ангидрида и серной кислоты. В обычных условиях трехфтористый бор— бесцветный газ со специфическим острым запахом; температура кипения около—101°, температура плавления —129°; плотность жидкого ВЕз при температуре кипения 1,769 г! см8. При обычной температуре стекло устойчиво к действию ВЕ3.
Впервые каталитическое действие трехфтористого бора было исследовано более 70 лет назад А. М. Бутлеровым в полимеризации пропилена и изобутилена. В последнее время этим способом получают изооктилен, который после гидрирования превращается в изооктан —важнейшую составную часть высокооктанового топлива. Другой способ получения изооктана — алкилирование изобутана изобутиленом в присутствии ВЕз. Комплексные соединения трехфтористого бора — лучшие катализаторы алкилирования изопарафинов олефинами. Много внимания уделяется синтезу алкилзамещенных бензолов при помощи ВЕг. Продукты этого синтеза обладают высокими антидетона - ционными свойствами и служат ценными компонентами авиационного топлива для винтомоторных самолетов. Широко изучена полимеризация изобутилена в присутствии ВЕз, приводящая к образованию некоторых сортов синтетического каучука.
Элементарный фтор легко реагирует с болыйянстйом металлов. Натрий, калий, литий воспламеняются в среде фтора. Для таких элементов, как барий, свинец, вольфрам, необходима повышенная температура. Никель, медь и платина реагируют с фтором только при 500°, поэтому из них делается аппаратура для работы с газообразным фтором.
В практике элементарный фтор используют для получения только тех фторидов металлов, которые нельзя синтезировать другим, более дешевым способом. Например, высшие фториды серебра, церия, платины, урана невозможно получить без участия фтора. Остальные фториды выгоднее получать с использованием безводного фтористого водорода или плавиковой кислоты.
Очень важным соединением является трехфтористая сурьма — реагент обмена галоидов на фтор. Наиболее простой способ ее получения — растворение трехокиси сурьмы во фтористоводородной кислоте. Не меньшее значение в химии фтора имеют фториды кобальта — дифторид и мощный фторирующий агент трифторид; последний получают действием фтора на дихлорид или дифторид кобальта при 150°.
Кремнефтористоводородная кислота Н281Г6 используется для стерилизации оборудования в пивоваренной промышленности, в производстве чистого свинца (электролитическое рафинирование), на кожевенных заводах (для очистки шкур). Соли кремнефтористоводородной кислоты (фторсиликаты) токсичны и применяются как средства (инсектициды) для уничтожения сельскохозяйственных вредителей—капустного жука, долгоносика, яблочного мотылька и др. Наиболее широко для этих целей применяется бариевая соль. Фторсиликаты магния и бария повышают водонепроницаемость и прочность бетона.
При взаимодействии элементарного фтора с другими галоидами образуются галоидфториды. Известны фториды йода, брома и хлора; температура плавления и кипения их приведена в табл. 3.
Галоидфториды очень реакционноспособные вещества. В этом отношении они приближаются к элементарному фтору. Трифторид брома, например, взрывообразяо реагирует с водой, деревом, резиной и даже асбестом. Наиболее интересное свойство галоидфторидов — их сильное окислительное действие.
|
Таблица 3
|
Наиболее реакционноспособен трифторид хлора CIF3. Например, он почти количественно превращает хлористое серебро во фторид двухвалентного серебра AgF2 — один из лучших фторирующих агентов. С окислами металлов он образует фториды высшей валентности; например, урановые соединения количественно превращаются в гексафторид урана UFe.
Во время второй мировой войны CIF3 применялся в Германии как зажигательное средство. В Фолькенхагене действовала установка для получения трифторида хлора производительностью 5 т/сутки.
Одно из необычных свойств многих фторидов — высокая летучесть неионных соединений, причем наиболее летучи из них те, в которых центральный атом соединен с максимальным числом атомов фтора. В соответствии с этим правилом SF4 (т. кип. —40°) менее летуч, чем SFe (т. кип.—64°); летучесть AsF6 (т. кип. —53°) превышает летучесть AsFe (т. кип. +63°). OsFs (т. кип. +47°) более летуч, чем OsFg (т. кип.+205°). Исключение из правила составляют резко электроотрицательные элементы, например кислород или хлор. В настоящее время известны летучие фториды металлов из семейства актинидов (элементы с номерами 89—96), например шестифтористый уран, превращающийся в газ уже при 56°. Он был впервые получен из пятихлористого урана и фтористого водорода Руффом, который пытался найти соединение, легко выделяющее элементарный фтор.
При взаимодействии газообразного фтора с фторидами плутония был получен гексафторид плутония PuF6. По своим химическим и физическим свойствам (т. кип. 62,3°, т. пл. 51°) это вещество оказалось близким гексафториду урана, что подтверждается сходством их молекулярных структур.
2
|
33 |
![]() И. Л. Кнунянц а А. В. Фокин
И. Л. Кнунянц а А. В. Фокин
Вследствие радиоактивного распада плутония, сопровождающегося выделением альфа-лучей, наблюдается радиолиз молекулы РиГб с образованием элементарного фтора и фторида плутония более низкой валентности. Скорость распада твердого РиГе 1,5% в день; в газовой фазе она значительно меньше, причем система может достигнуть устойчивого состояния (тепловая диссоциация при обычной температуре не наблюдается).
Исследуется возможность регенерации ядерного горючего, т. е. очистки урана от радиоактивных осколочных элементов, с помощью фторидов. В основу метода положено фторирование облученного в атомном реакторе уранового горючего, а затем отделение урана в виде летучего гексафторида. Получение 11Рб особенно выгодно в тех случаях, когда регенерированный уран направляют на диффузионную установку для обогащения. Эффективность описанного метода подтверждают данные табл. 4, из которых видно, что за редким исключением фториды продуктов деления менее летучи, чем гексафторид урана.
|
Таблица 4
|
Вначале делались попытки фторировать металлический уран элементарным фтором. Однако управление реакцией между газообразной и твердой фазами оказалось крайне сложным, так как скорость теплопередачи в данной системе была недостаточна для отвода огромного количества выделяющегося тепла. Практическое разрешение проблемы было найдено в применении жидких фторирующих реа
Гентов, например трифторида хлора, три - и пятифто - рида брома.
Гексафторид вольфрама ¥Ге используется для покрытий графитовых сопел реактивных двигателей. Процесс нанесения металла отличается быстротой; он основан на восстановлении паров шестифтористого вольфрама водородом при 650°.
В современных жидкостных реактивных двигателях используется химическая энергия, образующаяся в результате окисления горючего в замкнутом пространстве. Реактивное топливо представляет собой смесь двух компонентов — горючего и окислителя, причем расход второго в несколько раз превышает расход первого.
Горючим в ракетных двигателях могут быть те элементы или соединения, которые в сочетании с окислителями обеспечивают высокую теплопроизводительность топливной смеси (не менее 1500—2000 ккал/кг). Элементарный фтор и некоторые фторсодержащие соединения отвечают этим требованиям: из всех известных элементов, способных быть окислителями, только кислород и фтор образуют топливные смеси с высокой теплопроизводительностью. Здесь показатели фтора как окислителя в сочетании с большинством элементов (за исключением углерода) значительно превосходят показатели кислорода. Это объясняется рядом причин, в частности малым молекулярным весом фтора, низкой энергией диссоциации (38 ккал/молъ)у экзо - термичностью реакций со многими элементами. Высокая реакционная способность фтора, ведущая к воспламенению в его среде большинства горючих веществ, обусловлена, с одной стороны, малой величиной энергии, требуемой для разрыва связей в его молекуле, а с другой, большим количеством тепла, выделяющегося при образовании связи между атомом фтора и атомом какого-либо другого элемента (например, энергия связи С — Г равна 104 ккал/люлъ), и, следовательно, высокой стабильностью многих соединений фтора. Например, фтористый водород, образующийся при окислении водорода или водородсодержащего горючего фтором, может существовать в молекулярной форме даже при очень высокой температуре. После молекулы азота молекула НТ — одна из самых термически стабильных. Таким образом, продукт сгорания водорода во фторе — фтористый водород — по стойкости к диссоциации и термодинамическим свойствам значительно превосходит пары воды, образующиеся при окислении водорода кислородом.
Малая степень диссоциации продуктов горения дает возможность повысить коэффициент использования выделяющейся энергии, так как эта энергия не тратится на диссоциацию. Снижение непроизводительных затрат тепла на испарение продуктов горения в случае фтора объясняется также тем, что фториды обычно имеют более низкую температуру кипения, чем окислы. Так, ВЕз, 31Е4, НЕ — низкокипящие вещества.
Жидкий фтор можно использовать в двухкомпонентных системах топлива. Подобно кислороду, фтор является окислителем, который можно конденсировать и хранить при температуре жидкого воздуха. Фтор мощный воспламенитель, но температура воспламенения металлов в его среде очень высока: обычные металлы не горят в жидком фторе, а температура их вспышки в газообразном фторе несколько сот градусов. Однако здесь надо предусматривать случайные вспышки, возникающие при наличии загрязнений или примесей.
После того как научились сжижать элементарный фтор и перевозить его в специальных контейнерах, построенных по принципу сосуда Дюара, роль фтора, как одного из наиболее интенсивных окислителей горючего, значительно увеличилась. Однако реакционная способность фтора и температура сгорания топлива в его присутствии оказались настолько высокими, что потребовалось разрабатывать специальное оборудование для двигателей и охладительных камер.
Считают, что с помощью фтора можно получить очень высокую удельную тягу (специфический импульс), достигающую 375 кг-сек! кг. Удельная тяга, создаваемая при взаимодействии фтора с различными видами топлива по сравнению с другими окислителями, приведена в табл. 5.
Помимо удельной тяги, на скорость и дальность полета ракеты в значительной степени влияет плотность топлива, определяющаяся плотностью его компонентов. Плотность фтора в жидком состоянии при температуре кипения 1,51, а соответствующая плотность кислорода 1,14. Этим отчасти объясняется большая эффективность фтора как окислителя по сравнению с кислородом.
Сведения о плотности фтора оказались настолько важными для нужд ракетной техники, что этот вопрос стад объектом специальных исследований. До последнего времени, как уже было сказано, представления о плотности жидкого фтора при температуре кипения основывались на данных Муассана (1897), считавшего, что плотность фтора равна
|
Т а блица 5
|
1,14 г/см3. По данным 1937 г., плотность жидкого фтора при температуре кипения 1,11 г/см3. В 1952 г. эта величина была повышена до 1,54 г/см3 при —196°. Сотрудниками Лаборатории ракетных топлив Калифорнийского технического института установлены новые значения плотности фтора (табл. 6); исследования проводились с точностью до +0,002 г/см3.
Таблица 6
|
Температура, °С |
Плотность, г/см3 |
Температура, °С |
Плотность, г/см3 |
|
—207,6 |
1,639 |
—193,0 |
1,547 |
|
—205,9 |
1,630 |
—192,0 |
1,539 |
|
—203,0 |
1,613 |
—190,9 |
1,531 |
|
—199,9 |
1,587 |
—189,6 |
1,522 |
|
—197,6 |
1,578 |
—188,7 |
1,516 |
|
—195,2 |
1,562 |
—187,8 |
1,509 |
В литературе в качестве окислителей ракетного топ* лива помимо фтора рассматриваются и его соединения с галоидами и кислородом. Как уже сказано, фтор образует с углеводородами и другими горючими веществами
Топливные смеси, имеющие энергетические преимущества перед топливами на основе кислорода. Однако использование фтора для ракетного топлива несколько затрудняется его высокой реакционной способностью, низкой температурой кипения и сложностью транспортирования. К недостаткам фтора как окислителя топлива следует отнести и его токсичность. Уже в небольших концентрациях (0,0008 мг/л) он поражает дыхательные пути; в чистом виде он поражает кожу, вызывая болезненные, долго незаживающие ожоги. Для защиты от фтора применяются противогазы или маски, соединенные с источником чистого воздуха.
Среди возможных заменителей элементарного фтора привлекает юнимаиие окись фтора 0¥2 (т. кип.—146,5°, т. пл. — 223,8°, плотность 1,65 г! см3 при—190°). Теплота образования окиси фтора 130 ккал/кг; аналогично озону она обладает сильно выраженными окислительными свойствами. Окись фтора высокотоксичное вещество; при 300° она распадается на фтор и кислород. При обычной температуре окись фтора при смешении с водородом, метаном и другими веществами не дает воспламенения, как это наблюдается при смешении указанных веществ с фтором.
Окись фтора получается при пропускании фтора через 27%-ный раствор щелочи
+ 2^011 ОР2 + + Н20.
В качестве примесей в ней содержатся кислород и фтористый водород. При работе с окисью фтора возникают почти такие же затруднения, как и при работе с элементарным фтором: низкая температура кипения, токсичность, сложность хранения и перевозки. Однако по коррозионным и зажигательным свойствам окись фтора менее агрессивна, чем фтор. Другой фторид кислорода ОгГг не представляет практического интереса, так как быстро разлагается.
В качестве окислителя ракетных топлив рассматриваются также некоторые гакоидные соединения фтора. Среди них наиболее пригодны для использования в ракетном тоц^ ливе трехфтористый хлор и пятифтористый бром. Физические (т кип.+11,3°, плотность 1,825 г/см3) и энергетические свойства позволяют рассматривать трехфтористый хлор как эффективный, хорошо хранящийся жидкий окислитель, хотя его бурная зажигательная способность нежелательна. Пятифторнстый бром (т. кип. +40,5°, плотность 2,465 г/см3 при 25°) как окислитель изучен еще недостаточно.
Интересными характеристиками обладает перхлорил - фторид ГСЮз (т. кип. --46,80, т. пл. —146°, плотность 1,392 г! см3 при 20°). Благодаря наличию семивалентного хлора, трех атомов кислорода и атома фтора РСЮз обладает высокой окислительной способностью, которая проявляется при повышенной температуре и по расчетным данным приближается к окислительной способности жидкого кислорода. Перхлорилфторид может служить отличным окислительным компонентом в топливе, содержащем кислород и углерод. Он устойчив и химически довольно инертен, его можно длительное время хранить в емкостях и:я обычных конструкционных материалов; перхлорилфторид не взрывоопасен и не обладает зажигающими свойствами. Токсичность его невелика; при попадании на кожу он не вызывает ожогов, Это вещество было открыто в 1952 г., и в настоящее время его можно вырабатывать в больших количествах.
Низкокипящим жидким окислителем может служить также трехфтористый азот КРз. По своим свойствам оп резко отличается от взрывчатого хлористого азота и от окиси фтора, термически устойчив и умеренно активен, не обладает корродирующим действием. Для конденсации его в жидкость и для хранения требуется низкая температура. Т. кип. КЁз минус 128,87°; т. пл. минус 206,65°, плотность 1,54 г/см3 при —128°. Известны окислительные реакции, позволяющие использовать трехфтористып азот для получения высокотемпературного пламени. Раскаленный древесный уголь горит в трехфтористом азоте более энергично, чем в кислороде. Восстановители, такие как аммиак и водород, будучи подожжены, горят в трехфтористом азоте с выделением большого количества тепла Расчетные данные об удельном импульсе трехфтористого азота показывают, что он является хорошим окислителем, но не имеет преимущества перед жидким кислородом.
Известны горелки для резания металла, в которых используется фтор и фторхлориды. В настоящее время сконструирована горелка, работающая на смеси трехфтористого азота и водорода. Низкое коррозионное действие и большая стабильность создают ряд преимуществ при его использовании по сравнению с фтором, хотя тепловой эффект реакции несколько ниже:
Н-2 -}- 1^2 —2НР -}- 128 ккал
Н2 “I - 2/3 ^ > 2Н. Р -[- ^/з N2 -}- 110 ккйл.
Трехфтористый азот получается электролизом расплавленного бифторида аммония КН4НР.
Большой интерес представляют и другие соединения азота и фтора. В настоящее время синтезированы дифтор - гидразин ]Ч2Н2Г2 и тетрафторгидразин N^4. По патентным данным последний может быть получен из трехфтористого азота при нагревании до 370° в присутствии меди. Тетрафторгидразин кипит около—-74°; т. пл.—162°; критические температура и давление соответственно 36—37° и 54 атм; уд. вес 1,5 (при—100°); теплота образования 2—2,5 ккал/молъ. Тетрафторгидразин чрезвычайно легко диссоциирует на радикалы N3^4—>2№2, вследствие чего легко присоединяется к кратным связям и быстро реагирует с различными органическими соединениями. Так, с ос-дикетонами он образует дифторамиды карбоновых кислот
СН3 — СО — СО — СН3 + -> 2СН3 — СООТз.
ОРГАНИЧЕСКИЕ ПРОИЗВОДНЫЕ
ФТОРА
Органические производные галоидов в природе встречаются редко; среди них особенно редки соединения фтора, насчитывающиеся буквально единицами. Искусственное получение многих фторорганических соединений было осуществлено еще в середине прошлого столетия, однако до конца первой четверти XX в. они не находили применения и их свойства оставались неисследованными. Начиная с 30-х годов текущего столетия, химия этих соединений получила стремительное развитие и в настоящее время выросла в большую и самостоятельную область органической химии. Поводом к ее развитию послужило возникновение атомной промышленности, где понадобились химически стойкие материалы — смазочные масла, прокладки, трубопроводы, устойчивые к действию агрессивных агентов. Ни один из известных до тех пор материалов органического происхождения не удовлетворял этим требованиям. Благодаря счастливой случайности действие фтористого урана было испытано на образце полностью фторированного углеводорода, который в очень небольшом количестве хранился в одном из университетов Англии; он оказался устойчивым. Это наблюдение послужило толчком к изысканию новых методов исследования углеводородов, в которых атомы водорода полностью заменены на атомы фтора. Соединения этого типа (перфтор - углероды), естественно, оказались чрезвычайно стойкими к действию высокой и низкой температуры, окислителей, щелочей, металлов, негорючими, устойчивыми к действию микроорганизмов. Твердые пластмассы этого типа по многим свойствам оказались почти столь же устойчивыми, как и благородные металлы. До 1937 г. были известны лишь два перфторуглерода —перфторметан и перфторэтан; к настоящему времени благодаря разработке новых методов производства получены тысячи соединений этого типа с самыми разнообразными физико - механическими свойств ами.
Современная техника с ее двигателями нового типа, растущими скоростями и необычными условиями эксплуа' тации представляет высокие требования к конструктивным материалам. Здесь особое место занимают прочность, невоспламеняемость, теплоустойчивость, стойкость к коррозии. Часто для создания той или иной конструкции не находится подходящего материала и его приходится создавать заново. Химическая природа фторуглеродов открывает широкие возможности для получения таких веществ. Фторорганические соединения обладают рядом свойств, делающих их незаменимыми материалами. К их числу относятся невоспламеняемые гидравлические жидкости, пластические массы и покрытия, стойкие к высокой температуре и агрессивным средам, пламягасящие вещества и материалы для электронного оборудования.
Высшие фторуглероды — воскоподобные вещества — с успехом применяются в авиации и ракетной технике как запорные, сальниковые и прокладочные материалы. Вещества из класса фторуглеродов начинают широко использовать как растворители и реакционные среды. Для многих реакций, например окисления энергичными окислителями, часто бывает трудно подобрать достаточно стойкий растворитель, не реагирующий с окислителем. В этом отношении фторуглероды, обладающие исключительной стабильностью, незаменимы.
Строение фторуглеродов имеет внешнее сходство со строением углеводородов; часто те и другие имеют одинаковое соотношение элементов и одинаковое строение углеродного скелета. Однако этим сходство и ограничивается; свойства представителей того и другого класса, как мы увидим далее, резко отличны.
Номенклатура фторзамещенных углеводородов и их производных в общем не отклоняется от обычной. Положение атома фтора в соединении обозначается цифрой или греческой буквой. Например, соединение СН2Г — СНГ — СНЯ называют 1,2-дифторпропаном, а соединение СН2Г — — СН2Г— 1,2-дифторэтаном. Однако при обозначении по - лифторзамещенных производных возникают неудобства и классическая номенклатура становится громоздкой.
Напрймёр, соединение СР3 — СРН — СИ! СБ2 — —С¥2 —СГ2 —СГ2Н, согласно общепринятым правилам, следовало бы назвать 1,1,1,2,3,4,4,5,5,6,6,7,7-тридека-
Фторгептаном, а соединение ¥2С' СРН —
1.2.2.3.3.4.4.5.5.6.6- ундекафторциклогексаном и т. д. По^ этому была предложена иная номенклатура, исходящая из названий полностью галоидзамещенных соединений, для которых ранее была принята приставка «пер». Так СС13ЗС1 носит название перхлорметилмеркаптан, а СС13СОСС13 —перхлорцетон. В соответствии с этим, полностью фторированные углеводороды называются перфторуглеводородами; СР3(СГ2)5СГ?, например, называется перфторгептаном. Неполностью фторированные соединения рассматриваются как своеобразные производные перфторуглеводородов, что дает возможность упростить их названия. Соединение СГ3СЕН(СГ2)4 С¥2И можно назвать 1,6-дигидроперфторгептаном, а 1,2,2,3,3,4,4,
5.5.6.6- ундекафторциклогексан—моногидроперфторцикло- гексаном.
Термин перфторуглеводород часто заменяется термином фторуглерод, который показывает, что углеводород фторирован полностью. Еще большее упрощение достигается введением в номенклатуру полностью фторированных углеводородов приставки ф, которая включает понятие «перфтор». Так, перфторметан, перфторэтан, перфторгептан будут соответственно называться ф-метан, ср-этан, ф-гептан. Однако такая номенклатура не всегда однозначна, так как она не дает возможности выразить, относится ли приставка перфтор ко всему наименованию или только к части его. Например, двум различным соединениям с одинаковой эмпирической формулой СсН5С2Е5 может быть придано одно и то же название перфторэтилбензол.
Полностью фторированные углеводороды — четырехфтористый метан, гексафторэтан и другие — часто называют также метфоран, этфоран и т. д. Названия этих веществ строятся путем включения в наименование углеводорода частицы «фор».
Мет-фор-ан — метфоран эт-фор-ан — этфоран „эт-фор-илен — этфорилен проп-фор-илен —пропфорилен и т. д.
По этой номенклатуре указанным выше производным этилбензола следовало бы присвоить название: С6Н6С2Гб-^ этфорилбензол, С6ГбС2Гб—этфорилбензфорол.
Эта номенклатура хотя и применяется для обозначения перфторпроизводных, но не является общепринятой и пока не может быть распространена на производные ф-углеводородов. В современной литературе можно встретить все типы названий; все они равноправны и выбор определяется лишь простотой и удобством наименования тех или иных конкретных веществ.
Физические свойства фторуглеродов
До последнего времени исследования соединений фтора охватывали главным образом область неорганических веществ. Число работ по изучению органических соединений фтора измерялось буквально единицами. Только сравнительно недавно были созданы методы и процессы, при помощи которых стало возможным получать органические соединения фтора и начать их детальное изучение.
Это привело к открытию ряда интересных фактов, причем химические и. физические свойства фторуглеродов оказались поистине замечательными. Например, фтор - углероды имеют очень низкие температуры кипения и гораздо более летучи, чем углеводороды одинакового с ними молекулярного веса. Фторуглероды кипят немногим выше, чем инертные газы того же молекулярного веса. Этот факт свидетельствует о слабом действии межмо - лекулярных сил во фторуглеродах. На рис. 5 изображены кривые температуры кипения и молекулярного веса (по Саймонсу и Блоку) инертных газов, углеводородов и фторуглеродов. Кривая фторуглеродов лежит вблизи кривой инертных газов, а кривая углеводородов — значительно выше.
Обычно с увеличением молекулярного веса наблюдается рост температуры кипения вещества. При переходе от обычных к фторированным соединениям это правило не соблюдается. Только первые четыре представителя фторуглеродов ряда 0^+2 (рис. 6) кипят при несколько более высокой температуре, чем соответствующие углеводороды; для всех остальных представителей этого ряда наблюдается обратное явление. Следует отметить,
|
Рис. 5. Кривые температуры кипения и молекулярного веса ^ — углеводородов; 2 — фторуглеродов; 3 —^инертных газов |
Что замещение фтора на хлор во фторуглеродах приводит к резкому повышению температуры кипения (рис. 7).
Снижение температуры кипения фторированных углеводородов представляет собой удивительное явление, так как их молекулярный вес намного превосходит молекулярный вес аналогичных парафинов. Так, нормальный гептан с молекулярным весом 100 кипит при 98°, пер - фторгептан (мол. вес. 338) при 82°, перфтороктан (мол. вес 438) при 104°. Различие температур кипения изомерных фторуглеродов гораздо меньше, чем в случае изомерных углеводородов. Например, изомеры перфтор - пентана кипят при 22, 29 и 30°, а изомеры соответствующего углеводорода — при 27, 36 и 49°.
Изменение температуры кипения, приходящееся на группу СР2 в ациклических и циклических фторуглеродах, содержащих шесть — девять атомов углерода, составляет 20—25°; приблизительно столько же приходится и на группу СН2 в случае углеводородов. При замещении
Одного из атомов водорода парафиновых углеводородов на атом фтора происходит повышение температуры кипения, однако, естественно, меньшее, чем при замещении хлором (см. рис. 7). Дифториды, у которых оба атома фтора находятся у одного и того же атома углерода, кипят ниже дифторидов, у которых атомы фтора находятся у различных атомов углерода. Трифториды, содержащие трифторметильную группу, имеют более низкую температуру пения, чем дифториды. Таким образом последовательное замещение атомов водорода на фтор в парафиновых углеводородах вначале вызывает повышение температуры кипения, которое при дальнейшем замещении делается менее заметным, затем температура начинает понижаться и при исчерпывающей замене водорода на фтор она, как правило, становится ниже температуры кипения исходных парафинов.
|
Рис. 6. Температура кипения 1 —парафинов; 2— перфторпара - финов; 3 — разность в значениях точек кипения |
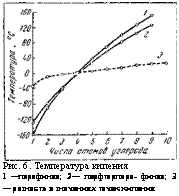
|
Рис. 7. Температура кипения фторированных и хлорированных производных этана |
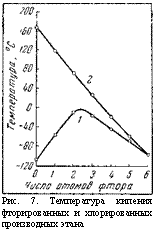 Очень резкое снижение температуры кипения наблюдается у соединений ацетиленового ряда, содержащих трифторметильную группу. В этом случае правило повышения температуры кипения с уменьшением насыщенности соединений также не соблюдается. Это видно из табл. 7, где приведена температура кипения ацетиленовых углеводородов и их фтор замещенных, содержащих трифторметильную группу.
Очень резкое снижение температуры кипения наблюдается у соединений ацетиленового ряда, содержащих трифторметильную группу. В этом случае правило повышения температуры кипения с уменьшением насыщенности соединений также не соблюдается. Это видно из табл. 7, где приведена температура кипения ацетиленовых углеводородов и их фтор замещенных, содержащих трифторметильную группу.
Аналогичное изменение температуры кипения наблюдается при замещении атомов водорода на фтор в ряде однофункциональных производных простейших углеводородов.
|
1 — ряд С2Н6 - С2Ев; 2 — ряд С2С1в С2¥в |
![]() Так, введение атома фтора в нитрилы, спирты, кетоны, кислоты и многие другие производные парафинов
Так, введение атома фтора в нитрилы, спирты, кетоны, кислоты и многие другие производные парафинов
Вначале повышает температуру кипения, как и в случае углеводородов. Однако дальнейшее введение фтора вызывает резкое снижение температуры кипения, которая в случае исчерпывающего замещения падает иногда на 100° и более.
|
Рис. 8. Температура плавления I — парафинов; 2 — перфторпарафинов |
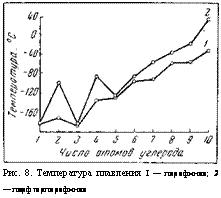 Это находит свое объяснение в том, что взаимодействие между молекулами ослабляется и устраняются условия для образования водородных связей. Снижение температуры кипения при исчерпывающей замене
Это находит свое объяснение в том, что взаимодействие между молекулами ослабляется и устраняются условия для образования водородных связей. Снижение температуры кипения при исчерпывающей замене
|
Таблица 7
|
Атомов водорода на фтор в производных простейших углеводородов показано в табл. 8.
Таблица 8
|
Соединение |
Т. кип., С° |
Соединение |
Т. кип., С° |
Д |
|
СНзСК |
+78 |
СЕзСК |
—63 |
141 |
|
СН3Ш2 |
+102 |
СГ3Ш2 |
—31 |
133 |
|
МС (СН2)4 СК |
+265 |
NC(CF2)4CN |
+63 |
202 |
|
СН3СН2Ш12 |
+19 |
СРзСГ2ОТ2 |
—34,3 , |
53,3 |
|
(СНз)2^Н |
+6,9 |
№>2^ |
—37 |
43,9 |
Из всех фторуглеродов, содержащих одинаковое число атомов углерода, наиболее высокую температуру кипения имеют циклические непредельные соединения.
Сравнение температуры плавления парафинов и их полностью фторированных аналогов показывает, что первые члены ряда фторуглеродов обладают'более высокой температурой плавления (табл. 9, рис. 8), чем соот - в етствующи е у г л ев од ор оды.
Таблица 9
|
Вещество |
Т. ил.,°С |
Т. кип., °С |
Плотность, г/см3 |
|
Перфторметан.................................. |
-184 |
—128 |
1,96 (-184°) |
|
Перфторэтан.................................... |
—100,6 |
—78,2 |
1,85 (—78°) |
|
Перфторпропан............................... |
—183 |
—38 |
1,45 (0,2°) |
|
Перфторбутан.................................. |
Стекло |
-4,7 |
1,47 (20°) |
|
Изоперфторбутан.............................. |
Стекло |
+3,0 |
— |
|
Перфторпентан................................. |
—96 |
—30 |
1,66 (20°) |
|
Перфторгекеан................................. |
— |
+58 |
1,68 (20°) |
|
Перфторгептан................................. |
—80 |
+82 |
1,70 (30°) |
|
Пер фторцикл обут ан....................... |
-83 |
—5 |
1,72 (0°) |
|
Перфторциклопентан.... |
—12 |
22 |
1,64 (30°) |
|
Перфторциклогексан.... |
+50 |
52 |
1,68 (30°) |
Фторуглеводороды затвердевают в виде белых кристаллов; при быстром охлаждении они превращаются в стекловидную массу. Твердые фторуглеводороды — мягкие, ломкие вещества, напоминающие парафин.
Плотность фторуглеродов, естественно, выше плотности аналогичных углеводородов. С увеличением числа атомов фтора в молекуле плотность фторуглеводородов повышается значительнее, чем плотность соответствую-, щих углеводородов. На рис. 9 приведены кривые плотности фторуглеродов. Жидкие фторуглероды с высокой плотностью используются в экстракционных колоннах, гироскопических прибор ах, манометр ах.
Температурный коэффициент плотности фторуглеводородов выше, чем у большинства органических соединений.
Отношение для перфторгентана составляет 0,0027?
А для гептана 0,00084 г/см3 °С, т. е. приблизительно втрое меньше. Одна из интересных особенностей жидких фторуглеродов — необычно малое поверхностное натяжение. Его значения значительно меньше, чем для соотв етствующих у г л ев одор од ов.
|
Рис. 9. Плотность и коэффициент преломления парафинов (4, 2) и перфтор- парафипов (1, 3) |
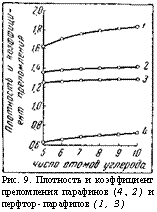 Поверхностное натяжение циклических фторуглеродов несколько выше, чем ациклических с тем зке количеством углеродных атомов (табл. 10).
Поверхностное натяжение циклических фторуглеродов несколько выше, чем ациклических с тем зке количеством углеродных атомов (табл. 10).
Низкое поверхностное натяжение фторуглеродов и их производных дает возможность применять их в качестве поверхностноактивных веществ. Например, разбавленные растворы перфторкарбоновых кислот с длинной цепью снижают поверхностное натяжение воды сильнее, чем любые другие вещества. Введение ф-кислот или их солей
|
Таблица 10
|
(в количестве менее 1%) уменьшает поверхностное натяжение воды примерно с 72 до 20 дин/см. Перфторкарбоно - вые и моногидроперфторкарбоновые кислоты используют в качестве эмульгирующих и диспергирующих агентов, в частности для получения водных дисперсий политетрафторэтилена.
Очень компактная и плотная структура атома фтора обздсцяет малое значение его атомной поляризуемости
И атомной рефракции. Значение последней для фтора гораздо ближе, чем для любого другого галоида, к атомной рефракции водорода:
|
Н |
1,100 |
С1 |
5,967 |
|
С |
2,418 |
Вг |
8,865 |
|
Г |
1,23 |
13,900 |
Атомная рефракция фтора во фторорганических веществах не постоянна; она зависит от числа атомов фтора в молекуле соединения и достигает наибольшего значения (1,23) в полностью фторированных углеродах (табл. 11).
Таблица 11
|
Число атомов |
Атомная рефракция |
|
1 |
0,95 |
|
2 |
0,99 |
|
3 |
1,02 |
|
4 |
1,08 |
|
5 |
1,14 |
|
Перфтор соединения |
1,23 |
Все фторорганические соединения обладают малым коэффициентом преломления. Для большинства жидких фторуглеродов он ниже минимального значения шкалы обычных рефрактометров (см. рис. 9). Величина коэффициента преломления для перфторпарафинов и перфтор - нафтенов меньше, чем для обычных нефторированных парафинов; в первом случае она равна 1,25—1,30, во втором 1,35—1,47. С уменьшением числа атомов водорода во фторорганических соединениях эта величина равномерно снижается, причем инкремент СГ2 составляет 0,009. Циклические фторуглероды обладают более высоким коэффициентом преломления по сравнению с соответствующими ациклическими.
Коэффициент преломления фторуглеродов зависит от температуры в большей степени, чем коэффициент прелом-
Ления углеводородов. Например, й пределах 10 —50а для С7Г16 эта зависимость выражается 0,0004 на 1°, а для С7Н1в-0,00014 (при 15-25°).
К настоящему времени исследованы диэлектрические свойства только отдельных фторуглеродов, но имеющиеся данные уже позволяют считать их отличными диэлектриками. Пробивное напряжение фторуглеродов превышает пробивное напряжение азота. Удельное сопротивление фторуглеродов достигает 1014 см! см3. Как диэлектрики фторуглероды превосходят насыщенные углеводороды. В табл. 12 приведены значения диэлектрических постоянных некоторых фторорганических соединений в сравнении со значениями для других веществ.
Таблица 12
|
Соединение |
Диэлектрическая Постоянная |
|
Вода................................................................................. Метиловый спирт............................................................... Ацетон............................................................................... Цианистый водород............................................................ Перфторэтан....................................................................... Псрфторциклопентан........................................................... Перфторгексан (смесь изомеров)........................................... Перфторэтилциклопентан..................................................... Н-Перфторгептан.................................................................. Н-Перфтороктан.................................................................. Политетрафторэтилен........................................................... Политрифторхлорэтилен...................................................... |
80 32.4 19.4 95 1,65 (—80°) 1,70 (15°) 1,68 (20°) 1,60 (20°) 1,89 1.79 1.79 (20°) 2,0 2,5-3 |
Фторуглеводороды с одним или двумя атомами водорода обладают значительно более высокими диэлектрическими постоянными, чем перфторуглероды. Так, диэлектрическая постоянная С7НГ15 равна 2,47, а С4Н2Г14— 3,18. Поэтому примесь не полностью фторированных веществ к фторуглеродам в значительной степени ухудшает диэлектрические свойства последних. Резкое снижение диэлектрической постоянной фторуглеродов после очистки их от указанных примесей было использовано для аналитического контроля продуктов фторирования. Например, еслй диэлектрическая постоянная н-перфторгептана значительно превышает 1,76, то, следовательно, в нем присутствуют примеси неполностью фторированных углеводородов, в частности моногидроперфторгептана.
Фторуглероды не растворяются в воде, спиртах и плохо растворимы в углеводородах и фтористом водороде (присутствие незначительных примесей гидрофторугле - родов сильно повышает растворимость фторуглеродов в БТ). Фторуглероды хорошо растворяются в ацетоне, фтор - и хлорпроизводных парафиновых и ароматических углеводородов; при повышенной температуре происходит смешение фторуглеродов с этими растворителями. Фторуглероды смешиваются во всех отношениях с эфиром а также с частично фторированными углеводородами, например с бензотрифторидом.
Растворимость фторорганических соединений, содержащих кислород или азот, в минеральных кислотах тем больше, чем легче растворяемое вещество образует оние - вый комплекс. Например, перфорированные эфиры, перфтортетрагидрофуран практически нерастворимы в кислотах, так как способность их кислородного атома к образованию оксониевого комплекса резко уменьшена благодаря влиянию атомов фтора. Растворимость фторуглеродов в органических растворителях, как правило, хуже, чем растворимость соответствующих углеводородов. Фторуглероды часто образуют с растворителями двухфазовые системы, которые при более высокой температуре смешиваются.
Фторсодержащие полимеры, например политрифтор - хлорэтилен, ограниченно растворяются и набухают в хлорированных и особенно фторированных соединениях. Для определения вязкости и других свойств этих полимеров используются 1,1,3-трифторпентахлорпропан, хлорбен - зотрифторид, дихлорбензотрифторид и другие соединения. Для политетрафторэтилена долгое время не могли найти сколько-нибудь подходящего органического растворителя. Недавно была показана возможность частичного растворения этого прочнейшего пластика во фторированных керосинах при высокой температуре и под давлением. Некоторые фторпласты, например сополимер трифторхлорэтилена и винилиденфторида, растворяются в ацетоне и в сложных эфирах карбоновых кислот.
Абсолютная вязкость фторуглеродов выше вязкости
Углеводородов и ниже вязкости воды.
|
Рис. 10. Абсолютная и кинематическая вязкость гептана (4,2) и перфтор - гептана (1,3) |
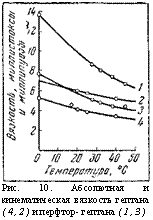 Изменение вязкости с температурой выражено у перфорированных соединений значительно резче, чем у углеводородов (рис. 10). Это в некоторых случаях препятствует использованию фторуглеродных производных в качестве смазочных материалов.
Изменение вязкости с температурой выражено у перфорированных соединений значительно резче, чем у углеводородов (рис. 10). Это в некоторых случаях препятствует использованию фторуглеродных производных в качестве смазочных материалов.
Вязкость (в миллипуазах) некоторых фторуглеродов при различной температуре приведена в табл. 13.
Скорость распространения ультразвука во фторуглеродах необычайно низка — менее 800 м/сек (при 20—60°); она особенно мала в пер - фторгептане (440 м/сек при 60°). Эта величина лежит в области скорости распространения ультразвука в газах и является наименьшей для всех известных жидкостей при обычной температуре.
|
Таблица 13
|
В связи со слабой реакционной способностью многих фторуглеродов важное значение для изучения их строения приобрели спектральные методы исследования. Исследование спектров поглощения в инфракрасной области и спектров комбинационного рассеяния позволяет в ряде случаев определить структуру различных фторуглеродов.
В этом отношений интересна История исследования пер- фторпропилена (СаГ6), получающегося при пиролизе политетрафторэтилена и считавшегося ранее циклическим соединением — перфторциклопропаном. Только с помощью спектральных методов удалось установить линейную структуру этого фторуглерода. Высокосимметричная трехуглеродная кольцеобразная молекула дает только 10 линий в спектре комбинационного рассеяния, а трехуглеродная линейная структура — 21 линию. Обнаружение у С3Г6 20 линий подтвердило его линейное строение.
I При изучении показателей преломления и масс-спектров продуктов разложения чистых фторуглеродов, образующихся в результате отщепления электрона, шкалы обычных приборов пришлось расширить (в первом случае из-за очень высокого, а во втором очень низкого значения величин). Масс-спектры фторуглеродов отличаются отсутствием пиков, соответствующих молекулярным ионам. Это указывает на большую вероятность процессов ионизации, протекающих с удалением фтора, чем процессов, обусловленных отрывом электрона.
Для исследования структуры фторорганических соединений используют также метод ядерного магнитного резонанса. С его помощью возможно установить наличие в молекуле отдельных алкильных групп, несущих различное число атомов фтора, например СН2Р-, СНР2- и СГ3- групп.
•
Химические свойства фторуглеродов
Из этих свойств насыщенных фторуглеродов наиболее характерны резко выраженная химическая инертность и высокая термическая устойчивость. Объяснение этих особенностей следует искать в природе фторуглеродной связи. Валентные электроны фтора при обобщении с электронами атомов углерода образуют прочную связь, чрезвычайно трудно подвергающуюся изменениям. Разложение фторуглеродов, связанное с отделением атомов фтора от углерода, требует гораздо больших затрат энергии, чем соответствующее разложение углеводородов. Энергия связи С — Г составляет 104, а С—1Н~УЗ ккал/молъ.
Необычайно высокую стабильность фторуглеводородов можно понять, если сравнить их молекулы с молекулами углеводородов. Вследствие малой величины водородных
атомов (ковалентный радиус 0,32 оболочки из этих атомов, окружающие молекулу углеводорода (рис. И), не экранируют внутреннее силовое поле; более крупные атомы фтора (ковалентный радиус 0,64 А), по-видимому, создают эффективный экран, защищающий молекулу фторуглерода от воздействия какой-либо вторгающейся молекулы. Другой причиной устойчивости фторуглеродов является то, что атомы углерода, соединенные с фтором» находятся в состоянии крайней степени окисления и, естественно, не обнаруживают склонности взаимодействовать с кислородом. Атомы водорода в углеводороде, наоборот, проявляют тенденцию соединяться с кислородом и другими окислительными агентами.
|
Рис. 11. Строение молекул углеводорода (1) и фторуглерода (2) |
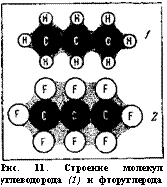 Для фторуглеродов известно сравнительно небольшое число реакций, причем большинство из них осуществляются только при высоких температурах. Все они характеризуются высокой энергией активации.
Для фторуглеродов известно сравнительно небольшое число реакций, причем большинство из них осуществляются только при высоких температурах. Все они характеризуются высокой энергией активации.
Расщепление углерод-углеродных связей удается осуществить при нагревании перфторуглеродов до 900—950° в присутствии хлора и брома.
Наиболее инертными в химическом отношении оказались перфторалканы. Из них наибольшей устойчивостью обладает перфторметан СГ4; нержавеющая сталь и вольфрам вступают в реакцию с ним только при 1000°, окись углерода — при температуре вольтовой дуги с образованием карбонилфторида СОГ2.
Начиная с перфторэтана и далее, т. е. с увеличением числа атомов углерода в соединении, прочность фторал - канов хотя и незначительно, но уменьшается. Моноцик - лические фторуглероды химически более устойчивы, чем ациклические.
• Насыщенные фторуглероды реагируют с тонко измельченным кремнеземом при температуре выше 600° с образованием двуокиси углерода и четырехфтористого кремния. Например, взаимодействие гексафторэтана с кварцем осуществляется только при 600—700°; в качестве основных продуктов получаются £^4, СО, СОг.
Гексафторэтан не подвергается деструкции при 900 — 1000°. В интервале 700—900° осуществляется пиролиз перфторгептана, в результате которого образуются насыщенные И олефиновые фторуглероды ОТ С! до С4. При повышении температуры возрастает количество образующегося гексафторэтана, который при температуре выше 1150° становится основным продуктом пиролиза.
Органические соединения фтора занимают особое место среди галоидоорганических веществ. Соединения хлора, брома и йода благодаря своей реакционной способности часто служат промежуточными продуктами при получении различных веществ. Так, хлористые, йодистые и бромистые алкилы являются активными алкилирую - щими агентами. В ряде случаев органические производные галоидов имеют значение и как конечные продукты; например, четыреххлористый углерод, хлороформ, йодоформ широко используются в медицине и промышленности.
Перфторалкилхлориды, - бромиды и - йодиды как промежуточные продукты органического синтеза пока не имеют почти никакого значения, так как фтор связан с углеродом настолько прочно, что реакции его обмена сильно затруднены. Фтористые алкилы не обменивают фтор на другие элементы в условиях, в которых протекает обмен остальных галоидов. Еще более прочно фтор связан с углеродом большинства ароматических соединений.
Прочность связи с углеродом, измеряемая теплотой ее образования, возрастает от йода к фтору. Для простых алифатических соединений прочность связи имеет следующие значения (в ккал/молъ):
С - 3 С —Вг С —С1 С —Е
45 59 72 104—114
Что составляет 48,4, 63,4, 77,4 и 122,6% прочности связи С —Н, равной 93 ккал/молъ. Как уже говорилось, незначительный размер атомов фтора делает возможной плотную упаковку его атомов вокруг атомов другого элемента. Это, наряду с высоким сродством фтора к электрону, как уже было сказано, ведет к образованию многих простых и комплексных фторидов, в которых элементы проявляют наивысшую валентность, например ЭГ6, ЗГ80.
Металлы, окислы металлов и некоторые неорганические соли взаимодействуют с фторуглеродами при повышенной температуре с образованием неорганических фто -
Рйдов. Хотя таких реакций описано много, изучены онй главным образом качественно. Большинство известных реакций этого типа протекает с заметной скоростью при 400-1000°.
Перфторметан, а также фторуглероды с более высоким молекулярным весом реагируют со щелочными металлами при температуре около 400° с образованием фторидов металлов и углерода. Эта реакция была исполь - зована для различных методов анализа фторуглеродов и их производных. Перфторметан при 900° не взаимодействует с медью, никелем, вольфрамом и молибденом. Магний медленно реагирует с фторуглеродами даже при 300°. Перекись натрия вызывает разложение фторуглеродов при повышенной температуре, однако для исчерпывающей минерализации фторуглеродов, необходимой для аналитических целей, требуется нагревание до 400 — 500°. В этих же условиях цинк, алюминий и олово реагируют лишь незначительно только с поверхности, а медь, серебро, ртуть, свинец, фосфор, мышьяк, сурьма, вольфрам, железо, платина, окиси магния, кальция, бериллия, фосфорный и мышьяковый ангидриды в реакцию не вступают.
Известно всего несколько реакций между фторуглеродами и солями. Хлористый алюминий реагирует с фторуглеродами, образуя смолы и фтористый алюминий. В некоторых случаях происходит замещение атомов фтора во фторуглероде на атомы хлора.
Фторуглероды очень устойчивы по отношению к окислителям, так как атомы углерода в них находятся в высшей степени окисления. При обычной температуре фторуглероды не взаимодействуют с концентрированными азотной и серной кислотами, нитрующей и хромовой смесями, перманганатом, перекисью водорода и другими сильными окислителями. Фторуглероды устойчивы к действию кислорода воздуха и не горят в его атмосфере, а также в пламени горелки. При сильном нагревании они деструктируются.
На инертности фторуглеродов основаны некоторые способы их очистки. Например, перфторциклогексан легко отделяется от примесей непрореагировавшего бензола посредством нитрования последнего и отделения образующегося динитробензола от летучего перфторцикло - гексана.
Восстановление фторуглёродой протекает в очень жестких условиях. Перфторметан вступает в реакцию с водородом на медной сетке только при 900°. В присутствии катализаторов и под давлением фторуглероды взаимодействуют с водородом при более низкой температуре; при 750— 900° реакция в этих условиях сопровождается разрывом С—С связей. С углеродом они не взаимодействуют при температуре ниже 1200°; медленная'реакция начинается в пламени электрической дуги с образованием тетрафторэтилена я перфторпропилена. Делались попытки использовать пиролиз перфторметана в электрической дуге для синтеза других фторуглеродов, однако низкая степень превращения не позволяет широко применять этот метод.
В обычных условиях и при умеренно повышенной температуре фторуглероды не взаимодействуют с галоидами за исключением фтора. Реакционная способность по отношению к фтору увеличивается от низших к высшим фтор- углеродам. Так, перфторэтан медленно реагирует с фтором при 300°, а перфторгептан — бурно при зажигании смеси электрической искрой. При взаимодействии фторуглеродов с элементарным фтором в качестве конечного продукта образуется перфторметан. Политетрафторэтилен при 150° начинает взаимодействовать со смесью фтора и азота (1 : 1).
Фторуглероды обладают необычайно высокой гидролитической устойчивостью. Так, при продолжительном нагревании перфторгептана при 100° с 20%-ным едким натром обнаруживаются только следы ионов фтора; при повторном нагревании это явление уже не наблюдается. По-видимому, появление продуктов гидролиза при первоначальном кипячении объясняется наличием примесей неполностью фторированных углеводородов. Это наблюдение было использовано для удаления следов гидролизующихся загрязнений из фторуглеродов.
В некоторых случаях происходит гидролитическое отщепление атомов фтора трифторметильной группы. Например, при многодневном кипячении с серной кислотой перфторбензотрифторида образуется небольшое количество перфторбензойной кислоты. Подвижность атомов увеличивается, если трифторметильная группа находится у атома, соединенного с соседним тг-кратной связью.
Фторуглеродные карбоновые кислоты гораздо сильнее соответствующих нефторировапных кислот. Диэлектрическая постоянная трифторуксусной кислоты примерно 13 пять раз выше соответствующей константы уксусной кислоты и обнаруживает необыкновенное свойство — увеличиваться с нагреванием в значительном интервале температур.
Соединения, состоящие из двух фторуглеродных радикалов, связанных атомом кислорода, т. е. полностью фторированные простые эфиры, не обладают свойствами, характерными для алифатических эфиров, и напоминают фторуглероды. Сочетание свойств фторуглеродов (негорючесть и стабильность) со свойствами эфиров (растворяющая способность) позволяет использовать эти вещества как превосходные растворители.
Аналогичные изменения свойств наблюдаются и у перфтораминов. По свойствам фторуглеродные аналоги аминов ближе трифториду азота, чем алифатическим аминам. Они не реагируют с кислотами и лишены основных свойств. По стабильности и химическим свойствам они также приближаются к фторуглеродам. В литературе эти вещества принято называть фторуглеродными нитридами.
Введение атомов фтора в молекулу спирта резко сказывается на увеличении кислотных свойств соседней спиртовой (гидроксильной) группы. Например, триметил - карбииол представляет собой один из наименее «кислых» спиртов, но достаточно ввести в одну из его метильных групп три атома фтора, как он превращается в кислоту, вытесняющую угольную кислоту из ее солей. Трифтор - этанол и трифторизопропиловый спирт обладают, подобно фенолу, кислыми свойствами.
9
Способы получения фторуглеродов
Органические галоидопроизводные получаются прямым воздействием на углеводороды хлора, брома и йода. Для фтора этот способ в большинстве случаев непригоден из-за его очень высокой реакционной способности. Будучи наиболее электроотрицательным элементом, фтор обладает большим положительным ядерным зарядом, вследствие чего удаление электрона с образованием положительно заряженного атома фтора весьма затруднительно. Этим и объясняется склонность к реакциям радикального, а не ионного типа. При фторировании возникают быстрые цепные экзотермические реакции, в процессе которых фтор разрушает молекулы фторируемого реагента. Тепловой эффект фторирования во много раз превышает тепловой эффект хлорирования и больше теплового эффекта, требующегося для разрыва С—С связи (80—85 ккал/моль). Ниже приведены значения указанных тепловых эффектов (в ккал/моль).
■^СН + ¥2 уС¥ + НЕ + 104 ^СН + С12 ^СС1 + НС1 + 23
|
|
В связи с этим прямое фторирование обычно заканчивается вспышкой или взрывом с образованием фтористого водорода и продуктов разложения фторируемого соединения.
Попытки прямого фторирования органических соединений, предпринятые сразу после получения элементарного фтора, были многочисленны и неудачны. Первые из них были сделаны Муассаном и Шаваном, которые, пытаясь снизить энергию действия фтора, фторировали твердый метан жидким фтором при низкой температуре и в темноте. Несмотря па это и на высокое мастерство экспериментаторов, единственным итогом опыта был разрушительный взрыв. Муассан установил, что фтор реагирует со многими органическими соединениями настолько бурно, что в результате деструкции молекул образуются четырехфтористый углерод, фтористый водород, уголь и другие продукты разложения. Другие исследователи стремились получить фторуглероды путем взаимодействия углерода или углеродсодержащих соединений с элементарным фтором. Однако, как и Муассану, им удавалось получить только четырехфтористый метан, причем опыты часто заканчивались взрывами. Лебо и Дамену удалось более подробно изучить эту реакцию и определить свойства образующегося четырехфтористого углерода.
Руфф установил, что причиной воспламенения реакционной смеси являются кислород и вода, адсорбирован -
Яые на поверхности угля. Фторирование активного угля, освобожденного от воды и кислорода длительным прокаливанием в глубоком вакууме, протекает без воспламенения при комнатной температуре, без доступа воздуха. В результате реакции получаются небольшие количества тетрафторэтана, гексафторэтана и следы высших фтор - углеродов. До тех пор пока не были разработаны методы получения сложных перфторуглеродов, эта реакция служила единственным источником получения высших перфторалканов, использовавшихся в качестве смазок, устойчивых к действию фтористого урана.
Прямое фторирование углеводородов было освоено только после создания специальной аппаратуры и разработки особых приемов, позволивших преодолеть трудности, возникающие при этой реакции. Большой вклад в это дело внес американский химик Хемистон. Каталитический процесс. Оказалось, что интенсивность реакций фторирования можно снизить путем хорошего отвода тепла и разбавления смеси фторируемого органического вещества и элементарного фтора инертным газом, например азотом. Для отвода тепла в реакционное пространство вводится туго скрученная медная сетка; выделяющееся тепло удаляется через стенки реактора, соприкасающиеся с сеткой. Таким образом удалось предотвратить сгорание органических веществ в свободном фторе. Дальнейшими исследованиями установлено, что природа металлической сетки (или насадки) оказывает заметное влияние на реакцию. Наиболее эффективными насадками при каталитическом фторировании являются медные стружки, покрытые различными металлами,— золотом, кобальтом, серебром, никелем или латунью; покрытия из ртути, хрома, родия и железа менее пригодны. Эффект покрытия объясняется образованием на поверхности сетки высших фторидов металлов, которые и являются фторирующими агентами; роль элементарного фтора при этом сводится, по-видимому, к регенерации фторидов металла. Таким образом, в процессе фторирования участвуют углеводород и высший фторид металла, являющийся менее активным фторирующим реагентом, чем фтор. Несмотря на жесткие условия, в присутствии насадок выход фторуглеродов повышается до 40—90%.
Процесс каталитического фторирования получил промышленное применение для производства фторуглево -
Дородов. В некоторых случаях он оказался пригодным и для получения фторуглеродов с функциональными группами. Так, из метилэтилкетона были получены полностью п частично фторированные кетовы. Этот способ получения фторированных кетонов оказался даже более эффективным, чем способ, основанный на применении трехфтористого кобальта, так как последний разрушает органические кетоны.
Металлофторидный процесс. Около 40—50 лет назад были получены некоторые фториды металлов, в которых металлы находились в состоянии высшей валентности. Позднее Руффом было показано, что такие фториды являются энергичными фторирующими агентами и не разрушают исходных веществ в процессе фторирования. Во время второй мировой войны этот метод был использован в США для получения фторуглеродов в значительных масштабах. Фторируемый углеводород предварительно испаряли и смешивали с азотом. Смесь пропускали через слой трехфтористого кобальта, в результате чего происходила реакция
1 1
'2_(— СН2 —) + 2СоЕ3 —»~2 (— СЕ2—) -4- НЕ + 2СоЕ2 + 46 ккал/моль.
Образующийся дифторид кобальта превращали в трифто - рид, пропуская над ним элементарный фтор при 250°:
2СоЕ2 + Е2 ^2СоЕ3 + 53 ккал/моль,
А затем повторяли фторирование. При тщательном контроле эту реакцию удается провести без заметного разложения углеводорода. Побочными реакциями являются полимеризация и циклизация.
Для прямого фторирования углеводородов используются также другие фториды металлов: дифторид серебра, фториды церия и марганца; последний пригоден для фторирования циклических соединений.
В оптимальных условиях можно получить высокий (до 80%) выход продуктов, сохраняющих строение исходных углеводородов. Металлофторидным методом получены многие фторуглеродные соединения, содержащие азот, серу, кислород и другие элементы, а также полностью фторированные гептан, бутан, пентан, диметилцикло-
Гексай, дйметйлцйклопентан. Йз хлорбензола й о-дйхЛор - бензола при 350° получен моно - и дихлорперфторцикло - гексан. Выходы продуктов фторирования некоторых углеводородов трехфтористым кобальтом даны в табл. 14.
|
Таблица 14
|
Недостатком метода следует считать применение дорогостоящего оборудования из никеля или монель-ме - талла.
Электрохимическое фторирование. В последнем десятилетии большое значение приобрел метод электрохимического фторирования, более экономичный, чем описанное выше прямое фторирование, так как для него не требуются получение и очистка элементарного фтора. Кроме того, электрохимическое фторирование почти не сопровождается разрушением углеродного скелета исходного вещества, что всегда в той или иной степени наблюдается при прямом фторировании.
Электрофторирование включает два одновременных процесса: электролиз раствора неорганического фторида с образованием свободного фтора и фторирование органического соединения. Электролитом служит раствор органического вещества во фтористом водороде. В случае неэлектропроводных соединений в раствор добавляют веществ а, у в ел ичив ающие электр опров о дность (например, фториды металлов).
Важным фактором является плотность тока. С повы« шением ее увеличивается скорость фторирования, но одновременно и степень разложения фторируемого соединения. Оптимальная плотность тока обычно 0,002— 0,02 а/см2. Естественно, что при такой малой плотности тока выход продуктов фторирования определяется поверх-
ЙосТью анода. В современных электролизерах для увеличения поверхности электроды выполняют в виде чередующихся пластин. Наилучший материал для анода — никель, для катода — стальные, железные, медные или другие пластины. Поскольку соприкосновение фтора и водорода практически исключается, нет необходимости в диафрагмах, разделяющих анодное и катодное пространства. В лабораторных электролизерах (ваннах) емкостью
1 л анодная поверхность равна 2500—3000 см2. Такие ванны из специальной стали, меди, никеля и других металлов очень компактны. Крышка ванны сделана из того же материала и в ней укреплена электродная группа. В крышке ванны имеются отверстия для вывода образующихся продуктов фторирования, ввода фторируемого продукта, предохранительного клапана и обратного холодильника. В качестве изоляционного материала используются устойчивые к действию фтористого водорода материалы — фтор - пласт-4 и фторпласт-3.
Температурный режим электролиза определяется выделяющимся при фторировании теплом и его отводом через стенки ванны. Обычно ванну помещают в охладительную смесь, а на крышке электролизера монтируют обратный холодильник. Поскольку охлаждение ванны происходит через стенки, а основная масса тепла выделяется в зоне реакции фторирования, перемешивание электролита способствует установлению режима работы. Кроме того, при перемешивании более интенсивно удаляются продукты реакции от поверхности анода и обеспечивается поступление к нему новых порций исходного вещества. Наиболее удобным перемешивающим устройством является ма - мут-насос или эрлифт. Для контроля и поддержания постоянного уровня электролита может быть использован прибор с радиоактивными изотопами.
Методом электрохимического фторирования получены фторпроизводные многих органических веществ: перфтор - карбоновые кислоты, перфтороктан, полностью фторированные окиси алифатических углеводородов, ацилфто - риды, простые и сложные эфиры, алифатические, ароматические и гетероциклические амины, сульфиды и другие полифторированные соединения.
Результаты электрохимического фторирования, полученные к настоящему времени, свидетельствуют о его перспективности.
Гидрофторирование. Фтористый водород присоединяется к олефинам с образованием соответствующих монофтор - алканов. Реакция
ИСН = СН2 + НГ — ИСНР — СН3
В большинстве случаев осуществляется без катализаторов. Порядок присоединения реагирующих компонентов следует правилу Марковникова: водород присоединяется к наиболее гидрогенизированному атому углерода.
Гидрофторирование осуществляют в автоклаве или бомбе из нержавеющей стали, где перед вводом олефина сконденсировано определенное количество фтористого водорода. Температуру и давление изменяют в зависимости от объекта фторирования. Реакция часто сопровождается образованием высокомолекулярных полимерных фторидов; понижение температуры и в некоторых случаях применение катализаторов способствуют уменьшению образования побочных продуктов. Иногда реакция осуществляется в растворителе, например в гексане, в четыреххлористом углероде.
Гидрофторирование обратимо: образующиеся монофториды легко теряют фтористый водород. Неустойчивость соединений увеличивается при переходе от первичных к третичным монофторидам. Присоединение фтористого водорода к олефинам, содержащим атомы хлора у углерода с двойной связью, происходит легко и приводит к образованию более стабильных соединений. В табл. 15 приведены продукты гидрофторирования некоторых хлорсодержащих олефинов.
Таблица 15
|
Олефин |
Продукт реакции |
Температура реакции, °С |
|
СН2=СНС1 (СНз)2С = СНС1 СНзССІ = СНС1 СН2С1—СС1=СН2 |
CH3CHC1F (CH3)aCHCHClF CHsCCIFCHaCI CH2C1CC1FCH3 |
150 —23 до 0 120 50—60 |
При избытке фтористого водорода часто выделяется НС1 из промежуточно образующегося хлорфторалкана
З II. Л. Кнунянц и А. В. Фокин 65
И в результате вторичного присоединения НГ образуются дифторалканы, например СН2С1СС1 = СН2 превращается в СН2С1СГ2 - СН3.
Фтористый водород сравнительно легко присоединяется к ацетиленовым соединениям
ИС ЕЕ СИ' + Я¥ -> ИСЕ = СНІГ,
ИСЕ = СНИ' + НЕ ИСЕ2 — СН2И'.
Для этого вещества смешивают при пониженной температуре или ацетиленовое соединение пропускают че рез раствор фтористого водорода в кислородсодержащем растворителе (например, эфире или ацетоне).
Ацетилен в отличие от других членов гомологического ряда при нормальном давлении не реагирует с фтористым водородом даже при 300°. Только при давлении свыше 12 атм удается получить смесь фтористого винила и этилиденфторида. Лучший результат достигается при 100° в присутствии катализатора—хлорида двухвалентной ртути или хлористого бария на активном угле. При этом образуется 80% фтористого винила и около 4% этилиденфторида.
Присоединение фтористого водорода к другим ненасыщенным соединениям изучено гораздо хуже. Известно, например, присоединение фтористого водорода к изоциа - новой кислоте, ведущее к образованию карбаминоилфто - рида
О
(С8Нв)20 /
Н-М = С = 0 + НЕ----- -->^N-6 ,
—80°
Е
А также к перфторкарбиламинфториду с образованием ди- (трифторметил) амина
НР
С¥3 - N = СЕ2 СЕ3 - ГШ — СЕ3.
При взаимодействии фтористого водорода с окисями олефинов в растворе серного эфира при 100° происходит раскрытие цикла и образуются монофторзамещенные спирты (выход — 50%)
СН2-СН2+ НЕ — ЕСН2СН2ОН,
О
СН3 — СН — СН2 + НЕ -> ЕСН2 — СНОП — сн3.
Выход этиленфторгидрина зависит от концентрации окиси этилена в растворе серного эфира; наибольший выход достигается при 5—6%-ном содержании окиси. Реакция распространяется и на замещенные алифатические окиси.
Замещение галоидов на фтор. Одним из распространенных методов получения фторорганических соединений является реакция между хлор-, бром - или йодсодержащими органическими соединениями с неорганическими фторидами или фтористым водородом. Таким способом были получены различные фторированные спирты, простые и сложные эфиры и другие соединения.
Из щелочных фторидов для замещения галоидов на фтор важнейшее значение имеет фтористый калий. Он легко заменяет хлор в сульфохлоридах, хлор ангидридах карбоновых кислот, хлорацетатах, хлорформиатах и галоидгидринах. Так, нагреванием этиленхлоргидрина и КГ в растворе диэтиленгликоля получают этиленфтор - гидрин
КР
С1СН2 — СН2ОН-------------- > ЕСН2 - СН2ОН.
130°
Для получения фторгидрина глицерина из соответствующего хлоргидрина успешно применяют также фторид лития
Ы¥
СН2ОН — СНОН - СН2С1 —> сн2он - снон — сн2е.
150°
Очень активным фторирующим агентом является фторид серебра. Еще Муассан с его помощью получал различные фтористые алкилы из иодистых алкилов. Хенне
Показал, что легкость замещения галоидов на фтор в орга- пических соединениях фторидом серебра увеличивается от хлора к иоду.
Если фтористое серебро служит только для замещения атомов галоида на фтор, то дифторид серебра способен к замещению водорода и используется для получения пер - фторуглеродов и их производных
II II
-^СН3+ 2А 4- СУ2+ 2А%¥ + НЕ.
С I С
Применяются также фториды ртути, цинка и особенно сурьмы. Свартс, например, использовал фтористую ртуть для обмена галоидов в хлорбензоле, бромистом гептиле и др. Еще более эффективным агентом для замещения галоидов в органических соединениях является дифтористая ртуть.
Свартс установил, что замещение атомов галоида в органических соединениях трехфтористой сурьмой облегчается в присутствии солей пятивалентной сурьмы — SbClg, SbCl2F3, SbCl3F2, SbF5 и др. В настоящее время реакция Свартса используется для промышленного производства ряда фторуглеродов.
Фтористый водород в реакциях замещения хлора на фтор менее активен, чем треххлористая сурьма. Однако и он может быть с успехом использован в присутствии небольших количеств SbF3. В этом случае вследствие полной нерастворимости выделяющегося НС1 во фтористом водороде создается эффективная реакционная система, в которой происходит непрерывная регенерация SbF3. Реакция обычно осуществляется при повышенной температуре, причем степень замещения зависит от температурного режима. Наиболее эффективно замещение происходит в полихлорированных углеводородах, и чем выше степень галоидирования, тем легче фтор заменяет в соединении хлор или бром. Группа СС13 наиболее реакционноспособна, она легко превращается в группы CC]2F и CC1F2о но менее легко в группу CF3. Группа СНС12 медленно превращается в группу CHC1F и с еще большим трудом — в CHF2-rpynny. Группы СН2С1 и СНС1 в большинстве случаев в тех же условиях остаются неизменными.
Еще лучше происходит обмен галоидов в соединениях типа аллилгалогенидов. Так, перхлорпропилен при обработке трехфтористой сурьмой превращается в смесь фторированных веществ:
Выход, %
СС12 = CCI — CC12F 3 СС12 = CCI — СС13 СС12 = CCI — CC1F2 3 1Б0° СС12 = CCI — CF3 33
В некоторых случаях хлор и бром замещаются фтором в присутствии одного безводного фтористого водорода. Наиболее легко в эту реакцию вступает хлор, содержащийся в перхлоралканах. Фторирование при помощи
|
НТ осуществляется в автоклаве из нержавеющей стали при 150—250°. В табл. 16 показаны продукты, получаемые этим способом. Таблица 16
|
Введение фтора с помощью тетрафторида серы. Недавпо установлено, что тетрафторид серы является уникальным селективным агентом, который заменяет на фтор гидроксильную группу в спиртах, кислород в карбонильных группах альдегидов, кетонов и производных карбоновых кислот. Ранее тетрафторид серы получали фторированием серы трехфтористым кобальтом или элементарным фтором; при этом получалась смесь продуктов, из которой с трудом можно было выделить ЗГ4. В настоящее время дихлорид серы обрабатывают избытком суспензии фтористого натрия в ацетонитриле
Сб^ж
ЭБСИз + 4ИаЕ------------ > БЕ4 + 32С12 + 4МаС1,
В результате достигается высокий выход сравнительно чистого ЗГ4.
Тетрафторид серы — газ с т. кип. —38°, его токсичность соответствует примерно токсичности фосгена. При взаимодействии £^4 с карбоновыми кислотами карбоксильная группа превращается в трифторметильную. Реакция протекает в две стадии: сначала образуется фтористый ацил, затем замещается карбонильный кислород:
С6Н5СООН + БЕ4 — С6Н5СОЕ + НЕ + БОЕз,
С6Н5СОЕ + БЕ4 -* СбН5СЕз + 80Е2.
Ангидриды, ацилгалогениды и соли карбоновых кислот реагируют подобным же образом.
При взаимодействии ЗГ4 с насыщенными карбоновыми кислотами двойные и тройные связи не затрагиваются
СН2 = СН — СООН----------------- * СН2 = СН — СЕз,
СН - С — СООН----------------- > СН = С — СЕ3.
Циклические ангидриды могут взаимодействовать с 8Г4 без потери кислорода. Так, ангидрид дихлормалеи - новой кислоты превращается в дихлортетрафтордигидро - фур ап
|
|
|
С1С —СО |
|
СЮ —СЕ2 |
Хлорангидриды вначале образуют фтор ангидриды, а затем трифторметильные соединения. Альдегиды и жетоны образуют дифторметиленовые соединения
^>С = О + ЭЕ« ср2 + ЭОГа.
При взаимодействии 8Г4 с ацетоном получается 2,2-ди - фторбутан (СН3СЕ2СН3). Антрахинон и другие хиноны превращаются в продукты, каждый атом кислорода которых замещен двумя атомами фтора
|
|
Кислород в двуокиси углерода замещается на фтор с образованием тетрафторметана.
Вещества, содержащие гидроксильную группу, также легко реагируют с тетрафторидом серы: при этом гидроксильная группа замещается на атом фтора.
Реакции с органическими и неорганическими веществами, содержащими С = 1Ч-связъ, приводят к образованию ранее неизвестных соединений с общей формулой И —N == БРг. Так, из изоцианатов получаются цроиз - родные иминодифторида серы и карбонилфторид
Р — N = 0 = 0 + 8Р4 -> Г1С1^ = ЭГа + СОГа.
Аналогичные производные образуются при взаимодействии с нитрил ами
И - С = N + ЗГ4 -> RCF2N = ЗГ2.
Иминодифториды серы представляют собой легкоки - пящие сравнительно инертные соединение обладающие значительной термической стабильность».
Введение фтора в органические соединения с помощью 8Г4 — новый оригинальный метод и применение его имеет очень широкие перспективы.
Фторирование ароматических соединений. Попытки осуществить прямое фторирование ароматических соединений показали, что большинство из них подвергается при этом разложению, полимеризации или превращению в насыщенные циклические фториды. Несмотря на многие патенты, посвященные этому вопросу, имеется лишь небольшое число индивидуальных веществ, полученных прямым фторированием ароматических соединений.
При фторировании трехфтористым кобальтом фтор не только замещает водород, но и присоединяется по всем двойным связям ароматического ядра. В результате образуются насыщенные циклические соединения, те же, что и при фторировании соответствующих гидроароматических соединений:
|
/= V |
|
”)>С2Н5 |
|
СЕ — С2Р5 |
|
Сн2 сн Н2с/ |
|
350° |
|
^ сн — сл - СН7сН2 |
|
СоР8 С/2 С1* ----- ► ¥2С( |
|
___ / СГ2 СР2 |
 |
При фторировании элементарным фтором на серебряном контакте при температуре около 200° протекают аналогичные реакции. В табл. 17 приведены продукты каталитического фторирования ароматических соединений.
Довольно широкое применение нашел метод синтеза фторсодержащих соединений ароматического ряда, заключающийся в разложении солей диазония фтористоводородной кислотой
С6Н512Х + НР -» СъЯьП2¥ + НХ СбЩГ^ -> С6Н5Р + N2.
|
Таблица 17
|
При этом выход, например фторбензола, достигает 40%, а орто-, мета - и парафтортолуола 55—65%. Орто-фтор - нитробензол этим методом получить не удается. Недостатки метода, главным образом загрязненность продуктов синтеза, были устранены применением термического разложения чистых борфторидов диазония. При этом выход фторбензола, орто-, мета - и парафтортолуола повысился соответственно до 80, 90, 87 и 97%; выход орто-фторнитро - бензола 18%.
Борфториды диазония, получающиеся при действии солей борфтористоводородной кислоты на соли диазония
С6н5гш + ШВЕ4 С6Н5К2ВЕ4 + ИаС1,
Представляют собой труднорастворимые в воде, хорошо кристаллизующиеся стабильные вещества. При нагревании в сухом виде они разлагаются с выделением азота, трехфтористого бора и фтористых арилов; чем ниже температура разложения, тем выше выход фторпроизводного. Таким путем была впервые получена, например, пара - фторбензойная кислота. Этот метод введения фтора может быть применен для получения фторпроизводных многоядерных углеводородов — нафталина, фенантрена, антрацена, дифенила, флуорена и др.
Существуют методы прямого фторирования с сохранением ароматического ядра. При обработке бензола три - фторидом хлора образуется монофторбензол, однако вместе с хлорбензолом и другими побочными продуктами
_____ У ссТГо^ ______ + __________________________________ /С1 + /~ /
При применении органических фторирующих средств, например йодбензолдифторида или пара-йодтолуолдифто - рида, также образуются фторароматические соединения, но оба эти метода не имеют практического значения из-за небольшого выхода целевых продуктов.
Сообщения в печати показывают, что в последнее время в области фторирования ароматических соединений достигнуты значительные успехи. Разработано несколько способов синтеза гексафторбензола. Один из них заключается в присоединении фтора к гексахлорбензолу с последующим дегалоидированием, другой — в пиролизе паров трибромфторметана в никелевой трубке при 630— 640° в токе азота. В последнем случае было получено 35% гексафторбензола, представляющего собой, в противоположность высокоплавкому гексахлорбензолу (т. пл. 224—226°), бесцветную жидкость с т. кип. 80,5°, т. пл. около 0° и уд. вес. 1,6184 (при 20°). Кроме того, из реакционной смеси были выделены пентафторбромбензол и дифтортетрабромэтан. Очевидно, здесь в качестве промежуточного продукта образуется дифтор ацетилен
СГВг3 —> СГВг2 — СГВг2 —^ С2¥2 —* СеРб»
Так как известно, что дихлор ацетилен тримеризуется в гексахлорбензол.
Гексафторбензол может быть получен и дегидрофторированием нонафторциклогексанов, образующихся при действии трехфтористого кобальта на бензол. Если дегидрофторированию подвергать октафторциклогексан, получающийся также при обработке бензола Со¥з, то образуется пентафторбензол. Недавно был опубликован новый способ получения гексафторбензола: перфторцикло - гексан, перфторциклогексен или перфторциклогексадиены пропускали над нагретым до 400° железом. Этот метод может быть пригодным для синтеза многих ароматических фторуглеродов. Например, из перфтордекалина можно получить перфторнафталин, а из перфтордиметилцикло- гексана (легко получаемого из орто-, мета - и пара-ксилола) — соответственно перфорированные орто-, мета - и пара-ксилолы.
Гексафторбензол и другие ароматические фторуглероды обладают своеобразными свойствами. Они довольно легко взаимодействуют с нуклеофильными реагентами, но толь
ко в неводных растворах. Так, гексафторбензол нри обработке метилатом натрия превращается в пентафтор - анизол
СА + СН8(Жа - С6Г5ОСН3;
При взаимодействии с амидом натрия образуется пентафторанилин, а с сульфидом — пентафтортиофенол.
Получение этих соединений открывает широкие возможности синтеза фтор ароматических соединений. Например, деметилированием пентафторанизола был получен пентафторфенол.
Пентафторанилин диазотируется способом, обычным для слабоосновных аминов, а тиофенол превращается в пентафторбензолсульфонилхлорид и через него в другие производные.
Пентафторфенол с хорошим выходом получается при нагревании гексафторбензола с гидроокисью натрия в третичном бутиловом спирте в мягких условиях
Шон
СА--------- » СвЕБ(Жа СбР5ОН.
|
О—н I Е ‘Л/г г |
 Он обладает типичным фенольным запахом, но его т. кип. (143°) значительно ниже т. кип. фенола (182°). Это объясняется образованием внутримолекулярной водородной связи в противоположность межмолекулярным связям, имеющимся в самом феноле
Он обладает типичным фенольным запахом, но его т. кип. (143°) значительно ниже т. кип. фенола (182°). Это объясняется образованием внутримолекулярной водородной связи в противоположность межмолекулярным связям, имеющимся в самом феноле
. о —н... о —н У У
Пентафторфенол оказался более сильной кислотой, чем фенол: константа диссоциации пентафторфенола К — 3-1СГ6, фенола 13-10“10. При действии на гексафтор- бензол водносииртового аммиака под давлением образуется пентафторанилин (т. кип. 156—157°) и декафтордл - фениламин
СА--------- > С6Е5ГШ2 + (ОДО^Н.
Из пентафторбейз'ола можно получать весьма интересные производные перфторбензола
|
Св¥5И - С6Г5Вг - I |
 БОз —>
БОз —>
——► С6Г5Х (X — Вг или I),
Х2
Си
------ >Съ¥5-Се¥ь
С6Р5]^Вг и т. д.
В 1960 г. был осуществлен синтез пентафторпиридина (т. пл. —42°, т. кип. +83,5°). Это соединение (в количестве около 20%) было получено при термическом дефторировании перфторпиперидина над железной проволокой при 580—610° в вакууме. Таким же методом, вероятно, могут быть получены перфторохинолины, пиридины и пиразины.
Способы получения фторолефинов
В некоторых случаях для получения полностью или частично фторированных олефинов пригодны способы, используемые в производстве обычных олефинов, но имеется также много специфических способов — декар - боксилирование солей перфторкарбоновых кислот, присоединение перфторалкилйодидов к ацетиленовым соединениям, пиролиз фторгалоидуглеродов и др. Из обычных способов часто используют дегидрогалоидирование.
Дегидрогалоидирование осуществляется обычно воздействием на соединение щелочных агентов или высокой температуры.
Удаление галоидводорода затрудняется, если атом галоида или водорода связан с атомом углерода, несущим фтор. Например, дегидрогалоидирование СНС12СС12С11Р2 и СС1*СН2СР2С1 приводит к образованию соответственно СС12 = СС1СНР2 и СС12 = СНСР2С1 вместо СНС12СС1 = СГ2 и СС13СН = СР2.
В качестве щелочных агентов используются гидроокиси и алкоголяты щелочных металлов, третичные амины, в некоторых случаях — фтористый калий, который отнимает НЕ, превращаясь в КТ-НГ. В присутствии гидроокисей или алкоголятов реакции протекают при комнат-
Ной или умеренно повышенной температуре. При участии в реакции третичных аминов, по-видимому, образуются четвертичные соли, при разложении которых получаются фторолефины. Наиболее эффективные агенты — трибу- тиламин и диметил анилин.
В ряде случаев дегидрогалоидирование осуществляется в паровой фазе в присутствии катализаторов при повышенной температуре. Например, фтористый винил образуется при пропускании СН3СНР2 над сульфатом магния при 400°, а винилиденфторид — при пропускании СН3СГ2С1 над окисью алюминия при 250—400°.
Одним из наиболее удобных способов получения пер - фторолефинов является дегалоидирование хлор - и фторсодержащих углеводородов, обеспечивающее высокий выход целевых продуктов. В этом случае реакцию проводят в жидкой фазе; растворителем служат спирт, ацетон, этилацетат, ацетамид, диметилформамид или уксусный ангидрид. Дегалоидирование осуществляется с помощью порошка цинка, активированного медью, при температуре кипения растворителя. Дегалоидирование низкокипящих фторгалоидоалканов проводят при повышенном давлении и 110—150°. Так, тетрафторэтилен получается из симметричного дихлортетрафторэтана при 110° и 15 атм.
Фтористый винилиден СН2 = С¥2 образуется из дифтор д и х л о р э т а 11 а ОСН2 — СГгС1 или дифтордибромэтаиа ВгСН2 — СГ2Вг, получаемых из хлористого винилидена путем следующих превращений:
С12 БЬГз
СН2 = СС12------ > С1СН2 — СС1з----- >
Ъп
СС¥2 - С1СН2----------- * СН2 = С¥2.
Трифторэтилен С¥* = СГН получается дехлорированием трифторхлорбромэтана, а хлортрифторэтилен СГ2 = СРС1 — один из доступнейших фторолефинов — дехлорированием трифтортрихлорэтана; последний получают, обрабатывая гексахлорэтан фтористым водородом или трехфтористой сурьмой.
В некоторых случаях при дегалоидировании могут быть удалены две молекулы галоида. Например, из 1,2,3,4-тетра- хлорперфторбутана или 1,2-дихлор-3,4-дибромперфторбу - тана получается перфторбутадиен-1,3 с выходом более 90 %. Частично фторированные олефины образуются также
При присоединении фтористого водорода к ацетиленовым углеводородам. Так получают, например, фтористый винил
СН = СН + НЕ -> СНЕ = СЕ;
Реакция протекает при повышенной температуре в присутствии катализатора — активного угля, пропитанного сернокислой ртутью, или окиси алюминия. В этих же условиях НЕ присоединяется к винилацетилену с образова
Нием смеси СН2 = СН — СР = СН2 и СН2 = СН -
Взаимодействие перфторалкилйодидов и ацетиленовых соединений при 200—260° и облучении ультрафиолетовым светом приводит к образованию фторсодержащих олефинов и продуктов теломеризации. Так, перфтор - йодэтан присоединяется к ацетилену с образованием С2Г6СН = СШ, С2Г5(СН = СН)21 и других веществ.
При декарбоксилировании при повышенной температуре калиевых солей перфторпропионовой и перфтормас - ляной кислот получается соответственно тетрафторэтилен и перфторпропилен, а натриевых солей перфторпентано - вой и перфторадипиновой кислот (при 290—300°) —пер - фторбутен-1 и перфторбутадиен.
СР3—С¥—С¥2— СР3—СР=СР2 + С02+ КЕ
|
|
Декарбоксилирование солей фторкарбоновых кислот с образованием олефинов, по-видимому, является уникальной реакцией, свойственной только фторкарбоновым кислотам. Многие перфторолефины могут быть получены пиролизом фторуглеродов и фторхлоруглеродов. Так, при пиролизе фреона-22 (дифторхлорметана) в никелевой или серебряной трубке при 500—680° с высоким выходом образуется тетрафторэтилен
2СЕ2НС1 СЕ2 = СЕ2 + 2НС1.
Этот метод имеет промышленное применение и в настоящее время служит основным методом получения этого чрезвычайно важного ненасыщенного фторуглерода.
При 500—700° наблюдается превращение простейших олефинов в более сложные. Так, тетрафторэтилен может
|
Рис. 12. Схема пиролитических превращений некоторых фторуглеродов |
Быть превращен в пропилен, а последний в нерфтор- изобутилея. При пиролизе хлортрифторэтилена в стальной трубе при 500—600° образуется смесь продуктов, из которой можно выделить 3,4-дихлорперфторбутен, 2,2-ди - хлорперфторциклобутан и смесь моно - и дихлорперфтор - иропенов. Первый продукт служит исходным материалом для синтеза перфторбутадиена.
Фторолефины можно получить и пиролизом полифтор- олефинов (рис. 12); например» основным продуктом, образующимся при нагревании политетрафторэтилена при 500—700° в вакууме, является тетрафторэтилен, а при обычном давлении — смесь его с перфторпропиленом и перфторциклобутаном. При более высокой температуре в продуктах пиролиза содержится 40—50% перфторизо- бутилена с примесью гексафторэтана. Разложение поли - хлортрифторэтилена в зависимости от условий сопровождается образованием жидких низкомолекулярных полимеров или исходного мономера.
Фторолефины получают также пиролизом насыщенных фторуглеродов. Условия пиролиза —температура, продолжительность контактирования, давление —определяют состав и строение получающихся продуктов. Например, при пиролизе перфторциклобутана при 300—600° образуется смесь перфторбутена-1 и перфторпропилена, а при 750° —перфторизобутилен и некоторое количеств о пер фтор бу тен а-2.
Основной способ получения олефинов — дегидратирование спиртов — в случае фторолефинов находит только ограниченное применение. Например, дегидратирование некоторых фторсодержащих спиртов фосфорным ангидридом приводит к образованию фторолефинов; так, из С3Г7СН(ОН)С3Н7 при 150-200° получается С8Г7СН = = СНС2Нб.
Частично и полностью фторированные олефины имеют весьма важное промышленное значение. Во-первых, они являются промежуточными продуктами очень многих синтезов фторсодержащих веществ —спиртов, эфиров, кислот, сульфидов, нитрилов, амидов и т. д. Во-вторых, что, пожалуй, наиболее важно, фторолефины используются в производстве фторпластов, где они служат исходными продуктами полимеризации и сополимеризации.
В нсследованиях фторорганических соединений наиболее плодотворными оказались работы по изучению фторированных олефинов- Именно они дали возможность организовать производство новых видов пластмасс, смазочных материалов, эластомеров и других веществ, необычайно устойчивых к температуре и химическим реагентам. В результате изучения фторолефинов получено много новых данных о природе кратной связи, влиянии заместителей, механизмах реакций присоединения и полимеризации; это подкрепило и расширило современные представления о сопряжении связей.
По химическим свойствам перфторолефииы резко отличаются от незамещенных олефинов, и это своеобразие проявляется в их производных. В частности, фторолефины в присутствии щелочных катализаторов легко присоединяют спирты, образуя соответствующие простые эфиры
С¥2 = С¥2 + ИОН -> СЯ¥2 — СР2ОИ;
Этилен и другие олефины в тех же условиях со спиртами не реагируют. Эфиры, образующиеся из вторичных и особенно третичных спиртов, менее устойчивы и легче гидролизуются, чем эфиры, полученные из первичных спиртов.
Тетрафторэтилен. перфторпропилен и другие фторолефины легко присоединяют амины. Тетрафторэтиламип
Гидролизуется в N-замещенные амиды дифторуксусной кислоты
Н20 у
С¥2 = С¥2 + [С¥2Я — СГ2Ш2]--------------- > ЯС¥2 - С + 2НЕ.
^Н2
При взаимодействии тетрафторэшлена с аммиаком образующийся дифтор ацетонитрил самопроизвольно полиме - ризуется в три(дифторметил)триазин
—2НР
С¥2 = С¥2 + ГШ8 [ЕС¥2 — СЕ2ГШ2]----------------------- > [НСЕ2С1М]з.
Вторичные амины реагируют с хлортрифторэтиленом, образуя при комнатной температуре исключительно диал- киламиды фторхлоруксусной кислоты
О
НСЕСКадНа—■^ НСЕС1 — С — И112.
При реакции тетрафторэтилена с бисульфитом натрия образуется натрийтетрафторэтилсульфонат, который омы - ляется в дифторацетат натрия
С¥2 = С¥2 + МаНЗОз ЯС¥2 ~ СЕ2803Ма —^ НСЕ2 — СООИа.
Легко осуществляются реакции между тетрафторэти - леном и меркаптанами с образованием фторсодержащих сульфидов
СГ2 = С¥2 + ИВН НСЕ2 - СЕ2 — 8И.
Известно, что подобные реакции для незамещенных этиленов сильно затруднены или вообще неосуществимы.
Поведение перфторолефинов позволяет сделать вывод об электронном истощении в этих соединениях тг-связи, являющимся следствием сильного электроностягивающего действия атомов фтора. Электронное истощение делает перфторолефины акцепторами электронов, в то время как и-связь в обычных олефинах является донором электронов. Поэтому первоначальной ступенью реакции присоединения следует считать атаку нуклеофильного реагента перфторолефина
11+ + СЕ2 = С¥2 + ОД -*[СР2 — СР2 — ОИ]-* СЕ211 — С¥% — ОД,
Подобного рода предположение подтверждается тем, что для присоединения веществ с нерезко выраженными нуклеофильными свойствами необходим щелочной катализ. В случае незамещенных олефинов осуществляется атака катионом.
|
Хг— Р------ С“-СР=^СР2 V |
 Замена в молекуле тетрафторэтилена атома фтора на трифторметильную группу резко сказывается на свойствах фторпропилена. Благодаря сильному электроностягивающему действию трифторметильиой группы и электронному истощению тс-связи в перфторпропилене наблюдается поляризация, в результате которой конечный атом углерода, несущий два атома фтора, особенно легко поддается нуклеофильной атаке и реакции протекают в более мягких условиях (почти без нагревания), чем с тетрафторэтиленом
Замена в молекуле тетрафторэтилена атома фтора на трифторметильную группу резко сказывается на свойствах фторпропилена. Благодаря сильному электроностягивающему действию трифторметильиой группы и электронному истощению тс-связи в перфторпропилене наблюдается поляризация, в результате которой конечный атом углерода, несущий два атома фтора, особенно легко поддается нуклеофильной атаке и реакции протекают в более мягких условиях (почти без нагревания), чем с тетрафторэтиленом
ОК
♦ СР3—СР11—с:р2—ОК
Анион присоединяющегося реагента направляется к углероду у двойной связи, несущему большее число фтора. Порядок присоединения доказывается омылением образующихся продуктов в а-моногидроперфторпропио - новую кислоту
СРз - СЕН - СЕ2 - (Ж —СЕ3 - СЕН - СООН.
При взаимодействии спиртов с перфторолефинами наряду с насыщенными эфирами СР3СРН — СР2ОК образуются непредельные соединения типа СЕ3— С]? = СР — О И или СГ2 = СЕ— СГ2ОК. Показано, что последние образуются непосредственным замещением фтора в винпль - ном или аллильном положении.
Получение этих веществ является результатом сопряжения связей. В первой стадии процесса частица нуклеофильного реагента атакует атом углерода с наименьшей электронной плотностью
Р
(Ж - — СР2=СР—с^- Р ------------------------------ ► ИОСР2-СР—СР3 (А)
В общем случае промежуточный ион А может стабилизоваться несколькими путями:
Присоединением протона с образованием насыщенного соединения I;
Выделением атомл галоида трифторметильной группы с образованием продукта аллильного замещения II;
Выделением атома фтора из а-положения (к замещающему агенту) с образованием продукта винильного замещения ш.
Р С—ср—ср—сж
|
4-Н |
|
СР3—СРН—СРгОИ 1 |
|
СР2=СИ—СНзСЖ II |
|
СР3-СР=СР—ОИ + НР |
|
III |
 |
![]()
Тенденция к образованию ненасыщенных соединений увеличивается с увеличением подвижности электронной пары атакующего реагента. При взаимодействии пер - фторпропилена с диэтил амином — ненасыщенного продукта (перфторпропениламина) образуется больше, чем соответствующего ненасыщенного эфира в случае реакции того же олефина со спиртами.
Реакция вторичных аминов с перфторизобутиленом приводит исключительно к замещению винильного атома фтора
СЕ3
|
С / |
![]() С = СЕ2 -> СЕ3 — С = СЕ1ЧГи.
С = СЕ2 -> СЕ3 — С = СЕ1ЧГи.
|
СЕ3 |
СЕз
Аналогично спиртам и аминам с фторолефинами реагируют другие нуклеофильные реагенты —меркаптаны, гидразин, гидроксиламин, магнийорганические соединения.
Меркаптаны в присутствии щелочных катализаторов присоединяются к фторолефиц^м с образоваццем цасы-
Щенйых тиоэфиров и перфторвйнплтйоэфиров
НСЕ2СЕ28И
С¥2 = СЕ2+ ИБН-»
СЕ2 = СЕ —БИ;
При осуществлении реакции в растворе ацетона образуются тиоэфиры, содержащие перфторвинильную группу.
При взаимодействии фторолефинов с гидроксилами - ном образуется новый класс соединений — фторангидри - ды фторированных гидроксамовых кислот
Е
СЕ3 — СЕ = СЕ2 + NН2ОН -> СЕ3 - СЕН — С + 2НЕ.
|
|
С магнийорганическими соединениями ф-олефины дают алкил - и арилперфторолефины
СЕ2 = СЕ2 + X -» ИСЕ = СЕ2.
Ф-Олефины легко реагируют с триалкиламмониевыми солями азотистоводородной кислоты с образованием фтор - алкил - и фторалкиленазидов
+ _ |—>СЕз — СЕН - СЕ2 — N3
СЕ3 - СЕ = СЕ2 + Н^ —
->СЕ3 — СЕ — СЕ — N3 + НЕ
При взаимодействии фторолефинов с нуклеофильными реагентами в ряде случаев имеет место атака молекулы фторолефина неподеленной парой недиссоциированной молекулы нуклеофильного реагента. При этом законно предположение об образовании переходного комплекса I (стр. 84) с четырехчленным циклом
Переходный комплекс отщепляет молекулу фтористого водорода, давая продукт винильного замещения
СГ:з—С=СР2 ----------- г NЫ И -—
СРа Н
“** ср8—<:=<*—Ош —*- ср3—с=ср—мнн + нр
РзС 1кР----- Н СР3
Осуществление присоединения винильного или аллиль - ного замещения зависит от строения фторолефина типа нуклеофильного реагента и условий реакции. Так, при действии на фторолефины спиртовых растворов алкоголята натрия, т. е. при наличии значительных концентраций алкоксидных ионов, образуются продукты присоединения. При осуществлении этой же реакции в среде инертного неполярного растворителя идет преимущественно атака недиссоциированной молекулой спирта, облегчается винильное замещение и образуется ненасыщенный эфир
СР3-СР=СР СРз—СР=СРСЖ ~ НР
Ь, I.1 Р--3 н
Приведенные реакции служат примером взаимодействия перфторолефинов с нуклеофильными реагентами, легкость присоединения которых возрастает с повышением полярности двойной связи. Вместе с тем другим характерным свойством этих соединений является затрудненность гетеролитических реакций с электрофильными реагентами. Замена водорода на фтор в молекулах оле - финов замедляет электрофильное присоединение или препятствует ему не только благодаря деактивации двойной связи, но и вследствие стерических влияний. Перфтор - бутен-2, перфторциклогексан и перфторциклобутен—вещества ярко выраженного электрофильного характера — оказывают сопротивление электрофильной атаке; они не взаимодействуют ни с йодом, ни с бромистым водородом даже при температуре выше 200°.
При присоединении галоидов, галоидоводородных кислот, хлористого йода, фтористого питрозила и других »электрофильных рёагентой к перфторолефинам не исключен и свободно радикальный характер реакции.
Присоединение йода к тетрафторэтилену протекает при повышенном давлении и температуре выше 101)°. Небольшие добавки йода к тетрафторэтилену способствуют превращению его при нагревании в воскообразный высокомолекулярный продукт, строение которого может быть выражено формулой 3(С¥2 — Последний, легко
Освобождая при нагревании или на свету атомарный йод, может служить инициатором полимеризации тетра - фторэтилена.
Тетрафторэтилен легко реагирует с 1,2-дихлортрифтор- йодэтаном
СР2С1 — С¥Си + СР2 = СР2 -> С¥2С — СЕС1 — {С¥2 — С¥2)п — С¥2С¥21.
Образующиеся теломеры (п = 1—6) при действии цинка в уксусном ангидриде легко превращаются в а, |3, е, о) тетрахлорперфторалканы
С1СГ2 - СЕС1 - (С¥2 - СЕ2)п - СГС1 - СР2С1.
Последние обработкой цинком в спиртах образуют пер- фтор-а, о)-диены
С¥2 = С¥- (С¥2 - С¥2)п ~С¥ = С¥2.
Взаимодействие фторолефинов с трифторйодметаном и трифторбромметаном осуществляется также по радикальному механизму. Реакция легко проходит в газовой фазе при повышенной температуре и ультрафиолетовом освещении. В зависимости от условий и соотношения реагирующих веществ образуются либо продукты присоединения, например С¥з — СГг — СГ2«Г, либо теломеры с различной длиной цепи СГз(СГ2 —
СГ3Т -> СГ3 + 5
С¥3 + СЕ2 = СКС1 -► СР3СР2—СТ С1 —* СР3СР2 - СГС11.
Аналогично ССЬВг образует СС1з— СГг — СГС1Вг, ССЬВг присоединяется к трифторпропилену при ультрафиолетовом освещении с образованием СГз — СНВг — —СН2-СС1з. Без освещения присоединение не происходит.
Трифторйодметан взаимодействует с перфторпропиленом при облучении светом (длина волны 300 А) с образованием продукта присоединения CF3 — CFJ — CF2 — СГз. При облучении более коротковолновым светом образуются продукты теломеризации CF3(C3Fe)nJ, в которых п ]> 1. Радикальная атака CF3 и Вг олефинов типа RCH = СН2, где R = F, CF3, С1 и другие частицы направляются исключительно к конечной метиленовой группе
I I----- ► GHa = GHGF3
CF3—^--- ► gh2 = cf2
I--- ► CF2 = CFC1
Такая же ориентация наблюдается при фотохимическом присоединении CF3J и НВг к винилиденфториду.
Одним из объяснений специфичности радикальной атаки является то, что реализуемому присоединению благоприятствуют стерические факторы. Вероятно, они играют важную роль, но имеются данные, показывающие, что присоединение подобного рода может протекать не так, как это предсказывается на основании одних только стерических соображений. Например, атака 1,1-ди - фторпропилена и 2-моногидроперфторпропилена радикалами CF3, СС1з и атомом брома направляется исключительно к СН-группе, т. е. в направлении, обратном предсказанному стерическими соображениями
ЫFS+ СН3 — CH = CF2 - СН8 - CH - CF2 —- СН3 — CH - CF2J
CF3 СГ3
Результат фотохимической реакции может быть объяснен и на основании стабильности промежуточных радикалов.
Присоединение к перфторолефинам электрофильных реагентов, как правило, затруднено и в большинстве случаев осуществляется в жестких условиях, не исключающих радикальный характер реакции.
Перфторциклобутен медленно взаимодействует с три - фторйодметаном, образуя 1-йод-2-трифторциклобутан
CF2 — С F — CFa CFo-GFJ
Перфторбутен-2 легко взаимодействует с бромистым водородом в ультрафиолетовом свете, образуя смесь продуктов присоединения СГ3 — СНГ — СРВг — СГз и дибромид. Образование дибромида вызывается фотолизом бромистого водорода с образованием свободного брома.
Перфторциклобутен реагирует с бромистым водородом еще труднее, чем перфторбутен-2, образуя 1-бром - 2-моногидроперфторциклобутен и несколько большее количество дибромида. Фотохимическое хлорирование перфторбутена-2 осуществляется медленнее, чем бромиро - вание. Бром и хлор реагируют с перфторциклобутеном в ультрафиолетовом свете с образованием 1,2-дибром - и
1,2- дихлорсоединений. Бромирование перфторизобутилена в темноте и при комнатной температуре не идет. Реакция протекает с выходом около 35 % в ультрафиолетовом свете при повышенной температуре (150°).
Перфторциклогексен не взаимодействует с бромистым водородом в условиях, использованных для перфторбутена-2 и перфторциклобутена. Присоединение хлористого водорода к 1,1,1-трифтор - и перфторпропилену идет только при высокой температуре и в ультрафиолетовом свете.
Бромистый водород присоединяется к хлортрифтор - этилену и трифторпропилену в газовой фазе при ультрафиолетовом облучении, образуя СР2Вг — СРСШ и СГ3СН2СН2Вг; в отсутствие освещения реакция не идет.
Фторолефины под действием света или нагревания до 100° легко присоединяют хлористый нитрозил. При этом вначале образуются нитрозосоединения, которые затем, окисляясь, превращаются в нитрохлорфторалканы
СГ2 = СХ2 —™ СР2С1СХ2ЫО СГ2С1СХ2РЮ2.
Одновременно идет хлорирование фторолефина с образованием соответствующего 1,2-дихлорпроизводного. Бромистый нитрозил в аналогичной реакции с тетрафторэти - леном дает тетрафторбромнитроэтан.
При конденсации 1,1-дифтор-2-хлорэтилена с хлористым нитрозилом в качестве основного продукта реакции получается высокомолекулярное полимерное соединение. Очевидно, все эти реакции — свободно радикальные. Фтористый нитрозил наряду с нормальной реакцией присоединения к фторолефинам проявляет свойства специфического окислителя кратной связи. Фтористый нитрозил реагирует с фторолефинами лишь при нагревании до 100°, причем вследствие гомолитической диссоциации ПЧО образуется смесь продуктов фторирования, нитрози - рования и нитрования. Например, тетрафторэтилен с фтористым нитрозилом реагирует только при 100—110° и образует гексафторэтан и некоторое количество продуктов нитрования.
При взаимодействии перфторизобутилена с фтористым нитрозилом с количественным выходом образуется третичный перфторнитрозоизобутан (СРз)зС]МО. Из перфтор - пропилена и Р]МО получается 2-нитрозоперфторпропан; наряду с ним образуется нитрит гексафториропано - ла-2, который при гидролизе превращается в гексафтор - ацетон. Образование нитрита гексафторпропанола-2 — несомненное доказательство радикального механизма реакции
СЕ3 — СЕ = СЕ2 —■-*■ СЕ3 — СЕ - СЕ3 —СЕ3 — СЕ - СЕ3.
I
Основная реакция между фтористым нитрозилом и фторолефинами часто сопровождается побочными реакциями окисления, фторирования и нитрования.
Подобно хлористому нитрозилу присоединяется и нитрилхлорид СШ02. В известной реакции его с тетра - фторэтиленом с хорошим выходом образуется 1-хлор-2- нитротетрафторэтан. При взаимодействии с трифторэти - леном образуется смесь веществ, из которых основным является продукт хлорирования 1,2-дихлор-1,1,2-трифтор этан и присоединения 1-хлор-1,1,2-трифтор-2-нитроэтан.
Таким образом, многочисленные реакции фторолефв - нов с электрофильными реагентами сильно затруднены в гетеролитических условиях и, наоборот, легко протекают в условиях свободно радикальной реакции. По реакционной способности фторолефины можно расположить в следующий ряд:
СЕ2 = С¥2 > СГ2 = СНС1 > СГ3 — СЕ = СЕ2 >
> цикло — С4Е6 > цикло — С6Ею.
При взаимодействии перфторолефинов с двуокисью азота в качестве основных продуктов реакции образуются
1,2- динитроперфторалканы и нитриты нитроперфторалка - нолов. Кроме того, в качестве побочных продуктов обра-
Зуются яитронитрозоперфторалканы и продукты теломе - ризации перфторолефинов, инициируемой двуокисью • азота
1ЧОаСРаСРа1ЧОа N02CF2CF20N0
С¥2 = С¥2 ^-4->
N0^^140 N02 (СР2)ПГЮ2
По способности вступать в реакцию с двуокисью азота перфторолефины располагаются в следующий ряд:
С¥2 = С¥2 >С¥3-С¥ = С¥2>
С¥3
I I
> СГ2 - СГ = С¥ - С¥2 > С = С¥2.
/
СР3
Таким образом, реакционная способность перфторолефинов в данном случае находится в соответствии с другими примерами свободно радикального присоединения элек- трофильных реагентов.
Производные фторуглеводородов
Альдегиды и кетоны. Исследованию фторированных альдегидов из-за трудности их получения и выделения до сих пор не уделялось большого внимания. Синтезировались главным образом альдегиды типа ИЮНО, образующиеся цри восстановлении перфторкарбоновых кислот.
В химическом отношении перфторальдегиды напоминают соответствующие хлоральдегиды; подобно хлоралю, они образуют устойчивые гидраты (альдгидролы). Фторированные альдегиды и альдгидролы образуют с ангидридами карбоновых кислот диацильные производные
СР3СН (0Н)2 + (ЯС0)20 - С¥3СЕ (ОСОЙ), + Н20.
Свойства диацильных эфиров перфторальдгидролов приведены в табл. 18.
Эти эфиры могут использоваться в качестве пластификаторов для фторопластов. Акриловые эфиры альдгидролов обладают способностью к полимеризации. Под
|
Таблица 18
|
Действием водоотнимающих средств (например, серной кислоты) альдгидролы превращаются в перфторальдегиды. При нагревании последних с водными растворами щелочей наблюдается типичный для полигалоидированных альдегидов галоформный распад с образованием соли муравьиной кислоты и фторированного углеводорода
СЕзСНО + ИаОН - НСО(Жа + С¥3Я.
Имеются сведения о полимеризации перфторальде - гидов с образованием пластиков, стойких к азотной кислоте.
У фторированных альдегидов сохраняются многие химические свойства альдегидов. Например, они восстанавливают аммиачный раствор азотнокислого серебра, дают цветную реакцию с фуксинсернистой кислотой, окисляются в карбоновые кислоты, восстанавливаются в соответствующие спирты и т. д.
Трифторацетальдегид, подобно ацетальдегиду, поли- меризуется в воскоподобную массу. При нагревании полимер превращается в газообразный трифторацетальдегид.
Общий метод получения перфторальдегыдов — восстановление соответствующих кислот алюмо-гидридом лития. При этом, наряду с перфторальдегидами (выход до 80%) образуются фторированные спирты. Этим способом синтезированы все члены гомологического ряда — от уксусного до перфторвалерианового альдегида и выше. Для получения фторированных альдегидов используется также окисление первичных фторированных спиртов.
Широкие исследования в области синтеза фторсодержащих кетонов указывают на большой интерес к этому своеобразному классу соединений.
На реакции кетонов типа РЦССЖ оказывает сильное влияние электроностягивающее действие перфторалкиль - ных групп.
Фторсодержащие кетоны характеризуются высоким содержанием энольной формы; легко образуют стабильные гидраты, р-дикетоны склонны к образованию ме - таллохелатных комплексов, что используется для разделения редких и рассеянных элементов. Так, с помощью теноилтрифторацетона
СН — СН О ОН СН — СН О О
II II II I II II II II
СН С — С — СН = С — СРз-^СН С — С - СН2- С - СЕ3
Выделяют и очищают бериллий, кобальт, гафний, цирконий и другие металлы. Этот метод обеспечивает высокую степень чистоты металла. Р-дикетоны могут быть регенерированы путем разложения хелатов сернистым водородом.
Известны многочисленные примеры использования те- ноилтрпфторацетона для разделения радиоактивных изотопов, а также осколочных элементов, образующихся в ядерном реакторе при получении расщепляющихся материалов. Наиболее широко этот дикетон применяется для выделения актиния и разделения актинидов методом экстракции. Здесь используется различная способность ионов металлов к комплексообразованию в зависимости от pH среды, р-дикетоны типа И — СО — СНг — СО — —СГз и трифторацетоуксусный эфир образуют с медью, железом и другими металлами устойчивые соединения относительно высокой летучести, способные перегоняться в вакууме. Соединения с медью (СГ3СОСНСОК)2Си окрашены в фиолетовый, синий или зеленый цвет. Для отделения циркония от гафния солянокислые растворы этих металлов шестикратно экстрагируют трифтор - ацети л ацетоном, в результате чего содержание циркония в смеси снижается с 1,56 до 0,05% моль, а содержание гафния возрастает с 7,5 до 99,98%. Еще более эффективным экстрагирующим веществом в данном случае является теноилтрифторацетон, особенно если растворителем служит не соляная кислота, а бензол.
Для экстракционного разделения циркония и гафния дз растворов хлорной кислоты, помимо тецоилтрифтор - ацетона, используются и другие (З-кетоны: 2-фуроилтри- фторацетон, 2-пирроилтрифторацетон, трифторацетилаце - тон и ацетилацетон. При этом было показано, что дикето - ны, содержащие трифторметильную группу, обладают лучшими экстрагирующими свойствами, чем ацетилацетон, так как являются гораздо более сильными кислотами
Энольной форме).
Теноилтрифторацетон пригоден для разделения урана и плутония и очистки их от осколочных радиоактивных элементов. В этом случае из сильно кислых растворов сначала экстрагируются четырехвалентный плутоний и цирконий, а затем ничтожные количества других веществ вымываются из органического слоя азотной кислотой. Плутоний (Ри4+) отделяется от циркония восстановлением до Ри3+ и реэкстракцией из органического слоя водным раствором азотной кислоты. Уран после удаления плутония экстрагируется раствором теноилтрифтораце - тона в гексане. Недавно описан быстрый количественный метод выделения плутония из смесей с другими элементами, также основанный на экстракции плутония раствором теноилтрифторацетона в ксилоле. Метод может быть контрольным при определении полноты отделения плутония. Этот же экстракционный раствор используется для выделения из кислых растворов нептуния-237 и микроколичеств нептуния-239. Все эти примеры свидетельствуют
О важном значении фторированных р-дикетонов в современной радиохимии и атомной промышленности.
Фторированные Р-дикетоны получаются конденсацией в присутствии метилата натрия соответствующих эфиров фторкарбоновых кислот, например трифторуксусноэтило - вого эфира, с кетонами — ацетоном, 2-ацетотиононом и др.
НС - СН
СР3СООС2Н5 + СН3СО — С СН сн»(Жа->
/
О НС —СН
II TOC o "1-5" h z II II
-» СКз — С = СН — С — С СН + С2Н5ОН + СНзОН I /
СШа Э
Получающуюся кристаллическую натриевую соль разлагают 10%-ным раствором серной кислоты. Теноил - трифторацетон выделяется в виде густой жидкости янтарного цвета, которая при стоянии превращается в бесцветное кристаллическое вещество (т. пл. 42,5°, коэффициент преломления 1,555).
Синтез фторированных кетонов основан на следующих реакциях: окисление фторолефинов перманганатом калия (например, перфторизобутилен легко окисляется в ге- ксафторацетон СГз — СО — СГз); радикальное присоединение альдегидов к фторолефинам; взаимодействие три - фторметилмагниййодида и других перфторалкильных гриньяровских реагентов с галоидными ацилами. Существует еще несколько способов получения фторированных кетонов, основанных на одновременном омылении и декарбоксилировании фторированных ацетуксусных эфиров
СР3С0СН2СО2С2И5 СГзСОСНз + С2И5ОН + со2.
К образованию фторированных кетонов приводит также окисление вторичных фторированных спиртов.
Введение фтора в молекулу кетона путем замещения атомов водорода оказалось менее удобным, чем указанные методы. При фторировании трехфтористым кобальтом наблюдается разрушение углеродного скелета молекулы. Небольшой выход продукта получается при фторировании ацетона элементарным фтором на медной сетке, однако наряду с кетоном образуются продукты деструкции: моно - и гексафторацетон, оксалилфторид, трифтор - ацетилфторид и др.
По мере накопления атомов фтора в молекуле кетона наблюдается снижение температуры кипения; например, гексафторацетон кипит при —28°.
Фторированные кетоны способны к образованию обычных производных — оксимов, гидразоиов, циангидри - нов, бисульфитных производных и т. д. Гексафторацетон легко конденсируется с фенолом, причем с хорошим выходом получается гексафтордифенилолпропан который образует с дихлорангидридами карбоновых кислот (в том числе с фосгеном и тиофосгеном) термостойкие полиэфиры.
Спирты. Фторированные спирты стали изучаться сравнительно недавно, однако в настоящее время уже известны многочисленные представители этой группы, начиная от моно-,ди-и трифторалкаиолов и кончая поли- фторированными высокомолекулярными спиртами и гли - колями, а также спиртами, содержащими функциональные группы. Некоторые фторсодержащие насыщенные и ненасыщенные спирты приведены в табл. 19.
Таблица 19
|
Формула |
Т. кип., °С |
Формула |
Т. кип., °С (мм рт. ст.) |
|
СН2ЕОН СЕзСН2ОН СНЕ2СН2ОН Сн2есн2он СЕ3СЕ2СН2ОН СЕ3СН2СН2ОН С¥5С¥2СіиОИ |
51 74 95,5-96 103.5 81-83 100—101 96.5 |
СЕ3СЕ2СН(ОИ)СН3 Се3се2сн2снсн2он СЕз (СЕ2)4СН2ОН СЕ2=СС1СН2ОН СС12=СЕСН2ОН Се3сн=снсн2он СЕзСееСС(СНз)2ОН |
86-87,5 155-157 128 42—43 (20) 61(10) 128—128,5 110-111 |
В отличие от ряда галоидированных спиртов, для которых неизвестны соединения, содержащие атомы галоида при углероде, несущем гидроксильную группу, в ряду фторалканолов удалось получить (правда, пока единственное) соединение этого типа — монофторметанол. Все попытки получить дифтор - и трифторметанол не увенчались успехом. Более высшие спирты, содержащие фтор в а-положении, также оказались нестабильными, и выделить их в индивидуальном состоянии не удалось.
Однако известны устойчивые производные таких спиртов, например трифторметилгипофторит СГ3ОЕ, а-фтори - рованные простые эфиры типа КСЕгОГГ и др. 1,1-Ди - гидроперфторспирты представляют собой стабильные соединения и могут быть получены различными способами.
Введение фтора в молекулу спирта приводит к увеличению кислотности этих соединений, причем кислотность увеличивается с накоплением атомов фтора, например от СН2ГСН2ОН к СР3СН2ОН. Монофторэтанол обладает слабокислыми свойствами, в то время как дифторэтанол по своей кислотности уже сравним с фенолом; трифтор - этанол — еще более сильная кислота. Третичные фторированные спирты по константам ионизации еще ближе фенолу.
В табл. 20 приведены данные об увеличении константы ионизации при переходе от первичных спиртов к третичным.
Таблица 20
|
Спирты |
Константа Ионизации |
Спирты |
Константа Ионизации |
|
СР3СН2ОН |
4ХІ0"12 |
С3¥7СЯ2ОЯ |
4,ЗхЮ~12 |
|
СРзч >снон С¥/ |
6,0ХЮ-12 |
>СНОН С3Н/ |
4,3х10~12 |
|
С СНз—СОН СН8/ |
2,5хЮ-12 |
С3Р7ч С3Н7-С0Н С^/ |
2,2х10-11 |
|
СГзч СРз—С—ОН | СРз/ |
З, охю-10 |
СзР7ч^ С3Р7-СОН Сз^з/ |
1,охю-10 |
В спиртах типа 1И(СН2)пОН влияние фтора уменьшается с увеличением количества групп СН2.
Высокая кислотность фторированных спиртов обусловливает их способность превращаться в алкоголяты при действии окислов щелочных и щелочноземельных металлов, а также водных растворов щелочей Например, дифторэтанол образует алкоголяты при взаимодействии с карбонатом, щелочами и окисью кальция, а трифтор - этанол — с карбонатами и даже бикарбонатами.
Атомы водорода гидроксильной группы фторированных спиртов обычными способами замещаются на кислотные остатки с образованием сложных эфиров неорганических и органических кислот.
Фторированные спирты могут быть получены также теломеризацией трифторхлорэтилена и тетрафторэтилена спиртом. Этим способом можно получить Н(СР2СРС1)П СН2ОН и Н(СР2СР2)пСН2ОН, где п = 1 —20. Теломери - зация инициируется органическими перекисями или действием ионизирующего излучения
= СР2 + НСН2ОН -> Н (СЕаСГа)пСНаОН.
Подобная же реакция протекает с меркаптанами в присутствии перекиси бензоила. Например, тетрафтор - этилен и этилмеркаптан образуют смесь тиоспиртов с общей формулой Н(СР2— СР2)ПСН2СН25Н, где п =1—25.
Другим относительно общим методом синтеза фторированных спиртов является восстановление фторированных кислот алюмогидридом лития, боргидридами или водородом в присутствии окислов хрома.
Восстановление перфторкарбоновых кислот или их эфиров алюмогидридом лития приводит к образованию 1,1-дигидроперфторспиртов и альдгидролов (гидратов альдегидов). При восстановлении кислот, содержащих атомы фтора, удаленные от карбоксильной группы, получается только фторированный спирт
С3Г7СООН + ЫА1Н4- С3Г7СН2ОН + С3Г7СН (ОН)2
СГ3СН (СН3) СН2СООН + ЫА1Н4-* СГ3СН (СН3) СН2СН2ОН.
При восстановлении почти любых производных три - фторуксусной кислоты с большим выходом образуется трифторэтанол
СЕдСОХ + 4Н СГ3СН2ОН + НГ.
Препаративным способом получения фторированных спиртов может служить реакция металлоорганических соединений с эфирами перфторкарбоновых кислот и пер- фторальдегидами. Так, магнийорганические соединения нашли широкое применение для синтеза высокофториро - ванных соединений этого ряда
СГ3СГ2СНО + CUзMgJ -+ СЕ3СРаСНОНСН3 + М&ОН.
Монофторзамещепные спирты получаются более простыми способами. Так, Р-хлор - и Р-бромзамещенные спирты превращаются во фторалканолы под действием фтористого калия при повышенной температуре. Монофтор-
алканолы могут быть получены расщеплением а-ошісей (например, окпсп этилена, пропилена) фтористым водородом
СНа — СН2+НЕ-> НОСІЇ2 — СН2Е.
Высокий выход фторированных спиртов достигается при гидролизе фторалкилбромидов плп хлоридов. Так, ди - и трифторэтанолы получаются при гидролизе СНЕгСНгВг и СРзСНгВг водой в присутствпп окиси ртути или свинца
2СЕ3СН2Вг + Н20 + HgO -* 2СЕ3СНаОН + ЩВт2.
Этим способом Свартсом были получены первые фторированные сппрты еще в 1908 г.
Концентрированная серная кислота — отличный катализатор непосредственной этерификации высокофто - рированпых спиртов карбоновыми кислотами; фторсодержащие спирты легко этерифицируются уксусным ангидридом. Акриловые и метакриловые эфиры фторп - рованпых спиртов используются в качестве мономеров при синтезе фторкаучуков и других фторированных полиакрилатов.
Сложные эфиры фторированных спиртов двухосновных карбоновых кислот — метилглутаровой, адипиновой, камфарной и других — применяются как смазочные материалы. Эфиры, синтезируемые на основе фторированных спиртов и циануровой кислоты, служат эффективными добавками к смазкам и пластификаторам.
Сульфаты высших полифторированных спиртов Н(СГ2)пСН20Э0зН (п=5—12) рекомендуются в качестве поверхностноактивных агентов, а эфиры, полученные из фосфорной кислоты и этих спиртов, служат пластификаторами для фторопластов и добавками при эмульсионной полимеризации фторолефинов.
Эфиры. При дегидратации фторированных спиртов до сих пор не удалось получить фторированные простые эфиры; однако они легко получаются присоединением спиртов или гликолей к фторолефинам в присутствии щелочных катализаторов
|
97 |
![]() СЕС1 = С¥2 + ИОН -> НСЕС1 — СЕ2ОИ.
СЕС1 = С¥2 + ИОН -> НСЕС1 — СЕ2ОИ.
4 II. Л. Кнунянц и А. В. Фокин
На этой реакций основан наиболее распространенный способ синтеза фторированных эфиров.
Фторированные эфиры могут быть получены также алкилированием фторированных спиртов
СР8СН2(Жа + СН3Вг -> СР3СН2ОСН3 + ИаВг
И теломеризацией фторолефинов. Например, из тетрафтор- этилена в присутствии диоксана получается фторированный эфир
СН2-СН2 О — СН2—- СН
/ перекись | |
СЕ2 = СГ2 + 0 О Н (СЕгСЕгк — СН — СН2 — О
СНа-СН3
Для получения полностью фторированных эфиров пригоден только один метод — электрохимическое фторирование простых эфиров
СН3СН3 - О - СН2СН3 + 20¥ -+ (С2Р5)2 О + ЮНГ.
Этим методом удается фторировать не только диалкиловые эфиры, но и простые циклические эфиры с пятью и шестью атомами углерода.
Вследствие отсутствия способности к ассоциации перфорированные эфиры обладают низкими температурами кипения, например (С2Е5)20 кипит при +1°.
С увеличением числа атомов фтора свойства простых эфиров все более отклоняются от свойств обычных диалкп - ловых эфиров, а перфорированные эфиры лишены их полностью: они не растворяются в кислотах, не образуют комплексы и перекисные соединения. Введение фтора в одно из а-положений только ослабляет «основные» свойства простых эфиров; введение фтора в оба «-положения молекулы эфира приводит к полному исчезновению этих свойств. По мере удаления атомов фтора от кислорода влияние его на «основные» свойства уменьшается. В табл. 21 приведены свойства некоторых частично и полностью фторированных эфиров.
|
Таблица 21
|
Перфорированные простые эфиры обладают высокой термостабильностыо и отличными диэлектрическими свойствами; это позволяет с большим эффектом использовать их в качестве изолирующих материалов в электропромышленности. Фторалкильные эфиры имеют низкую температуру кипения и химически инертны. Они приобрели важное значение как хладагенты и инертные реакционные среды для химических процессов.
Сложные эфиры большинства фторкарбоновых кислот, содержащие фтор в ацильной или спиртовой группе или в обеих группах, могут быть получены методом прямой этерификации. Особенно легко протекают реакции с поли- перфторкарбоновыми кислотами, которые, являясь сильными кислотами, образуют эфиры уже при обычном смешении со спиртами. Этерификация высокофториро - ванных спиртов несколько затруднена из-за высокой кислотности этих соединений.
При этерификации кислот используют обычные катализаторы — хлористый водород, концентрированную серную кислоту, фторсульфоновую кислоту, ангидрид три - фторуксусной кислоты и др.
При этерификации 1,1-дигидрогептафторбутанола акриловой кислотой в присутствии ангидрида трифтор - уксусной кислоты образуется эфир акриловой кислоты
(СР8С0)20
СН2 == СНСООИ + адСНйОП-------------------- ► сн2 = снсо2сн2с3г7.
Сложные эфиры можно получить и присоединение*! перфторкарбоновых кислот к ацетилену. Так, три - фторацетат образуется при жидкофазном присоединении трифторуксуспой кислоты к ацетилену в присутствии окиси ртути, сульфата ртути и гидрохинона.
При конструировании паровых турбин всегда имеется стремление уменьшить размеры и вес двигателя и количество потребляемого им топлива при сохранении высокой мощности. Если бы вместо воды для получения пара можно было использовать фторуглероды, задача стала бы легко разрешимой. Температура кипения пер - фтор дибутилоксида всего на 1° выше температуры кипения воды, а молекулярный вес паров в 25 раз больше, чем у воды. Следовательно, при той же температуре и давлении он обладает по сравнению с водой в 25 раз большей плотностью пара. При использовании такого фторуглеро - да можно было бы создать мощные паровые двигатели с небольшими размерами турбины и котельного устройства. Применение же в таких турбинах фторуглеродов с еще более высокой температурой кипения и соответственно большим молекулярным весом открывает перспективы значительно большего увеличения мощности этих машин.
Фторкарбоновые кислоты. Благодаря своеобразию свойств фторкарбоновых кислот и возможности широко использовать их для научных и промышленных целей, они служат объектом интенсивных исследований и в настоящее время являются хорошо изученной группой веществ. К наиболее интересным свойствам кислот следует отнести низкое поверхностное натяжение, хорошую растворимость, высокую кислотность (приближающуюся к кислотности минеральных кислот), стойкость к окислению.
Перфторкарбоновые кислоты — наиболее сильные из органических кислот. Константы диссоциации их закономерно изменяются с удалением фторуглеродной группы от карбоксильной (табл. 22). Ненасыщенные фторкарбоновые кислоты еще сильнее насыщенных. Например, константа диссоциации СЕзСН = СНСООН равна 270 • 1СГб, а СЕзСН2СН*СООН - 33,2 • 10'Б. Благодаря чрезвычайно низкому поверхностному натяжению щелочные соли высших перфторкислот являются в кислых средах поверхностноактивными веществами и диспергирующими агентами.
|
Таблица 22
|
Один из методов получения а-монофторзамещенных кислот—обмен атома галоида на атом фтора в эфирах галопдзамещенных кислот при помощи фтористого калия или фтористого серебра. Получено большое количество co-фторкарбоновых кислот с общей формулой FCH2(CH2)nCOOH. Производные высших гомологов таким способом не получаются, так как происходит отщепление фтористого водорода. При присоединении фтористого водорода к ацетиленовым кислотам образуются дифторпроизводные с двумя атомами фтора у одного атома углерода.
Ди- и полифторзамегценные карбоновые кислоты (за исключением дифторуксусной) методом обмена галоида на фтор также не удается получить. Трифторуксусная кислота впервые была получена Свартсом с количественным выходом из бензотрифторида
С6Н5СС13 CgH5CF3-*N02C6H4CF3-+NH2 - CgH4-CF3->CF3 - СООН.
Позднее было осуществлено окисление полифторолефи - нов, содержащих фторуглеродные группы у двойной связи (например, CF3 — CGI = CCI — CF3). Этот метод широко применялся для получения ди-, три - и полифтор- карбоновых кислот. В частности, легко протекает окисление фторолефинов в перфторкарбоновые кислоты щелочным перманганатом. Хороший выход соответствующих фторуксусных кислот CF2COOH и CHF2COOH получается при окислении CF3CC1=CC12 и CF2HCH = СС12.
Олефины, содержащие фтор в а - или у-положешш, легко окисляются в фторкарбоновые кислоты, однако в щелочной среде p-фторолефины вследствие дегидрафториро - вания превращаются в ненасыщенные кислоты; так, из CH3CF2CH2CH = CH2 образуется CHsCF - CHCQOH.
Окисление щелочным нерманганатом применяется и для получения двухосновных кислот; например, тетра - фторянтарная кислота — продукт реакции окисления пер - фторциклобутена. Высшие перфтордвухосновные кислоты, например адипиновая, получаются из 1,2-дихлориер - фторциклогексена или из перфторциклогексена, себацино - вая и додекандикарбоновая из ф-диолефинов тина CF2 == CF(CF2)mCF = CF2, малоновая из СН2 = CHCF* —
— СН =СН2 или ССЬ - CC1—CF2 — CCI =СС12. Трифторук - сусная кислота может быть получена также из ацетонитрила, который хлорируют до CChCN в присутствии треххлористого алюминия. При этом ацетонитрил тримеризуется в циклическое соединение трп(трихлорметил)триазин, последний в присутствии трехфтористой сурьмы превращается в три(трифторметнл)триазин
GFs
С
N N F3C—С ( — GF3
N
Образующий со спиртом в присутствии серной кислоты эфир трифторуксусной кислоты. Трифторуксусная кислота CFaCOOH иолучается также при гидролизе CF3CCI3 концентрированной серной кислоты. При одновременном фотохимическом хлорировании и окислении CF2CI —
— CCI — CCI2 и CF2CI — CF — СС12 образуются хлоран - гидриды фторхлорзамещенных пропионовых кислот. Эти хлорангидриды превращаются в амиды, а затем в нитрилы, при дехлорировании которых получаются производные акриловой кислоты CF2 = CC! CN nCF2= CF — CN.
Наиболее эффективный способ получения одноосновных перфторкислот и их производных, имеющих промышленное значение, — электрохимическое фторирование.
При гидратации тетрафторэтилена в присутствии сульфита натрия и перекиси бензила при повышенной темпера-* туре и давлении образуется дифторуксусная кислота. Гидратация перфторпропилена приводит к обра§0£$ШТО а-гидроперфторпропрудовой кислоты.
При прямой гидратаций перфторпзобутилейа в растворе апетона с количественным выходом образуется мо - воіидроиерфторизомасляная кислота
CF3 CF3
= CF2 Н0Н > н — СООН+2HF.
СР3 CF3
Описапа перегруппировка диазокетонов, в результате которой образуется трифторпропиояовая кислота
CF3COCHN2 + Ag20 GF3CHaCOOH.
Высшие фторированные кислоты, например со-гидро- перфторкислоты H(CF2CF2)mCOOH, могут получаться из продуктов теломеризации, тетрафторэтилена метиловым эфиром муравьиной кислоты; при этом образуются соответствующие метиловые эфиры H(CF2CF2)n — СООСНз, которые затем гидролизуют в кислоты.
Фторкарбоновые кислоты могут быть получены с помощью магшшорганичеоких соединений
RfMgX + С02 Rf — GOOMgX.
При взаимодействии перфтор - и фторхлоролефинов с двуокисью азота образуются динитросоединения и ни - троперфторалкилнитриты; последние upu гидролизе водой превращаются в нитроиерфторкарбоновые кислоты
GF2 = CF2+ N204- NOa— CF2 — CF2ONO —^ OaNCFa— COOH.
При гидролизе продуктов нитрования перфторбутадие - на образуется нитроперфторкротоновая кислота
GF2 - GF - GF = CF2 —02NCF2 - GF = GF — GF2ONO -
О
- NOaCF* —CF = GFG^
Нитроперфторкарбоновые кислоты — еще более сильные uo сравнению с соответствующими перфторкарбоно - выми кислотами. Константа диссоциации, например, ни-* тродифторуксусной кислоты равна 97000-Ю“6.
Фторолефины энергично взаимодействуют с серным ангидридом с образованием р-сультонов
СЕ2 = С¥2 + БОз -> СЕ2 — С¥г - 802.
При гидролизе Р-сультонов образуются а-сульфофторид - карбоновые кислоты. Таким образом из тетрафторэтилена при обработке его серным ангидридом и последующем гидролизе продукта реакции образуется сульфофторид - дифторуксусная кислота Г028СГ2 — СООН. Соответствующие сультоны и сульфофторидкарбоновые кислоты получаются из гексафторпропилена, трифторхлорэтилена и других фторолефинов
СЕз — СЕ = СЕ2 + 803 -> СЕ3 — СЕ — С.:
802 — О
В отличие от насыщенных фторированных кислот известно сравнительно небольшое число непредельных фторированных кислот.
Амиды дифтор - и трифторметакриловой кислоты получаются при омылении циангидринов дифтор-и трифтор - ацетона
СИ
I тт сл
СН8—»С — СЕ3 ^ СН3 — С — СО — N112.
ОН СЕз
Перфторакрилонитрил получается в результате дегидрофторирования продукта взаимодействия гексафторпропилена с аммиаком
СЕз — СЕ = СЕ2 + ]'Ш3-> СЕз — СЕН — С1Ч + 2НЕ СЕ3 — СЕН —- С1Ч -* СЕ2 = СЕ — СГ*.
Фторкарбоновые кислоты представляют собой бесцветные яшдкости или кристаллические вещества. Опи кипят при температуре примерно на 50° ниже температуры кипения соответствующих карбоновых кислот.» Плотность этих кислот очень велика: от 1,49 для пер - фторуксусной до 1,79 для перфторкапроновой.
|
В табл. 23 приведены свойства двух наиболее хорошо исследованных кислот — трифторуксусной и гептафтор - масляной, в сравнении со свойствами соответствующих незамещенных кислот. Таблица 23
|
Известны многие соли трифторуксусной, пентафтор - пропионовой, гептафтормасляной и других фторзаме - щенных кислот. Большинство солей растворимо в воде, ацетоне и спиртах; хорошо растворимы в воде даже соли серебра и свинца. Растворимость солей перфтормасля - ной кислоты (г/100 г растворителя) приведена в табл. 24.
|
Таблица 24
|
В промышленности перфторкарбоновые кислоты используются как исходные вещества для синтеза многих производных фторуглеродов —эфиров, амидов, нитрилов и других соединений, способных к дальнейшим превра - щениям.
Соли щелочных металлов фторкарбоновых кислот при нагревании до 250° пиролизуются с образованием фторолефинов. При пиролизе серебрянных солей образуются перфторуглеводороды и полностью фторированные эфиры
СзР7 — СООА^ —> СбРх4 -|- СзЕ7СООСзЕ7 -|- А^.
При взаимодействии с перекисью водорода трифтор - уксусная кислота превращается в надкислоту СГзСОООН. Эта кислота обладает способностью к окислению различных органических соединений: олефинов, кетоиов, аминов, оксимов и др.
По сравнению с реакциями окисления гидроперекисями реакции с трифторнадуксусной кислотой отличаются исключительной однозначностью, что позволяет получать высокие выходы продуктов окисления высокой степени чистоты.
Растворы трифторнадуксусной кислоты получаются обычно прибавлением концентрированной перекиси водорода к избытку трифторуксусного ангидрида или три - фторуксусной кислоты (часто в растворе инертного растворителя).
Трифторнадуксусная кислота более устойчива, чем известные органические гидроперекиси, в том числе и надмур ав ьин ая кисл от а.
![]() При окислении олефинов трифторнадуксусной кислотой в присутствии солей слабощелочного характера (карбонатов, бикарбонатов и кислого фосфата натрия) получаются а-окиси олефинов с количественным выходом
При окислении олефинов трифторнадуксусной кислотой в присутствии солей слабощелочного характера (карбонатов, бикарбонатов и кислого фосфата натрия) получаются а-окиси олефинов с количественным выходом
|
|
ОН О — СО — СЕз
При окислепии олефинов в присутствии спиртов образуются гликолн. а-Окиси и гликоли получаются легко не только из незамещенных олефинов, но также из соеди -
Цевий, содержащих различного тииа заместители в а - или р-положении к двойной связи. Например, при окислении этилметакрилата трифторвадуксусной кислотой в растворе метиленхлорида образуется а-окпсь и соответствующий гликоль.
При окислении оксимов кетонов и альдегидов трифгор- надуксусной кислотой образуются соответствующие вторичные или первичные нитросоединения. Окисление первичных ароматических аминов трифторнадуксусной кислотой осуществляется уже при комнатной температуре и приводит к образованию соответствующих нитросоединений.
При наличии электроностягивающих заместителей окисление протекает наиболее эффективно. Например, в случае анилина выход нитробензола составляет 8У%, а в случае пара-аминоэтилбензоата или 2,4,6-трибром - аыилина достигается количественный выход соответствующих нитросоединений.
Трифторуксусная кислота и ее ангидрид успешно используются в качестве катализаторов этерификации спиртов, гликолей. целлюлозы и других веществ уксусным ангидридом. При синтезе сложных эфиров карбоновую кислоту растворяют в указанном ангидриде и к раствору прибавляют спирт или другие гидроксильные соединения.
Для простейших кислот и спиртов реакция протекает самопроизвольно и быстро.
С помощью трифторуксусной кислоты получают эфиры из насыщенных кислот; при этом не происходит полимеризации, наблюдаемой в случае применения минеральных кислот. Таким способом из фенола и акриловой кислоты в растворе можно получить хороший выход фенилакрилата.
Каталитическая способность трифторуксусного ангидрида объясняется образованием промежуточного несимметричного смешанного ангидрида трифторуксусной н соответствующей карбоновой кислот, хорошо диссоциа- циирующего на ионы СН3СООЩ и СЕ3СОО”. Недавно установлена каталитическая активиость дифторнитро - уксусной кислоты, более сильной по сравнению с трифторуксусной.
Эфиры трифторуксусной кислоты легко реагируют с гидроксил амином, образуя трифторацетгидроксамо - вую кислоту, которая при нагревании распадается на трифторнитрозометан и формальдегид
О О
/ II
СЕ3 — С - г NН2ОН -► С¥9— С — ЛИОН + ИОН
ОН
/
СЕз — С - 1ЧНОН - СЕ3 - N0 + СН20.
Как указывалось, эфиры двухосновных перфторкар - боновых кислот используются для получения стойких смазочных материалов и в синтезе фторированных каучу - ков. Приполимеризации амидинов перфтормоно-и перфтор- дикарбоновых кислот образуются термоустойчивые эластомеры. Соли полностью фторированных карбоновых кислот и алкилсульфонатыф-кислот с недавних пор стали применять как поверхностноактивные вещества. Помимо высокой активности, проявляющейся уже при меньшем, чем у углеводородных аналогов, числе углеродных атомов в основной цепи, эти соединения отличаются стойкостью к окислению. Это позволяет применять их в условиях, в которых другие детергенты разрушаются. Например, применение перфторалкилсульфоната СГз — (СРя)з — СРз — БОгСЖа дает возможность снизить потери хрома в электролитических ваннах с 10 до 2%.
ФТОРОПЛАСТЫ
Получение фторопластов и их свойства
Большинство термопластичных высокомолекулярных полимеров, используемых для производства пластических масс, получают полимеризацией этилена, его гомологов и производных. Широкое практическое применение в промышленности получили карбоцепные полимеры — полиэтилен, полипропилен, поливинилхлорид, полистирол, полимеры производных акриловых кислот, поливинил- ацетали и др. Последние 15—20 лет получены и все шире используются полимеры на основе фторированных олефи - нов.
Значительная часть обычных карбоцепных полимеров имеет сравнительно невысокую температуру размягчения и часто весьма ограниченную химическую стойкость. Так называемые изотактические полимеры, например изотактические полипропилен, полистирол, плавятся при более высокой температуре, чем обычные полипропилен и полистирол. Однако фторсодержащие полимеры намного превосходят их устойчивость в этом отношении, что в сочетании с другими ценными свойствами делает их незаменимыми материалами. Наряду с химической и термической устойчивостью они характеризуются более высоким удельным весом, низкой влагопо - глощаемостью, отличными изоляционными свойствами. Очень часто эти полимеры пригодны тогда, когда все другие пластики не могут объединить в себе требуемого комплекса свойств. Изделия из них находят применение в химической, электротехнической, авиационной, атомной и других отраслях промышленности.
В последнее время широко рассматривается вопрос об использовании фторуглеродов в области ракетной тех -
Ликй. При выборе конструктивных материалов для ракетных устройств должны учитываться высокая температура и необыкновенно сильное корродирующее действие химических веществ, входящих в состав ракетного топлива или служащих инициаторами горения. Еще более жест кие требования предъявляются к электроизоляционным и смазочным материалам, защитным покрытиям, материалам для трубопроводов, диафрагм и т. д. Многие требования ракетной техники могут удовлетворить только материалы, созданные на основе фторированных соединений.
О важной роли фторполимеров в авиации свидетельствует замечание авторов обзора по фторсодержащим соединениям Банкса и Хасцельдина: «Современные самолеты и управляемые снаряды, — пишут они, — были бы немыслимы без применения фторполимеров. На каждый новый самолет типа «Дуглас ДС-8» расходуется около 13 кг фторсодержащих полимеров».
Ценные свойства фторопластов связаны с особыми химическими свойствами фторуглеродов. Как уже говорилось, в отличие от других галоидов фтор обладает атомным радиусом, соответствующим половине межатомного расстояния углерод-углеродной связи. Благодаря этому обеспечивается экранирование С—С связей в полимере. Высокая энергия связи С—Г определяет химическую инертность этих соединений. По образному выражению Саймонса, фторполимеры обладают алмазным сердцем и шкурой носорога.
Полимеры с низким содержанием фтора, например полимеры фтористого винила и фторозамещенных стиро - лов, по термической прочности и химической устойчивости мало отличаются от полимеров, не содержащих фтор. Однако они могут быть использованы в некоторых специальных случаях. Перспективы использования полимеров с высоким содержанием фтора более широки, так как эти материалы обладают широким диапазоном физических и химических свойств, которых по самой своей природе лишены углеводородные полимеры.
Наибольшей склонностью к полимеризации обладают тетрафторэтилен и трифторхлорэтилен. В связи с тем, что полимеры этих фторолефинов представляют чрезвычайно цепные в техническом отношении материалы, полимеризация их изучена наиболее подробно. Винилиденфторид
И трифторэтилеп полимеризуются в более жестких уело - ряях. Перфторпропилен и перфторизобутилен обладают егце меньшей способностью к полимеризации; даже применение катализаторов, высоких давлений и температур не приводит к образованию из них полимеров, и в настоящее время не имеется надежных способов их полимеризации. Однако уже известно, что перфторпропилен сравнительно легко сополимеризуется с этиленом, винилиденфторидом, винилацетатом и виниловыми эфирами. Содержание фторированного мономера в образующихся полимерах достигает 50%.
Важнейший из фторполимеров — политетрафторэтилен. Его производство превышает 90% мирового (без СССР) производства фторполимеров, которое в 1957 г. составило 5000 т. Прочное положение в промышленности завоевал также политрифторхлорэтилен. В настоящее время в больших масштабах выпускаются фторкаучуки на основе сополимеров трифторхлорэтилена и винилиденфторида, гексафторпропилена и винилиденфторида.
Учитывая быстрое развитие химии фтора и его соединений и растущую потребность в специальных материалах для современной техники следует предвидеть расширение областей применепия и создание новых более экономичных способов изготовленпя существующих и вновь разрабатываемых фторсодержащих материалов. Политетрафторэтилен (фторпласт-4). Этот полимер - продукт полимеризации тетрафторэтилена. Промышленный способ получения последнего основан на взаимодействии хлороформа с фтористым водородом в присутствии трех - и пятихлористой сурьмы
СНС13 + 2НЕ - СНР2С1 + 2НС1.
При нагревании дифторхлорметан распадается с образованием радикалов, в результате рекомбинации которых образуется тетрафторэтилен
2СНК2С1 С0°~100> 2СР2- СР2 =
—НС1
Тетрафторэтилен — газообразное нетоксичное вещество без цвета и запаха; т. кип.—76,3°, т. замерз. —142,5°, критическая температура +33,3°, критическое давление 37,8 атм. Удельный вес жидкого тетрафторэтилена при т. кип. 1,519
Тетрафторэтилен сравнительно легко полимеризуется по радикальному механизму в присутствии перекисных катализаторов при повышенной температуре и умеренном давлении с образованием полимера высокого молекулярного веса. Содержание кислорода в исходном мономере не должно превышать 0,002% во избежание преждевременной полимеризации и взрыва.
Полимеризация тетрафторэтилена была открыта случайно в 1938 г. Из баллона с тетрафторэтиленом внезапно прекратилась подача газа. Когда баллон вскрыли, обнаружилось, что он заполнен белым порошком, оказавшимся политетрафторэтиленом.
Полимеризация тетрафторэтилена сопровождается выделением тепла в количестве 25—30 ккал на 1 моль мономера. Этого тепла достаточно для разложения мономера на углерод и тетрафторметан. И действительно, при большой скорости полимеризации наблюдается деструкция не только полимера, но и мономера. Иногда это явление сопровождается взрывом, так как при разложении мономера давление в реакторе увеличивается, а это в свою очередь повышает скорость реакции. Для получения качественного полимера необходимо строгое регулирование температурного режима полимеризации.
Тетрафторэтилен сравнительно быстро полимеризуется при хранении. В этом случае инициатором полимеризации служит кислород воздуха или следы перекисей. В качестве ингибиторов самопроизвольной полимеризации применяют вещества с сульфгидрильной группой (сероводород, бутилмеркаптан), а также аммиак и амины. Например, 0,5% бутилмеркаптана ингибирует полимеризацию тетрафторэтилена, находящегося под давлением в течение нескольких месяцев. Для повышения безопасности хранения к мономеру иногда добавляют в качестве ингибитора полимеризации пинен или метил - стиролы С6НбС (СН3) = СН2, СН3С6Н4С(СН3) = СН2 в количестве 0,01 —5 %.
Наиболее распространенные способы получения политетрафторэтилена — блочная и водно-эмульсионная полимеризация при температуре 20—200° и давлении 10 — 200 ат и выше в зависимости от способа полимеризации и активности катализатора. В качестве последнего используют персульфаты щелочных металлов, перекись водорода, органические перекиси.
Полимеризация тетрафторэтилена протекает в водном* растворе, содержащем около 0,1 % катализатора. Перед введением мономера в реактор из последнего полностью удаляют воздух. Раствор мономера перемешивают и нагревают до 80°. Первоначальное саморазвивающееся давление в реакторе постепенно падает по мере уменьшения количества мономера; полимеризация обычно заканчивается в течение часа. Степень полимеризации регулируется по шкале относительного удельного веса. Для этого через определенные промежутки времени отбирают пробы реакционной смеси и измеряют удельный вес полимера в строго определенных условиях спекания и охлаждения-
Определение молекулярного веса основано на зависимости удельного веса полимера от его кристалличности, которая в свою очередь зависит от упорядоченности структуры полимера при переходе из расплава в твердое состояние. Упорядоченность структуры находится в обратной зависимости от внутренней вязкости цепей полимера, а последняя обусловлена, в конечной степени, его молекулярным весом.
Средний молекулярный вес промышленных образцов политетрафторэтилена колеблется в пределах 389 ООО— 890 ООО.
Имеются сведения о политетрафторэтилене с молекулярным весом более миллиона.
Вопрос о концевых группах в молекулах политетрафторэтилена нельзя считать окончательно решенным. Наиболее интересные данные приведены в работе Бро и Сперати (1951), которые, полимеризуя тетрафторэтилен в присутствии радиоактивного персульфата калия, вместо ожидаемого радиоактивного полимера, образующегося вследствие соединения концевых групп полимера с радиоактивной серой, получили нерадиоактивный полимер. Этому факту дано следующее объяснение. Инициирующие частицы, получающиеся при деструкции персульфата, представляют собой ион-радикалы, которые вызывают полимеризацию, образуя с политетрафторэтиленом эфиры серной кислоты. Эфиры немедленно гидролизуются водой с образованием конечных карбоксильных групп. При взаимодействии сульфатных ион-радикалов с водой возникают гидроксильные радикалы, которые также могут инициировать полимеризацию. Образующийся при этом
Перфорированный спирт немедленно гидролизуется до соответствующей кислоты
2 СЕ2СЕ2ОН ]----------
|
— СР2 — СЕа — ОБОз — |
II I *
— СР2 - С - ОБОз] -
Нго
/
_* _ ср2 - с
Наличие карбоксильной группы на концах молекул полимера было доказано титрованием водно-спиртовых эмульсий полимера и исследованием инфракрасных спектров.
В патентной литературе описывается полимеризация тетрафторэтилена при 55—70° и 50 ат в присутствии перекисей двухосновных кислот (0,1—0,4%) с образованием устойчивой дисперсии, содержащей 5% полимера; размер частиц 0,1—0,3 микрона. Дисперсия стабильна при комнатной температуре примерно в течение недели; при более длительном хранении применяются стабилизаторы. Качество дисперсий во многом зависит от смачивающего агента. Смачивающими агентами обычно служат производные алкилфенолов, добавляемые в количестве около 6% веса фторопласта. Наиболее важными характеристиками дисперсий являются процентное содержание твердого вещества, диаметр частиц, удельный вес, влажность и кислотность. Удельный вес или вязкость можно изменять добавлением воды или других разбавителей.
В дисперсии полимера можно вводить наполнители — графит, уголь, асбест и другие инертные вещества, не снижающие химической стойкости фторопласта; количество наполнителя может достигать 50—80%. При этом получаются порошки более высокого качества, чем при механическом смешении полимера с наполнителем, так как при смешивании в жидкой фазе достигается более теснее соединение частиц полимера и наполнителя.
Одна из наиболее серьезных проблем технологии фторопластов — чистота исходных мономеров и устранение возможности загрязнения продукта в процессе полимеризации или переработки. Наличие загрязнений зачастую понижает стойкость полимеров.
Производство политетрафторэтилена организовано пока в немногих странах. Его вырабатывают в СССР (фто - ропласт-4), США (тефлон), Англии (флюон), Италии (ал - гофлон), ФРГ (гостафлон) и Франции (серафлон или гаф - лон).
В Советском Союзе, кроме того, выпускается фторо - пласт-4Д — модификация полимера, обладающая несколько меньшим молекулярным весом и высокой дисперсностью; частицы фторопласта-4Д имеют форму шариков диаметром около 1 микрона. В результате водно-эмульсионной полимеризации образуется нестойкая водная дисперсия фторопласта-4Д, которую коагулируют для получения порошка, идущего на изготовление смазочных паст, или концентрируют в присутствии поверхностноактивных веществ или органических растворителей (для предотвращения коагуляции) до состояния суспензии, содержащей 50—60% полимера и 10% детергента. Чтобы частички порошкообразного полимера имели одинаковый размер, свежеприготовленную суспензию коагулируют в строго контролируемых условиях в присутствии электролитных органических растворителей или механическим перемешиванием. Изменяя условия перемешивания (форму и число оборотов мешалки, продолжительность перемешивания), можно регулировать средний размер частиц порошка. Рыхлый сыпучий порошок фтороплас - та-4Д предназначается для изготовления профильных изделий.
Политетрафторэтилен относится к классу термопластических смол: его физическое состояние обратимо изменяется при изменении температуры. Переход из твердого состояния в пластическое, постепенный у других термопластов, совершается у фторопласта-4 при 327° скачкообразно.
Политетрафторэтилен — высококристаллический, способный к ориентации полимер. Его молекулы характеризуются регулярным строением, отсутствием разветвлений и незначительным количеством поперечных связей
TOC o "1-5" h z р г г г
І І І I
-с —с —с —с-
І! I
Вследствие симметричного расположения электроотрицательных атомов фтора макромолекула полимера не имеет неуравновешенных диполей и ее суммарный дниоль - ный момент равен нулю. Полимер является насыщенным неполярным веществом. Симметричное строение его макромолекул, аналогичное строению молекул полиэтилена, обусловливает кристаллическое строение полимера.
Кристаллические полимеры обладают рядом специфических свойств, отсутствующих у аморфных полимеров. Строение полимерных кристаллов существенно отличается от строения обычных кристаллов низкомолекулярных веществ. Цепная макромолекула полимера, состоящая из чередующихся групп атомов, пе может целиком вместиться в решетку кристалла, так как для этого она слишком длинна. Вследствие этого в массе изогнутых и перепутанных полимерных цепей только отдельные участки правильно ориентированных цепей, называемые кристаллитами (рис. 13), обладают упорядоченной структурой. Кристаллиты связаны между собой аморфными участками, в которых цепные молекулы располагаются неупорядоченно.
Политетрафторэтилен кристаллизуется с образованием двух различных форм кристаллитов; переход из одной формы в другую происходит при 16—19°. У обеих форм цепи располагаются спирально. В элементарной ячейке формы, стабильной при высокой температуре, содержится 15 групп С¥я, а в ячейке формы, стабильной
|
|
При низкой температуре, 13 групп.
|
Рис. 14. Зависимость плотности фторопласта-4 от содержания кристаллической фазы |
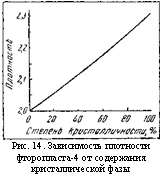 !Зторая форма отличается от первой большей плотностью.
!Зторая форма отличается от первой большей плотностью.
Расчетная плотность кристаллической фазы политетрафторэтилена 2,31. При помощи инфракрасной спектроскопии была установлена зависимость между плотностью полимера и степенью его кристалличности (рис. 14). Данные о плотности фторопласта-4 указывают на его высокую кристалличность, достигающую 93,97% (при плотности 2,296).
Физические свойства политетрафторэтилена определяются в основном молекулярным весом, степенью кристалличности и микропористостью. Например, жесткость является функцией кристалличности и не зависит от молекулярного веса. Прочность при многократных изгибах зависит и от кристалличности, и от молекулярного веса. Электрическая прочность зависит от микропористости. Сочетание каучукоподобной аморфной фазы с высокоплавкой кристаллической фазой объясняет малую твердость, чрезвычайно низкую температуру хрупкости, гибкость и некоторую эластичность при растяжении фторопласта-4. Механическая прочность фторопласта-4 также зависит от степени ориентации. В неориентированном состоянии предел прочности при растяжении в 7 —8 раз меньше, чем в ориентированном или растянутом. На следующей странице приведены свойства и техническая характеристика фторопласта-4.
При нагревании выше точки перехода фторопласт-4 плавится. При этом вся его масса становится аморфной и непрозрачной, но до 415° не переходит из высокоэластичного состояния в вязкотекучее. Выше этой температуры начинается разложение полимера. Таким образом, ни при какой температуре фторопласт-4 не становится текучим. Этим объясняется то, что его нельзя перерабатывать способами, применяемыми для обычных пластмасс.
Вначале эта особенность фторопласта объяснялась наличием в нем поперечных связей. Теперь считают, что необычайно высокая вязкость полимера связана со стериче - скими затруднениями, а также с его очень высоким молекулярным весом.
Удельный вес, кг/'см3....................................................................... 2,1—2,3
Температура плавления кристаллитов, °С. . 327
Температура стеклования аморфных участков, °С............. 120
Предел прочности при растяжении, кг/см2:
Незакаленные образцы............................................................ 140—250
Закаленные образцы............................................................... 160—315
Относительное удлинение при разрыве, % . 250—400
Предел прочности при сжатии, кг/см2:
TOC o "1-5" h z неориентированные пленки.................................... 140
Ориентированные » 1200
Твердость по Бринеллю, кг! см2...................................... 3—4
Удельная ударная вязкость, кг-см/сль1 . . . 100
Теплостойкость при низкой нагрузЕ^е, °С. . 130
Коэффициент расширения (25—60°)................................ 5,5-Ю"5
Водостойкость (привес за 24 часа), % . . . 0,00
Теплопроводность, кал} см-сек, °С-10-4 . . . 5,9—6,0
Удельная теплоемкость, кал'г-°С.................................... 0,25
Коэффициент преломления............................................. 1,37—1,38
Коэффициент трения по стали......................................... 0,2—0,3
Диэлектрическая постоянная при 60—109 гц 1,9—2,2
Удельное объемное сопротивление, ом-см. . 1016—1017
Удельное поверхностпое сопротивление, ом. (1*4—2,7)-1015
Электрическая прочность ири толщине 4 мм,
Ке! мм................................................................. 25—27
Тангенс угла диэлектрических потерь при
60—108 гц........................................................... 2.10“4—2,5* 10~4
Дугостойкость, сек........................................................ 250
При охлаждении после нагревания выше точки перехода (327°) фторопласт-4 кристаллизуется: наибольшая скорость кристаллизации наблюдается при 315°. Быстрое охлаждение полимера от 327 до 250° приводит к так называемой закалке. Закаленный образец характеризуется малым содержанием кристаллической фазы и, вероятно, мелкокристалличностью. Он малоустойчив и, постепенно твердея, переходит в кристаллическое состояние. Этот переход ускоряется с повышением температуры. При кристаллизации удельный вес фторопласта увеличивается, что обусловливает усадку образцов.
Температура стеклования аморфной фазы лежит около—120°, однако фторопласт-4 не становится хрупким, даже при температуре жидкого гелия (—269,3°). Зависимость механических свойств незакаленного (1) и закаленного (2) образцов фторопласта-4 от температуры показана в табл. 25.
Таблица 25
|
Температура °С |
Модуль упругости при сжатии, к<з/сл*2 (образец 1) |
Модуль упругости на изгибе, кг'см* (образец 2) |
Модуль упругости на изгибе, кг/см* (образец 1) |
Предел прочности при растяжении, кг/см2 (образец 2) |
Относительное удлинение при разрыве, % |
|
|
Образец 1 |
Образец 2 |
|||||
|
—60 |
18 000 |
13 200 |
27 800 |
|||
|
—40 |
17 000 |
И 300 |
23 900 |
500 |
350 |
100 |
|
—20 |
15 000 |
9800 |
23 300 |
440 |
325 |
160 |
|
0 |
И 000 |
7400 |
18 100 |
330 |
300 |
190 |
|
+20 |
7000 |
4700 |
8500 |
250 |
200 |
400 |
|
+40 |
4500 |
4000 |
5100 |
240 |
180 |
500 |
|
+60 |
3300 |
2900 |
4800 |
— |
— |
— |
|
+80 |
2400 |
2180 |
3800 |
200 |
135 |
500 |
|
+100 |
1700 |
— |
— |
190 |
115 |
480 |
|
+120 |
— |
1100 |
2450 |
— |
— |
— |
Тонкие пленки полимера свободно пропускают видимый свет, ультрафиолетовые лучи с длиной волн 2000 — 4000 А и инфракрасные с длиной волн 2—7,5 микрон.
Фторопласт-4 не изменяется при хранении на открытом воздухе. Опытный образец, хранившийся в течение семи лет в таких условиях, совершенно не изменился. Гранулированный полимер устойчив также к высокой температуре, что видно из данных табл. 26.
Таблица 26
|
Температура, °С |
Потеря веса, %/час |
Температура, °С |
Потеря веса, %/час |
|
204 |
0,0002 |
360 |
0,0001 |
|
260 |
0,0002 |
390 |
0,006 |
|
316 |
0,0002 |
420 |
0,090 |
Политетрафторэтилен относится к полимерам, которые деструктируются при радиоактивном облучении. Соотношение между количеством (х) выделяющегося при облучении фтора и суммарной дозой облучения (у) составляет х = 3,73 • 10'7 • у рентген.
Однако электрические свойства фторполимера при облучении изменяются в меньшей степени, чем свойства полимеров стирола и этилена. Полная деструкция фторопласта происходит при длительном облучении большой дозой 'у-лучей (более 10 млн. рентген). При этом наблюдается существенное отличие фторопластов от других пластиков, которые при длительном радиоактивном облучении увеличивают молекулярный вес вследствие сшивки отдельных молекул полимера вновь образующимися поперечными связями. Деструкция политетрафторэтилена обусловлена разрывом наиболее слабых в его молекуле углерод-углеродных связей, в то время как для образования поперечных связей необходим разрыв более прочных фтор-углеродных связей. Кроме того, атомы фтора создают стерические препятствия рекомбинации радикалов, которая могла бы привести к сшиванию макромолекул.
Как уже упоминалось, фторопласт-4 отличается исключительной химической инертностью. Он взаимодействует только с расплавленным натрием (при высокой температуре), элементарным фтором и трехфтористым хлором. Фторопласт-4 испытывали во многих кипящих растворителях, включая галоидированные углеводороды, кетоны, эфиры, спирты; при этом не наблюдалось ни набухания, ни изменения веса. Полимер не изменяет свойств и при кипячении в царской водке и фтористоводородной кислоте; он также стоек к действию щелочей любой концентрации и галоидов. Только недавно было найдено, что высококипящие фторуглероды растворяют полимер при температуре более низкой, чем температура плавления его кристаллической фазы.
Помимо химической инертности, фторопласт-4 характеризуется весьма малой проницаемостью (в случае достаточно плотного покрытия из фторопласта скорость проникновения многих жидких и газообразных веществ через него настолько мала, что ее можно не принимать во внимание), отличными электрическими и механическими свойствами, низким коэффициентом трения, прак-
Тически полной гидрофобностью и, к сожалению, очень слабой адгезией ко всем материалам.
Все эти качества приобретают особую ценность благодаря высокой термостойкости фторопласта-4, диэлектрические свойства которого не изменяются до 200°* а химические до 300°. Такое сочетание свойств делает фторопласт-4 весьма экономичным материалом, даже несмотря на его относительно высокую стоимость по сравнению с другими пластиками.
Физические свойства фторопласта-4, как и свойства полиэтилена, можно изменять в широких пределах, изменяя его молекулярную структуру и условия переработки. Если свойства полиэтилена определяются главным образом условиями полимеризации, то свойства политетрафторэтилена— условиями термической обработки. Полифторхлорэтилен (фторопласт-3). Способ получения трифторхлорэтилена основан на дехлорировании трифтор - трихлорэтана, илп фреона-113,
СЕ2С1 — СЕС12 — - СЕ2 = СЕС1 + ЗНС1.
Фреон-113 получают при обработке гексахлорэтана фтористым водородом в присутствии пятихлористой сурьмы
СС1з — СС1з СР2С1 - СРС12 + ЗНС1.
Трифторхлорэтилен представляет собой бесцветный газ, не обладающий запахом (т. кип. — 26,8°, т. замерз.— 157,9°). Удельный вес жидкого мономера около 1,48. Трифторхлорэтилен сравнительно легко полимеризуется при повышенной температуре и умеренном давлении в присутствии перекисных катализаторов. Под влиянием других инициаторов радикальных реакций, например облучения, образуется полихмер с более высоким молекулярнъш весом. При хранении газообразного мономера на свету часто наблюдается медленная самопроизвольная полимеризация. Основным промышленным способом получения политрифторхлорэтилена является водно-эмульсионная полимеризация в присутствии персульфата аммония или калия, а также перекиси бария или цинка. Описана полимеризация трифторхлорэтилена под влиянием ультрафиолетового света и длительного нагревания при 45°.
В результате полимеризации трифторхлорэтилена получается белый сыпучий порошок, состоящий из шариков
Полймера, слипающихся в агрегаты размером 10—15 микрон и более.
Как и фторопласт-4, политрифторхлорэтилен отличается высокой температурой размягчения, негорючестью, химической инертностью, ничтожным поглощением влаги, хорошими электрическими свойствами, стойкостью к низкой температуре. Он не реагирует с большинством кислот, растворителей и окисляющих агентов, естественно не смачивается водой и не набухает в ней. При хранении образца фторопласта в воде в течение нескольких тысяч часов не удается обнаружить изменений его веса.
Нерастворимость или плохая растворимость фторопласта-3 при низкой температуре связана с плотной укладкой цепных молекул полимера в кристаллах, что мешает проникновению молекул растворителя между цепями полимера. Растворение полимера осуществляется главным образом за счет его аморфной фазы. Некоторые растворители абсорбируются фторопластом-3. При этом происходит набухание образца, увеличивающегося с повышением температуры до определенного предела, после которого полимер остается неизменным. Например, карвон вызывает набухание фторопласта-3 при 130°, а при 165—170° образует из него мягкую гомогенную прозрачную массу. При воздействии при 160° терпинеола получается мягкая масса, способная формироваться в самые тонкие волокна уже прп 100°. Камфора образует при 175° 12%-ный раствор политрифторхлорэтилена, остающийся прозрачным и гомогенным до 162°. Данные о набухании фторопласта-3 в органических растворителях при 45° в течение 40 час. приведены в табл. 27. Высыхание набухших образцов по - литрифторэтилена протекает медленно; например, в течение 7 дней при 50° удаляется только 50% абсорбированного вещества.
По химической инертности и стойкости к высокой температуре политрифторхлорэтилен уступает только тетра - фторэтилену. По сравнению с фторопластом-4 он более тверд и обладает большей механической прочностью. Кроме того, он размягчается и плавится при 210°. Это дает возможность перерабатывать его в изделия методами прессования и литья под давлением. Последнее осуществляется при 250—300° и удельном давлении 500— 1000 кг/см2. Прессформы, нагретые до 130—150°, после заливки полимера быстро охлаждают до 100°. При этом
|
Таблица 27
|
Полимер превращается в аморфный материал, из которого получаются закаленные упругие и прозрачные изделия. Медленное охлаждение приводит к росту кристаллитов и сообщает полимеру совсем иные оптические и механические свойства.
При нагревании изделий выше 100° эффект закалки постепенно исчезает; изделия приобретают хрупкость и становятся мутными. Вследствие этого их не рекомендуется использовать при значительных механических нагрузках, если температура превышает 70°. При отсутствии механических напряжений фторопласт выдерживает 200°. При 300—315° он разлагается.
Точные данные о молекулярном весе фторопласта-3 еще не получены, что объясняется экспериментальными трудностями, возникающими вследствие его плохой растворимости. Фторопласт-3 растворяется в некоторых фторхлоруглеродах, терпенах и других веществах только при 100—120°, в то время как обычно молекулярный вес пластиков или их вязкость определяется при более низкой, температуре. Наиболее подходящий растворитель для оп-: ределения молекулярного веса фторопласта-3 — 1,1,3- трифторперхлорпропан. Молекулярный вес политрифтор - хлорэтилена, определенный с его помощью, 50 000— 100 000.
Фторопласт-3 — ценный диэлектрик для низких частот, так как его объемное электрическое сопротивление, электрическая прочность и дугостоцкооть очеш> велики.
Показатели модуля упругости, статической прочности ц линейной растяжимости фторопласта-3 превышают аналогичные показатели фторопласта-4. Свойства и техническая характеристика фторопласта-3 приведены ниже:
Удельный вес, кг/см3.................................................... 2,1—2,15
Температура плавления кристаллитов, °С. 208—210
Температура стеклования аморфных участков, °С............. 50
Предел прочности, кг/см2:
При растяжении.................................................... 350—400
При изгибе........................................................... 600—800
При сжатии........................................................... 500—570
TOC o "1-5" h z Относительное удлинение при разрыве, % . 40—70
Предел упругости, кг/см2 ............................................... 150—250
Модуль упругости при растяжении, кг/см2 . 15 000—18 000
Твердость по Бринеллю, кг/мм2...................................... 10—13
Удельная ударная вязкость, кг-см/слР. . . 20—160
Удельная теплоемкость, кал/г-'°С................................... 0,22
Теплопроводность, кал/см-сек, °С-10~4 . . . 1,44
Водостойкость (привес за 24 часа), % . . . 0,88
Коэффициент преломления............................................. 1,53
Удельное объемное сопротивление, ом-см. 1,2-1018
Электрическая прочность при толщине
2 мм, кв/мм........................................................ 13—15
Диэлектрическая постоянная при 103 щ. . 2,5—3,0
Тангенс угла диэлектрических потерь при
106 гц................................................................. 10"2—1,5* 10"2
Фторопласт-3 можно получать в виде неводных дисперсий типа латекса. Такие дисперсии используются для нанесения защитных покрытий на металлы с последующей сушкой и термической обработкой при 300—360°. Суспензии получают диспергированием полимера в смеси производных терпенов или камфоры, в смеси этилового спирта и ксилола, в чистом спирте. Фторопласта-3 в суспензии обычно содержится 22—23%.
Поливинил фторид. Фтористый винил был впервые синтезирован Свартсом еще в 1901 г. Однако полимер из него начали получать только полвека спустя (в 1947 г.) с помощью перекисиых катализаторов. Полимер привлек вни-
Мание своей способностью образовывать прозрачные, прочные, гпбкие пленки.
Фтористый винил синтезируют непосредственно пз ацетилена п фтористого водорода в присутствии ртутных солей. Он может быть получен также косвенпым путем пз тех же веществ через 1,1-дифторэтан с последующим его пиролизом до фтористого винила.
Фтористый впнил представляет собой бесцветный газ с т. кип. — 72,2°. Для получепия из него полимера высокого качества пеобходима тщательпая очпстка газа, что осуществляется перегонкой и пропусканием мономера через колонку с химическими поглотителями. Фтористый впнил, очищенный от кислорода, полимерпзуется в присутствии перекисп бепзоила и других перекиспых катализаторов при давлении около 300 am п 85—100°. Полимеризация осуществляется в автоклаве из пержавеющей стали в водном растворе, из которого предварительно удаляют растворенный кислород. Полимер имеет вид белой пудры. Его строение, вероятно, соответствует формуле
I TOC o "1-5" h z Н Н н III
I! I I
_Lg-g-g-g1
LII F H F Jn
Свежеприготовленный полимер промывают спиртом; в этом отнонгеппи продукт полпмеризации фтористого винила напоминает поливинилхлорид, который делается более устойчивым к нагреванию и свету после отмывания низкомолокулярных веществ.
Поливинилфторид обладает высокой химической стойкостью. Его используют для изготовления прочных, устойчивых к атмосферпым воздействиям пленок, тканей и покрытий. Плотность полимера около 1,4 г/см3, молекулярный вес колеблется в пределах 180 000—500 000. Некоторые свойства полимера можно модифицировать, изменяя режим полимеризации. Полимеры, полученные в присутствии перекиси бензоила, плавятся при 190—198°.
Поливинилфторид не растворим при 100—110е; прп более высокой температуре он растворяется в N-замещен - ных амидах, кетонах, нитрилах. Из таких растворов могут быть получены пленки, однако лучшим растворителем для этой цели является диметилформамид. Пленки ИЗ ПО - ливинилфторида отличаются прочностью при растяжении, упругостью, стойкостью к химическим реагентами полной прозрачностью.
Полимеры фтористого винила, полученные в органических растворителях, обладают меньшим молекулярным весом и вследствие этого лучше растворимы.
Пластификаторами поливинилфторида служат дибу - тилфталат и трикризилфосфат; их добавляют к полимеру в количестве 10—15%. Введение такого количества пластификатора понижает температуру размягчения полимера.
Для получения пленок и брусков, обладающих максимальной прочностью к удару, поливинилфторид перерабатывают методом литья под давлением при температуре выше 200°. Пластифицированные полимеры фтористого винила можно перерабатывать методом экструзии.
П о дивинил иденфторид. Недавно появился новый пластический материал, полученный из винилиденфторида СГа — = СН-2. Поливинилиденфторид обладает свойствами термопластичной смолы, и изделия из него можно изготовлять на обычном оборудовании. Полимер плавится при более низкой температуре, чем фторопласт-4 и фторопласт-3; в течение длительного времени он устойчив при 150° и около 16 час.— при 260°. Скорость термического разложения при температуре выше 250° увеличивается в присутствии двуокиси кремния. Медь, алюминий и железо не оказывают каталитического действия на деструкцию полимера. По сравнению с фторопластом-3 поливинилиденфторид химически менее устойчив: он разлагается дымящей серной кислотой и бутиламином, растворяется в полярных растворителях — диметилсульфоксиде, диметил ацетамиде. Поливинилиденфторид устойчив к действию ультрафиолетовых лучей и обладает атмосфероустойчив остью.
Тефлон-100. Весьма перспективным представляется новый материал — сополимер тетрафторэтилена с гекса - фторпропилепом, так называемый тефлон-1 ООх (т. пл. 285—295°)
Расплав сополимера обладает достаточно низкой вязкостью, благодаря чему его можно перерабатывать в изделия более обычными способами, чем фторопласт-4. По имеющимся данным, он почти так же химически инертен, как и фторопласт-4, но несколько уступает ему по электроизоляционным свойствам. Однако его можно использовать для получения пленок, сохраняющих при 200° электроизоляционные свойства. Кроме того, по-видимому, он окажется хорошим футеровочным материалом для химической аппаратуры.
•
Полимеризация под действием радиоактивных излучений
В последние годы была показана возможность радиационной полимеризации фторолефинов.
Под действием радиоактивного излучения удается по- лимеризовать не только тетрафторэтилен и трифторхлор - этилен, но и такие трудно полимеризующиеся фтороле - фины, как перфторпропилен, перфторбутадиен, перфтор- акрилонитрил.
Несмотря на малый выход и низкие молекулярные веса продуктов полимеризации, имеющийся опыт позволяет надеяться, что ионизирующее излучение поможет осуществлению полимеризации при низкой температуре и без участия инициирующих веществ, загрязняющих полимеры. Кроме того, некоторые перфорированные алкены и диены полимеризуются только под действием радиации. Однако при этом требуются очень высокие дозы облучения, а получающиеся полимеры состоят из коротких цепей с большим числом поперечных связей. Полимеризация, под одновременным влиянием радиации и давления, приводит к образованию более совершенных продуктов. Дозы облучения, необходимые для полимеризации некоторых фторолефинов, приведены в табл. 28.
В результате облучения перфторпропилена образуются высококипящие вещества, соответствующие три - или тетрамерам этого олефина. Перфторбутадиен превращается в мягкий вязкий материал, представляющий собой смесь димера и твердого полимера, частично растворимую в кислородсодержащих растворителях. Перфторакрило - нитрил образует твердый низкомолекулярный продукт, растворяющийся в ацетоне, этил ацетате и др.
|
Таблица 28
|
Естественно, что полимеры, легко образующиеся обычными способами, не требуют высоких доз облучения при радиационной полимеризации.
Описана блочная полимеризация трифторхлорэтилена под действием у-излучения кобальта 60 различной интенсивности. Высокий выход продукта достигается при суммарной дозе в несколько миллионов рентген. Интересно, что с увеличением мощности дозы облучения (с 10 до 300 рентген/сек) наблюдается снижение температуры плавления кристаллической фазы полимера с 210 до 185°.
Тетрафторэтилен полимеризуется при еще более низкой дозе облучения (104 рентген); вероятно, это позволит в ближайшее время создать промышленное производство его на основе радиационного способа.
Винилиденфторид также легко поддается радиационной полимеризации; при суммарной дозе 24-10° рентген мономер полностью превращается в полимер.
Недавно показана возможность радиационной сополи - меризации трифторхлорэтилена с различными полностью и частично фторированными олефинами, а также с окисью этилена. Оказалось, что под действием ^"излУт^ния три - фторхлорэтилен сравнительно легко сополимеризуется с тетрафторэтиленом, перфторпропиленом и винилиден - фторидом. Условия последней сополимеризации и выход сополимера приведены в табл. 29.
Сополимер представляет собой прозрачное бесцветное вещество, обладающее свойствами каучука. Он не растворяется в спиртах, не набухает в маслах и стоек к азотной кислоте; растворим в сложных эфирах и ацетоне.
В аналогичных условиях получены сополимеры трифторхлорэтилена с тетрафторэтиленом и с перфторпропи*
|
Таблица 29
|
Леном. В первом случае сополимеризация протекает гораздо легче, чем во втором: чтобы получить 100%-ный выход первого сополимера требуется суммарная доза 2,5 • 106 рентген; 43%-ный выход второго достигается при суммарной дозе 52-106 рентген.
Радиационная полимеризация фторолефинов находится в первоначальной стадии развития, но она весьма перспективна, так как имеет серьезные преимущества. Отпадает необходимость в применении инициаторов и высокой температуры, что обеспечивает чистоту конечных продуктов. Полимеризации можно подвергать твердые мономеры, а также мономеры, не полимеризующиеся в обычных условиях.
В последние годы на основе радиоактивного облучения были разработаны методы получения привитых сополимеров политетрафторэтилена. К его пленкам с помощью облучения у‘лучами были привиты акрилонитрил, стирол, винилпироллидон и другие виниловые мономеры. В первых работах прививка ограничивалась внешней зоной пленок, в последующих описывается прививка по всей массе полимера. Опыты проводились с промышленными образцами пленок толщиной около 0,1 мм; радиоактивным источником служил кобальт-60. Степень облучения при комнатной температуре в зависимости от дозы и продолжительности колебалась в пределах 51,5—22 ООО рентген/ час. В некоторых случаях прививаемый мономер предварительно растворяли в бензоле.
Акронитрил и метилметакрилат прививаются только на поверхности пленки из политетерафторэтилена. В случае метилметакрилата удавалось даже отделить пленку привитого полимера от пленки основного. Интересно, что
5
|
129 |
![]() И. Л. Кнунянц и А. В. Фокин
И. Л. Кнунянц и А. В. Фокин
при этом свойства поверхности фторопластовой пленки (в частности, смачиваемость органическими растворителями) изменяются. При небольшой интенсивности облучения пленки из фторопласта увеличиваются в объеме без изменения основных геометрических форм даже при высокой степени прививки. При десятикратном увеличении веса (степень прививки выше 10) пленки деформируются.
При одинаковой продолжительности облучения степень прививки тем выше, чем ниже интенсивность облучения. Так, при интенсивности облучения 350 рентген/час в течение 24 час. вес пленки увеличивается в два раза, а при 22 000 рентген/час — всего на 24%.
В результате изучения кинетики прививки установлено, что сначала, когда поверхность пленки полимера не нарушена и мономер не может проникнуть в глубину пленки, слой привитого полимера образуется только на ее поверхности. Затем начинается набухание сополимера в мономере, в результате чего последний диффундирует в более глубокие слои, в каждом из которых продолжается прививка мономера. Процесс идет с прогрессивно нарастающей скоростью, последовательно захватывая слой за слоем. Если скорость полимеризации меньше скорости диффузии мономера и его количества достаточно для поддержания реакции, прививка будет протекать гомогенно по всей массе пленки. Если же мономер успеет по - лимеризоваться до проникновения через привитой слой, прививка на внутренних слоях пленки не происходит и на поверхности полимера образуется слой гомополимера. Уменьшение интенсивности облучения ослабляет полимеризацию и, следовательно, ускоряет прививку в глубине фторопласта. Однако полимеризацию можно замедлить и без изменения интенсивности облучения, а значит, и скорости диффузии. Для этого надо растворить мономер в веществе (например, бензоле), которое диффундирует медленнее или так же, как и полимер. На основе полученных данных удалось осуществить прививку метилмета - крилата на всю глубину образца фторопласта.
Другой метод прививки, способствующий диффузии мономера через привитую зону, заключается в периодическом прекращении облучения; в интервалах облучения происходит только диффузия. При таком методе степень прививки стирола на политетрафторэтилен значительно выше, чем при непрерывном облучении той же интенсив
Ности. Это наблюдение свидетельствует о том, что прививка не прекращается во время интервалов облучения.
Интересные продукты получены при прививке стирола к фторопласту. Пленки, содержащие 20—70% стирола, представляют собой однородную массу, более светлую и плотную, чем непривитая масса фторопласта. При нагревании до 150° материал размягчается и переходит в пластический полимер. При большей степени прививки сополимер становится прозрачным. Материал, содержащий более 97% стирола, дробится на небольшие прозрачные зерна, способные абсорбировать бензол в количестве, во много раз превышающем собственный вес.
Привитые сополимеры выдерживают значительное давление, обладают механической прочностью и высоким сопротивлением на разрыв. Они еще недостаточно изучены, но уже сейчас им можно дать высокую оценку и предсказать их широкое использование.
По-видимому, особенно интересны материалы, содержащие 30—50% фторопласта, так как они в значительной степени сохраняют свойства исходного фторопласта, но вместе с тем перерабатывать их в изделия (пленки или покрытия) гораздо легче, чем политетрафторэтилен. Изучение особенностей таких соединений даст ценные сведения о структурах, в которых длинные цепи —углеводородные и фторуглеводородные — связаны химически.
Установлено, что в политетрафторэтилене под влиянием радиоактивного облучения происходит разрыв С — Г связей и образуются весьма устойчивые радикалы типа —СР2 — СЯ?—С¥2—, способные при взаимодействии с кислородом переходить в не менее устойчивые перекис - ные радикалы. Концентрация радикалов, изменяющаяся в зависимости от параметров процесса, измеряется методом электронного парамагнитного резонанса. К подобному роду радикалов и прививаются виниловые мономеры.
Для создания материалов, сочетающих радиационную устойчивость со стойкостью к тепловому старению, облучению подвергали термостойкие полимеры — полисили - коновые, уретанизоцианатные и фторэластомеры. Наиболее стойкими к действию ионизирующих облучений оказались полиуретаны, наименее стойкими — фторполимеры. Под действием облучения во фторопластах развивается интенсивно идущее структурирование: при дозах
5 • 107 —108 рентген полимеры становятся жесткими и не
Выдерживают динамических нагрузок* Особенно слабыми по отношению к действию ^-лучей оказались полимеры хлортрифторэтилена типа кель-Ф. Витон-А (сополимер винилиденфторида с перфторпропиленом) по устойчивости напоминает полисилоксаны.
•
Применение и обработка фторопластов
Наиболее широкое применение фторопласт-4 находит в химической и электротехнической промышленности, т. е. там, где требуется химическая и термическая стойкость в сочетании с высокими диэлектрическими показателями. Его используют для изготовления изделий, подвергающихся действию кислот, щелочей, активных растворителей любой концентрации в диапазоне температур от—195 до +250°. Ассортимент изделий из фторопласта-4 весьма широк: детали химической аппаратуры (рис. 15), работающей в этих условиях, емкости и реакторы, мембраны и диафрагмы (рис. 16), насосы и фильтры, клапаны и трубопроводы, прокладки и уплотнительные устройства, подшипники (рис. 17), набивка насосов и вентилей, вставки аккумуляторных баков. Во всех этих случаях применение любых других пластиков не дает удовлетворительных результатов.
Для характеристики устойчивости фторопласта-4 к высокой температуре можно привести следующий пример: при 200° изделие из него деформируется только на 22%, и эта деформация не изменяется в течение 200 суток.
Изделия изготовляют из чистого полимера, а также из его смесей с различными компонентами. Всякий материал, выдерживающий температуру эксплуатации фторопла - ста-4, пригоден в качестве добавки. Это условие исключает возможность использования большинства органических веществ, но не препятствует применению неорганических термостойких материалов, например медного порошка, стеклянной ваты, графита, глины, талька, фтористого калия. Естественно, выбор того или иного компонента обусловлен назначением изделия. При введении добавок повышается стойкость к истиранию, жесткость, прочность на сжатие, уменьшается деформирование при нагрузке. При этом большинство ценных качеств фторопласта остается без изменения. Таким образом, введение добавок значительно расширяет применение фторопластов.
|
|
Низкий коэффициент теплопроводности фторопласта-4 позволяет изготовлять из него вращающиеся детали с невысокой периферической скоростью. Изучается возможность применения его для рассеяния тепла, возникающего при трении на больших скоростях.
Коэффициент трения полимера, по сравнению с другими материалами, относится к числу самых низких. Графитированный фторопласт марки ФУ2-3 имеет еще более низкий коэффициент трения; он изнашивается в несколько раз медленнее, чем фторопласт-4, в то время как другие его свойства ничем не отличаются от свойств чистого полимера.
Тонкостенные трубки из фторопласта-4 служат внутренней облицовкой гибких шлангов высокого давления, используемых для перекачки газов и жидкостей в широком диапазоне температур. Его применяют для изготовления штампов, цилиндров, покрытий лабораторных столов, конвейерных лент и т. д.
В настоящее время усовершенствуются способы нанесения фторопластовых покрытий на металлические,
133
Стеклянные и другие поверхности. В некоторых случаях полимер наносится в виде водной дисперсии, однако при этом большие затруднения вызывает слабая адгезия полимера. Нет сомнений, что они будут преодолены, так как уже удается получать прочные покрытия на стали, железе, меди, алюминии; плохие покрытия получаются на металлах, осажденных гальваническим путем на цинке, кадмии и других легких металлах. Весьма интересны фторопластовые покрытия на стекле, матированном наждаком.
Фторопласт-4 может служить для защиты нагреваемых металлических пластин при наложении швов, например на оболочки из термопластов (полиэтилена, полихлорвинила и др.).
|
Рис. 16. Диафрагма изолятора |
 Недостатком фторопласта-4 является его хладотеку - честь, увеличивающаяся с повышением давления. При удельных нагрузках 30—50 кг! см21 появляется заметная остаточная деформация, а при 200—250 кг! см2 материал переходит в область регулярного течения. Поэтому изделия из фторопласта-4, работающие при 80—100°, не следует нагружать свыше 30 кг! см2 из-за опасности остаточной деформации. Хладотекучесть полимера используется при изготовлении пленок на вальцах и труб на штанг - прессах. При нагревании холоднотянутых изделий их размеры сокращаются, в связи с чем рекомендуется предварительный нагрев изделий до температуры, на 15—20° превышающей температуру эксплуатации. Для предотвращения хладотечения крупные изделия армируют слоями металлической сетки или проволокой. В других случаях слои порошка полимера прокладывают полосами льняной ткани, а затем заготовки прессуют и спекают.
Недостатком фторопласта-4 является его хладотеку - честь, увеличивающаяся с повышением давления. При удельных нагрузках 30—50 кг! см21 появляется заметная остаточная деформация, а при 200—250 кг! см2 материал переходит в область регулярного течения. Поэтому изделия из фторопласта-4, работающие при 80—100°, не следует нагружать свыше 30 кг! см2 из-за опасности остаточной деформации. Хладотекучесть полимера используется при изготовлении пленок на вальцах и труб на штанг - прессах. При нагревании холоднотянутых изделий их размеры сокращаются, в связи с чем рекомендуется предварительный нагрев изделий до температуры, на 15—20° превышающей температуру эксплуатации. Для предотвращения хладотечения крупные изделия армируют слоями металлической сетки или проволокой. В других случаях слои порошка полимера прокладывают полосами льняной ткани, а затем заготовки прессуют и спекают.
При изготовлении прокладочных и упаковочных материалов коллоидные неспек - шиеся частицы фторопласта-4 смешивают с пластификатором и многократно пропускают через вальцы при постепенно возрастающем давлении до образования компактного прочного листа. Раз
работай способ получения тонкостенных труб на поршневом экструзере.
 Весьма эффективным и экономичным способом повышения химической стойкости материалов (пластмасс, резины, асбеста) является обмотка изделий из них прокатанной лентой из фторопласта-4.
Весьма эффективным и экономичным способом повышения химической стойкости материалов (пластмасс, резины, асбеста) является обмотка изделий из них прокатанной лентой из фторопласта-4.
Фторопласт-4, эмульгированный в спирте или р аств ор е к ар боксимети л - целлюлозы, хорошо формуется в волокна, из которых вырабатывают так называемую тефлоновую ткань. В частности, ткань не электризуется и к ней ничего не прилипает. Особенно ценное значение она имеет как фильтрующий материал Волокна используются для набивки сальников, для изготовления фильтров для горячих газов и т. д.
Все большее признание получает фторопласт-4 как материал для бытовых нужд. Например, благодаря чрезвычайно низкому коэффициенту трения о снег и лед, практически не зависящему от температуры, из него получаются прекрасные лыжные смазки, обеспечивающие скольжение при любой температуре.
Описано применение фторопласта-4 при изготовлении лыж из стеклопластиков или алюминия; нижнюю часть лыж выполняют из фторопласта-4 и приклеивают к верхней части.
Большим преимуществом фторопласта-4 перед многими другими материалами является то, что он не токсичен при любых видах переработки, если температура ее не превышает температуру разложения полимера. За пятнадцать лет его использования не отмечено ни одного случая интоксикации. При изучении токсичности полимера его вводили в пищу подопытных животных. Никаких признаков отравления при этом не наблюдалось.
Однако необычайно высокая термическая стойкость и нерастворимость полимера весьма затрудняют его обработку. Вследствие высокой вязкости даже в расплавленном виде он не обладает текучестью, достаточной для
обычного формованйя, а при принудительной подачи расплава под высоким давлением происходит заметная ориентация молекул. Это явление, наблюдаемое и при повышенной температуре, приводит к некоторой деформации изделий при их эксплуатации.
Для расширения практического применения фторопластов требуется разработка специальных способов их переработки.
Такая работа проводится с 1944 г., однако ее нельзя считать законченной, так как ассортимент и размеры изделий из политетрафторэтилена лимитируются технологией его переработки.
Методы формования фторопласта-4 напоминают скорее методы, применяемые в порошковой металлургии или в керамической промышленности, чем обычные методы формования полимеров. Одним из основных способов производства изделий из фторопласта-4 является холодное таб- летирование порошка при удельном давлении 300 — 350 кг/см2у спекание заготовок в свободном состоянии при 375 +10° и последующее охлаждение. Скорость охлаждения определяет структуру материала, а следовательно, и его механические свойства. Изделия, закаленные быстрым охлаждением, имеют более высокие показатели прочности на растяжение и удлинение, но вместе с тем меньшие значения модуля упругости.
Для подгонки размеров изделий заготовки подвергают механической обработке. Холодная текучесть полимера также может быть использована для доводки изделий с помощью повышенного давления. Но при этом следует иметь в виду, что с повышением температуры размеры, приданные изделию при холодной деформации, изменяются, а при температуре перехода (327°) быстро возвращаются к первоначальным.
Тонкие пленки из политетрафторэтилена вырабатывают методом резания. Из порошка полимера делают заготовки в виде цилиндров, с которых на токарном станке срезают тонкие ленты (рис. 18). Эти ленты, выпускаемые в качестве «неориентированной» пленки, обладают высокой прочностью на разрыв. Электрическая прочность неориентированной пленки невысока, так как в ней имеется много мелких отверстий, через которые происходит пробой. Двухслойная пленка толщиной 100 микрон имеет электрическую прочность 30 кв/мм.

![]() Н еори ентир ов ан - ную пленку раскатывают на точном прокатном стане при небольшом подогревании для облегчения раскатки. При этом происходит односторонняя ориентация пленки, в результате чего она приобретает повышенную механическую прочность в направлении раскатки: предел прочности при растяжении достигает 1000 кг/см2 при относительном удлинении 20—30%. Электрическая прочность пленки также резко возрастает —до 250 кв/мм и выше. При нагревании наблюдается усадка пленки, при обмотке высокочастотных кабелей это свойство обеспечивает натяжение и плотность обмотки. Для повышения эластичности плен* ки к фторопласту-4 добавляется резина.
Н еори ентир ов ан - ную пленку раскатывают на точном прокатном стане при небольшом подогревании для облегчения раскатки. При этом происходит односторонняя ориентация пленки, в результате чего она приобретает повышенную механическую прочность в направлении раскатки: предел прочности при растяжении достигает 1000 кг/см2 при относительном удлинении 20—30%. Электрическая прочность пленки также резко возрастает —до 250 кв/мм и выше. При нагревании наблюдается усадка пленки, при обмотке высокочастотных кабелей это свойство обеспечивает натяжение и плотность обмотки. Для повышения эластичности плен* ки к фторопласту-4 добавляется резина.
Пленку изготовляют также методом экструзии, для чего можно использовать червячные и плунжерные профилирующие прессы. Возможна выработка пленок с наполнителями", например с керамическим порошком (размер частиц менее 25 микрон).
В некоторых случаях при выработке пленок, в фторо - пласт-4, фторопласт-3 или их смесь вводят полностью фторированные углеродные масла (т. кип. 250—300° при 10 мм). Пластифицированные таким образом полимеры отлично формуются.
Фторопласт-4 способен свариваться. Свариваемые части материала нагревают с помощью металлической пластинки, обогреваемой электрическим током (контактный способ). Фторопласт можно сваривать также токами высокой частоты и инфракрасными лучами. При нагревании до 380—390° и действии нагрузки (500 кг/см2) вязкость фторопласта снижается, что обеспечивает контакт свариваемых частей. Сварку применяют при изготовлении из пленки или листового материала сосудов, тонкостенных трубок, прокладок с эластичными вкладышами. Из жгутов сваривают прокладочные кольца большого диаметра.
Гладкие фланцы, особенно для фарфоровой, алюминиевой и стеклянной аппаратуры, делают комбинированными; пленки из фторопласта-4 прокладывают резиной. При этом резина служит уплотняющим материалом, а фторопласт — защитным.
Разработан способ получения пористого фторопласта в виде пластин с различной величиной пор. Пористый фторопласт — прекрасный фильтрующий материал; кроме того, из него изготавливают сильфоны различного размера и конфигурации для автоматических устройств, для соединения трубопроводов и для насосов, перекачивающих агрессивные жидкости.
Из фторопласта-4 вырабатывают магнитофонные ленты, превосходящие по прочности ленты из любых других материалов. Они совершенно негигроскопичны; их толщина не превышает 10—12 микрон.
Ранее склеивание фторопластовых материалов вызывало значительные затруднения, и это сужало возможности их использования. Создавались специальные клеющие вещества и приемы склеивания. Теперь разработан способ обработки фторопласта, который обеспечивает склеивание обычными клеями. Способ заключается в изменении поверхности пластика путем обработки ее раствором металлического натрия в жидком аммиаке. По - видимому, при этом удаляется фтор из поверхностного слоя материала, в котором образуются радикальные центры. Это подтверждается тем, что в растворе натрия обнаруживаются фтор-ионы. Электрические свойства обработанного таким образом фторопласта-4 не изменяются.
Раствор натрия может быть заменен раствором натрий - нафталина (или другого металлоароматического соединения) в тетрагидр офуране. Эти же вещества пригодны для подготовки поверхности изделий из фторопласта-3.
Фторопласт-3 можно обрабатывать многими способами, применяемыми в промышленности пластмасс. Этим он существенно отличается от фторопласта-4.
Пленки из фторопласта-3 изготовляют двумя методами: экструзией твердого полимера и распылением его раствора или суспензии с последующей термической обработкой. Для облегчения экструзии к порошку полимера добавляют в качестве пластификатора до 5% дибутилфта - лата или жидкие низкомолекулярные полимеры трифтор - хлорэтилена. При распылении слой полимера нужной толщины наносится на подложку, от которой готовая пленка легко отделяется. При использовании в качестве подложки фольги последнюю для отделения от пленки растворяют в кислоте или щелочи.
Для повышения прочности тонких пленок их подвергают закалке, после чего длительное (в теченид 240 час.) нагревание при 100° или резкие перепады температуры не оказывают на них никакого действия. При 20° предел прочности при растяжении и относительное удлинение при разрыве составляют соответственно: для закаленных пленок 356—400 кг! см2 и 100—200%, для незакаленных — 300 —360 кг! см2 и 20 —40 %.
Дисперсии фторопласта-3 пригодны для покрытия металлических и других поверхностей. Дисперсии наносятся тонким слоем методом распыления. После испарения растворителя покрытие подвергают термической обработке. Поверхность металла, защищенная покрытием, приобретает исключительную химическую устойчивость.
Фторопласт-3 формуется методами, обычными для термопластов. Изделия из него сохраняют термопластичные свойства при температуре от —200 до +200°. Обычно прессованию подвергают полимеры молекулярным весом 75 000—110 000, пластифицированные более низкомолекулярным маслообразным полимером трифторхлорэтилена. При шприцевании фторопласта-3 применяют электрообогрев; мундштук и шнек шприцмашины изготовляют из нержавеющей стали. Этот способ переработки полимера во многом зависит от постоянства температурного режима.
К электрическим характеристикам полимеров, используемых в радиационных, телевизионных, радиолокационных, счетнорешающих, управляющих и других устройствах, работающих на высоких и сверхвысоких частотах, предъявляются весьма высокие требования. Материалы должны иметь высокие показатели удельного объемного и поверхностного сопротивления (выше 1014—1015 ом/см), малое значение тангенса угла диэлектрических потерь (не выше 0,0003—0,0006). Весьма важно также, чтобы эти характеристики не изменялись под влиянием температуры или влажности. Лучше всех остальных материалов этим требованиям отвечают фторопласты.
Электрические свойства фторопласта-4 — исключительны. Будучи неполярным полимером, он является
Однйм из лучших диэлектриков и не уступает в этом отношении полиэтилену. Диэлектрические свойства фторопла - ста практически не зависят от частоты тока (в пределах до 108 гц) и температуры (в пределах от —160 до +280°). Его можно было бы использовать даже при температуре жидкого азота, если бы этому не препятствовала хрупкость материала при столь низкой температуре. При длительной выдержке в поле высокой напряженности электрическая прочность полимера значительно снижается.
Объемное сопротивление фторопласта-4 превышает 1015 ом! см даже после продолжительного вымачивания в воде; поверхностное сопротивление равно 3,6 *102 ом при 100%-ной относительной влажности. Пластик обладает высоким потенциалом пробоя. При возникновении дугового разряда происходит частичное превращение его в парообразное состояние без образования угля.
Как изолирующий материал фторопласт-4 применяется для кабелей и проводов высокого напряжения. Полимером покрывают дистанционные диски, коаксиальные кабели, применяемые в телевидении, в линиях передачи модуляции частот (рис. 19, 20). В электронике используются печатные схемы, где проводники впечатываются в изолирующие блоки из фторопласта-4. Из него делают цоколи для электрических ламп, переходные изоляторы (заменяющие янтарные) для ионизационных камер дозиметрической аппаратуры, конденсаторы для индивидуальных дозиметров и т. д. До последнего времени в высокочастотных установках применялся полистирол, обладающий достаточно хорошими электрическими характеристиками, но недостаточно термостойкий (температура разложения 160°) и подверженный быстрому старению. Фторопласты с большим успехом заменяют полистирол во многих областях его применения.
Испытания фторопласта-4 позволяют рекомендовать его для изоляции проводов, используемых при 180—190°. Такие провода применяются в самолетной и реактивной технике, а также для электрооборудования, от которого требуется химическая и механическая устойчивость при низкой и высокой температуре. Из пластика, содержащего наполнители, могут быть получены изоляционные, магнитные и полупроводниковые материалы с ценными техническими свойствами. Как упоминалось, наполненные фторопласты обладают повышенными показателями соп-
Ротивления износу, жесткости, прочности, твердости нри неизменном коэффициенте электрических потерь.
Весьма эффективно применение фторопластов в электрической промышленности. Благодаря тому, что пластики не обугливаются и не перегреваются, трансформаторы с изоляцией из фторопласта могут работать при 200°, а в течение короткого времени даже при 250°. Это позволяет увеличивать мощность и КПД машин примерно на 25%, не изменяя габаритов, или уменьшать размеры машин, не изменяя мощности. Кроме того, в таких машинах может быть уменьшен вес системы охлаждения. Аналогичные преимущества фторопласты дают при использовании в самолетостроении.
Для высокочастотных кабелей применяется изоляция в виде обмотки из тонкой прокатанной пленки политетрафторэтилена. Такая же пленка используется для изоляции катушек, пазов электрических машин, конденсаторов и т. д. Несмачиваемость и ненабухаемость в воде позволяют применять изоляцию в условиях высокой влажности.
Фторопласт-3 обладает несколько худшими электрическими свойствами по сравнению с фторопластом-4, но превосходит многие материалы, применяемые в электропромышленности. Сравнительно высокие показатели диэлектрических потерь ограничивают применение фторо - пласта-3 в технике высоких частот, но он весьма пригоден в качестве изоляционного материала для сильноточного оборудования, так как его удельное сопротивление, электрическая прочность, дугостойкость и устойчивость к влаге очень высоки.
В литературе имеются многочисленные работы по изучению возможности использования фторопласта-4 как материала, уменьшающего трение. На исключительно низкий коэффициент его сухого трения обратили внимание еще в 1943 г. Однако ранние опыты с трущимися деталями из фторопласта показали, что из-за большой текучести при повышенных нагрузках, возрастающей в результате разогрева трущихся поверхностей, и плохой теплоотдачи практическое применение его ограничено. Более целесообразным представлялось использование фторопласта в виде покрытий на твердой основе, что потребовало разработки способов производства пленок, хорошо пристающих к твердым телам.
При изучении зависимости коэффициента трения от наличия в полигалоидэтилене того или иного галоида установлено, что хлор увеличивает, а фтор уменьшает коэффициент трения. При трении фторопласта о чистую металлическую поверхность в результате сдирания пластика на металле образуется пленка, располагающаяся в соответствии со срезывающими усилиями металлической поверхности. После образования пленки перенос фторопласта на металл прекращается. Этим объясняется изменение значения коэффициента трения: вначале, когда происходит трение пластика о металл, он равен 1,10, а затем, в процессе приработки поверхностей, быстро снижается до 0,04—0,05, что соответствует трению фторопласта о фторопласт.
Прочность фторопластовых покрытий может быть увеличена, если поверхность покрываемого металла сделать несколько шероховатой. Глубина шероховатости не должна превышать 0,1 мм, так как в противном случае прочность покрытия снижается. Для создания шероховатости поверхность металла обрабатывают струей кварцевого песка под давлением 5—6,6 от, а затем нагревают в присутствии воздуха для окисления металла. На подготовленную таким образом поверхность наносят фторопластовое покрытие.
В результате кратковременного нагревания до высокой температуры твердость некоторых металлов уменьшается. Например, твердость латуни при нагреве до 385° снижается на 50%. В связи с этим были разработаны другие способы нанесения фторопласта на металл. Отличное покрытие без значительного снижения твердости и прочности на разрыв латуни достигается при нагревании ее токами высокой частоты (400 кгц) с последующим охлаждением водой. Этот же способ весьма эффективен и при покрытии алюминия.
Фторопласт, являющийся мягким пластиком, текущим без нагревания при давлении 140 от, может выдерживать значительно большее давление, когда он находится в виде тонкослойного покрытия на твердой основе. Такое покрытие выдерживает рабочее трение под нагрузкой в 3500 ат, причем первоначальный коэффициент трения (0,04—0,05) не изменяется после 100 циклов возвратно-поступательного движения трущихся поверхностей.
В настоящее время созданы образцы прозрачных однослойных фторопластовых покрытий, прочно удерживающихся на латуни и стали. Покрытия повышают сопротивляемость металла коррозии и устраняют заедание механизмов при работе. При нанесении двух и более слоев общей толщиной 0,5—0,7 мм получаются покрытия, предохраняющие детали от дождевой и морской воды, сырости. В наиболее удачном покрытии толщина нижнего слоя равна 0,3, верхнего —0,3—0,4 мм. Такое покрытие на стали холодного проката хорошо защищает металл при 49° и 20%-ной влажности морского воздуха в течение 150 час. Точечная коррозия не вызывает отслаивания покрытия от подложки и распространения ржавления под покрытием.
В США фторопластовыми покрытиями были с успехом заменены смазочные материалы на широко распространенных 20-миллиметровых автоматической (М-3) и авиационной (МК-12) пушках. Многочисленные опытные стрельбы показали, что трение движущихся поверхностей резко снизилось, а скорострельность не отличалась от развиваемой при смазке обычным ружейным маслом высокого качества. Когда пушка М-3 в дополнение к фторопластовому покрытию была смазана синтетическим ружейным маслом, ее скорострельность повысилась примерно на 10% по сравнению с наилучшими показателями, достигнутыми при стрельбе из этого оружия.
Для длительного хранения всех видов оружия и механизмов требуются консервирующие антикоррозийные материалы. При консервации оружия необходимы смазочные материалы, одинаково эффективные при температуре от —70° до +50°. Применение таких материалов связано с большими затруднениями. В связи с этим была сделана попытка заменить консервирующие и смазочные материалы фторопластом. В результате испытаний оказалось, что в условиях низкой температуры (—75°) оружие, покрытое обычной смазкой, сделалось негодным к употреблению. Те же результаты были получены и при хранении во влажном воздухе. Механизмы, защищенные фторопластовым покрытием, работали после хранения безотказно. При —75° металл не прилипал к рукам, как это бывает при низкой температуре. Это очень важно при устранении повреждений механизмов на морозе.
Опытные стрельбы из винтовок, карабинов и пулеметов с тефлоновыми покрытиями проводились в самых разнообразных условиях. После восьмимесячных испытаний ни один образец оружия с фторопластовым покрытием не вышел из строя, и не было отмечено ни одного1 заедания, вызванного повышенным трением или коррозией. У всех видов оружия, покрытого обычной смазкой, после испытаний были обнаружены те или иные недостатки. В результате фторопласт был признан средством, годным для предохранения оружия и механизмов при долгосрочном хранении, а также хорошим заменителем обычных смазочных материалов для ручного оружия в армии.
Условия эксплуатации смазочных материалов на подводных лодках весьма жесткие. Атмосфера внутри лодки вредно действует и на жидкие, и на густые смазки. Снаружи лодки смазочные материалы приходят в соприкосновение с морской водой, в результате чего образуется эмульсия, загрязненная солью, водорослями и морскими организмами. Такие эмульсии быстро загустевают или затвердевают и скорее препятствуют, чем способствуют приведению в действие устройств. Много сил и времени тратится на очистку механизмов и обновление смазки.
На борту обычной подводной лодки имеется много механизмов, которые можно было бы защитить с помощью фторопласта. На трех подводных лодках в Портсмутской военно-морской верфи им были покрыты различные механизмы, и в течение 18 мес. никакие другие смазочные материалы не применялись. Каждые 6 мес. командиры кораблей сообщали о состоянии механизмов, и ни одного недостатка в их работе отмечено не было. В связи с этим был разработан проект опытного покрытия фторопластом всех механизмов подводных лодок и кораблей на верфи Маре - Айленд. В частности, им заменили смазывающие материалы в счетчиках горючего лопастного типа, где необходимо минимальное трение в начале отмера. В эти счетчики вместе с горючим часто попадает морская вода, вы-' зывающая коррозию; это снижает точность прибора в течение нескольких месяцев эксплуатации на 85%. Применение фторопластового покрытия обеспечило сохранение 99,95% точности счетчиков даже тогда, когда в них умышленно впускали большое количество морской воды. При покрытии обоймы перископа фторопластом крутящее усилие на его приводе уменьшилось с 2,59 до 1,47 кг! см2, и срок службы перископов значительно увеличился. Уменьшилась стоимость перископов, так как снизились требования к точности обработки их поверхностей. Устранено снижение прозрачности линз и призм, вызываемое конденсацией паров жидких смазочных материалов.
Фторопластовое покрытие с успехом применено для оборудования шлюзовых камер, в клапанных устройствах механизма восплытия, в воздухозаборных устройствах и других механизмах, особо сильно подверженных корродирующему действию морской воды.
Имеются сведения об использовании фторопласта для покрытия авиационного оборудования, например поршневых колец в гидравлических системах. Обычно продолжительное пребывание поршневых колец в масле или топливе делает их липкими и они прилипают к стенкам поршня в период его бездействия. При пуске системы кольцо продолжает цепляться за поршень, в результате чего нарушается герметичность системы. Для устранения подобного прилипания систему время от времени приходится без нужды приводить в действие. При покрытии фторопластом поверхности колец и поршня прилипания не происходит, кольца долго не теряют упругости и система функционирует безотказно. Толщина покрытия не должна превышать 0,1 мм. Для нанесения такого тонкого слоя достаточно потереть (в одном направлении) чистую сухую поверхность механизма куском пластика.
Лабораторные испытания показали преимущества фторопластового покрытия разнообразных деталей гидравлических приводов, коллекторов, насосов. Использование обработанных таким образом деталей на производстве подтвердило лабораторные данные.
В настоящее время все более широкое применение находит ититан. Но он обладает одним неприятным свойством; склонностью к самосвариванию в местах сильного трения. Обычные смазочные материалы не могут предот
Вратить это явление. Был проведен следующий опыт - Титановые гайки и болты различных размеров покрыли тонкой пленкой фторопласта, который в данном случае играл роль против о заедающего средства и заменителя смазочного материала. Это мероприятие полностью устранило и заедание и самосваривание. Кроме того, трение нитками резьбы было настолько незначительным, что степень затяжки болтов можно было определить по закручивающему усилию. Теперь титановые болты и гайки с фторопластовым покрытием применяются на авиазаводах.
Необычайное использование фторопласт нашел в производстве одного сервоустройства, состоящего из неболь шого электромотора, редуктора и выдвигающегося шток - домкрата. Это устройство работает при температуре от —87° до +268° и должно быть водонепроницаемым. Никакие природные и синтетические материалы не могли обеспечить термоустойчивость в таких условиях, а также минимальное начальное усилие кручения, герметичность системы и достаточную стабильность при хранении. Фторопластовое покрытие ответило этим требованиям и теперь применяется в производстве сервоустройства.
Также успешно фторопластовые покрытия применяются в шестереночных бензонасосах систем питания. Их эффективность была продемонстрирована сравнением работы насоса с бронзовыми шестернями с работой того же насоса, шестерни, прокладки втулок и зацепляющиеся поверхности которого были покрыты фторопластом. В первом случае при выкачивании бензина из бака подземного хранилища требовалась предварительная заливка, насос перегревался и работал с перегрузкой из-за плохой смазки осей, подшипников, рабочей зубчатки и сальника; во втором случае не было нужды в предварительной заливке, в течение года нормальной эксплуатации трение оставалось низким, нагревания при работе насоса не наблюдалось, никаких осложнений со стороны сальника не было.
Фторопласт оказался пригодным для покрытия различных видов винтовой резьбы — от болтов и гаек до домкратов. Например, винт регулятора давления, покрытый пластиком, используется для редуктора кислорода, так как фторопласт, в противоположность обычным смазочным материалам, не окисляется и, следовательно, не взрывоопасен. Им можно заменять смазки в оптических приборах, электромеханических системах и связанных с шт- ми механизмах, в зубчатых передачах и подшипниках синхронизирующих устройств. Применение пластика может весьма облегчить работу с конструктивно сложными или трудно очищаемыми устройствами — орудийными затворами, прицельными приспособлениями, дальномерами, вычислительными машинами и автоматами.
Из этого, конечно, не следует, что фторопласт в состоянии разрешить все проблемы, связанные с уменьшением трения, или что он является универсальным сухим смазывающим материалом. Неудачи прошлого объясняются тем, что во многих случаях применение фторопластовых покрытий ограничивается его сравнительной мягкостью, пористостью пленки и плохой теплопроводностью. Малый коэффициент трения еще не дает возможности решить с помощью полимера все проблемы смазочных материалов. Не следует считать его и наилучшим антикоррозийным средством только потому, что из всех известных пластмасс он химически наиболее стоек. Здесь нельзя забывать о пористости фторопластовых покрытий, что снижает их консервирующие свойства. Имеются лучшие антикоррозийные покрытия и с этой точки зрения, и в экономическом отношении.
Мы перечислили довольно много областей техники, где фторопласт нашел себе применение; безусловно, в будущем оно еще более расширится.
Но фоторопласт используется не только в технике. Химическая инертность, отсутствие запаха и вкуса делают возможным употребление пластика в пищевой промышленности, например в качестве упаковочного материала, устраняющего всякое опасение порчи продуктов. Благодаря отсутствию адгезии к липким материалам фторопласт пригоден для облицовки валов для раскатки теста, а также устройств для формования и транспортирования сырых кондитерских изделий; при этом отпадает необходимость в каких-либо подмазках и присыпках.
Эти же свойства делают его перспективным материалом для некоторых областей медицины, например восстановительной хирургии, где используют сделанные из него искусственные кости, зубы, сосуды и т. д. Уже сейчас из фторопластовой пленки изготовляют тару для ценных фармацевтических веществ, а также хирургические инструменты, стерилизовать которые можно любыми антисептиками или нагреванием до высокой температуры.
Фтороуглеродные пластмассы являются идеальными конструктивными материалами. Они не горят, не подвергаются коррозии, не гниют и не распадаются в тех условиях, в которых всему этому подвержены обычные углеводородные материалы. Ни грызуны, ни насекомые, ни грибки не могут найти в них питательных веществ. Мебель, драпировки и другие предметы домашнего обихода, изготовленные из фтороуглеродов, огнестойки.
|
Рис. 20. Штепсель и гнездо для неизолированной шины |
 Заканчивая эту главу, приведем слова известного исследователя в области фтороорганических соединений Саймонса: «Будущие фторуглеродные соединения смогут также улучшить и наши автомобили. Когда будут изготовлены соответствующие жидкости, двигатель автомобиля
Заканчивая эту главу, приведем слова известного исследователя в области фтороорганических соединений Саймонса: «Будущие фторуглеродные соединения смогут также улучшить и наши автомобили. Когда будут изготовлены соответствующие жидкости, двигатель автомобиля
Будут делать полностью закрытым, в качестве смазки будет использовано фторуглеродное смазочное масло, не нуждающееся в замене свежим. Охладительная система также будет заполнена жидким фторуглеродом; не будет потребности в антифризе, и радиатор никогда не будет ржаветь. Шины будут служить столько же, сколько весь автомобиль. Они будут изготовлены из фторуглеродных эластомеров, которые не будут портиться в результате медленного окисления. Ткань, покрывающая сидения, будет огнеупорной и не будет впитывать пыли. Чтобы придать обивке огнестойкость, ее будут обрабатывать фторуглеродными соединениями. Если же автомобиль каким-нибудь образом загорится, жидкость, заполняющую радиатор, можно будет применить для гашения пламени. Даже мотор сможет быть подвергнут поразительным переменам: представим себе, что двигатель внутреннего сгорания заменен высокотемпературной турбиной, приводимой в движение сильной струей термически устойчивых паров фторуглерода».
Таковы перспективы использования фторуглеродных соединений в технике и быту. Ничего фаНТаСТИЧвСКОГО в этих предположениях нет, так как возможные направления использования полностью обеспечиваются свойствами, заложенными в этих интересных соединениях.
ФТОРКАУЧУКИ
Необходимость в термически и химически стойких пластмассах была, в известной степени, удовлетворена получением политетрафторэтилена и полихлортрифторэтилена. Однако в современной технике появилась потребность в создании фторсодержащих эластомеров —каучуков, не набухающих в углеводородных горючих материалах, смазочных маслах и гидравлических жидкостях при низких и высоких температурах, т. е. в условиях эксплуатации современных скоростных самолетов и реактивных двигателей.
Силиконовые каучуки, которые ранее были единственными эластомерами, пригодными к эксплуатации при 200—260°, недостаточно стойки ко многим жидким средам, применяемым в самолетах, а также в химической промышленности.
Большинство фторопластов представляют собой жесткие, плохо растворимые вещества, ничем не напоминающие каучук. Полимеризация перфторбутадиена привела к образованию масло - и смолообразных продуктов с сравнительно малым молекулярным весом; полимеризацию перфтори- зобутилена с помощью катализаторов осуществить не удалось. Трудно протекающей радиационной полимеризацией перфторизобутилена также не удалось получить эл астичных пр одукт ов.
Получение каучукообразных материалов было осуществлено совместной полимеризацией некоторых фторсодержащих ненасыщенных соединений.
Среди фторсодержащих эластомеров, полученных со - полимеризацией фторолефинов и фторпроизводных акри - левой кислоты или поликонденсацией фторированных кислот и спиртов, наиболее важное значение имеют сополимеры трифторхлорэтилена или гексафторпропилена с
Винилиденфторидом — полпгептафторбутилакрилат, 3,3,3- трифторпропилметилсиликоновый каучук и др.
Переход от пластика типа политетрафторэтилена к материалам, обладающим каучукоподобными свойствами, требует изменения в структуре полимера. Жесткой однородной полимерной цепи необходимо придать более подвижную структуру, нарушить ее «гомогенность» (введением объемистых атомов или групп) и обеспечить возможность образования поперечных связей между цепями полимера при вулканизации.
Первая задача может быть разрешена введением в цепь метиленовых групп, причем наиболее подходящим реагентом для этого явился винилиденфторид СГ2=СНг. Сополимер фтористого винилидена с тетрафторэтиленом при комнатной температуре представляет собой пластик, более мягкий, чем политетрафторэтилен. Необходимая гетерогенность структуры может быть достигнута введением мономера с общей формулой СГг = СГИ
,_Е ЕЕ Н-
_С —С —С —С— 1111 1~¥ И Е Н Ч,
Группой И может быть хлор, трифторметильная группа и др. Наличие водородсодержащих групп в этом типе сополимеров создает возможность образования поперечных связей.
Сополимеризация хлортрифторэтилена с винилиденфторидом осуществляется в эмульсионной системе при повышенной температуре (около 100°) в присутствии смеси персульфатов. Вероятная структура сополимера может быть выражена формулой
TOC o "1-5" h z г - Е Е Н Е _.
—С — С — С — с —
II I I
•-Е С1 Н ¥ ->п
В зависимости от соотношения мономеров образуются продукты, обладающие различной прочностью и эластичностью. При соотношении мономеров 1 : 1 получается теплостойкий каучук с молекулярным весом 500 ООО —
1 ООО ООО, обладающий высокой химической стойкостью. Для вулканизации этого полимера непригодны обычные агенты; их заменяют органическими перекисями или полиаминами. Сополимер можно усиливать сажей или специальными сортами двуокиси кремния.
Вулканизаты каучукоподобного сополимера отличаются прекрасными физико-механическими показателями, высокой термостойкостью (испытания проводились в течение 30 суток при 200° на воздухе). В этом отношении они уступают только силиконовым каучукам. Вулканизаты обладают исключительной стойкостью к действию концентрированных кислот, в том числе дымящей азотной кислоты, перекисей, щелочей, спиртов, хлорированных растворителей, алифатических и ароматических углеводородов.
К недостаткам материала следует отнести ниткую морозостойкость, текучесть и набухание в синтезических смазках типа сложных эфиров, а также фреонах и других низкомолекулярных фторуглеродах. Все эти вещества не действуют на фторкаучук химически, а вызывают лишь его набухание. Безводный гидразин, действие которого представляет собой пример аминной вулканизации, реагирует с полимером и придает ему хрупкость.
Фторкаучук на основе хлортрифторэтилена и винили- денфторида совместим в широких пределах: он может быть совулканизован с натуральным каучуком, бутадиен-сти - рольным, хлоропреновым, силиконовым и др. Предварительные данные свидетельствуют, что добавление фтор - каучука увеличивает химическую стойкость смесей.
Рентгеноструктурное исследование показало, что эластомер аморфен даже при —40°. Однако при растяжении до 300% он способен к ориентации и образованию кристаллов. Удельный вес полимера 1,85; содержание фтора в нем превышает 50%. Полимер обладает высокой теплостойкостью; в нем не обнаруживается разрыва цепей или потери галоида даже после длительной выдержки при 226°. Опыты показывают, что он в состоянии выдерживать периодическое действие температур до 250°. Высокая теплостойкость фторкаучука сочетается с довольно низкой температурой хрупкости (—51°).
По своим электрическим свойствам фторкаучук подобен большинству виниловых полимеров, и эти свойства не изменяются после выдержки в течение одной недели при 25° и 95%-ной относительной влажности. Сопротивление разрыву невулканизированного полимера 21 — 22 кг/см2у а вулканизата 130—250 кг! см2. Относительное удлинение при переходе от сырого полимера к вулканизованному несколько снижается (с 600—800 до 450 — 600%).
Изделия из фторкаучука можно формовать давлением на обычном оборудовании. Методом шприцевания из фторкаучука получены трубки и шнуры; его можно использовать для покрытия металлов и для выработки кислотостойких пленок. На каландре из него получают листовые материалы.
Фторкаучук растворим в некоторых кетонах и простых эфирах. Это позволяет "использовать его для приготовления клеев. Из растворов фторкаучука можно вырабатывать прочные пленки (отливкой), перчатки и другие полые изделия (способом макания). В настоящее время из каучука изготовляют дисперсию или латекс концентрацией 10-15%.
Изделия из фторкаучука выдерживают действие дымящей азотной кислоты в течение длительного времени. Равновесное набухание в азотной кислоте, равное 20 — 30% (по объему), достигается примерно за одну неделю. В течение этого времени растяжимость и твердость изделий практически не изменяются, но сопротивление разрыву падает. В аналогичных условиях другие резины разрушаются за несколько минут или даже секунд.
Прокладочные кольца из каучука кель-Ф испытывались при работе в контакте с дымящей азотной кислотой при температуре от —54 до +71°. Несмотря на резко увеличивающиеся при низкой температуре жесткость и твердость, уплотнение сохраняло удовлетворительные свойства в течение недели. При +71° уплотнение оставалось прочным и гибким. Никакой другой каучук не обладает подобной стойкостью к действию сильных окислителей.
На основе фторкаучука предложено делать защитную одежду для персонала, работающего с сильными окислителями, а также бензобаки и рукава для транспортирования и хранения такого рода жидкостей.
В США существуют эластомеры кель-Ф двух марок —3700и5500; первый отличается хорошими механическими свойствами, теплостойкостью и устойчивостью к действию горючих материалов; второй длительное время выдерживает действие сильных окислителей; на него, например, в'течение 400 час. при 100° не оказывает действия раствор электролита для анодного окисления (смесь 85%-ной фосфорной и 67%-ной азотной кислот).
Слой фторкаучука второго типа толщиной 0,075 мм, нанесенный на ткань, оказался непроницаемым для белой дымящей азотной кислоты в течение 40 час. и красной дымящей азотной кислоты в течение 165 час. Эти данные особенно значительны при сравнении их с данными для обыкновенных прорезиненных тканей, которые в таких условиях полностью разрушаются за несколько минут.
Другой каучукообразный материал, созданный из ф! ор - олефинов, сополимер гексафторпропилена и винилиден - фторида, известен в США под названием витон-А. Содержание фтора в пластике около 65%. Полимер имеет линейную структуру и по сравнению с другими известными полимерами обладает относительно низким молекулярным весом. Цепь полимера состоит из чередующихся звеньев гексафторпропилена и винилиденфторида
РЕН Г
1111 —С — С — С — С—
Г
Эластичность, т. е. растяжимость в сочетании с высокой прочностью, а также возможность образования поперечных связей при вулканизации и подвижность структуры обусловлены наличием метиленовых групп (—СН2—) винилиденфторида, а также трифторметильной группы гексафторпропилена.
Сополимеризацию проводят в аппаратуре из нержавеющей стали при 100° в присутствии смеси персульфата и бисульфита или других окислительно-восстановительных реагентов. При этом оба мономера находятся при температуре, превышающей их критические температуры. Эмульгатором служит перфтороктанат аммония, преимущество которого в том, что он не генерирует водорода, способного оборвать цепь полимера. Мономеры полиме - ризуются с резко различной скоростью, поэтому необходимо строго соблюдать режим процесса, чтобы исключить или свести к минимуму гомополимеризацию.
При перемешивании во вращающемся автоклаве полимеризация заканчивается за 20 мин. Полученный латекс под влиянием ионных коагулянтов (хлористого натрия или соляной кислоты) превращается в белый полупрозрачный порошок с удельным весом, несколько превышающим удельный вес остальных фторкаучуков. После сушки и прессования порошок становится прозрачным.
Сырой полимер хорошо растворим в кетонах, например в метилэтилкетоне. Смеси на основе витона-А легко обрабатываются на обычном оборудовании резиновой промышленности, хорошо шприцуются и формуются. Наполнителями могут служить сажа и кремнекислотные добавки. В качестве вулканизирующих агентов используются амины и перекиси. Смеси из витона-А вулканизуются также под действием облучения высокой интенсивности.
Кремнекислотные наполнители по сравнению с сажевыми придают смесям более высокую термостойкость, но несколько снижают показатели остаточного сжатия.
Смесь на основе витона-А, вулканизованная в прессе при 135° в течение 30 мин., а затем при 204—260° в течение 24 час., обладает необычайной стойкостью к набуханию в дымящей азотной кислоте, а также во многих средах, представляющих интерес для авиации. В табл. 30 приведены данные по набуханию резин на основе витона-А в различных маслах.
Таблица 30
|
Масло |
Увеличение объема образца, % |
Температура, °С |
|
Трансмиссионное . . |
2 |
100 |
|
Масло № 3................... |
3 |
149 |
|
Гидравлическое 0-45 |
5 |
204 |
|
Турбинное .................. |
10 |
204 |
На образцах витона-А, растянутых на 10% и подвергнутых в течение месяца действию прямого солнечного света, не наблюдается появление трещин.
Из витона-А изготовляют баки, рукава, прокладки, сальниковые устройства; он пригоден также для покрытий и клеев. К изделиям из витона предъявляются высо
кие требования в отношении термостойкости и устойчивости к маслам и растворителям. Испытания изделий дали хорошие результаты. Например, уплотнительные кольца круглого сечения выдерживали более 60 ООО циклов при нагрузке 211 кг! см2 в среде гидравлического масла при 200°. По предварительным данным из витона-А можно делать мягкие баки, эксплуатируемые при 150—200°. Уплотнительные ленты из губчатой резины на основе этого каучука применяются при 200°.
Иным способом создания фторированных каучукоподобных материалов является полимеризация эфиров акриловой кислоты и фторсодержащих соединений, несущих алкоксильную группу, например гептафторбутилового спирта. Эластомеры подобного типа носят название полифтор алкилакрилатов; по своим свойствам они во многом сходны с фторкаучуками.
Из многочисленных гомо - и сополимеров был отобран поли (1,1-дигидроперфторбутил)акрилат, получающийся эмульсионной полимеризацией 1,1-дигидроперфторбутил - акрилата
Н Н
-С-С —
|
|
|
Н |
|
V- |
![]() Е7С3Н2С — О
Е7С3Н2С — О
Эластомер известен в США под названием поли-ЕВА, или эластомера 1Е4.
Резины из полифторбутилакрилата, полученные путем вулканизации полиаминами в присутствии серы, характеризуются стойкостью к набуханию не только в ароматических и алифатических углеводородах, но и в синтетических смазках типа сложных эфиров дикарбоновых кислот. Сочетание таких свойств делает их особо ценным материалом для современной авиации. Однако изделия из полифторбутилакрилата имеют низкую морозостойкость, что, естественно, ограничивает их применение.
Введение простой эфирной связи в молекулу фторал - килакрилата резко снижает температуру стеклования. Наибольший интерес представляют полимеры, содержащие простую эфирную связь на расстоянии трех углеродных атомов от сложноэфирной группы, например полимер акрилата СНа = СНСООСНа (СЕг^СЕгОСЕз. Такой поли-
(фторалкоксиалкил)акрилат известен под названием 2Р4. Его элементом является следующая группировка атомов:
-СН2 — СП - I
СО I
ОСН2СЕ2СЕ2ОСЕ3
Полимеры таких акрилатов имеют температуру стеклования примерно на 40° ниже, чем каучуки на основе хлор - трифторэтилена и винилиденхлорида, и отличаются высокой масло - и термостойкостью даже при 200°.
Синтез фторсодержащих эластомеров, по-видимому, наиболее перспективный путь создания термобензомасло - стойких каучуков с хорошими эластическими и физикохимическими свойствами. Сравнительно недавно получен фторкремнийсодержащий каучук — силастик Ь3-53, сочетающий качества двух термоустойчивых материалов: фторуглеродной пластмассы и кремнийсодержащего каучука. Фторксилоксановый каучук — полимер, полученный на основе диалкилдихлорсиланов строения
СН3 С1
ИСН2СН2 С1, где И = СР3, С2Р5 и т. д.
Исходный продукт СНз (СРзСНгСШ^СЪ получен путем присоединения метилдихлорсилана к СРзСН = СНг в присутствии перекиси третичного бутила. Кремнийфтор - содержащий полимер образуется, по-видимому, в результате частичного гидролиза и ступенчатой конденсации этого вещества. Продуктом реакции является смесь фторсодержащих органополисилоксанов с общей формулой
— [81СН3 (СН2СН2СЕ3) 0]п8ЮНз (СН2СН2СР3) —
Установлено, что соединения, содержащие фтор у а-или [3-атома углерода алкильной группы, находящейся у атома кремния, неустойчивы к термическим и гидролитическим воздействиям. Напротив, фтор у углерода, находящегося в у-положении
—•С — С — С — С — 81 — 0—,
Сообщает силиконам и силиконовым каучукам повышенную теплостойкость и уменьшает растворимость в органических растворителях, в частности в углеводородных маслах. Таким образом удается устранить один из недостатков обычных диметил силиконовых каучуков.
Для создания фторсилоксановых каучуков были получены различные фтор алкил силиконовые мономеры путем каталитического присоединения метилдихлорсила - на к фторированным олефинам
С1 С1
ИСН - СН2 + Н - ^ - СНз КСН2СН2 - к - СН3, И = СР3, С2¥5, С3¥7. С1 С1
Метил-3,3,3-трифторпропилсиликоновый каучук более устойчив к растворителям и маслам по сравнению с обычным кремнийсодержащим каучуком и является отличным материалом для изготовления топливных баков, уплотнительных деталей люков и убирающихся шасси, смотровых стекол, воздухопроводов, диафрагм и т. д.
Полигексафторпентаметиленадипинат получают из 2,2, 3,3,4,4-гексафторпентандиола и хлорангидрида ади - пиновой кислоты
С1СО (СН2)4СОС1 + ОНСН2 (СГ2)3СН3ОН - -[-СО (СН2)4СО - ОСН2 (СГ2)3СН20-]-п
[Полимер имеет молекулярный вес от 17 ООО до 25 ООО, обладает высокой морозостойкостью (рабочий интервал температур от —72 до +150°), хорошо поддается обработке. Его свойства по сравнению с другими фторсодержащими эластомерами наиболее близки к свойствам натурального каучука. Но стоимость его даже в промышленном производстве будет, по-видимому, высока.
Большинство описанных эластомеров представляют собой полимерные соединения, построенные на основе углерод-углеродной связи. Создание еще более термоустойчивых материалов на основе углеродного скелета ограничено энергией разрыва связи С—С. По-видимому, получение материалов, устойчивых при 600° и более высоких температурах, будет осуществляться путем синтеза иолимеров, включающих в свой скелет иные атомы, на
пример азот, фосфор, бор, кислород. Возможно, что здесь будут использованы «неорганические полимерные» системы, основанные на чередовании следующих элементов:
— В — IV — В — IV — —В—Р—В—Р—
Где X может быть О, 14, Р, Б, металлом и т. п.
В последнее время описан новый тип полимеров, полученный поликонденсацией смеси амидинов моно - и диперфторкарбоновых кислот
|
Гш |
![]()
|
Гш |
![]() N11
N11
|
С - С3¥6 - С / гш2 гш2 |
|
Ч |
|
СзГ7 |
|
N I С — сг2 — сг2 — сг2 - |
|
/ |
|
СзГ7С |
|
+ |
|
NN2 N II - С |
 |
N
Здесь имеется цепь, в которой триазиновые кольца связаны несколькими дифторметиленовыми группами. Этот материал — один из немногих эластомеров, не содержащих атомов водорода. Его наиболее интересное свойство — высокая термическая устойчивость: при 350° после небольшой начальной потери веса полимер не де - структируется в течение 72 часов. При выдержке невулка- низованного эластомера при 400° в течение 30—40 час. потеря веса не превысила долей процента.
Показано также, что при взаимодействии перфтор - алкилнитрозосоединений с фторолефинами образуются элементорганические сополимеры, обладающие, по-видимо - му, высокой прочностью. Например, из трифторнитрозо - метана и тетрафторэтилена получается полимер строения
—
|
СЕз |
![]() N - О - С¥2 - С¥2 — N - О - С¥2 — С¥2 —
N - О - С¥2 - С¥2 — N - О - С¥2 — С¥2 —
СР3
При этой сополимеризации — N = О взаимодействует подобно группе С = С. в результате чего повторяющимся
звеном в сополимере является группа —К—О—С—С —. В зависимости от условий реакции и строения олефина получается масло-, воско-или каучукоподобный материал. При 100° в основном образуется продукт димеризации нитрозосоединения и олефина — циклодимер, а при Сополимер. Оба продукта очень устойчивы к маслам, топливам, кислотам, щелочам, окислителям и восстановителям, но растворяются во фторуглеродных растворителях.
Эластомер на основе перфторнитрозосоединений или, как его теперь называют, нитрозокаучук, выдерживает продолжительное нагревание при 180°; при 200° он начинает разлагаться с медленным образованием газообразных продуктов. Эластомер не теряет гибкости при —30°. Его молекулярный вес 150 000—200 000; прочность на разрыв 35—42 кг/см2, относительное удлинение при разрыве 500—600%.
Совокупность свойств новых фторкаучуков представляет собой качественный скачок по сравнению со свойствами природных и синтетических материалов, применявшихся до настоящего времени. Но теперь уже и они не могут удовлетворить возросшие требования к конструктивным материалам. Для управляемых снарядов и самолетов нужны каучукообразные материалы, которые должны выдерживать температуры порядка 500—600°.
Возникает также необходимость в каучуках, стойких к ядерному излучению. Предполагалось, что каучук, вулканизированный гамма-излучением, будет обладать высокой стойкостью к дальнейшему облучению, но эти ожидания не оправдались. Выпускаемые за рубежом радиационностойкие каучуки, так называемые анти-рады, оказались годными только в ограниченной степени.
Исследования в области создания термо - и радиационностойкого каучука должны идти, по-видимому, в направлении синтеза этого материала из неорганических элементов. Силиконы обладают неорганическим молекулярным скелетом, однако боковые цепи этих веществ построены из органических радикалов.
Теоретически возможно получение полимеров на основе бора, фосфора (что в известной степени уже достигнуто), алюминия и других неорганических элементов.
В заключение приведем перечень (табл. 31) наиболее изученных фторполимеров, некоторые из которых вырабатываются в промышленных масштабах.
|
Полимер |
Формула |
Фирменное Название |
Тип |
|
Политетра |
[С¥2С¥2]п |
Фторо |
Термоплас |
|
Фторэтилен |
Пласт-4, |
Тичный |
|
|
Тефлон, Флуон |
|||
|
Политрифтор- |
[СР2СЕС1]п |
Фторо |
Термоплас |
|
Хлорэтилен |
Пласт-3, Флуоротен, Кел-Е, Генетрон, Хостафлон |
Тичный |
|
|
Сополимер |
[СГ2(СГ2)2СР]П |
Тефлон-100 |
Термоплас |
|
Тетрафторэти- |
1 |
Тичный |
|
|
Лена и гекса- |
СГз |
||
|
Фторпропи- |
|||
|
Лена |
|||
|
Сополимер |
[СН2(СР2)2 СГ]П |
Фтор- |
Эластомер |
|
Винилиден- |
1 |
Каучук-62, |
|
|
Фторида и гек- |
СГз |
Витон А, |
|
|
Сафторпропи- |
Кел-Е 214 |
||
|
Лена |
|||
|
Сополимер |
[СН2(СГ2)2СЕС1]п |
Фтор- |
Эластомер |
|
Трифторхлор- |
Каучук-32, |
||
|
Этилена и ви- |
Кел-Е |
||
|
Нилиденфто- |
|||
|
Рида |
|||
|
Поливинил- |
[СН2С1ЩП |
Пленка |
Термоплас |
|
Фторид |
Типа II |
Тичный |
|
|
Поли-1 Д-ди- |
[СН------------ сн2]п |
Фтор- |
Эластомер |
|
Гидрогепта- |
1 |
Каучук 1Е4, |
|
|
Фторбутил- |
СООСН2С3Г7 |
Поли-ФБА |
|
|
Акрилат |
|||
|
Поли-1,1-ди- |
[СН СН2]П |
Фтор- |
Эластомер |
|
Гидро-3-три- |
1 |
Каучук-2Е4 |
|
|
Фторметокси- |
СООСН2(СГ2)2— |
||
|
-2,2,3,3-тетра- |
-ОСГз |
||
|
Фторпропила- |
|||
|
Крилат |
|||
|
Полигекса- |
[0СН2(СГ2)зСН20— |
Фториро- |
Эластомер |
|
Фторпентаме- |
-СО (СН2)4СО]п |
Вапный |
|
|
Тилен адипинат |
Полиэфир |
||
|
Метил-3,3,3- |
№ (СН2)2 СНз - ЭЮ]П |
Силастик |
Эластомер |
|
Фторпропилен- |
ЬБ-БЗ |
||
|
Силиконовый |
|||
|
Каучук |
|||
|
Фтор - и фтор- |
Сп^2п’ |
Флуоро- |
Масла, кон |
|
Хлорсодержа- |
С Р С1 |
Луб |
Систентные |
|
Щие масла и |
^71 X у |
Смазки |
|
|
Смазки |

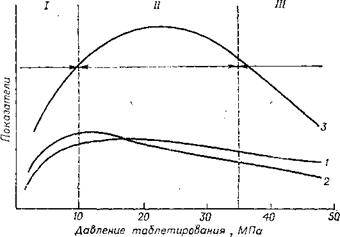
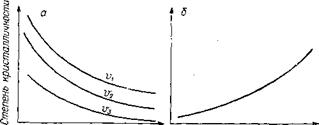
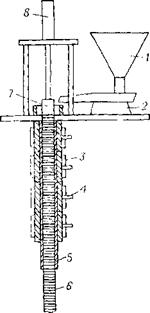
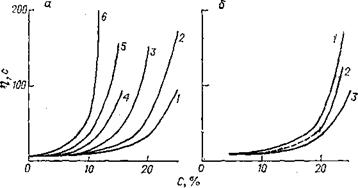

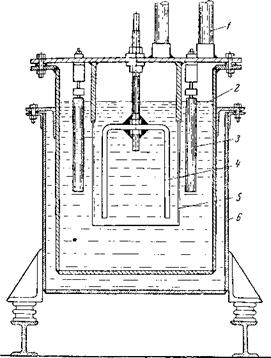
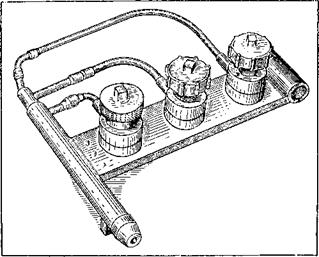
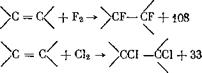
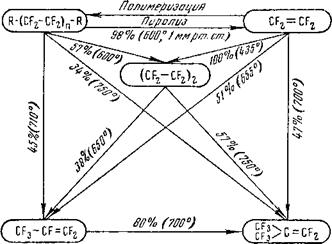
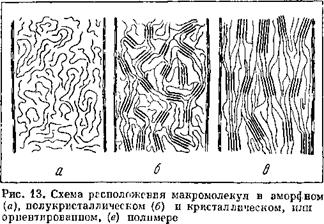
 Опубликовано в
Опубликовано в