Основные процессы, протекающие при дуговой сварке
 22 марта, 2016
22 марта, 2016  Oleg Maloletnikov
Oleg Maloletnikov Процессов, протекающих в условиях дуговой сварки, много. Рассмотрим те, которые имеют общий характер во всех или большинстве случаев выполнения сварки.
Диссоциация газов и соединений. При диссоциации происходит распад более сложных компонентов на атомы или составные части. Этому процессу способствуют наличие высоких температур в зоне сварки и каталитическое действие расплавленного металла. При дуговой сварке в первую очередь диссоциации подвергаются молекулы газов как простых — кислород, азот, водород, так и сложных — углекислый газ С02, пары воды Н20 и др. Диссоциация газов происходит по реакциям
о2 0 + 0
N2 ^ N + N
Кислород и водород при температурах дуги практически полностью диссоциируют на атомы, азот диссоциирует в меньшей степени.
Диссоциация водяного пара в зависимости от температуры проходит по реакциям
Следовательно, в зависимости от условий протекания ]>еакций водяной пар может окислять или восстанавливать металл сварочной ванны.
Диссоциации подвергаются и более сложные соединения. Во многих электродных покрытиях и флюсах содержится плавиковый шпат CaF2. При высоких температурах он разлагается по реакции
CaF2 -> CaF + F
Атомы фтора, соединяясь с электронами, превращаются в ионы с малой подвижностью. Это ведет к снижению проводимости дугового промежутка и ухудшению стабильности дуги. Но в то же время атомы фтора способны связывать водород в молекулы HF, не растворяющиеся в металле ванны, уменьшая насыщение металла шва водородом.
В состав многих покрытий электродов входят карбонаты, например СаСО,. Разлагаясь при высоких температурах, они выделяют углекислый газ, который в свою очередь диссоциирует с образованием кислорода:
СаСО, ^ СаС + С02 С02 -> СО + О
Находясь в атомарном состоянии, газы становятся химически активными и, реагируя с металлом, резко ухудшают его качество.
Окисление металла ари сварке. Металл сварочной ванны может окисляться за счет кислорода, содержащегося в газовой среде и шлаках в зоне сварки. Кроме того, окисление может происходить и за счет оксидов (окалины, ржавчины), находящихся на кромках деталей и поверхности электродной проволоки. При нагреве имеющаяся в ржавчине влага испаряется, молекулы воды диссоциируют, а получающийся кислород окисляет металл. Окалина при плавлении металла превращается в оксид железа также с выделением свободного кислорода. При недостаточной защите сварочной ванны окисление происходит за счет кислорода воздуха.
Кислород с железом образует оксиды: FeO (22,3% 02), Fe304 (27,6% 02), Fe203 (30,1% 02). При высокой температуре сварочной дуги за счет атомарного кислорода в результате реакции Fe + О
FeO образуется низший оксид, который при понижении температуры может переходить в другие формы высших оксидов.
Наибольшую опасность для качества шва представляет оксид FeO, способный растворяться в жидком металле. Этот оксид обладает температурой плавления меньшей, чем у основного металла. Поэтому при кристаллизации металла шва он затвердевает в последнюю очередь. В результате он располагается в виде прослоек по границам зерен, что вызывает снижение пластических свойств металла шва. Чем больше кислорода в шве находится в виде FeO, тем сильнее ухудшаются его механические свойства. Высшие оксиды железа не растворяются в жидком металле и, если они не успевают всплывать на поверхность сварочной ванны, остаются в металле шва в віще шлаковых включений.
Железо может окисляться также за счет кислорода, содержащегося в С02 и парах воды Н20:
Fe + C02^Fe0 + C0 Fe + Н20 FeO + Н2
В процессе-сварки кроме железа окисляются и другие элементы, находящиеся в стати,— углерод, кремний, марганец. При переходе капель электродного металла в дуге окисление элементов происходит в результате взаимодействия их с атомарным кислородом газовой среды дугового промежутка: С + О -> СО, Мп + О -> > MnO, Si 20 > Si02.
В сварочной ванне элементы окисляются при взаимодействии их с оксцдом железа:
С + FeO СО + Fe Mn + FeO MnO + Fe Si + 2FeO ^ Si02 + 2Fe
Окисление этих элементов приводит к уменьшению их содержания в металле шва. Кроме того, образующиеся оксиды могут оставаться в шве в виде различных включений, значительно снижающих механические свойства сварных соединений, особенно пластичность и ударную вязкость металла шва. Повышенное содержание кислорода вредно влияет и на другие свойства —уменьшает стойкость против коррозии, повышает склонность к старению металла, сообщает ему хладноломкость и красноломкость. Поэтому одним из условий получения качественного металла шва является предупреждение окисления его в первую очередь путем создания различных защитных сред.
Раскисление металла при сварке. Применяемые при сварке защитные меры не всегда обеспечивают отсутствие окисления расплавленного металла. Поэтому его требуется раскислить. Раскислением называют процесс восстановления железа из его оксида и перевод кислорода в форму нерастворимых соединении с последующим удалением их в шлак. Окисление и раскисление, в сущности, представляют два направления протекания одного и того же химического процесса. В общем случае реакция раскисления имеет вид FeO + Me^^Fe + МеО, где Me — раскислителъ.
Раскислителем является элемент, обладающий в условиях
сварки большим сродством к кислороду, чем железо. В качестве раскислителей применяют кремний, марганец, титан, алюминий, углерод. Раскислители вводят в сварочную ванну через электродную проволоку, покрытия электродов и флюсы. Ниже приведены наиболее типичные реакции раскисления.
Раскисление марганцем: Fe + Mn^^Fe + MnO.
Оксид марганца малорастворим в железе, но сам хорошо раст воряет оксид железа FeO, увлекая его за собой в шлак.
Раскисление кремнием: 2FeO + Si^=^2Fe + Si02.
Оксид кремния плохо растворим в железе и всплывает в шлак. Раскисление кремнием сопровождается реакциями образования более легкоплавких комплексных силикатов марганца, кремния и железа, которые лучше переходят в шлак:
MnO + Si02 = MnO - Si02 FeO + Si02 = FeO • Si02
Раскисление титаном: 2FeO + Ті = 2Fe + TiO.
Титан — энергичный раскислителъ, при этом образуются легкоплавкие титанаты марганца и железа:
МпО + ТЮ2 — МпО • ТЮ2 FeO + ТЮ2 = FeO • ТЮ2
Марганец, кремний и титан вводят в сварочную ванну через электродную проволоку, легируя ее через покрытие электрода или флюс, вводя соответствующие ферросплавы.
Раскисление углеродом: FeO + С = Fe + СО.
Образующийся оксид углерода выделяется в атмосферу в газообразном состоянии, вызывая сильное кипение сварочной ванны и
образуя поры в шве. Для получения плотных швов реакцию раскисления углеродом следует «подавить» введением в сварочную ванну других раскислителей, например кремния.
Взаимодействие с азотом. Азот воздуха, попадая в столб дуги, ра«огревается и частично диссоциирует. В атомарном состоянии njor растворяется в жидком металле. В процессе охлаждения азот выпадает из раствора и взаимодействует с металлом, образуя ряд соединений —нитридов Fe2N, Fe4N. Атомарный азот может соединяться и с кислородом, образуя оксид азота NO, который, растворяясь в каплях электродного металла, переходит в сварочную ванну. Содержание азота в металле шва вредно влияет на его механические свойства, особенно пластичность. Кроме того, насыщение металла азотом способствует образованию газовых пор. С'нижение азота проводят для защиты расплавленного металла от воздуха или введения в него химических элементов, удаляющих азот к виде неметаллических включений.
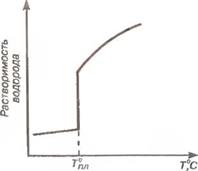
Взаимодействие с водородом. Водород может попасть в зону сварки из влаги покрытия электрода или флюса, ржавчины на поверхности сварочной проволоки и детали, из воздуха. Атомарный водород хорошо растворяется в жидком металле, и с увеличением температуры нагрева растворимость увеличивается. Важной закономерностью в поведении газов является скачкообразное изменение их растворимости в металле при фазовых изменениях его и особенно при переходе из жидкого состояния в твердое (рис. 6.1).
При охлаждении и кристаллизации сварочной ванны выделяющийся водород не успевает полностью удаляться из металла шва. ію приводит к образованию в нем газовых пор. Кроме того, атомы водорода, диффундируя в имеющиеся полости и несплошности в затвердевающем металле, приводят к повышению в них давления, развитию вчметаллс внутренних напряжений и образованию микротрещин. Снижение газснасыщения швов проводят за счет качественной защиты расплавленного металла при сварке очисткой и прокалкой свариваемого и сварочных материалов.
Реакции с серой и фосфором.
 Сера является вредной примесью в сталях. В сварочную нанну она попадает из основного металла, сварочной проволоки и иногда из покрытия электродов или флюса. В металле сера может находиться в виде соединений —сульфидов.
Сера является вредной примесью в сталях. В сварочную нанну она попадает из основного металла, сварочной проволоки и иногда из покрытия электродов или флюса. В металле сера может находиться в виде соединений —сульфидов.
Особо вреден сульфид железа FcS, хорошо растворимый в железе. Наличие в металле шва серы снижает его механические свойства и сильно повышает
СКЛОННОСТЬ К образованию Трс - Рис. (i. l. Растворимость полпреда в ЩИН - Поэтому десульфурация, отрицаемом металле
очистка металла от серы, имеет целью уменьшение общего содержания серы в шве и особенно FeS. Десульфурацию проводят введением в сварочную ванну элементов, имеющих большее сродство к сере, чем железо. Образующийся сульфид элемента должен плохо растворяться в металле и хорошо в шлаке. Таким элементом
является марганец, обладающий большим сродством к сере. Сульфид марганца не растворяется в металле, имеет малую плотность и легко всплывает в шлак сварочной ванны.
Процесс идет по реакциям
FeS + Мп — MnS + Fe FeS Р MnO = MnS + FeO
Такого же эффекта достигают введением кальция по реакции FeS + СаО = FeO + CaS.
Оксид кальция получают разложением в дуге мрамора СаС03.
Реакции с фосфором. Фосфор также вредная примесь в сталях. Пути попадания его в шов те же самые, что и для серы. В металле фосфор находится в виде соединений — фосфидов железа с температурой плавления много ниже, чем у железа (1170°С):
3Fc ч Р — Fc3P
2Fe + Р = Fe3P
Фосфор в металле шва располагается по границам зерен в виде легкоплавкой прослойки и приводит к сильной неоднородности металла, росту зерен и снижению пластичности, особенно при низких температурах, вызывая хладноломкость металла. Удаление фосфора проводят его окислением и последующим связыванием в прочное соединение, удаляемое в шлак:
2Fe2P + 5FeO = Р205 + 9 Fe
2Fe3P + 5FeO = P205 + 11 Fe
Затем происходит связывание оксида фосфора по реакциям
ЗСаО + Р205 = Са3Р20><
4СаО t P2Os = Са4Р209
Полученные соединения выводятся в шлак.

 Опубликовано в
Опубликовано в