ОДНОАТОМНЫЕ ФЕНОЛЫ
 19 апреля, 2013
19 апреля, 2013  admin
admin Для получения продуктов конденсации с формальдегидом используются следующие одноатомные фенолы: фенол (карболовая кислота), о-, м - и тг-крезолы, 2,3-, 2,4-, 2,5-, 2,6-, 3,4- и 3,5-кси - ленолы.
Получение фенолов из продуктов перегонки каменноугольных смол
В странах с богатыми запасами каменного угля фенолы получают из каменноугольной смолы, а в ГДР — почти исключительно из смолы бурого угля или из сточных вод полукоксования. В каменноугольной смоле коксохимического производства содержится от 0,01 до 0,1% фенолов, в продуктах полукоксования — от 0,5 до 0,7%, в масле, образующемся при гидрогенизации, и в сточной воче вместе взятых — от 0,8 до 3,7%. В смоле бурого угля и в сточных водах полукоксования содержится от 0,1 до 0,4% фенолов, в жидкофазном масле и в сточной воде — от 0,8 до 3,8%.
При дистилляции смолы выделяются легкие, средние и тяжелые масляные фракции. В среднем масле (фенольная фракция, температура кипения 190—225 °С) содержатся фенолы и пиридиновые основания. Часть фенолов из неочищенных паров при охлаждении растворяется в конденсате. Поскольку фенолы являются мал о летучими продуктами, то после отгонки аммиачной воды они
Со сточной водой и& дистилляционной колонны поступают в водосборники, что может приводить к загрязнению водоемов. Концентрация фенола порядка 3—5 мг/л уже губительна для рыб., Поэтому сточные воды коксохимических производств необходима обеЬфеноливать.
В настоящее время в ГДР из жидких продуктов коксования, полукоксования и гидрогенизации бурого и каменного углей, а также из сточных вод этих производств получают основное количество потребляемых фенола, крезолов и ксиленолов. Существуют следующие способы извлечения фенолов:
Экстракция едким натром из смол переработки угля; экстракция сульфидом натрия из фенолсодержащих масел жидких продуктов перегонки;
Экстракция бутилацетатом или смесями эфиров высших алифатических спиртов из сточных вод (фенолосольватный способ)- В производственном объединении «ЕтвсЬег» (ГДР) применяется способ, по которому охлажденный конденсат, содержащий в среднем 2 г/л фенола, экстрагируют бензолом. Фенолы из бензола извлекают едким натром. Ежегодно из сточных вод коксохимических производств выделяют приблизительно 8000—9000 т сырого* фенола. Сырой фенол может быть получен также из масляной фракции (температура кипения 160—210 °С) путем экстракции под давлением обесфеноленной водой, используемой в качестве растворитёля. В способе обесфеноливания экстрагентом
Служит 80—90%-ный метанол.
Получение фенолов из продуктов нефтепереработки
При каталитическом крекинге нефти выделяется смесь побочных продуктов, таких как фенолы, крезолы, ксиленолы и высоко - кипящие фенольные соединения, из которой перечисленные вещества извлекаются для дальнейшей переработки [1]. Механизм образования этих фенолов был исследован в присутствии катализаторов на основе А1203 при 455 °С и давлении 3 кгс/см2. Показано, что при добавлении воды к нефти содержание фенола увеличивается. В присутствии 5% воды оно возрастало вдвое, а при последующем добавлении приближалось к некоторому пределу. Вода влияла на содержание фенолов лишь в присутствии катализаторов крекинга. Добавление воды увеличивало также' степень превращения содержащихся в нефти эфиров. Воздух и нафтен^т меди в отличие от воды на выход фенола влияния не оказывали^
Из нефтей с высоким содержанием ароматических углеводородов выделялось больше фенола. Повышение температуры крекинга приводило к более интенсивному фенолообразованию. Эти результаты указывают на то, что фенолы образуются из кислородсодержащих соединений с большой молекулярной массой, уже имеющихся в исходном продукте в виде эфиров и (или) гетероциклических соединений. Исследования дифенилового эфира и алкил- фениловых эфиров подФверждают это предположение.
Синтез фенола
Фенол был обнаружен Рунге в 1834 г. в каменноугольной смоле и назван им карболовой кислотой. В 1867 г. его синтезировали путе1у1 щелочного плавления бензолсульфокислого натрия. Однако лишь незадолго до начала XX столетия решили приступить к промышленному производству фенола по этому способу в связи с большой потребностью в сырье для получения пикриновой кислоты.
После второй мировой войны спрос на фенол резко возрос. В 1964 г. мировой объем производства фенола составил [2]: способом Рашига — около 122 тыс. т, кумольным способом — около 725, хлорированием — около 146, сульфированием — около 180, толуольным способом — около 106,9 и окислением бензола — около 9 тыс. т. За период 1968—1975 гг. 79% фенола было получено кумольным способом, 9% — толуольным, 5% — хлорированием* и сульфированием бензолги^! 7% — из каменноугольной смолы (48 тыс. т).
В существующих способах производства фенола используется главным образом бензол. Недавно для синтеза фенола начали применять значительно более дешевый продукт — толуол. В промышленности помимо старого способа Рашига применяются следующие:
Сульфирование бензола с последующим щелочным плавлением ’бензолсульфокислого натрия; /
Щелочной гидролиз хлорбензола (способ Дау); модифицированный способ Рашига (процесс Хукера); разложение перекиси кумола на фенол и ацетон; окислительное декарбоксилирование бензойной кислоты, разработанное фирмами «California Research Corp.» и «Dow Chemical Clorp.»;
Толуольный способ.
Несомненно, все большее значение будет приобретать процесс Хукера, характеризующийся отсутствием побочных продуктов, а также окислительное декарбоксилирование бензойной кислоты, при котором побочным продуктом является сама бензойная кислота.
Помимо перечисленных выше известны другие способы, которые пока еще не применяются в промышленности.
Сульфирование бензола с последующим щелочным плавлением бензолсульфокислого натрия [3]
Реакция
' ' ' C6H5S03Na + 2Na0H -------- ► CeH5ONa+ Na2S03 + H2Q
(взаимодействие бензолсульфокислого натрия и едкого натра в расплаве) была открыта Вюрцем и Кекуле еще в 1867 г. В отсутствие кислорода воздуха выход продуктов может быть более 95%.
Бензол пропускают непрерывно через концентрированную серную кислоту, нагретую до 150 °С. Образующаяся при этом бензолсульфокислота нейтрализуется сернистокислым натрием, выделяющимся при щелочном плавлении, или углекислым натрием. Окончательную нейтрализацию проводят углекислым кальцием, причем выделяющийся С02 затем используют для нейтрализации раствора фенолята натрия. Гипс отделяется как побочный продукт.
TOC o "1-5" h z ЗСзНбЗО3Н -(- N^28 О3 >- 2СвНб80з^+ 802 + Н20 (1^
Оог. 44 0 °Г
СбН58’ОзКа+2Ка'ОН ------------- СбН5(Жа + Ка2803 + Н20 (2)
Сернистый ангидрид и пары воды, образующиеся по реакции (1), служат для выделения фенола из раствора фенолята:
2С6Н5ОКа+802 + Н2О —► 2СбН5ОН + №2803 (3)
Побочными продуктами являются: оксидифенилы', дифенил - сульфон, дифениловый эфир, органические соединения серы (например, дифенилсульфид), углекислый натрий, гипс и избыточное количество сернистокислого натрия. Сульфат натрия (Ка2803) продается целлюдозным заводам.
Преимущества этого способа — простое аппаратурное оформление, чистота фенола, практически не содержащего серы, и высокий выход — более 90%.
Не представляют больших трудностей дальнейшее упрощение технологического процесса и экономия серной кислоты и щелочи. Так, серную кислоту можно сэкономить за счет использования олеума вместо моногидрата и за счет удаления реакционной воды, образующейся при сульфировании. Согласно Гайоту [4], можно сэкономить половину серной кислоты, если реакционную воду, образующуюся. при сульфировании, удалять парами бензола.
Если перегретый водяной пар пропускать через расплавленный фенолят натрия, последний частично гидролизуется, выделяется фенол, а в расплаве остаются ионы натрия в виде КаОН и бензол- сульфокислый натрий. На этом основан непрерывный способ [51 получения фенола. При относительно высоком расходе энергии при данной технологии экономится 1 моль КаОН на моль фенола*
ЩелочноЗ гидролиз хлорбензола & |(способ Дау) [6]
В 1872 г. Дусарт и Барди показали, что хлорбензол разлагается водным раствором каустической соды на фенолят натрия и поваренную соль при 300 °С. Способ получения фенола подобным образом заключается в электролизе поваренной соли с одновременным хлорированием бензола. Экономически он оправдан только при наличии исходного сырья.
Способ щелочного гидролиза хлорбензола привлек к себе внимание особенно после того, как Эйлсворту [7] удалось осуществить непрерывную реакцию хлорбензола с водным раствором щелочи при подаче смеси реагентов при 340—390 °С чррез систему труб под высоким давлением. Ниже приведены уравнения протекающих при этом реакций:
Электролиз 2^С1 + 2Н20-------------- С12- + 2КаОН + Н2
Хлорирование бензола С6Нб+С12 С6Н5С1 + НС1
Получение фенола С6Н5С1 + 2^0Н —^ С6Н5ОКа+ ШС1-Ь Н20
C6H50Na + HCl —► С6Н5ОН + ^С1
Суммарно СбНб-}-Н20 —.......... > СбН50Ы-|-Н2
Побочными продуктами процесса являются дифениловый эфир и оксидифенилы.
Количество образующегося дифенилового эфира можно регулировать изменением параметров реакции, и так как дифениловый эфир может расщепляться в условиях реакции с образованием фенолята натрия, то он снова можеОринимать участие в реакции. Выделяющийся оксидифенил (примерно 7 % от массы получающегося фенола) практически не оказывает влияния на качества конечного продукта. Соотношение о - и тг-оксидифенилов зависит от материала, из которого изготовлен автоклав.
Хлорбензол, каустическая сода и в случае необходимости — дифениловый эфир дозировочными насосами подаются в смеситель, где они интенсивно перемешиваются, после чего нагнетаются в автоклав насосами высокого давления. Автоклав состоит из трубы высокого давления длиной около 100 м. Реакция протекает при 360—390 °С и давлении 280—300 кгс/см2. Вслед за отделением дифенилового эфира проводят нейтрализацию (pH = 6—7) соляной кислотой, образовавшейся при хлорировании бензола,' затем отделяют и очищают фенол. Хлорбензол получают в присутствии катализатора РеС12 (0,1%) при 60—70 °С.
Модифицированный способ Рашига (процесс Хукера)
На первой стадии бензол превращается в хлорбензол при пропускании через него хлористого водорода и воздуха в присутствии хлоридов меди и железа, являющихся катализаторами:
С6Н6 + НС1 + 1/202 —* С6Н5С1 + Н20
На второй стадии происходит омыление хлорбензола водяным паром при 500 °С в присутствии кремневой кислоты (или трифос - фата кальцйя)
С6Н5С1 + Н20 —► С6Н5ОН + НС1
CeH6-f i/2Oa —► СвН5ОН
В 1914 г. Мейер и Бергиус проводили гидролиз хлорбензола водяным паром. Выход фенола не превышал 20%.
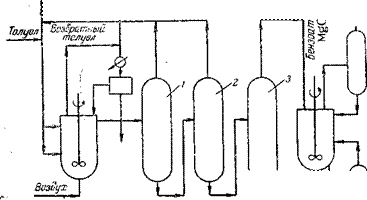
Способ, осуществленный Рашигом в 1935—45 гг. на опытной установке производительностью 5 т/сут [8], был модифицирован и освоен в промышленном масштабе фирмой «Hooker Chem. Со» [9]. Схема технологического процесса получения фенола по способу Рашига представлена на рис. 1.1.
|
Отходящие Газы
Рис. 1.1. Получение фенола по способу Рашига: 1 — холодильник; 2 — смеситель; з — разделитель; 4 — реактор хлорирования; 5 — подогреватель; 6 — гидролизный аппарат. |
Преимуществами процесса Хукера перед старым способом Рашига являются селективность катализатора; то, что выделяющийся дихлорбензол превращается в фенол, а также технологические усовершенствования, касающиеся аппаратов перегонки, упрощения конструкции катализаторного отсека [10] и отвода тепла во время экзотермической реакции. Применение хрома и тантала наряду с керамическими материалами уменьшает коррозию аппаратуры.
Хлорирование бензола проводят в стальном реакторе с воздушным охлаждением при 230 °С. Для этого бензол нагревают до 290 °С и перемешивают с горячим воздухом (150 °С) и с соляной кислотой, нагретой до 110 °С. Соотношение бензол : воз-
Дух : 16,5%-ная соляная кислота составляет 10 : 2,18 : 3,05 масс, ч - Смесь при 210 °С подают в реактор для хлорирования, где значительная часть тепла отводится с помощью воздушного охлаждения. Катализатор хлорирования получается осаждением окиси алюминия из раствора алюмината натрия под воздействием солянокислого раствора СиС1/РеС13. Катализаторы, получаемые пропиткой окиси алюминия хлоридами меди и железа, здесь непригодны [11].
Гидролиз хлорбензола проводят водяным паром при 420 °С в присутствии трифосфата кальция. Выход фенола составляет около 80%, что, однако, при 10—15% за проход на обеих стадиях является очень низким показателем. Поэтому, чтобы процесс был рентабельным, следует пропускать большие объемы исходных компонентов.
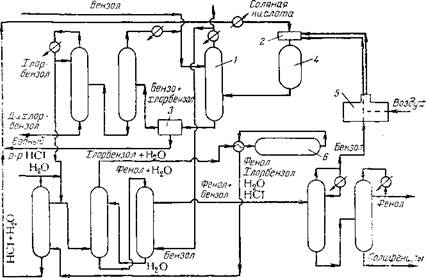
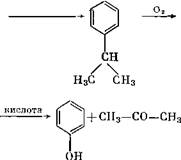
Разложение перекиси кумола на фенол и ацетон (кумольный способ)
Хоком и Лангом [12] было обнаружено, что если кумол при повышенной температуре окислять воздухом или кислородом п воздействовать на него ультрафиолетовыми лучами, то обра-
|
Рис. 1.2. Получение фенола из кумола: і — реакторы; 2 — аппарат для гидрирования; 3 — концентратор; 4 — аппараты для - промывки; 5 — колонна ацетона; 6 — колонна кумола; 7 — колонна а-метилстирола; 8 — колонна фенола; 9 — разделитель. |
Зуется гидроперекись, которая в присутствии кислоты распадается ка фенол и ацетон. Промышленное получение фенола указанным способом освоили фирмы «Hercules Powder» (США) и «Distillers Сотр.» (Англия) *. Технологическая схема процесса приведена на рис. 1.2.
* Промышленное производство фенола и ацетона кумольным методом ’“ыло осуществлено в СССР в 1949 г. П. Г. Сергеевым, Б. Д. Кружаловым 4 Р. Ю. Удрпеом. — Прим. ред.
В 1953 г. выдала первую продукцию установка фирмы «В. А. Shawinigan 1Л;с1.» (Канада) производительностью 8000 т/год. Благодаря доступности нефтехимического сырья, незначительной коррозии аппаратуры в процессе переработки, возможности проведения всех стадий процесса в умеренных условиях, описанный способ получения фенола занял ведущее место среди всех остальных.
Технологический процесс складывается из следующих стадий: получение кумола (изопропилбензола) путем алкилирования бензола пропиленом;
Окисление кумола кислородом или воздухом в гидроперекись кумола;
Кислотное разложение гидроперекиси на фенол и ацетон. Схематически это можно представить следующим образом:
|
|
|
F |+СН2=СН-СНа |
|
Катализатор |
-О—О—Н
Окисление бензола в фенол сопровождается окислением пропилена в ацетон. В ходе исследования процесса выяснилось, что щелочи стабилизируют окисление кумола в гидроперекись, а добавление небольшого количества гидроперекиси или введение озона ускоряет окисление; кроме того, в присутствии щелочи ускоряется автоокисление кумола. Однако повышение концентрации щелочи способствует распаду перекиси [13].
Кумол получают алкилированием бензола пропиленом в присутствии катализаторов Фриделя — Крафтса — А1С13, H2S04, Н3Р04. При использовании в качестве катализатора фосфорной кислоты на кизельгуре объемное соотношение бензол : пропилен составляет 5 : 1, в случае H2S04 — от 5 до 6 : 1 и в случае А1С13 — от 4,5 до 4,7 : 1.
Алкилирование в присутствии А1С13 проводят в реакционных колоннах при 50—70 °С при нормальном давлении. Преимущество использования А1С13 заключается в том, что в этом случае ускоряется алкилирование бензола диалкилбензолами, которые могут быть возвращены в процесс. Применяемый бензол должен быть химически чистым и обязательно свободным от тиофена во избежа-
Ние образования изопропилтиофена, ингибирующего автоокисление. Для получения кумола используются также пропилен - пропановые смеси, содержащие 40—55% пропилена.
Кумол, образующийся при непрерывном жидкофазном алки - лировании бензола пропиленом, проходя снизу вверх через несколько циркуляционных колонн высотой 8—10 м, окисляется в водно-щелочной эмульсии при pH = 8,5—10,5 воздухом в перекись при избыточном давлении порядка 4—6 кгс/см2 и температура 110—130 °С. Для перемешивания реагентов применяют воздух (по принципу аэрлифта).
При увеличении содержания перекиси в реакционной смеси возрастает и выход побочных продуктов, поэтому содержание перекиси к концу реакции составляет всего 25—30%. Чтобы снизить выход побочных продуктов до минимума, окисление нередко проводят в несколько стадий.
Опасность взрыва в газовой фазе окислительной установки [пределы взрываемости смеси паров кумола и кислорода при нормальном давлении - составляют 1,5—43% (объемн.) кумола! устраняется за счет введения в газовую фазу 10—20% водяного пара, который служит одновременно для удаления образующейся при окислении муравьиной кислоты.
С целью предотвращения разложения гидроперекиси следами образующейся кислоты добавляют небольшое количество щелочи (соды) в качестве стабилизатора.
Реакцию разложения гидроперекиси в присутствии кислотного катализатора можно проводить двумя способами: либо в гомогенной среде, при этом избыток продукта разложения — ацетона используется в качестве растворителя для гидроперекиси и кислоты [14], либо в двухфазной системе, когда'неочищенный продукт окисления механически распределяется в водной и кислотной фазах [15]. Катализаторами разложения помимо Н2304 могут быть все сильные кислоты и кислоты Льюиса. Скорость разложения перекиси с увеличением концентрации кислоты возрастает.
На первой стадии разделения продуктов разложения содовым раствором и водой удаляют кислоту. Свободная от кислоты смесь содержит ацетон, фенол, кумол и побочные продукты (а-метил - стирол, ацетофенон, фенилдиметилкарбинол, а-кумилфенол). Затем вакуумной перегонкой разделяют следующие фракции:
Кумол (основное количество), загрязненный а-метилстиролом и незначительным количеством фенола;
Фенол (основное количество, 98—99%-ный); а-метилстирол с незначительным содержанием кумола; ацетофенон (и фенол); фенилдиметилкарбинол.
Кубовый остаток состоит преимущественно из а-кумилфенола, который при нагревании может расщепляться на фенол и а-метилстирол.
Кумол возвращают в цикл окисления. Выделяющийся в больших количествах а-метилстирол либо гидрируют, либо используют в качестве компонента при сополимеризации.
Окислительное декарбоксилирование бензойной кислоты [2]
Промышленное значение окислительного декарбоксилирова - ния бензойной кислоты еще не оценено в полной мере, хотя побочным (промежуточным) продуктом процесса получения фенола
Отработанный
|
Фенол на о и и. с тку |
![]() Воздух
Воздух
|
Ш спирт кислота |
![]()
|
Т**ї L |
![]()
|
Окисление Толуола |
![]()
|
Окисление бензойной кислоты |
![]()
|
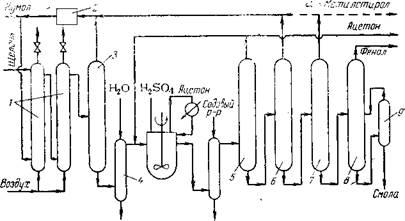
Рис. 1.3. Получение фенола из толуола: колонна толуола; 2 |
![]()
 КоШьтоЗый I оензальдегад бензойная
КоШьтоЗый I оензальдегад бензойная
|
Y |
![]() Каташзиглоп Бензило£м
Каташзиглоп Бензило£м
Колонна побочного продукта; з — колонна бензойной кислоты; 4 — осадите ль.
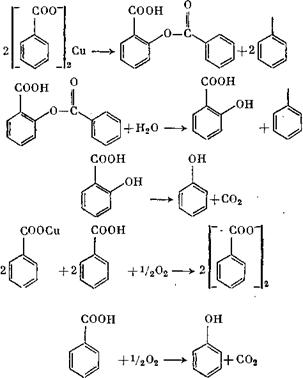
Является лишь одна бензойная кислота, которая повторно вводится в технологический цикл
Фирмы «California Research Corp.» и «Dow Chem. Corp.» разработали двухстадийный способ производства фенола из толуола U6] (рис. 1.3). Толуол превращают в бензойную кислоту путем жидкофазного окисления воздухом в присутствии растворимого в толуоле кобальтового катализатора. Процесс протекает при 140 °С и избыточном давлении 2,5—3 кгс/см2. От полученной смеси отгоняют толуол, бензиловый спирт и бензальдегид, которые возвращают на окисление, а затем отгоняют бензойную кислоту, выход которой составляет 85—90%.
Способ Дау [17] предусматривает жидкофазное окисление толуола в присутствии солей марганца, активированных бромом, или солей кобальта, активированных кетонами. Окисление бензойной кислоты в фенол (или в фениловый эфир бензойной кислоты) катализируется ионами Си2+ и протекает с отщеплением двуокиси углерода. Регенерация ионов Си2+ осуществляется
кислородом. Каталитическое действие ионов меци может быть усилено добавками ионов натрия, калия, лития, бария и особенна марганца и кобальта. Фениловый эфир бензойной кислоты гидролизуется водяным паром.
Процесс получения фенола описывается следующими реакциями:
|
СООСи |
![]()
|
СООН |
![]()
|
Или суммарно |
![]()
|
Си + Н20 |
(2>
(3>
(4>
(5>
Бензоилсалициловая кислота [реакция (1)] разлагается водяным! паром на бензойную и салициловую кислоты (2); салициловая кислота быстро декарбоксилируется на фенол и С02 (3). Бензоат меди регенерируется продуваемым воздухом (4). Механизм реакции (6) выглядит следующим образом: атом кислорода при распаде соли меди атакует смежное с СООН-группой положение в бензольном кольце:
' О
|
|
|
|
|
|
![]()
![]()
Этот механизм был доказан Шоо [20] с помощью бензойной кислоты, меченной атомом 14С.
Установлено, что бензойная кислота частично превращается в фенол при пиролизе бензоата меди; при этом кроме незначительных количеств фенола могут образовываться салициловая кислота и фенилбензоат, о чем свидетельствуют соответствующие инфракрасные спектры [18-— 21].
Аналогично получали крезолы окислением толуиловых кислот. Из о - и тг-толуиловых кислот образовывается только ж-крезол, из ж-толуиловой кислоты — смесь о - и /г-крезолов. Таким же образом может быть получен ряд алкилзамещенных бензойной кислоты и соответствующих фенолов. Окисление псевдокумола ведет к образованию трех изомеров диметилбензойной кислоты, из которых можно получить изомеры ксиленола.
При замещении водорода ароматического кольца толуола алкильными группами, содержащими два или несколько атомов углерода, и последующем окислительном декарбоксилировании образуется сложная смесь продуктов. Исключение составляют третичные бутиловые группы, стойкие к окислению в данных условиях [22]. Так, п-трет-бутилтолуол превращается в п-трет- бутилбензойную кислоту, которая затем превращается в м-трегп- бутилфенол.
К другому варианту описанного способа получения ^фенола относится окислительное декарбоксилирование ароматических кетоцов [23].
Способы получения фенола, еще не используемые в промышленности
Прямое окисление бензола [24]. Предпринимались неоднократные попытки прямого окисления бензола, однако до сих пор этот метод не получил промышленного применения. Основная трудность — стадия окисления фенола, которая сопряжена с большими потерями целевого продукта. Прямое окисление бензола станет возможным при наличии достаточного количества сырья. В настоящее время действует опытная установка производительностью 10 тыс. т/год [25], в которой бензол подвергают жидкофазному окислению под действием у - излучения 60Со. При парофазном окислении бензола при 500 °С, незначительном избыточном давлении и 8—10%-ном превращении за проход выход фенола может достигать 70%. В качестве катализаторов применяются соли кобальта, AgNOз и У205.
В газовой фазе окисление бензола проводят воздухом при 600—800 °С без катализатора. При использовании окислов азота в качестве катализаторов температура реакции составляет 600— 750 °С [26].
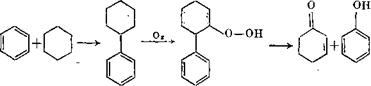
Модифицированный кумольный способ [27]. Способ кислотного разложения гидроперекиси циклогексилбензола разработан фирмой' «Мопіесаіїпі». Циклогексан присоединяется к бензолу, в результате чего образуется циклогексилбензол, который окисляется в гидроперекись, разлагающуюся на фенол и циклоге - ксанон:
|
|
Окисление циклогексани [28]. Циклогексан окисляют в цикло - гексанол и дегидрируют в фенол. Для гидрирования бензола при получении циклогексана используют водород. Этот способ был разработан для получения капролактама из циклогексанона, образующегося в результате окисления циклогексанола. Способ может быть использован и в производстве фенола:
|
|
|
ОН |
|
ОН |
|
;+зн2 |
При окислении циклогексана воздухом образуется смесь циклогексанола и циклогексанона. Дегидрирование проводят в жидкой фазе в присутствии платинового катализатора [17].

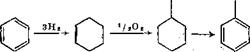
 Опубликовано в
Опубликовано в