ОБЩИЕ ПОНЯТИЯ ОБ ЭЛЕКТРОХИМИЧЕСКОМ. ГЕНЕРАТОРЕ
 27 октября, 2015
27 октября, 2015  Mihail Maikl
Mihail Maikl 1.1. ОСНОВНЫЕ ПРОЦЕССЫ В ТОПЛИВНОМ ЭЛЕМЕНТЕ
Основными типами ЭХГ, созданными в мире, являются водородно-кислородные (воздушные) системы с пористыми электродами (щелочной электролит) или с ионообменными мембранами (кислый электролит). Рассмотрим процесс в единичном топливном элементе (ТЭ), входящем в состав ЭХГ.
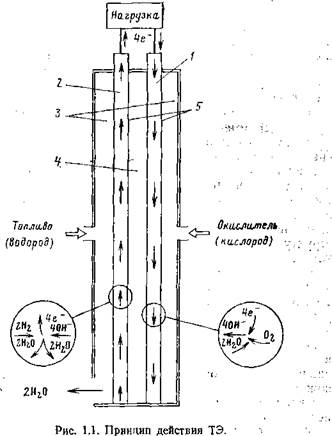
С общих позиций процесс генерирования в ЭХГ может быть описан как процесс обмена электронами между горючим и окислителем с образованием нового химического соединения— продукта реакции (рис. 1.1). В зависимости от структуры реагентов реакция на электродах - ТЭ протекает по различным промежуточным стадиям. Так, для водородно-кислородного ЭХГ реакция на кислородном электроде имеет вид
(реагент) 02 + 2H20+4e--v40H~ и на водородном электроде
(реагент) 2Н2 + 40Н-^-4Н20 + 4е_.
Таким образом, суммарная реакция в элементе
2Н2+Ог^-2Н20 (продукт реакции).
Результатом реакции является переток (каналирование) электронов внутри молекулярных структур с уровней, где они обладали большим запасом энергии (уровни энергий электронов, расположенных на валентных орбитах исходных продуктов реакции), на уровни с меньшим запасом энергии (валентные электронные уровни конечных продуктов реакции). Таким образом, образуются новые молекулярные структуры (продукты реакции) из ранее существовавших молекулярных структур (реагирующих веществ). Если реакция неорганизованная (с точки зрения сбора и распределения электри - 8
ческих зарядов), между продуктами реакции происходи!1 хаотический обмен электронами. Выделяющаяся энергия за счет соударений между молекулами расходуется на повышение кинетической энергии реагирующих молекул— конечных продуктов реакции (тепловой процесс), а также рассеивается излучением.
|
/ — катод; 2— анод; — газовые камеры; 4 — электролит; 5 — катализированные электроды. |
Задача заключается в обеспечении рационального протекания процесса через такие промежуточные акты реакции (например, предварительную ионизацию, гетерогенный катализ и др.), которые могли бы привести к минимальным потерям энергии при «коммутации»
Электронов в конструкции ЭХГ перед выводом их во
внешнюю электрическую цепь. Одной из актуальных проблем является возможно более полное использование потенциала процесса, соответствующего свободной энергии химической реакции (приближение рабочего напряжения ЭХГ к его ЭДС). Однако свободная энергия при химических реакциях не превышает долей или единиц электрон-вольт. Этой энергии часто бывает недостаточно, например, для преодоления пороговых барьеров в актах промежуточных превращений. Малый энергетический потенциал (малые значения ЭДС процесса) и приводит к затруднениям в разработке рациональных путей использования этой энергии. Эти проблемы относятся к проблемам, исследуемым теорией катализа.
В традиционных химических источниках тока (аккумуляторах), имеющих твердофазные активные материалы на пути электронных переходов, энергетические барьеры возникают на границе твердая фаза — раствор. Физический смысл затруднения кинетической интерпретации состоит в том, что электрические свойства обеих твердофазных границ в процессе генерирования энергии непрерывно изменяются по законам, не учитываемым современной теорией, а именно изменяется не только структура, но и химический состав твердой фазы, так как катод непрерывно (пропорционально количеству Прошедшего электричества) обогащается металлом, а анод — окислителем (например, кислородом); рождается новая твердая фаза, электрическое поведение которой с точки зрения современной теории твердого тела не поддается прогнозу: переток электрических зарядов (ионов) через систему, представляющую собой, как правило, многослойную среду, происходит в сложных нестационарных условиях переноса энергии и вещества, сопровождается разрывами сплошности потенциала и соответствующими скачками коэффициентов переноса (при нелинейных граничных условиях).
Современная теория в кинетическом плане не в состоянии решить рассматриваемые проблемы. Химическая термодинамика дает возможность теоретически оценить лишь запасы энергии в исходных продуктах и потенциал процесса (ЭДС). Законченной теории, позволяющей рассчитывать рабочее напряжение ЭХГ, количественно предсказывать расходные коэффициенты горючего и окислителя и КПД реакции или хотя бы прогнозировать вероятность ее протекания, не создано. Отсутствуем
ют также [1.1, 1.2] законченные теории растворов и
катализа.

 Опубликовано в
Опубликовано в