НАФТАЛИН
 18 августа, 2013
18 августа, 2013  admin
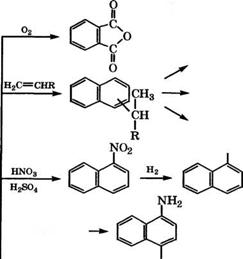
admin Основные направления применения нафталина представлены на схеме (рис. 16).
Одной из важнейших областей промышленного использования нафталина является окисление до фталевого ангидрида. Окисление нафталина проводится парофазным способом на вана - дий-калийсульфатном катализаторе в стационарном или псевдо - ожиженном слое [1]:
О
II
+ 4-502 — а: > +2С02 + 2Н20
Н
Выход фталевого ангидрида на этом катализаторе составляет
86- 89 %, производительность по продукту 40 кг/ч на 1 м3 катализатора. Побочными продуктами процесса являются 1,4-наф - тохинон, малеиновый ангидрид, С02.
Модифицирование катализатора позволило повысить его производительность до 50-55 кг/(ч • м3) и выход фталевого ангидрида до 90-94 %. Процесс окисления происходит при массовом соотношении нафталин : воздух = 1 : 35 и температуре 360-370°С. Расход нафталина составляет 1.05-1.1 т на 1 т фталевого ангидрида.
Фирма «Badger» разработала процесс окисления нафталина при более высокой его концентрации (массовом соотношении нафталин : воздух — 1 : 12) в псевдоожиженном слое катализатора.
Парофазным окислением нафталина воздухом при 250-450°С в присутствии катализаторов V205, V205-A1203, Zr02, Si02-W03, B203, фосфатов щелочных металлов получают также 1,4-наф - тохинон [2]. В качестве катализатора возможно использование V205-K2S04, модифицированного оксидами Fe, Sn, Si, Ti, Al.
|
+ |
|
НОзБ ВОдН |
|
ШОН |
|
КН2 |
|
Теплоносители смазочные масла ПАВ |
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
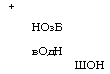 |
|
|
|
|
![]()
![]()
![]()
![]()
ОН
|
|
ОН
|
|
|
СН(СН3)2 |
![]() Н2о2
Н2о2
- ХХУ
(СН3)2НС
Рис. 16. Направления использования нафталина 278
Сн2=снсн
|
Он |
|
С2Н5 |
|
Сн2=сн2 С6Н^П(С2Н5)„ |
|
С2Н5 |
|
I Ноос II :1 + Х)и С2н5 |
|
Сн3он |
|
СН3 |
|
|
|
|
|
|
|
|
 |
|
 |
|
|
![]()
![]()
|
С12 |
|
Три - + тетрахлорнафталины, |
|
ГеС1з СОСНз На28х тиоиндигоидные |
|
|
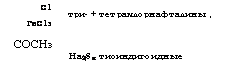 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
![]()
![]()
![]()
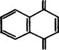
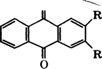
Рис. 16 (продолжение)
При температуре 430-480 °С окисление нафталина происходит с высокой конверсией, что позволяет исключить стадии отделения и рециркуляции сырья [3].
Возможно получение 1,4-нафтохинона окислением 1-нафтола кислородом с выходом 90 % в присутствии каталитического комплекса Со-салкомин в диметилформамиде [2].
1,4- Нафтохинон используется для синтеза антрахинона и его производных, красителей, антибактериальных препаратов и фунгицидов.
Алкилированием нафталина высшими линейными а-олефи - нами, содержащими 12-20 углеродных атомов, получают высшие алкилнафталины. В качестве катализаторов используются макропористые цеолиты типа Y с Н+ и NH4 обменными центрами [4], те же цеолиты, модифицированные рением [5], твердокислотные катализаторы на основе Zr02, модифицированного (NH4)6H4W1205. Полученные моноалкилнафталины используются в качестве смазочных масел и высокотемпературных теплоносителей с высокой теплопроводностью.
В качестве алкилирующего агента вместо оолефинов могут применяться спирты, алкилгалогениды. Фирма «Mobil Oil Corp.» запатентовала для алкилирования нафталина катализатор МСМ-49 состава Х203 • пУ02, где п < 35, X - трехвалентный элемент (А1, В, Fe, Ga или их смесь), Y - четырехвалентный элемент (Si, Ti, Ge или их смесь) [6].
В 1975 г. разработан высокотемпературный теплоноситель Термолан на основе высших алкилнафталинов, выпускаемый ПО «Оргсинтез» (г. Новомосковск). Это жидкий продукт с температурой плавления -30-ь-45°С, температурой кипения 450-500°С и температурным диапазоном устойчивой работы от -35 до 350°С. Теплоноситель отличается невысокой токсичностью (ПДК = = З0мг/м3), низким давлением насыщенного пара (0.05-0.1 МПа при максимальной температуре использования), сравнительно невысокой вязкостью (60 мм2/с при 20 °С), малой коррозионной активностью, высокой радиационной стойкостью [7, 8].
Алкилнафталины, полученные из нафталина и 1-эйкозена или 1-докозена, применяются в качестве рабочих жидкостей в вакуумных пароструйных насосах и обеспечивают создание ульт - равысокого вакуума (2.8-4.8) ■ 10“7 Па [9]. Вместо индивидуальных а-олефинов для алкилирования нафталина может использоваться фракция С18-С20 крекинг-дистиллята твердого парафина. Алкилирование нафталина проводится в присутствии катализатора BF3-H3P04-S03 при 100 °С в течение 1 ч, выход алкилнафталинов составляет 50-55 %. Полученная вакуумная жидкость, 280
названная Алкарен-1, позволяет создавать в диффузионных насосах вакуум около 10“7 Па [10].
На базе фракции 180-240 °С крекинг-дистиллята, содержащей а-олефины С8-С20, и нафталина получена также вакуумная рабочая жидкость Алкарен-24 [11]. Во избежание олигомеризации а-олефины предварительно гидрохлорировали в присутствии 1 % (мае.) гпС12 на силикагеле. Алкилирование нафталина алкилхлоридами проводилось в присутствии А1С13 при 20-100°С. Вакуумные масла получены также алкилированием дифенила алкилхлоридами С8-С12 (Алкарен Д24) и а-олефинами С12-С14 (Алкарен Д35). Технология получения вакуумных масел Алкарен отработана на опытно-промышленной установке ПО «Химпром» (г. Кемерово). Важное преимущество вакуумных масел на основе нафталина или дифенила и промышленных смесей а-олефинов по сравнению с зарубежными аналогами, полученными с использованием индивидуальных углеводородов, состоит в их значительно меньшей стоимости.
Алкилированием нафталина спиртами, например 2-бутано - лом, и одновременным сульфированием концентрированной Н2804 или слабым олеумом получают алкилнафталинсульфона - ты, применяющиеся в качестве ПАВ [12]. Алкилнафталинсуль - фонаты применяются также в качестве антикоррозионных и моюще-диспергирующих присадок к смазочным маслам [13].
Работы по применению алкилнафталинов, опубликованные до 1990 г., рассмотрены в обзорах [14, 15].
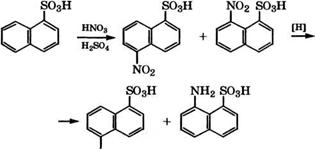
Нитрованием нафталина смесью концентрированных НЖ)3 и Н2в04 при 50-60°С получают 1-нитронафталин. Примеси 2-нитронафталина составляют 4-5 % (мае.) и динитронафталинов - около 3 % (мае.). При дальнейшем нитровании 1-нитронафталина образуется смесь 1,5- и 1,8-динитронафталинов [16].
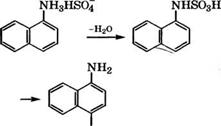
Гидрированием 1-нитронафталина в присутствии № или Си получают 1-нафтиламин, сульфированием которого производится нафтионовая кислота [17]:
|
|
|
Н2во4 |
![]()
![]() №
№
Перегруппировка гидросульфата 1-нафтиламина проводится в среде о-дихлорбензол а при 175-180 °С.
Сульфирование нафталина концентрированной H2S04 при температуре около 80 °С приводит к образованию 1-нафталин - сульфокислоты, а при температуре свыше 150 °С - к 2-нафта - линсульфокислоте [18].
Фирма «Chemie AG Bitterfeld-Wolfen» запатентовала способ получения нафтионовой кислоты взаимодействием 1 моль
1- нафтиламина и 1-1.2 моль 95-100 %-й H2S04 с образованием нафтиламингидросульфата и последующим его спеканием с
1- 1.3 моль мелкокристаллической амидосульфокислоты при 160-200 °С. Нафтионовую кислоту выделяют нагреванием реакционной смеси с 1 н. НС1 до кипения и очищают через нафтионат натрия с использованием активированного угля. Очищенная нафтионовая кислота пригодна для получения пищевых красителей [19].
Взаимодействием 1-нафтиламина с анилином в жидкой фазе при 230-250 °С в присутствии 12 или /г-толуолсульфокислоты или в паровой фазе при 800 °С над гелем А1203 получают N-фе - нил-1-нафтиламин (неозон А), применяющийся в производстве арилметановых красителей [16].
При нитровании 1-нафталинсульфокислоты получается смесь 5- и 8-нитронафталин-1-сульфокислот, восстановлением которых чугунными стружками получают соответствующие аминопроизводные [17]:
|
NH2 |
Аналогичным путем из 2-нафталинсульфокислоты получают кислоты Клеве - смесь 5- и 8-аминонафталин-2-сульфокислот. Нафтиламиносульфокислоты применяются в производстве красителей, а также в качестве реагентов для кинофотопромышленности.
При двухстадийном сульфировании нафталина сначала 20%-м олеумом при температуре не выше 35°С, затем 65 %-м олеумом 282
При 55 °С получают нафталин-1,5-дисульфокислоту (кислоту Армстронга) с примесью нафталин-1,6-дисульфокислоты [20].
Щелочным плавлением нафталин-2-сульфокислоты при 300- 315 °С получают 2-нафтол с выходом до 82 % [16, 21]. Возможно получение 2-нафтола гидроксилированием нафталина 28 % - м раствором Н202 сначала при 50 °С, затем при 80 °С в присутствии катализатора - тетракис(декахлор)фталоцианина меди. Конверсия нафталина составляет 22.3 %, селективность образования 2-нафтола - 90 % [22].
Алкилированием нафталина 2-пропанолом в присутствии мор- денита при 250 °С получают 2-изопропилнафталин [23], окислением которого до гидропероксида и кислотным разложением также возможно получение 2-нафтола и ацетона. Максимальный выход 2-нафтола - 61 % достигнут при использовании в качестве катализатора НС104 в растворе уксусной кислоты [24].
При алкилировании нафталина 2-пропанолом на цеолитах Н - У и ЬаН-У образуется в основном 1-изопропилнафталин [23], из которого может быть получен 1-нафтол. В промышленности 1- нафтол производится щелочным плавлением нафталин-1-сульфокислоты с КаОН при 300 °С с выходом около 93 % или гидролизом 1-нафтиламина под действием 20%-й Н2804 при 185- 240 °С [16].
Алкилирование нафталина пропиленом или 2-пропанолом в присутствии нанесенной на морденит Н-типа с мольным соотношением 8Ю2/А1203 свыше 15, при конверсии нафталина 95.2% сопровождается образованием 2,6-диизопропилнафтали - на с селективностью 61.9 % [25]. При алкилировании нафталина на том же морденитовом цеолите с 0.5 % (мае.) Р1 в присутствии добавок воды конверсия повышается до 97.5 % и селективность образования 2,6-диизопропилнафталина - до 67.3 % [26]. Пропитка Н-морденита нитратом церия (при 30 % (мае.) Се) приводит к повышению селективности по тому же изомеру до 70 %
[27] .
Компьютерный поиск оптимального катализатора синтеза
2,6- диизопропилнафталина также подтвердил выбор морденита
[28] .
При каталитическом взаимодействии нафталина с ди - и три- метилнафталинами в присутствии цеолитов протекают одновременно реакции трансметилирования и изомеризации с обогащением реакционной смеси 2,6-диметилнафталином [29, 30].
При алкилировании нафталина метанолом с использованием цеолита Н-гвМ-б происходит образование 2-метилнафталина. Механизм Р-селективного метилирования объясняется тем, что молекулы 1-метилнафталина, имеющие больший объем, не проникают в каналы цеолита [31]. При дальнейшем метилировании 2-метилнафталина на цеолите ZSM-5, особенно при отравлении его внешней поверхности с помощью 2,4-диметилхинолина, селективно образуется 2,6-диметилнафталин [32].
Аналогичные методы могут быть использованы и для получения 2,6-диэтилнафталина. Алкилированием нафталина этиленом или этилгалогенидом в присутствии цеолитов получают преимущественно 2,6-диэтилнафталин, который очищают кристаллизацией [33] или хроматографией на цеолите типа Y, модифицированном ионами Na, К или Ва [34].
Фирма «Nippon Steel Chemical Со.» запатентовала процесс получения 2,6-диэтилнафталина взаимодействием нафталина или 2-этилнафталина с полиэтилбензолами в присутствии цеолита У. Так, при взаимодействии 2-этилнафталина с тетраэтил - бензолами при 80 °С через 2 ч достигнута конверсия 2-этилнафталина 82.7 %, выход диэтилнафталинов 62.3 %, их состав, %:
2,6- 50.1; 2,7- 24.8; 1,6- 15; 1,7- 5.3; прочие изомеры 4.8 [35]. Окислением 2,6-диалкилнафталинов получают 2,6-нафталинди - карбоновую кислоту.
Гидрирование нафталина в присутствии никелевых катализаторов при 150°С приводит к образованию тетралина, а при 200 °С - к смеси цис - и транс-декалинов [16]. Выход декалинов составляет около 95 % при гидрировании тетралина на платино- алюмофосфатном катализаторе, нанесенном на А1203, при температуре процесса 220 °С и давлении 5.17 МПа [36]. Эффективный катализатор гидрирования нафталина до декалинов - 0.1 % (мае.) Ru на смешанных оксидах Mn203-Ni0 [37].
Гидрирование тетралина до цис- и mpawc-декалина проходит с высоким выходом в двухфазной системе, включающей катализатор - димер хлор(1,5-гексадиен)родия и водный буферный раствор с ПАВ. Катализатор сохраняет высокую активность после 8 циклов [38].
Тетралин и декалин рекомендуется использовать вместо 100-200 ароматических растворителей - опасных загрязнителей атмосферы. Они применяются в красках и чернилах, фармацевтических препаратах, в производстве агрохимикатов. Тетралин и декалин выпускает, в частности, американская фирма «Koch Specialty Chemicals» на заводе г. Корпус-Кристи, шт. Техас [39]. В России тетралин производит ОАО «Торжокский завод полиграфических красок» в Тверской области [40].
На основе алкилтетралинов получают среднещелочные сульфонатные присадки к моторным маслам [41].
Жидкофазным хлорированием нафталина в присутствии FeCl3 получают 1-хлорнафталин с примесями 2-хлор-, 1,4- и 1,5-ди - хлорнафталинов. Хлорированием расплавленного нафталина производится также смесь три - и тетрахлорнафталинов - гало - вакс. Галовакс применяется в качестве флегматизатора, заменителя воска и смол при пропитке тканей, изоляции проводов, изготовлении конденсаторов [42].
При ацетилировании нафталина уксусным ангидридом в среде дихлорэтана или хлорбензола получают с выходом 98 %
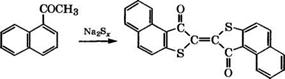
1- ацетилнафталин, а при проведении реакции в среде нитробензола - 2-ацетилнафталин с выходом около 70 % [16]. 2-Ацетил - нафталин применяется как душистое вещество и фиксатор запаха при составлении отдушек для мыла и парфюмерных композиций.
При взаимодействии 1-ацетилнафталина с полисульфидом натрия получают тиоиндигоидный краситель красно-коричневый Ж [43]:
|
|
Тиоиндигоидные красители более стойки, чем индигоидные, к действию окислителей, щелочей и применяются для печати по хлопку, льну, вискозе, для кубового крашения шерсти и меха, как пигменты в полиграфии.

 Опубликовано в
Опубликовано в