МЕХАНИЧЕСКИЕ ТЕПЛОВЫЕ ДВИГАТЕЛИ
 7 февраля, 2016
7 февраля, 2016  Mihail Maikl
Mihail Maikl 3.1. ТЕПЛОТА СГОРАНИЯ
Наличие разности температур является основным условием для обеспечения работы тепловых двигателей. Поэтому тепловые двигатели должны иметь нагреватель (источник теплоты) и холодильник (утилизатор теплоты). Источником теплоты может быть солнечное излучение, геотермальные воды, градиент температур в океане, энергия ядерного распада или энергия сгорания ископаемого топлива. В промышленно развитых странах около 90 % вырабатываемой энергии получают в результате сжигания различных видов топлива, большую часть которого составляет ископаемое углеводородное топливо.
При полном сгорании углерода в атмосфере кислорода образуется диоксид углерода, который при нормальных земных условиях находится в газообразном состоянии. Однако большая часть имеющегося на Земле топлива содержит в себе не только углерод, но и водород, при сжигании которого образуется вода. Вода выводится из работающего двигателя либо в виде жидкости, либо в виде пара. В первом случае теплота конденсации воды утилизируется в двигателе Этим объясняется тот факт, что водородсодержащие топлива характеризуются двумя различными величинами: высшей теплотой сгорания, которая относится к случаю образования воды в жидкой фазе, и низшей теплотой сгорания, соответствующей водяному пару.
Высшая теплота сгорания водорода 143 МДж/кг, тогда как его низшая теплота сгорания всего 125 МДж/кг. Для сравнения теплота сгорания углерода равна 32,8 МДж/кг. Приближенная формула для определения высшей теплоты сгорания углеводорода типа СиНт выглядит следующим образом:
АГГ 12и ■ 32,8 + 143и
А Н=------------------------ . (1)
12и + т
В этом случае после реакции вода находится в жидком состоянии.
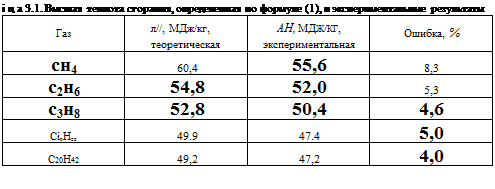
В табл. 3.1 для сравнения приведены данные о высшей теплоте сгорания, пученной путем расчета по упрощенной формуле, и результаты эксперимен - ільньїх измерений. Формула (1) дает несколько завышенные результаты из-за о, что она не учитывает энергию углерод-водородных и углерод-углеродных - зей. Однако эта формула достаточно точно отражает зависимость теплоты ['рання от молекулярной массы.
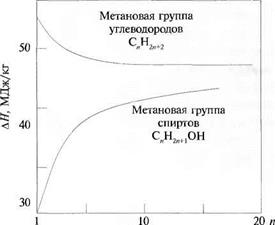
3 глеводороды высших порядков, в молекулах которых содержится большое ячество атомов углерода, имеют меньшую теплоту сгорания. Так, у метана, эго простейшего углеводорода, теплота сгорания составляет 55,6 МДж/кг. увеличением числа содержащихся в молекуле атомов углерода теплота сго- шя уменьшается до 47 МДж/кг. Эта зависимость иллюстрируется рис 3.1. логичная зависимость наблюдается и у других групп углеводородов. 5л 3.2 эта зависимость показана на примере группы СяН2я1 .
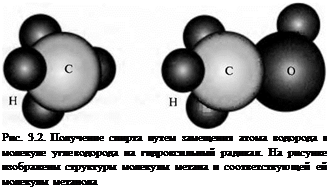
Спирты получают из молекул углеводородов замещением атома водорода ралом ОН (рис. 3.2). При этом газообразные углеводороды можно преобразо - в спирты, при нормальных условиях находящиеся в жидком состоянии. Это эятельство особенно важно для транспорта. Для получения жидкого топли - I транспорта целесообразно исходные газообразные продукты подвергнуть чному окислению, несмотря на то. что при этом имеет место некоторое ■ ение теплоты сгорания:
СН4 (55,6 МДж/кг) — продукт СН3ОН (22,7 МДж/кг),
С2Н6 (52.0 МДж/кг) — продукт С2Н5ОН (29.7 МДж/кг).
1 кюля метана (16 кг) получается 1 кмоль метанола (32 кг). Следователь - кг ' іетаиа может быть преобразован в 2 кг метанола с эффективностью
![]()
![]()
![]() 2 ■ 22,7
2 ■ 22,7
55,6
|
Таблица 3.2. Высшая теплота сгорания углеводородов группы СяН2я+я, МДж/кг
|
|
Рис. 3.1. Теплота сгорания углеводородов и спиртов |
В табл. 3.3 приведены теоретические значения эффективности преобразования углеводородов в соответствующие спирты.
|
Метана в метанол |
0,82 |
|
Этана в этанол |
0,88 |
|
Пропана в пропанол |
0,91 |
|
Таблица 3.3. Эффективность преобразования углеводородов в спирты |
Кроме углеводородов и спиртов в данной главе будут рассмотрены и неко - 1 орые другие виды топлива.
 |
Топливо можно получить, например, из биомассы (см. гл. 11). Однако такое тотиво содержит в своей структуре атомы кислорода, что приводит к тому, что его теплота сгорания оказывается меньше, чем у углеводородов. Целлюлоза, например, имеет теплоту сгорания всего 17,4 МДж/кг.

 Опубликовано в
Опубликовано в