МЕТОДЫ ТЕРМОДИНАМИЧЕСКОГО АНАЛИЗА ЗНЕРГОХИМИКО-ТЕХНОЛОГИЧЕСКИХ СИСТЕМ (ЭХТС)
 20 марта, 2013
20 марта, 2013  admin
admin Простейшим методом термодинамического анализа ЭХТС является энергетический, основанный на первом законе термодинамики. Этот метод позволяет оценить потери энергии в ЭХТС и в ее отдельных элементах, а также выявить элементы ЭХТС, процессы в которых протекают с наибольшими потерями. Существенным недостатком этого метода является то, что в нем не учитывается ценность различных видов энергии, т. е. их практическая пригодность, что неверно с точки зрения второго закона термодинамики. Как было указано выше, в реально протекающих процессах происходят потери энергии на необратимость. Поэтому в настоящее время применяются два метода термодинамического анализа систем, учитывающих необратимость термодинамических процессов: энтропийный (метод циклов) и эКсергетический. Оба метода были обоснованы в работах Р. К. Клаузиуса, Д. В. Гиббса и А. Стодолы. Существенный вклад в развитие и использование этих методов внесли советские ученые А. И. Андрющенко, В. М. Бродянский, Д. П. Гохштейн и др. Оба метода основаны на втором законе термодинамики и по существу решают одну и ту же задачу определения потерь работоспособности, потерь на необратимость реально протекающих процессов. Однако на базе эксергетического метода можно более тщательно провести термодинамический анализ ЭХТС и изыскать наиболее эффективные пути уменьшения затрат топливно-энергетических ресурсов при одновременном повышении технологических показателей.
Энтропийный метод. Энтропийный метод термодинамического анализа систем позволяет на базе первого и второго законов термодинамики найти связь между внешними энергетическими потоками (количеством теплоты и работы) и параметрами системы, а также между некоторыми внутренними параметрами. Посредством анализа теплового баланса системы, в которой совершаются термодинамические процессы, можно вычислить характеризующие их коэффициенты и сопоставить их с аналогичными коэффициентами идеальных термодинамических процессов. Это позволяет определить в данной системе суммарную потерю производимой и затрачиваемой работы вследствие необратимости процессов. Если для инженерного анализа системы этих данных недостаточно, то анализ циклов дополняется подсчетом возрастания энтропии в отдельных частях системы.
Для термодинамической оценки эффективности системы (данной установки) следует ответить на четыре вопроса, а именно: 1) насколько велик к. п. д. обратимого цикла установки, от каких факторов он зависит и что следует предпринять для его увеличения; 2) насколько велики потери от необратимости в реальной установке; 3) как распределяются эти потери по отдельным элементам установки; 4) на усовершенствование какой части установки следует обратить внимание с целью уменьшения степени необратимости, в частности увеличения к. п. д. цикла, по которому работает установка. В соответствии с этими задачами термодинамический анализ установки проводится в два этапа: вначале анализируется обратимый цикл, а затем необратимый с учетом основных источников необратимости. В дальнейшем к. п. д. обратимого цикла
T|t _ - iiL= і _ Si.» IlL (1.208)
Ч Ч Чі
Будем называть термическим к. п. д., а реального
= (1.209)
Ч
Внутренним, подчеркивая тем самым, что речь идет о к. п. д. собственно цикла, который характеризует степень совершенства процессов, совершаемых рабочим телом.
Известно, что степень совершенства данного обратимого цикла характеризуется сравнением его термического к. п. д. с термическим к. п. д. цикла Карно в том же интервале температур, т. е. относительным термическим к. п. д.
T|q = ——. (1.210)
Л к
Для того чтобы оценить, насколько данный действительный (необратимый) цикл менее совершенен, чем теоретический (обратимый), вводят понятие относительного внутреннего к. п. д. цикла как отношение
11ш = Лі-=|_. (1.211)
Л< 'и
Однако кроме необратимых потерь, учитываемых Ло< (т. е. потерь, имеющих место в процессах, совершаемых собственно рабочим телом в цикле), в реальных условиях работы установки имеются потери, обусловленные необратимостью тепловых, механических, химических и электрических процессов в отдельных узлах ее. Поэтому эффективность реальной установки в целом характеризуется так называемым эффективным к. п. д. Ле> который представляет собой отношение количества энергии (в форме теплоты или работы), отданной внешнему потребителю, к количеству энергии (в форме теплоты или работы), подведенной к установке. Эффективность системы может быть оценена также работоспособностью ее: подсчитав потерю работоспособности в каждом элементе, можно найти потерю работоспособности всей системы.
Обязательным элементом ее являются устройства, в которых за счет подвода работы извне осуществляются процессы сжатия (компрессоры, турбокомпрессоры, насосы и т. д.), и устройства, в которых производится работа путем расширения (паровые и газовые турбины, турбодетандеры и т. д.). Реальные процессы расширения и сжатия сопровождаются потерями на необратимость и поэтому внутренний относительный к. п. д. каждого J-Го элемента системы находится следующим образом:
Для расширительных устройств
Л Kj = (і-212)
Где и LpJ — действительная и теоретическая работы расширения J-Vo элемента системы;
Для сжимающих устройств
Tfou =-т^Ч (1-213)
Где Lcj и — теоретическая и действительная работы сжатия J-Го элемента, которые совершаются за счет подвода энергии извне; здесь в действительном процессе сжатия приходится затрачивать энергию на сжатие (/£,) большую, чем в теоретическом процессе, на величину потерь на необратимость.
Таким образом, в установке обратимая работа цикла
K = Z4j~ Z4j> (1-214)
;= І J=I
А необратимая
'S= Zto - I (1-215)
J=I J=І
Или с учетом формул (1.212) и (1.213)
T^J^J-likjMoiJ - (1-216)
J= І ;= І
Тогда с учетом формулы (1.211) можно написать, что
J = Tl J = п
Е 1Р. А - Е (Hjfaoij) Лої = — —п ^ • <L217)
Е 1Pj - Е
J=i J=I
Внутренний к. п. д. цикла гн с учетом формул (1.208), (1.214) и (1.217);
TOC o "1-3" h z J=n j=n j=n j=n
E 1Рл$і - E Ocjfaou) E 1P.JNfiu - E (Kjmoij J=i j=i ^ j=i j=i
ЛІ = ЛоіПЇ =----------------- ;------------------- - =----------------------------------- •
/д q і
(1.218)
Величина потерь в каждом элементе системы характеризуется еще величиной эффективного к. п. д. этого элемента т}eJ. Перемножив между собой все эффективные к. п. д. элементов системы на абсолютный внутренний к. п. д. цикла, получим эффективный абсолютный к. п. д. для всей системы
J = N
Л С = Л 0І Л Г П reJi (1.219)
J= і
J = n
Где П reJ — произведение величин эффективных к. п. д., характеризую - j= і
Щих необратимые потери во всех п элементах системы.
К. п. д. г)с, показывает, какая доля выделенной в системе теплоты превращена в полезную работу, отданную внешнему потребителю;
*пол = Ле9і. (1.220)
Очевидно,
Ад = (1 - л.) (1-221)
Представляет собой долю теплоты qu не превращенную в работу, и включает в себя как теплоту q2, передаваемую холодному источнику, так и потери теплоты Aqn, обусловленные необратимостью процессов в отдельных элементах установки вследствие трения и конечной разности температур, потерями в окружающую среду и т. д. Очевидно,
А <2 п = 1ц 'пол» (1.222)
Где /ц — работа, производимая в обратном цикле.
С учетом формул (1.208) и (1.220) можно написать, что
Aqn = л«<7і - Л,</і = (Л< - Л,)<?ь (1-223)
А так как максимальная обратимая работа цикла может быть получена только в обратимом цикле Карно, то, следовательно, максимальная потеря работоспособности А/„ в системе, равная максимальному значению Aqw будет
А'п = <?i (Л* - Ле). (1-224)
В отличие от энергетических установок в ЭХТС наряду с машинами имеется очень много технологических аппаратов, в которых, как известно, никакой работы не производится. Однако в этих аппаратах имеются большие потери на необратимость: конечная разность температур, протекание химической реакции и т. д. В рассматриваемом методе термодинамического анализа они учитываются при определении эффективного к. п. д. Ле анализируемой установки. Однако определение этих потерь связано с большими трудностями и поэтому при термодинамическом анализе ЭХТС методом циклов очень важно оценить эффективность работы всех ее элементов — и машин и технологических аппаратов, подсчитав для каждого из них потерю на необратимость по формуле (1.207).
В соответствии с формулой (1.207) потеря работоспособности ЭХТС
А/^,тс = Т0 ДРХТС.
Изменение энтропии системы равно сумме изменений энтропии огдель ных ее элементов, т. е.
Д, ЭХТС= '^"д,. І-- 1
Умножая на температуру окружающей среды І о, получим
А/эхтс = Т0 As3XTC = T0Ast= Z А/ь (1-225)
1=1 1=1
Т. е. величина потери работоспособности всей системы в целом равна сумме потерь работоспособности в отдельных ее элементах. Найденные значения А/г покажут, в каких элементах ЭХТС необратимые процессы вносят основной вклад в величину А/эхтс и, следовательно, какие процессы в этих элементах системы должны быть в первую очередь усовершенствованы.
Эксергетический метод. Эксергетический метод термодинамического анализа ЭХТС основан на широком использовании эксергии. В самом общем смысле эКсергия вещества есть максимальная работа, которую оно может совершить в обратимом процессе с Окружаюіцей средой в качестве источника даровой теплоты, если в конце этого процесса все Участвуюіцие в нем виды материи переходят в состояние термодинамического равновесия со всеми компонентами окружающей среды.
Эксергетический метод является универсальным способом термодинамического исследования различных процессов преобразования энергии в ЭХТС. Все реально протекающие процессы — необратимые, и в каждом случае необратимость является причиной снижения совершенства процесса. Это происходит не из-за потери энергии, а из-за Понижения ее качества, так как в необратимых процессах энергия не исчезает, а обесценивается. Так, например, дросселирование рабочего тела не изменяет его энергии (Hx — H2), а снижает ее пригодность к совершению работы или использованию в теплообменниках. Таким образом, каждое необратимое явление — это причина безвозвратной потери энергии. Универсальность эксергетического метода термодинамического исследования ЭХТС следует рассматривать в том смысле, что характер процессов анализируемой системы (например, круговой или разомкнутый) не имеет принципиального значения: подход к решению задачи и метод ее решения не изменяются. В эксергетическом методе термодинамического анализа ЭХТС каждый ее элемент рассматривается как самостоятельная термодинамическая система. Эффективность работы каждого элемента ЭХТС оценивается путем сравнения эксергии на входе в этот элемент с потерей в нем работоспособности, т. е. с потерей эксергии в результате необратимых процессов, протекающих в этом элементе, и обусловленных как внутренней (потери на компенсацию в рабочем теле градиентов А р/р, Ар/р и А Т/Т и трение о стенки канала), так и внешней (потери на конечную разность температур при теплообмене) необратимостью. Таким образом, при определении потерь эксергии в каждом элементе исследуемой ЭХТС выявляются и количественно оцениваются причины несовершенства протекающих в них процессов, что дает информацию о возможности повышения совершенства во всех элементах и позволяет создать наиболее совершенную ЭХТС. Это является основной целью эксергетического метода анализа ЭХТС.
Виды эксергии. Эксергия делится на два основных вида, а именно: эксергия видов энергии, не характеризуемых энтропией, для которых она равна самой энергии е — Э (механическая, электрическая и др.), и эксергия видов энергии, характеризуемых энтропией е ^ Э (внутренняя энергия, энергия излучения, термомеханическая, нулевая). Эксергия последних видов энергии подразделяется на эксергию вещества в замкнутом объеме, эксергию потока вещества и эксергию потока энергии. Эксергия вещества в замкнутом объеме состоит из термомеханической (физической), нулевой (химической — в реакторах периодического действия) и излучения. Эксергия потока вещества состоит из термомеханической и нулевой. Эксергия потока энергии состоит из эксергии теплового потока и эксергии излучения.
Эксергия вещества в замкнутом объеме е„ рассматривается в закрытых системах. Определим термомеханическую эксергию вещества в замкнутом объеме, т. е. максимальную работу, которую может совершить вещество с начальными параметрами Р, V, Т, и, H, S при обратимом переходе в равновесие с окружающей средой, когда его параметры будут иметь значения р0, V0, Т0, U0, ho, So - Для того чтобы вещество перешло в равновесие с окружающей средой, необходимо изменить его внутреннюю энергию за счет подвода (или отвода) к нему теплоты либо за счет совершения им работы, поскольку в соответствии с первым законом термодинамики du = 5q — 8/.
В обратимом процессе подвод теплоты к веществу либо отвод от пего теплоты в окружающую среду происходит при постоянной температуре, равной температуре окружающей среды Т0, т. е. Dq = TQ ds. Тогда эксергия вещества в замкнутом объеме Dev будет равна работе 5/ за вычетом работы, затрачиваемой веществом на преодоление им давления окружающей среды р0 Dv, т. е.
Dev = Ы — р0 Dv = Hq — Du — р0 Dv — TQ Ds — Du — P0 Dv, (1.226) или после интегрирования
Є„ = TQ (SQ - S) - (uQ ~ u) - Po (v0 - V) = (u - UQ) - To (s - So) + Po(v - Do).
(1.227)
Так как для данной среды, окружающей вещество, PQ, V0, Т0, и0 и s0 есть величины постоянные, то уравнение (1.227) можно представить в следующем виде:
Ev = и - T0S + P0V + с, (1.228)
Где с =- и0 + T0S0 - PQV0 — const, и следовательно, е„ является параметром состояния вещества и среды — эксергетической функцией.
Для определения термомеханической эксергии потока вещества требуется найти максимальную работу его при обратимом переходе от данного состояния, характеризующегося параметрами Р, V, Т, и, H и s, к равновесному состоянию со средой, т. е. с параметрами р0, V0, Т0, щ, H0 и S0. Очевидно, эксергия потока вещества е отличается от эксергии вещества в замкнутом объеме Ev на величину работы, связанной с перемещением потока. Для конечного изменения состояния эта работа будет равна работе Pv За вычетом работы P0V, затрачиваемой на преодоление давления среды,
Pv -P0V = V{P- Ро). Следовательно, эксергия потока вещества
E = Ev + V(P-ро). (1.229)
Подставляя в уравнение (1.229) значение е„ из уравнения (1.228), получим
Е = (и + Pv) - T0s - и0 -h T0S0 + P0v - P0v0 - P0v.
Учитывая, что и + Pv - H, a —U0 + T0SQ - PQv0 = с есть величина постоянная, окончательно получим
Е = H - T0S + с. (1.230)
Функция е, равно как и <?„, является эксергетической функцией, так как ее величина однозначно определяется параметрами вещества и среды.
Обычно в расчетах определяют разность величин Aev и Ае в двух состояниях системы. В этом случае Aev и Ае будут соответственно равны
Aev = Au-T0As + P0Av, (1.231)
Ае = Ah — Т0 As. (1.232)
Следует иметь в виду, что эксергия вещества в замкнутом объеме определяется взаимодействием его с окружающей средой только по температуре и давлению; состав окружающей среды значения не имеет.
Н у л е в а я (х и м и ч е с к а я) э к с е р г и я е0 связана с установлением равенства химических потенциалов между соответствующими компонентами вещества и окружающей среды и измеряется количеством работы, которая может быть получена в обратимом процессе установления равновесия компонентов вещества с соответствующими компонентами окружающей среды при р0 и Т0. Следует помнить, что процессы взаимодействия вещества с окружающей средой, связанные с обменом массы, не всегда сопровождаются химическими реакциями; примером этого являются процессы разделения, смешения и растворения. В химических реакторах нулевая эксергия является основной. Для определения с о необходимо знать состав окружающей среды. Однако состав окружающей среды весьма неоднороден, и поэтому расчет абсолютных значений eQ с такой же точностью, как расчет е и Ev, принципиально невозможен. Обычно для практических целей вводят упрощающие допущения в расчете е0, однако при условии соответствия требований эксергетического анализа и строгого термодинамического обоснования.
Вычислим нулевую эксергию при химических превращениях. Пусть в химическом реакторе протекает реакция
+ >2А2 + ...^ \А + V2A'2 + ..., (1.233)
Где vb v2,... и v'x, v2 ... — стехиометрические коэффициенты соответственно исходных Ati А2,••• и получающихся А'ъ А2,.., веществ.
В инженерной практике расчет нулевой эксергии при химических превращениях, протекающих в химических реакторах, ведется на основании формулы эксергии потока вещества е (1.230).
Если реакция протекает при температуре Т = 298 К, то эксергия Ехр (кДж/моль) определится по формуле
Ехр~Аг°298 ~%Е0ф (1.234)
J
Где AZ°298 = ]Гуг(ЛZ°298)I ~ ZvHAZ°298)'I = І>г(ДЯ°98)£ - ЈvJ(A - І і і і
~ ~ ZvK^sX]; А2298 — стандартный изобарно-изотерми-
І і
Ческий потенциал при 7"= 298 К, ' кДж/моль; (АН298)' и (АН29В) - стандартные значения энтальпий (теплоты образования) конечной и начальной составляющих реакций соответственно, кДж/моль; (s298)' и (Агов) — стандартные абсолютные значения энтропии конечной и начальной составляющих реакции соответственно, кДж/(моль-К);
YJEQj — сумма значений нулевых эксергий дополнительных веществ, J
Участвующих в реакции [левая часть уравнения (1.233)], взятых при ро и Т0 (например, в реакции получения СаСОэ по уравнению Са + 0,502 + С02 = СаС03 дополнительными веществами являются 02 и С02).
Методику определения нулевых эксергий дополнительных веществ и таблицы их значений для элементов наиболее распространенных неорганических соединений можно найти в монографии «Эксергия» Я. Шаргута, Р. Петела (М., 1968).
Если реакция протекает при температурах выше 298 К, то с достаточной для инженерных расчетов точностью нулевую эксергию химического превращения в реакторах можно подсчитать по формуле
Ехр = AZ°t-]TЈOj, (1.235)
Где
|
( |
Т 298
2'31g 298~~1+ ~Т~}
А^р.298 = 1>г(цср>298)г - Х>і (ЦСр. гевХ;
І і
(|ісРі298)г и (|xc'p>298X - - мольные изобарные теплоемкости при температуре 298 К начальной и конечной составляющих реакции соответственно, кДжДмоль • К).
При вычислении AZ°T надо брать абсолютное значение величины ДМ<Ср,298-
Если дополнительные вещества в окружающей среде находятся не
В виде соединения с другими веществами, а в свободном состоянии (как, например, газы атмосферного воздуха), то нулевая эксергия J-Ro компонента вещества E0J определяется минимальной работой, необходимой для получения его в чистом виде при параметрах среды Ро и Т0. В этом случае в соответствии с формулой (1.230)
EQj = АН0 + Т0 (S0 — S) = Т0 (S0 - S) = Rj-IjT0 In {P0/Pj (1.236)
Где AH0 = 0 при T0 = const для любого компонента воздуха, рассматриваемого как идеальная газовая смесь компонентов; так как парциальное давление /-го компонента этой смеси — Vjp0 = Njp0, где rj и Nj — объемные и мольные доли компонентов в смеси, то окончательно:
E0j = R[ijT0n(l/Nj). (1.237)
В этом случае, например, эксергия потока воздуха (Д/г0 =0): Е = H - T0s + с + е0 = срт(Т - Т0) - - Т0 [cpm In (Т/То) ~ R In (р/ро)} + Z RiT0 In (l/rЈ) = = срт(Т~ То) - Т0 [срш In(T/TQ) ~ R In(Р/Ро) ~ IR; In (l/rdl
Где изменение энтропии As написано в соответствии с формулой (1.83), а г; — объемная доля компонента в воздухе.
Эксергия Eq теплового потока Q рассчитывается по уравнению
= Ї 8ft - Е ^ (1-238)
1=1 І (=1
Гдете = 1 — (Т0/Т) называется эксергепшческой температурной функцией.
В частном случае при Т = idem и те = 1 — (Т0/Т) — idem формула (1.238) представится в виде
Eq = Qxe. (1.239)
Функция те имеет универсальное значение: она пригодна для оценки максимальной работоспособности в круговых и разомкнутых термодинамических процессах.
Можно доказать, что частная производная термомеханической эксергии потока по энтальпии при постоянном давлении равна т4>, т. е.
(Ј)f-V (1.240)
Так как (8H)P = 8Qp или (Ah)P = Qp, то из уравнений (1.238) и (1.239) следует, что
(Ае)р = (Ah)PXe = Qp т, = (Eq)P, (1.241)
Т. е. изменение эксергии потока рабочего тела в изобарном процессе равно эксергии Eq связанного с этим процессом теплового потока. Следовательно, во всех процессах теплообмена, протекающих при постоянном давлении, эксергию теплового потока можно вычислять
По разности эксергий потока вещества Де. Это значительно упрощает расчеты, когда точный расчет непосредственно еч является трудоемким, как, например, при переменной температуре.
Эксергия излучения ес определяется максимальной работой, которая может быть совершена в обратимом процессе приведения этого излучеиия в состояние равновесия с окружающей средой (при 7'0). Ее вычисляют по уравнению
|
|
|
, (1.242) |
Где є — степень черноты поверхности; С0 — коэффициент лучеиспускания абсолютно черного тела.
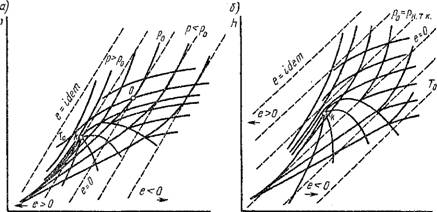
Эксергетические диаграммы состояния. Эксергетические диаграммы широко применяются при термодинамическом анализе энерготехнологических систем: из них непосредственно определяются величины е, Eq и их составляющие для различных веществ и их смесей, значения те при заданных значениях Т и Т0, а также наглядно и просто проводятся решения соответствующих задач. Среди известных эксер - гетических диаграмм наибольшее распространение получили следующие: Hs- и Ts-диаграммы с линиями е — idem и Eh-Диаграмма. Обозначим через Т% — нормальную температуру кипения.
На рис. 1.48 изображены Hs-Диаграммы с нанесенными на них линиями е = idem: А — при Т0 > Т*; б — при TQ = Т*. Точка начала отсчета (нулевое состояние) определяется только параметром Tq И в некоторых случаях р0. Как видно из этой диаграммы, эксергия вещества для данного термодинамического состояния определяется посредством равномерной сетки прямых е — idem. Выше линии е = О расположена область положительных значений эксергии (е> 0), ниже — отрицательных (е < 0).
На рис. 1.49 представлена Ts-диаграмма воздуха с нанесенными на ней линиями е = idem, которые, в отличие от предыдущей диаграм-
|
|
|
Рис. 1.48. /Zs-диаграмма паров с нанесенными на ней линиями е = Idem |
|
І |
|
S |
|
S |
|
|
|
120 130 |
|
Moo |
WO 120 W б, КДж!(К моль • к)
Рис. 1.49. ^-диаграмма воздуха с нанесенными на ней линиями е = Idem
Мы, являются неэквидистантными линиями (за исключением области влажного пара).
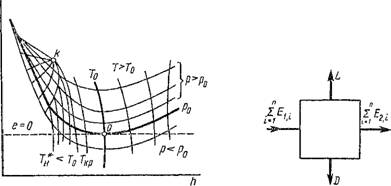
На рис. 1.50 изображена е/г-диаграмма при Т0 > Т*. Нулевая точка определяется пересечением изобары р0 с изотермой Т0, находящейся в области перегретого пара или газа. Если в любой точке пересечения изотермы с изобарой провести касательную к последней, то тангенс угла наклона а ее будет численно равен эксергетической температурной функции тс, поскольку в соответствии с формулой (1.240)
При этом возможны три случая: если Т > Т0, то tgap>0 и, 78 следовательно, tL, > 0; если Г < Т0, то tg ар < 0 и хе < 0, если Т — Т0, То tg ар — 0 и х(, = 0.
С помощью ей-диаграммы можно найти работу и другие характеристики разомкнутых процессов и циклов.
Эксергетические балансы и эксергетические к. п. д. ЭХТС и ее Отдельных элементов. При исследовании ЭХТС в первую очередь составляются материальный и тепловой балансы, а затем уже эксер - гетический.
Тепловой баланс не отражает степень приближения ЭХТС к идеальной, ее термодинамическое совершенство. В отличие от теплового баланса эксергетический баланс учитывает потери от необратимости в ЭХТС и тем самым отражает степень приближения системы к идеальной, для которой эксергетический к. п. д. равен единице.
Перед составлением балансов необходимо выделить систему, подлежащую исследованию, для чего мысленно отделяют ее от других объектов контрольной поверхностью, а эксергии всех проходящих через нее потоков вещества и энергии включаются в эксергетический баланс.
Для ш кг вещества в единицу времени или за определенный период эксергетический баланс ЭХГС имеет следующий вид:
I Ей = Ї E2J + '£" Ц + X А, (1-243)
І=І Г = і і = і
Или
ZD, = I Еи - (уІЕгл + £ іЛ (1.244)
І = І ;=і І=І І=І /
I-N I~N
Где £ EJti и £ E2,I — сумма входящих в ЭХТС эксергий и выходящих і = 1 і = 1
Из нее соответственно, сюда входят все виды эксергии, рассмотренные
|
Рис. 1.50. Eh-Диаграмма Рис. 1.51. К определению Эксергетического баланса машины |
І я и I = п
Выше; Е Li — сумма работ, совершаемых в ЭХТС; Е — сумма эк - «=і /=і
Сергетических потерь ЭХТС.
В открытых системах эксергия Ev — 0. В закрытых системах, где отсутствует обмен веществом через границы системы, равны нулю эксергии потока вещества и нулевая эксергия. Однако в химических реакторах периодического действия нулевая эксергия при химических превращениях является основной.
На основании эксергетического баланса определяются относительные или абсолютные характеристики ЭХТС и ее отдельных частей.
Рассмотрим эксергетические балансы отдельных элементов ЭХТС. Любая ЭХТС в общем случае состоит из машин и всевозможных аппаратов.
Эксергетический баланс любой машины составляется на основании схемы, изображенной на рис. 1.51: для т кг вещества
Xf £1>г= £ E2.T + L+D; (1.245)
/= 1 i=l
При D — 0
L='f Еи - '£Е2>і, (1.246)
1=1 і = 1
Т. е. при обратимом процессе в машине работа, совершаемая ею или затраченная на ее действие, равна изменению эксергии на входе и выходе из нее.
Для 1 кг вещества эксергетический баланс машины напишется аналогичным образом
EVi=' 'Јe2ti + l + d. (1.247)
І- 1 i=l
Для любого аппарата ЭХТС эксергетический баланс запишется в виде для т кг вещества
ЈEU= Ё" E2J + D; (1.248)
І=1 1=1
Для 1 кг
І = п І = п
Е «1.1 = Е + d. (1.249)
Ї=1 і = 1
І = п і = и
При D = 0 Е EUi — Е Е2,і, Т. е. при обратимом процессе в аппарате i=i I=I
Эксергия вещества, находящегося в нем, не изменяется. 80
Очевидно, совершенство ЭХТС и ее элементов тем выше, чем меньше потери эксергии, и поэтому степень совершенства ЭХТС и ее элементов обычно характеризуют так называемым эксергети - ческим к. п. д., который определяется из эксергетического баланса, а именно: для ЭХТС
І-п і = и і — п І = И
І е2,І + Z и Z EU - Z DI I=l Ј=1 (=1 i=l
Л« = -------- Г=ПІ-------- =---------- ^-------------- ; (1.250)
Z Z Eu
І = І і = і
Для машин
2 Е2,І + L Z El,I - D
Л« = ^------------ = ^------------- Ї d-251)
Z Eи Z Eu
X = 1 1=1
Для аппаратов
ЈE2J X Eu-D
^------------------------------- • (1.252)
Z Eu £ Eu
Очевидно, для ЭХТС и ее элементов при отсутствии потерь
І = 11
На необратимость (потерь эксергии), т. е. при £ D,- = 0, эксергетиче-
І = 1
Ский к. п. д. будет равен 1.

 Опубликовано в
Опубликовано в