Количественный анализ мономеров акрилового и метакрилового рядов
 4 января, 2013
4 января, 2013  admin
admin Определение содержания акриловой кислоты. В две конические колБы с притертыми пробками емкостью 200—250 мл отвешивают на аналитических весах с точностью до 0,0001 г приблизительно по 1 г акрило-
153
Вой кислоты, быстро приливают в каждую по 15 мл нейтрализованного» этилового спирта и после растворения навесок, добавив в качестве индикатора несколько капель фенолфталеина, содержимое колб титруют 0,5 н. едким кали до появления слабо-розового окрашивания. Содержание акриловой кислоты х (в %) рассчитывают по формуле
_А/<;0,036-100
JC — —————■ »
G
Здесь а — объем 0,5 н. щелочи, израсходованной на титрование, мл,-, К— коэффициент нормальности 0,5 н. щелочи; G — навеска акриловой кислоты, г; 0,036 — количество акриловой кислоты, соответствующее I мл 0,5 н. раствора щелочи, г.
Определение содержания метакриловой кислоты проводится по этой; же методике. Однако в расчетную формулу следует внести изменение: количество метакриловой кислоты, соответствующее 1 мл 0,5 н. раствора щелочи, равно 0,043.
Содержание акриловой и метакриловой кислот можно определить - методом бромирования с помощью бромид-броматной смеси (аналогична определению содержания метилметакрилата, см. ниже).
Определение содержания метилового эфира метакриловой кислоты. В две конические колбы емкостью по 250 мл, снабженные холодильниками, отвешивают на аналитических весах по 1 г эфира, добавляют по> 10—15 мл нейтрализованного этилового спирта и оттитровывают содержащуюся в эфире метакриловую кислоту 0,1 н. КОН в присутствии фенолфталеина до появления неисчезающего слабо-розового окрашивания. Затем в каждую колбу из бюретки приливают по 40 мл 0,5'н. спиртового раствора едкого кали, присоединяют колбы к обратным холодильникам и нагревают на кипящей водяной бане в течение 3 ч. Верхние концы холодильников закрывают трубками, наполненными натронной известью. Одновременно ставят контрольный опыт. По окончании, нагревания колбы охлаждают и содержимое их оттитровывают 0,5 н. соляной кислотой.
Содержание метилового эфира метакриловой кислоты в процентах (х) рассчитывают по формуле
_ (а — Ь) У<0,05-100
X— ,
G
Где а — объем 0,5 н. соляной, кислоты, израсходованный на титрование контрольной пробы, мл; Ъ — объем 0,5 н. соляной кислоты, израсходованный на титрование пробы с навеской, мл; К—коэффициент нормальности 0,5 н. соляной кислоты; g— навеска эфира, г; 0,05 — количество метилового эфира метакриловой кислоты, соответствующее 1 мл 0,5 н. едкого кали, г.
Количественное определение метилового эфира акриловой кислоты производят по этой же методике, только в расчетной формуле коэффициент 0,05 заменяют на 0,043. При определении содержания этилмета - крилата этот коэффициент равен 0,057, а бутилметакрилата — 0,071.
Определение содержания свободной метакриловой кислоты в эфире. В две конические колбы с пришлифованными пробками емкостью по 154 100—150 мл вводят по 10 мл нейтрализованного этилового спирта и взвеШивают на аналитических весах с точностью до 0,01 г.
Затем туда же отвешивают по 10 г метилового эфира метакриловой кислоты и содержимое колбы титруют 0,1 и. едким кали в присутствии фенолфталеина до исчезновения в первый момент розового окрашивания. Во время титрования сильно встряхивать колбу не рекомендуется.
Содержание метакриловой кислоты х (в %) находят по формуле
А/СО, 0086 -100
Л= =--------- ,
Где а — объем 0,1 н. едкого кали, израсходованный на титрование, мл; К — коэффициент нормальности 0,1 н. едкого кали; g— навеска эфира, г; 0,0086 — количество метакриловой кислоты, соответствующее 1 мл 0,1 и. Едкого кали, г (для акриловой кислоты — 0,0072). -
Определение степени чистоты метилметакрилата методом бромиро - вания. Описание метода дано для метилметакрилата; однако он может быть использован и для определения других мономеров акрилового и ме - такрилового рядов; лишь в формуле для определения х2 теоретическое ■бромное число изменяется ;в зависимости от строения мономера.
В бюкс на аналитических весах отвешивают около 2 г вещества, растворяют навеску в небольшом количестве 50%-ной уксусной кислоты и через воронку переносят в мерную колбу емкостью 100 мл. Бюкс и воронку несколько раз обмывают кислотой и промывную жидкость сливают в колбу. Уксусной кислотой доводят уровень до метки и, закрыв мерную колбу притертой пробкой, смесь тщательно перемешивают.
В две чистые сухие конические колбы с пришлифованными пробками емкостью по 500 мл вводят пипеткой по 50 мл 0,1 н. бромид-броматного раствора[17] и 10 мл приготовленного раствора метилметакрилата в уксусной кислоте. Затем туда же мерным цилиндром быстро добавляют по 10 мл концентрированной соляной кислоты, закрывают колбы пробками и оставляют на 20 мин на рассеянном дневном свету. После этого быстро мерным цилиндром прибавляют по 10 мл 10%-ного раствора иодистого калия, колбы встряхивают и выделившийся иод оттитровььвают 0,1 н. Гипосульфитом натрия, добавив в качестве индикатора несколько капель раствора крахмала. Параллельно ставят контрольный опыт.
Количество присоединившегося брома (в %) —бромное число Х— Рассчитывают по формуле
_(а - Ь) КО, 00799-100-100________________ (а - Ь) К -79,9
Где а — объем 0,1 и. гипосульфита натрия, израсходованный на титрование контрольной пробы, мл; b — объем 0,1 н. гипосульфита натрия, израсходованный на титрование пробы с навеской, мл; К—коэффициент нормальности 0,1 н. гипосульфита натрия; G — навеска вещества, г; 0,00799 — количество брома, соответствующее 1 мл 0,1 н. гипосульфита натрия, г.
Степень чистоты метилметакрилата, в процентах (х2) определяют по формуле
_ JCglOO
"15М" '
Где х — найденное бромное число; 159,8 — теоретическое бромное число» метилметакрилата.
Определение содержания стабилизатора (гидрохинона). Метод основан на взаимодействии гидрохинона с иодом, взятым в избытке, и на последующем определении количества не вступившего в реакцию иода титрованием гипосульфитом натрия.
При анализе метилметакрилата, содержащего не 'более 0,005% гидрохинона, в коническую колбу с притертой пробкой отвешивают 100 г нспыту^шго вещества, прибавляют 100 мл дистиллированной воды, точно 5 мл. 0,5 н. раствора иода и около 5 мл 5%-ного раствора крахмала. Колбу энергично встряхивают в течение 1 мин и содержимое ее титрую г 0,1 н. раствором гипосульфита натрия. Параллельно ставят контрольный опыт с образцом метилметакрилата, не содержащим гидрохинона.
Содержание гидрохинона х (в %) рассчитывают по формуле
__ (а — Ь) У<0,0055-100
X— ,
Где а — объем 0,1 н. гипосульфита натрия, израсходованный на титрование контрольной пробы, мл; Ъ — объем 0,1 н. гипосульфита натрия,, израсходованный на титрование пробы с навеской, мл; К — коэффициент нормальности 0,1 н. гипосульфита натрия; g— навеска образца метилметакрилата, г; 0,0055 — количество гидрохинона, соответствующее 1 мл 0,1 н. гипосульфита натрия, г.
Этот же метод используют для количественного определения гидрохинона в других мономерах.
Определение содержания головной фракции. Головной фракцией метилметакрилата считается фракция, кипящая до 98° С. Количество ее определяют отгонкой 100 г метилметакрилата в колбе с дефлегматором. Нагревание ведут на глицериновой бане, при 130—135° С.
Фракцию, кипящую до 98° С, собирают в предварительно взвешенный приемный сосуд. Как только температура достигнет 98° С, перегонку прекращают и приемную колбу с отгоном взвешивают. Масса продукта в граммах соответствует содержанию головной фракции в процентах. Если перегонка велась при барометрическом давлении ниже нормального (ниже 760 мм рт. ст.), то процентное содержание этой фракции, приведенное к нормальному давлению, находят в табл. 7.
Рассмотрим пример расчета. Предположим, что отгонка проводилась при давлении 745 мм рт. ст.; при этом получено 4,3 г головной фракции. После приведения к нормальному давлению (760 мм рт. ст.) содержание этой фракции будет равно 2,4%.
Количественное определение акрилонитрила реакцией с сернисто - кислым натрием. В основу метода положена реакция акрилонитрила с Сернистокислым натрием с последующим титрованием выделяющейся <56
ТАБЛИЦА Т
Зависимость содержания головной фракции от давления
Содержание головной фракции, %
|
760 |
1,2 |
|
755 |
1,4 |
|
750 |
1,8 |
|
745 |
2,7 |
|
740 |
3,7 |
|
735 |
4,8 |
|
1,6 |
2,0 |
|
1,8 |
2,3 |
|
2,4 |
2,8 |
|
3,2 |
3,7 |
|
4,0 |
4,7 |
|
5,7 |
6,3 |
|
2,4 |
3,0 |
|
2,75 |
3,4 |
|
3,4 |
4,0 |
|
4,3 |
5,0 |
|
5,2 |
6,0 |
|
7,0 |
8,0 |
|
3,5 |
4,0 |
|
4,0 |
4,5 |
|
4,7 |
5,6 |
|
5,7 |
6,4 |
|
6,7 |
7,6 |
|
8,9 |
9,8 |
|
4,6 |
5,0 |
|
5,1 |
5,5 |
|
5,8 |
6,а |
|
7,0 |
7,& |
|
8,4 |
9,4 |
|
10,7 |
12,0 |
Щелочи раствором соляной кислоты обычным или потенциометрическию титрованием.
В две конические колбы емкостью 250 мл вносят 25 мл 0,25 н. раствора Na? S03, навеску 0,3—0,35 г акрилонитрила (взвешивают с точностью до 0,0002 г). Пробы выдерживают в течение 30 мин при комнатной температуре и периодическом перемешивании и затем титруют 0,4 н. раствором НС1 в присутствии 3 капель тимолфталеина до исчезновения синей окраски. В аналогичных условиях титруют контрольную пробу с раствором Na2SC>3. Содержание акрилонитрила х (в %) вычисляют по формуле
(а — Ь) КО,0053-100
X— ,
Где а и Ъ — объемы 0,1 н. раствора НС1, израсходованные на титрование контрольной пробы и пробы с навеской, мл; К — поправка к титру НСЦ 0,0053 — количество акрилонитрила, соответствующее 1 мл точно 0,1 н. раствора НС1, г; g— навеска, г.
Для потенциометрического титрования взвешивают в коническук> колбу 0,1—0,15 г акрилонитрила (с точностью до 0,0002 г) и заливают 25 мл 0,25 н. свежеприготовленного раствора Na2S03; колбы выдерживают 30 мин при комнатной температуре, периодически помешивая содержимое.
Потенциометрическое титрование проводят на потенциометре со - стеклянным электродом; перед титрованием необходимо измерить потенциал стеклянного электрода. Для этого в стакан вносят пипеткой 25 мл раствора Na2S03 и 150 мл дистиллированной воды. В раствор опускают стеклянный и каломельный электроды, включают мешалку и замеряют на потенциометре значение потенциала стеклянного электрода (в мВ).
Пробу с навеской переносят количественно в стакан, доливают водой до 150 мл и погружают в раствор электроды. Выделившуюся щелочь от - титровывают раствором НС1 (при перемешивании) до значения потенциала стеклянного электрода (в мВ) в контрольной пробе. Расчет производят по приведенной выше формуле.
Определение содержания азота по Кьельдалю. Акрилонитрил можно определить по содержанию азота в веществе (по методу Кьельдаля) или по процентному содержанию нитрильных групп.
Сущность определения азота по Кьельдалю состоит в том, что органическое вещество при нагревании с концентрированной серной кислотой разлагается до образования прозрачного бесцветного раствора. Углерод при этом окисляется в углекислоту, а азот превращается в аммиак, который остается в растворе в виде сернокислой соли. К разбавленному кислому раствору прибавляют избыток щелочи и отгоняют аммиак, улавливая его определенным количеством титрованной кислоты, остаток которой оттитровывают щелочью.
Точную навеску анализируемого вещества (0,1—0,5 г) помещают в круглодонную колбу емкостью 200—300 мл с длинным горлом (колбу
Кьельдаля). Прибавляют 3 мл концентрированной серной кислоты так, чтобы она смочила навеску, и неплотно закрывают колбу небольшим стеклянным шариком с короткой запаянной трубкой. Затем колбу закрепляют с помощью лапки в слегка наклонном положении, ставят в вытяжной шкаф и нагревают небольшим пламенем микрогорелки Буязена.
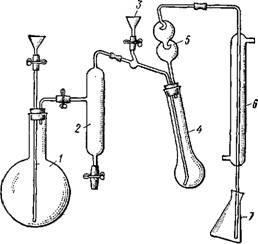
Нагревание ведут постепенно, так как смесь может вспениваться, особенно при больших навесках. Смесь в течение 15 мин осторожно доводят до кипения, затем в колбу прибавляют 1 г сухого порошкообразного сульфата калия и кристаллик сульфата меди и продолжают нагревание до тех пор, пока смесь не станет прозрачной и бесцветной или же слегка окрашенной в зеленоватый цвет. После охлаждения жидкость разбавляют 30 мл дистиллированной воды и присоединяют к установке для отгонки с паром (рис.45).
|
Рнс. 45. Установка для отгонки аммиака • с водяным паром по методу Кьельдаля: 1 — парообразователь; 2 — конденсатор; 3 — загрузочная воронка; 4— колба Кьельдаля; 5 — брызго - улавлнватель; 6 — холодильник; 7 — приемник |
В колбу парообразователя наливают дистиллированную воду и нагревают. Конец дистилляционной трубки холодильника Либиха погружают в колбу-приемник. Перед началом дистилляции в колбу, содержащую навеску, через делительную воронку приливают 10 мл концентрированного раствора едкого натра. Во избежание толчков в колбу вносят 3—4 г цинкового порошка (или чистой цинковой фольги), который одновременно разлагает амидные соединения, если они образуются. 158
Выделяющиеся пары, содержащие аммиак, отгоняют и последний улавливают в приемной колбе, в которую налито 20 мл титрованного раствора 0,1 н. H2S04. В качестве индикатора применяют метиловый оранжевый или метиловый красный. Для выделения всего аммиака достаточно отогнать 100 мл дистиллята.
Оттитровав 0,1 н. раствором щелочи (NaOH или КОН) избыток серной кислоты в приемной колбе, находят количество выделившегося аммиака и рассчитывают содержание азота в анализируемом продукте-
Содержание азота х (в %) рассчитывают по формуле
_ (аК — Ki)0,0014-100 X— ,
Где а — объем 0,1 н. H2SO4, взятый для улавливания аммиака, мл; Ь — объем 0,1 н. щелочи, израсходованной на титрование избытка серной кислоты после улавливания аммиака, мл; К — коэффициент нормальности 0,1 н. H2S04; Ki — коэффициент нормальности 0,1 н. щелочи; G — Навеска анализируемого вещества (акрилонитрила), г; 0,0014 — количество азота, соответствующее 1 мл 0,1 н. H2S04, г.
На основе полученных данных рассчитывают процентное содержание акрилонитрила (*i) по формуле
Xl~ 26,41 '
Где х—содержание азота в анализируемом веществе, %; 26,41 —расчетный коэффициент для акрилонитрила.
Определение содержания азота омылением нитрильных групп. СущНость метода, состоит в том, что нитрильную группу гидролизуют кипяЧением с избытком разбавленного раствора едкого натра и выделившийся аммиак оттитровывают кислотой. Однако этот метод неприменим к. Летучим нитрилам, в частности к акрилонитрилу, поэтому его видоизменяют следующим образом.
Вначале в колбе проводят реакцию 100 мл этилового спирта с небольшим кусочком металлического натрия. На аналитических весах в - Маленькой ампуле взвешивают 0,5—1 г акрилонитрила. Ампулу, помещают в колбу и там разбивают. Колбу закрывают пробкой и оставляют на час. Акрилонитрил вступает в реакцию, образуя высококипящий нитрил этоксипропионовой кислоты. Полученный продукт переносят в перегонную колбу (такую же, как при определении азота по методу Кьельда - ля) и, влив через делительную воронку избыток разбавленного раствора едкого натра, кипятят до полного гидролиза нитрильной группы. Выделяющийся аммиак улавливают титрованным 1 н. раствором H2S04.
Дальнейший ход анализа и расчеты проводят так же, как при опРеделении содержания азота методом Кьельдаля.
Определение нитрильных групп в полимере полиакрилонитриле ил» ■ Его сополимере можно определять этим же методом, 1внеся лишь изменение в предварительную стадию. В случае полимера нет необходимости в обработке металлическим натрием.
Определение акрилонитрила в'полимере, в дисперсиях, отгонах. Так. Же как при определении акрилонитрила в реактиве, в основу метода поЛожена реакция акрилонитрила с сернистокислым натрием с последующим титрованием выделяющейся щелочи раствором соляной кислоты потенциометрическим методом или обычным титрованием в присутствии тимолфталеина.
В две конические колбы вносят пипеткой 25 мл раствора Na2S03 и 5—ю г дисперсии (маточного раствора, отгона), взвешенной с точностью до 0,01 г. Смеси выдерживают 30 мин при комнатной температуре, периодически перемешивая. Титрование проб производят 0,1 н. раствором НС1 в присутствии 2—3 капель тимолфталеина до исчезновения синей окраски. В аналогичных условиях титруют (контрольную пробу. Содержание акрилонитрила х (в %) рассчитывают по формуле
АК-0,005306-100 Х =---------------- !------------ ,
S
Здесь а — объем 0,1 н. НС1, пошедший на титрование пробы с веществом, мл; К — поправка к 0,1 н. раствору НС1; 0,005306 — количество акрилонитрила, соответствующее 1 мл точно 0,1 н. раствора НС1, г; g— навеска пробы, г;
Проведение потенциометрического титрования см. стр. 157.
Это же определение можно осуществить и другими методами: колориметрическим и полярографическим. Последний дает возможность раздельно определить концентрацию нескольких мономеров, в то время как потенциометрический не позволяет отделить акрилонитрил от других производных акриловой и метакриловой кислот [5].
Определение примесей в акрилонитриле. В качестве примесей в ак - рилонитриле всегда присутствуют альдегиды. Определить их количество можно оксимированием по следующей реакции:
У0 .ДОН
R-Cf + NH2OH-HCl->R-Cf +NC1 + H20 ХН ХН
В две конические колбы емкостью 250 мл берут навески акрилонитрила (около 5 г), взвешенного с точностью 0,01 г, заливают их 20 мл 7%-ного спиртового раствора солянокислого гидроксиламина, перемешивают и оставляют на 1 ч. Затем приливают 100 мл воды, 4—5 капель раствора метилового оранжевого и титруют образовавшуюся в результате реакции соляную кислоту 0,1 н. раствором NaOH. Оттитровывают контрольную пробу.
Содержание альдегидов х (в %) в пересчете на карбонильную группу рассчитывают по формуле
__ (д — Ь)КО,0028'100
X— ,
Где а к B — объемы 0,1 н. раствора NaOH, пошедшие на титрование контрольной пробы и пробы с навеской, мл; К — поправочный коэффициент 0,1 н. раствора NaOH; 0,0028 — коэффициент пересчета на карбонильную группу, соответствующий 1 мл точно 0,1 н. раствора NaOH; G — Навеска вещества, г.
Определение содержания амида метакриловой кислоты. В чистый сухой взвешенный бюкс емкостью 10 мл отбирают 5—6 г исследуемого
вещества. Бюкс с веществом охлаждают до комнатной температуры и Взвешивают на аналитических весах с точностью до 0,01 г. Содержание бюкса через воронку переносят в мерную колбу емкостью 250 мл. Бюкс и воронку тщательно ополаскивают дистиллированной водой и промывные воды сливают в ту же колбу, объем жидкости доводят до метки и Тщательно перемешивают содержимое колбы.
В две конические колбы с притертыми пробками емкостью по 250 мл наливают из бюретки по 25 мл 0,1 н. бромид-броматной смеси (см. стр. 155) пипеткой приливают по 10 мл испытуемого раствора, затем мерным цилиндром в каждую колбу добавляют по 5 мл концентрированной соляной кислоты. Быстро закрывают колбы пробками, хорошо взбалты - вают и оставляют на 5 мин в темноте. Затем мерным цилиндром быстро вливают по 5 мл 10%-ного раствора иодистого калия, приняв меры'пре - досторожности против потерь брома. Выделившийся иод оттитровывают 0,1 н. раствором гипосульфита до обесцвечивания раствора, добавив-в качестве индикатора несколько капель 2%-ного раствора крахмала.
Параллельно ставят контрольный опыт.
Содержание амида х (в %) рассчитывают по формуле
_(д- Ь) КО,00425-250-100
Где а — объем 0,1 н. раствора гипосульфита, израсходованный на титрование контрольной пробы, мл; Ъ — объем 0,1 н. раствора гипосульфита, израсходованный на титрование пробы с навеской, мл; К — поправка на нормальность 0,1 н. раствора гипосульфита; G — навеска исследуемого вещества, г; 0,00425 — количество амида, соответствующее 1 мл 0,1 н. гипосульфита, г.

 Опубликовано в
Опубликовано в