КИНЕТИКА ПРОЦЕССОВ (МИКРООПИСАНИЕ)
 14 декабря, 2015
14 декабря, 2015  Mihail Maikl
Mihail Maikl 2.4.1. Электрскатализ
Фундаментальное место в микроописании процессов в ТЭ занимает катализ—одно из самых удивительных явлений природы. Прикладной характер монографии не 54
позволяет подробнее остановиться на многочисленных теориях катализа. Фрагментарно будут рассмотрены лишь некоторые аспекты теории, имеющие прямое касательство к проблеме ТЭ. Мы остановимся на классической теории так называемого электрокатализа, рассмотрим модель переноса заряда на границе электрод — электролит и роль материала электрода, а в заключение приведем основные положения электромагнитной теории катализа, позволяющей объяснить и предсказать некоторые наблюдаемые явления.
Ряд терминов и соотношений физики твердого тела, а также электродинамики сплошных сред (уравнения квантовой механики, уравнения Максвелла и т. д.) даются без выводов и ссылок в предположении, что читатель легко может при необходимости их найти в соответствующей обширной литературе.
В ТЭ реализуется в основном гетерогенный катализ. Многочисленные исследования процессов на ртутном электроде, очень удобном для теоретического анализа и исследования стадийности некоторых реакций химических превращений, не давали практического выхода к инженерным аспектам проблемы ТЭ, а также для химических производств, в которых использовались металлические и полупроводниковые электроды. Объектом изучения электрокатализа является кинетика перехода заряженных частиц (электронов или протонов) через поверхность раздела твердой и жидкой фаз. Скорость этого перехода характеризует вклад, вносимый в значение электрического тока генерации структурой поверхности. Если без катализатора скорость реакции — экспонен - циоиальная функция отношения энергии активации к средней энергии теплового движения kT, то при наличии катализатора она меняется в зависимости от поля, вносимого катализатором. Тем самым можно влиять на скорость реакции (ток).
В дальнейшем было показано, что на скорость процессов влияют не только основные носители, но и другие компоненты, участвующие в реакции (ионы электролита, растворители и т. д.). Наличие электрического поля, вносимого катализатором, — основная особенность и объект исследования электрокатализа.
Электрокаталитические процессы в общем виде включают три стадии:
1) адсорбцию реагентов;
2) собственно перенос заряда через границу электрод — электролит;
3) десорбцию продуктов реакции.
Существенное влияние иа протекание процессов оказывает ряд факторов, в том числе структура двойного слоя (прямое воздействие на стадию 2 и косвенно на 1 и 3), структура и морфология электрода (прямое влияние на стадии 1 и 3) и т. д.
Интерпретация адсорбции при электрокатализе отличается от классической, в первую очередь от адсорбции в газовой фазе, так как электрическое поле, вносимое катализатором, может коренным образом влиять на кинетику адсорбции и необходимо учитывать электрические свойства не только реагирующих веществ (реагенты, продукты реакции), но и растворителя, состав иоьов, продукты разложения растворителя и т. д. Значения, полученные в классических адсорбционных измерениях, таким образом, не могут быть непосредственно использованы для расчетов электросорбционных явлений: необходимо учитывать сольватацию (гидратацию), частичную адсорбцию на поверхности молекул растворителя и
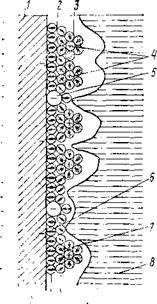 т. д., зависимость от температуры, концентрации реагирующих веществ. Показано, что для заряженных частиц свободная энергия — линейная функция, а для нейтральных— квадратичная функция электрических параметров. На границе раздела образуется двойной слой (рис. 2.3), заряды в котором разделены (диполи)
т. д., зависимость от температуры, концентрации реагирующих веществ. Показано, что для заряженных частиц свободная энергия — линейная функция, а для нейтральных— квадратичная функция электрических параметров. На границе раздела образуется двойной слой (рис. 2.3), заряды в котором разделены (диполи)
[2.5] . Двойной слой возникает под действием электрических сил на межфазовой границе. Частицы, составляющие двой-
Рис. 2.3. Детализированная структу-
ра двойного электрического слоя (по
Д. Бокрису).
/ — граница металла; 2 — слой Гельмгольца; 3 — слой Гуи; 4 — сольватированный катион; 5 — анионы специфической адсорбции; 6 — первый слой воды; 7 — второй слой воды; в — вода нормальной структуры.
ной слой, находятся под действием электростатических (кулоновских) сил (дальний порядок) и так называемых специфических, адсорбционных сил (ближний порядок взаимодействия). Условно двойной слой разбивают на две зоны — диффузную часть, где действуют только электродинамические силы, и плотную часть, в которой частицы подвержены также действию специфических сил. Ионы в диффузной части обычно гидратированы и удерживаются молекулами растворителя на расстоянии нескольких десятков долей нанометра. Общая толщина диффузного слоя зависит от концентрации и природы электролита, а также от заряда поверхности электрода и достигает нескольких десятков нанометров. Негидра- тированные ионы могут проникать в плотную часть слоя и под действием специфических сил вступать в контакт с поверхностью электрода (так называемая специфическая адсорбция).
Распределение потенциала в двойном слое условно принято считать линейным в плотной части и экспоненциальным в диффузной части слоя.
Мы остановимся подробнее на одной из основных проблем электрокаталитического процесса — переносе заряда через границу электрод — электролит.
Современный метод описания этого процесса использует принятое в квантовой механике одиоэлектронное приближение. Это означает, что рассматривается поведение лишь одного заряда в поле сил, обусловленных другими частицами. Для коллективных моделей, более полно отражающих существо процесса, одноэлектронное приближение следует рассматривать лишь как первый шаг. Многообразие реальных явлений требует учета многочастичных эффектов, что пока еще в количественном плане для описания кинетики переноса в реальных системах не разработано.

 Опубликовано в
Опубликовано в